异养硝化菌 Acinetobacter sp.的分离鉴定及其脱氮特性
2017-11-23王秀杰王维奇张彦灼孙艺齐王思宇
王秀杰,王维奇,李 军,李 芸,张彦灼,孙艺齐,王思宇,卞 伟
异养硝化菌sp.的分离鉴定及其脱氮特性
王秀杰,王维奇,李 军*,李 芸,张彦灼,孙艺齐,王思宇,卞 伟
(北京工业大学建筑工程学院,北京100124)
从北京市高碑店污水处理厂BBR(Bacillus Bacteria Bioreactor)中试设备的活性污泥样品中分离得到一株异养硝化-好氧反硝化菌株JQ1004,利用16S rDNA对其进行同源性分析,初步鉴定其为不动杆菌属(sp.).在好氧条件下,以丁二酸钠为碳源,分别以氨氮和硝酸盐氮为氮源,研究其脱氮特性,发现该菌株在33h时氨氮去除率达到99.45%,COD去除率达到92.54%;在34h时,硝酸盐氮去除率达到84.42%,而COD去除率达到93.11%.另外通过研究发现,与降解氨氮相比,菌株JQ1004在降解硝酸盐氮时需要更高的C/N.利用Compertz模型对其脱氮特性进行拟合发现,菌株对氨氮的最大降解速率明显高于降解硝酸盐氮的最大降解速率,分别为m=7.93mg/(L·h)和m=4.08mg/(L·h).利用响应面法进行实验设计,优化其脱氮条件,得到最佳脱氮条件为:pH=7.33;温度=31.80℃;转速=154.54r/min;C/N=7.76.
不动杆菌属;异养硝化-好氧反硝化;响应面;动力学
目前,生物脱氮工艺主要依赖于传统硝化和反硝化过程,即硝化菌在好氧条件下将氨氮转化为亚硝酸盐氮和硝酸盐氮,再依靠反硝化菌在缺氧条件下将亚硝酸盐氮和硝酸盐氮转化为N2O、NO或N2[1].硝化菌为自养菌,有机碳会抑制其生长[2],然而反硝化菌为异养菌,其生长代谢依赖于有机碳;另外,硝化菌降解氨氮时依赖于溶解氧,而溶解氧又会对反硝化菌产生抑制[3].由于有机碳和溶解氧的限制,使得硝化过程和反硝化过程必须分别在好氧池和厌氧池内进行,这就使得污水厂基建费用大大增加.另外,由于硝化菌为自养菌,世代周期长,生长易受外界环境影响,导致传统生物脱氮工艺抗冲击负荷能力差、水力停留时间长、能耗大等缺点[4].为了克服这些不足,近年来越来越多新型生物脱氮工艺被研究利用,包括短程硝化、好氧反硝化、厌氧氨氧化以及它们的组合工艺[5].
继Verstraete等[6]在1972年从自然界中分离出了第一株异养硝化菌sp.之后, Robertson等在1983年从活性污泥中分离出了一株同时具有异养硝化和好氧反硝化功能的脱氮菌(现更名为)[7].到目前为止越来越多异养硝化-好氧反硝化菌被分离出来,如No.4[8]、Y-11[9]、YB[10]、A1[11]、CPZ24[12]等.这些异养硝化-好氧反硝化菌与传统硝化菌相比,世代周期短,且对环境有更强的适应性.另外,这类菌株可以实现同步脱氮除碳,利用有机碳在同一好氧阶段将氨氮转化为气态氮排放到大气中,并且能够利用多种不同氮源进行生长代谢.异养硝化-好氧反硝化菌的这些优点使得在同一反应器内实现同步硝化反硝化(SND)成为可能.
为探究异养硝化好氧反硝化菌的脱氮特性及降解动力学特性,本研究通过建立Compertz模型,对一株从活性污泥样品中分离出的异养硝化-好氧反硝化菌株JQ1004的脱氮特性进行模拟,同时利用响应面法对其脱氮特性进行优化,以期为异养硝化好氧反硝化菌在生物添加领域的应用提供新的菌源.
1 材料与方法
1.1 实验材料
菌株分离自北京市高碑店污水处理厂BBR(Bacillus Bacteria Bioreactor)中试设备活性污泥. BBR设备将生物膜法(生物转盘主体)和活性污泥法(4个连续曝气池)集于一体(设备流程如图1所示),在设备运行期间定期添加活化后芽孢杆菌生物菌剂,设备进水氨氮浓度为50~ 60mg/L,COD浓度为200~300mg/L,经过2个月的启动维护,设备实现了稳定同步脱氮除碳.氨氮和COD去除率稳定保持在95%及以上,TN去除率达到80%.
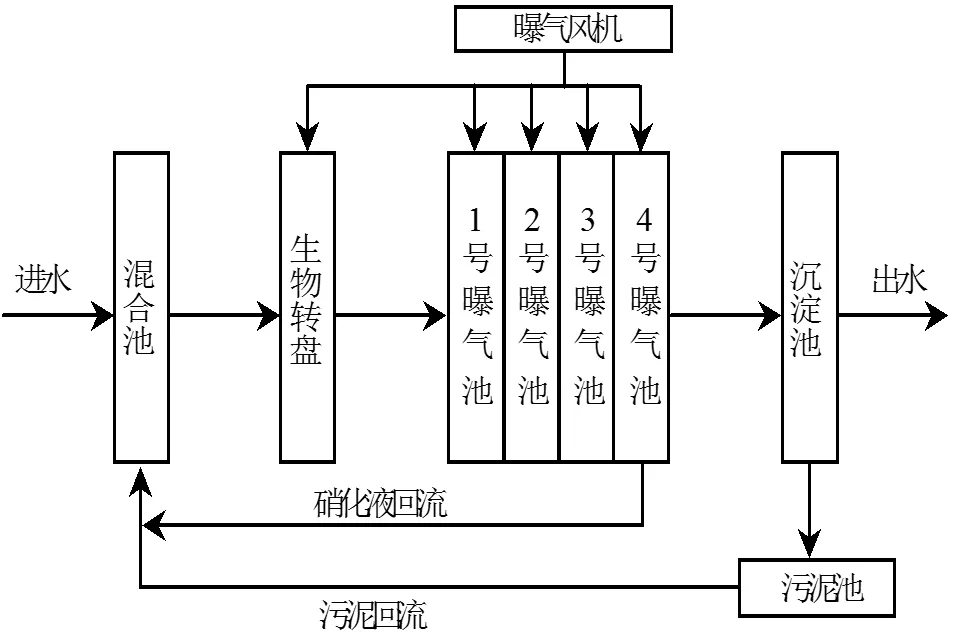
图1 BBR设备工艺流程
1.2 培养基
异养硝化培养基(g/L):0.47 (NH4)2SO4,4.219 (CH2COONa)2·6H2O,50mL维氏盐溶液,C/N=7.5.
反硝化培养基(g/L):0.72KNO3,4.219 (CH2COONa)2·6H2O,50mL维氏盐溶液,C/N=7.5.
维氏盐溶液(g/L):6.55K2HPO4·3H2O, 2.5MgSO4·7H2O,2.5NaCl,0.038MnSO4·H2O,0.05 FeSO4·7H2O.
LB培养基(g/L):10.00 胰蛋白胨,5.00 酵母提取物,10.00NaCl.
以上培养基中C/N指培养基中TC/TN (/).培养基在使用前用Na2HPO4和NaH2PO4缓冲溶液调整pH=7.0~7.1,121℃高压蒸汽灭菌15min.平板培养基需加入1.5%~2%琼脂粉.
1.3 菌株的分离与鉴定
1.3.1 菌株的筛分 取10mL活性污泥于90mL0.9%生理盐水中,用玻璃珠将泥样充分打散,使细菌呈单细胞状态悬浮于溶液中.采用梯度稀释法将菌液稀释.将各梯度稀释液涂布到异养硝化固体培养基上,于30℃培养2~3d.等菌落长出后,用接种环挑取单菌落接种于异养硝化液体培养基中.30℃、140r/min摇瓶培养24h后,测定氨氮、硝酸盐氮、亚硝酸盐氮浓度变化,进而挑选出具有显著氨氮去除效果的菌株进行复筛.最终筛选出脱氮性能最好的菌株JQ1004.采用平板划线法对最终筛选出菌株进行纯化,反复划线纯化5~7代,直至形成均匀单菌落,且无异常菌落出现.以上操作均在无菌环境中.菌株冻存于-80℃的40%甘油中.
1.3.2 菌株的16S rDNA鉴定 挑取茁壮单菌落接种于液体异养硝化培养基中,30℃、140r/min摇床过夜培养12h.取菌液于12000r/min、4℃离心5min,获得菌体.将菌体反复重悬于无菌水中洗涤3次.再次离心获得菌体.加入400μL Buffer SCL裂解菌体,65℃水浴1h左右,中间每隔10min混匀1次,直至混合液变澄清.然后离心取上清液进行DNA提取.采用Ezup柱式基因组DNA抽提试剂盒(上海生工)提取基因组DNA.将提取的DNA作为模板,采用针对细菌16S rRNA基因的通用引物对27f(5′-AGAGTTTGATCCTGGC- TCAG-3′)和1492r(5′-TACGGYTACCTTGTTA- CGACTT-3′)进行PCR扩增.将PCR产物送交上海生工进行测序,将测得的序列利用BLAST在线程序与Genbank中已有的模式菌株序列进行比对,并下载同源性较高的序列,利用MEGA5.0中的Neighbor-joining算法进行系统发育树的构建.
1.4 不同氮源条件下菌株JQ1004降解特性及动力学模型分析
将新鲜固体培养基上生长良好的单菌落接种于无菌水中并定容,制备成均匀菌悬液(0.5麦氏浊度)作为接种液.以下实验均以此菌液作为接种液.分别以硫酸铵、硝酸钾为唯一氮源,探究菌株在不同氮源情况下脱氮特性.C/N=7.5, pH= 7.0~7.1,培养条件为30℃,140r/min.定时取样测定氨氮、亚硝酸盐氮、硝酸盐氮浓度,数据测定3次取平均值.
菌株JQ1004对不同氮素的降解动力学模型与Compertz 模型相似度较大可以通过修饰过的 Compertz 模型[13-15]来进行拟合:

式中:指某一时刻氮素浓度,mg/L;0指氮素初始浓度,mg/L;m指最大转化速率,mg/(L·h);0指迟滞时间,h;指培养时间,h;e是数学常数.
1.5 响应面法优化菌株的脱氮条件
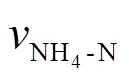

表1 Box-Behnken实验设计的变量及其水平值
1.6 测试分析与计算方法
NH4+-N:纳氏试剂分光光度法;NO2--N:N- (1-萘基)-乙二胺分光光度法;NO3--N:麝香草酚分光光度法;CODcr:重铬酸钾法;NH2OH:间接分光光度法;pH值、温度: WTW/Multi3420便携式测定仪.
平均氨氧化速率计算:

2 结果与讨论
2.1 菌株的分离与鉴定

图2 菌株JQ1004在固体培养基上的形态
利用梯度稀释法和平板划线法一共筛分得到24株具有异养硝化-好氧反硝化功能的菌株.将全部菌株分别接种于液体异养硝化培养基中进行摇瓶实验,验证得到一株脱氮效果最好的菌株,命名为JQ1004.菌株JQ1004在异养硝化固体培养基上培养24h后,如图2所示菌落呈白色,凸起,边缘整齐,表面光滑湿润,黏稠不易挑取.
提取该菌株DNA,并利用通用引物对27F/1492R经PCR扩增后得到长度为1400bp基因片段,将该片段利用BLAST在线程序与Genbank中已有的模式菌株序列进行比对后发现,菌株JQ1004与An17同源性在98%以上,结合菌株形态可以初步鉴定JQ1004为不动杆菌.利用MEGA 5.0中的Neighbor- joining 算法对菌株JQ1004与一些已经发现的异养硝化-好氧反硝化菌以及其他不动杆菌进行系统发育树构建,得到菌株JQ1004系统发育树(图3),进一步证明JQ1004为不动杆菌属(sp.),命名为sp. JQ1004.
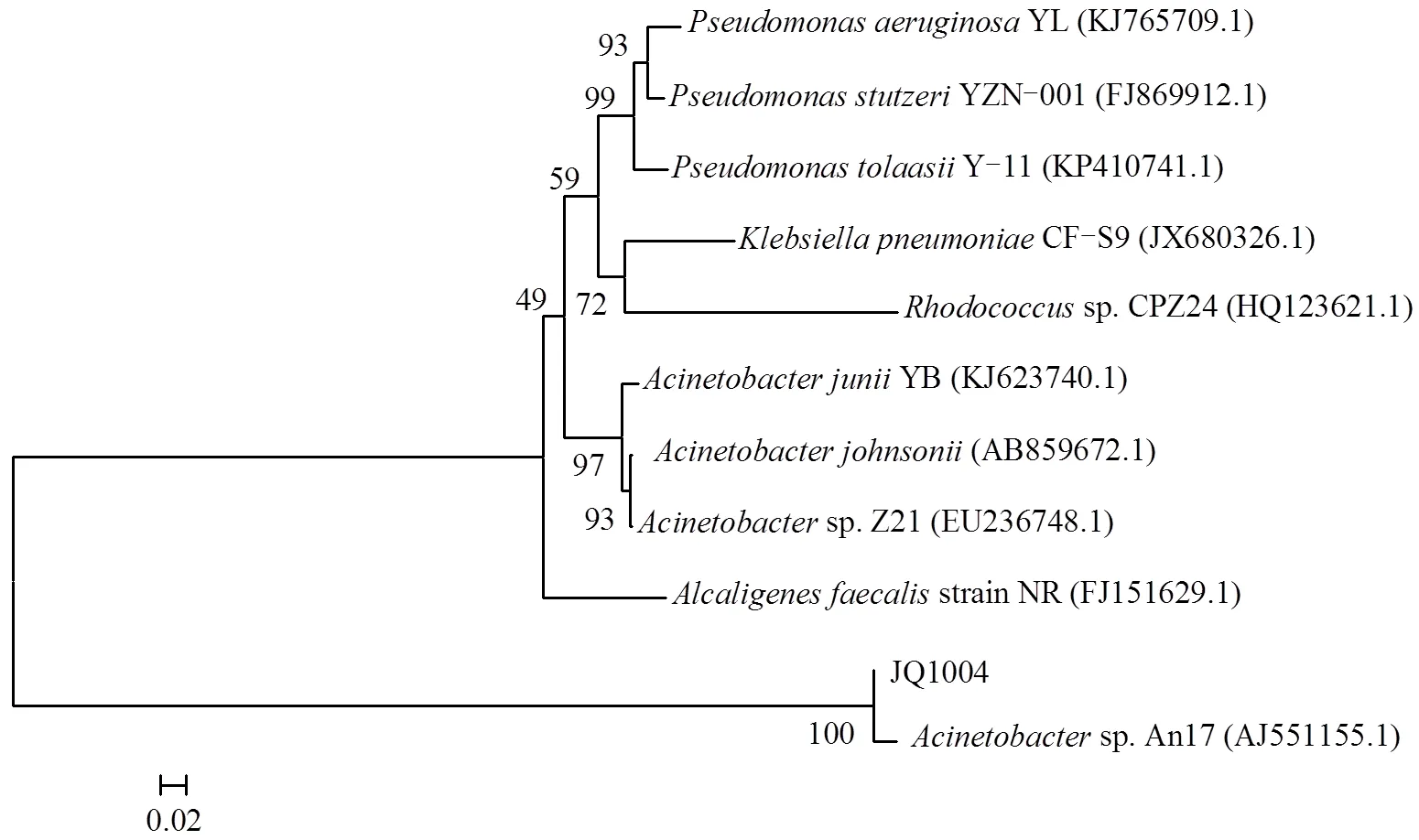
图3 菌株JQ1004系统发育树
2.2 不同氮源条件下菌株JQ1004降解特性及动力学模型分析
2.2.1 菌株JQ1004对不同氮素降解特性 以氨氮为唯一氮源,菌株脱氮特性如图4(A)所示.菌株在经历2~3h迟滞期后开始迅速生长,此时氨氮和有机碳被大量降解,氨氮氧化速率在此阶段达到最大值.在24h时,OD600达到最大并进入稳定期.在33h,氨氮去除率达到99.45%,COD去除率达到92.54%.Chen等[12]报道,sp. CPZ24在初始氨氮浓度为50mg/L条件下,氨氮去除率在20h内可完全去除,而在相同条件下,硝酸盐氮去除率为67%.当培养基中不添加有机碳源时,菌株JQ1004无法生长,只有外加有机碳源时,氨氮才能够被降解利用,这表明菌株JQ1004为异养硝化菌.由图4(A)可知,在对数期时,菌株快速繁殖,氨氮与有机碳被大量降解,这表明菌株能够在好氧条件下(140r/min),实现同步脱氮除碳.在整个氨氧化过程中,只检测到少量的硝酸盐氮积累,而未检测到亚硝酸盐氮和羟胺积累,这是由于在氨氮被氧化过程中,亚硝酸盐氮和羟胺等中间产物被迅速转化而未产生积累[18].

由图4(B)可知,在好氧条件下菌株JQ1004能够以硝酸盐氮为氮源进行反硝化,这表明菌株JQ1004不仅具有异养硝化功能,还具有好氧反硝化功能,这与大部分已分离的异养硝化-好氧反硝化菌株如sp. HA2[19]、sp.Y16[20]、YB[10]等脱氮特性一致,即在好氧条件下能够以氨氮和硝酸盐氮为唯一氮源进行新陈代谢;而另一类异养硝化-好氧反硝化菌株,如No.4[8],HNR[21],NR[22]等,分别以氨氮、硝酸盐氮、亚硝酸盐氮和羟胺为唯一氮源研究其脱氮途径时发现,该类菌株不能够利用亚硝酸盐氮和硝酸盐氮进行反硝化,只能利用氨氮和羟胺进行代谢.此两类异养硝化-好氧反硝化菌株的脱氮途径还未有统一定论,仍需进一步的研究.由图4(B)可知,在经过5h的迟滞期之后,菌株JQ1004进入对数期,在这一时期菌株迅速生长繁殖,OD值迅速上升,硝酸盐氮和有机碳被大量降解.直到34h左右,菌株生长进入稳定期,在此时刻之后OD值稳定在1.1左右,不再大幅度上升.此时硝酸盐氮去除率仅达到84.42%,而COD去除率达到93.11%.分析可能的原因是在氮素初始浓度相同条件下,菌株JQ1004降解硝酸盐氮比降解氨氮需要更高的C/N比,由于碳源不足,在反应过程的后期,C/N不能够满足菌株新陈代谢的需要,从而限制了菌株的生长.
2.2.2 菌株JQ1004对不同氮素降解动力学模型构建及分析 实验表明,温度、pH值等对菌株JQ1004降解不同氮素具有显著影响.菌株对氨氮和硝酸盐氮的降解情况随时间的变化,采用修饰过Compertz模型进行拟合.
菌株JQ1004对不同氮素降解动态拟合曲线见图5.从图5中可以看出,修饰过的Compertz模型很好地描述了菌株降解不同氮素随时间的变化情况,由表2可知氨氮和硝酸盐氮拟合曲线的相关系数2分别为0.997和0.985.

图5 菌株JQ1004对不同氮素降解动态拟合曲线

表2 菌株JQ1004降解不同氮素动力学参数
从Compertz模型拟合后(图5)可以看出,菌株JQ1004在降解氨氮与硝酸盐氮时均存在迟滞期,且降解硝酸盐氮的迟滞期(12.74h)明显长于降解氨氮的迟滞期(5.91h).在相同条件下,氨氮平均降解速率明显大于硝酸盐氮平均降解速率,氨氮在6~24h被迅速降解,且在这一时间段内降解速率达到最大(m=7.93mg/(L·h));而硝酸盐氮在经过12.74h的迟滞期后,进入快速降解期,在13~35h硝酸盐氮降解速率达到最大值m= 4.08mg/(L·h).Ren等[10]通过研究YB在不同C/N条件下氨氮去除效果,发现氨氮最大去除率在4.04~10.09mg/(L·h)之间.分析这种脱氮特性的原因,一方面可能是该菌株降解氨氮和硝酸盐氮的代谢途径不同,经前期研究发现,异养硝化-好氧反硝化菌可能存在两条脱氮途径,一种是与传统脱氮途径相同,即NH4+-N→ NO2--N→NO3--N→NO2--N→NO→N2O→N2,另一条是NH4+-N→NH2OH→NO→N2O→N2,推测当氨氮为氮源时,菌株JQ1004脱氮途径以第二条脱氮途径为主,以硝酸盐氮为氮源时以NO3-- N→NO2--N→NO→N2O→N2为主;另一方面可能是氨氧化过程中酶的活性要高于好氧反硝化过程中酶的活性[18].
2.3 响应面法优化菌株JQ1004的脱氮条件
参考前期相关文献,确定出pH值、温度、转速、C/N为显著影响异养硝化-好氧反硝化菌株脱氮性能的环境因素.通过单因素实验确定出各环境因子的最佳范围,以30h内平均氨氮氧化速率为响应值,利用Box-Behnken法的中心组合试验设计原理设计四因素三水平的实验组合.各组实验响应值如表3所示.
利用Design Expert对各组实验数据进行拟合和方差分析,得到响应值与各因素编码值之间的函数关系式如下:
=3.06+0.39+0.39+0.30+0.015+0.033-
0.055-0.020+0.12-0.028+
0.15-0.542-0.672-0.252-0.212
式中:表示氨氧化速率,、、、分别表示pH值、温度、转速、C/N.

表3 实验设计和响应值
对拟合模型进行方差分析(ANOVA),结果如表4.
由表4可知,该模型值<0.0001,表明拟合得到的方程极为显著,模型在整个被研究的回归区域内拟合性很好.模型失拟项(Lack of Fit)用来表示所用模型与实验值的拟合程度,即二者的差异程度.该拟合模型中失拟项为0.5385>0.05,不显著.表明无失拟因素存在,因此可用该回归方程代替试验真实点对实验结果进行分析.同时结合图6中平均氨氧化速率的实际值与模型预测值之间的拟合关系可知,实际值与预测值具有很好的拟合度,其中散点为实验所得平均氨氧化速率,直线为预测值拟合直线.

表4 响应面结果的方差分析
注:*<0.05.

图6 回归模型平均氨氧化速率预测值与实际值的关系
另外,模型决定系数2=0.9957,表明99.57%的实验数据可用该模型进行解释,说明方程可靠性高且回归有效.校正决定系数(Adj2=0.9913)和预测决定系数(Pred2=0.9801)差值为0.0112< 0.2,变异系数CV=2.23%<10%,说明实验具有较高可信度和良好的稳定性.该模型的信噪比为51.563,其值大于4,说明该模型具有足够分辨力,能适应实验结果[23].在统计学中,Cook距离表示某一条数据从回归统计量和计算中排出后,由此造成的回归系数变化有多大,通常认为D<1的数据为合理数据[24].由图7可知,用于回归分析的数据的D均小于1,不存在对二次多项式的系数产生明显影响的数据.综合以上分析,该模型可以用来分析和预测菌株JQ1004降解氨氮的最优实验条件.
根据表4中数据分析可知,各因素对氨氮降解速率的影响排序为:pH值>温度>转速>C/N.并且,pH()、温度()、转速()的值均小于0.0001,这表明它们对模型的影响极其显著,即pH值、温度、转速是氨氮降解速率的重要影响因素.C/N()的值为0.3422,不显著,这表明C/N对于菌株降解氨氮并没有显著影响,分析可能原因为C/N在满足菌株JQ1004正常代谢要求后,氨氮降解速率随C/N的改变不会产生大的变化.C/N在6.5以上时已经满足了菌株降解氨氮的需求,故C/N已经不是影响氨氮降解的显著因素.另外,由交互项系数的值可知,、的值均小于0.05,这表明温度与转速、转速与C/N之间的交互作用明显.
如图8所示,由响应面图和等高线图中也可以看出各因素之间的交互作用,响应面图中等高线形状可直接反映出两个因素间的交互作用强弱,等高线越接近圆形两因素间的交互作用越弱,而越接近椭圆形两因素间的交互作用越强[25].由图8中(以和为例) pH()和C/N()的等高线图呈圆形,说明之间的交互作用较弱;而pH()和温度()的等高线图明显呈椭圆形,说明之间的交互作用明显较强.另外,从各因素响应面3D图中也可以直观看出各因素之间具有明显的交互作用,各因素之间并不是简单的线性关系.同时可以明显看出模型开口向下,表明实验结果具有最大值,即响应值具有最优条件的响应点.

图7 回归模型的Cook距离分布
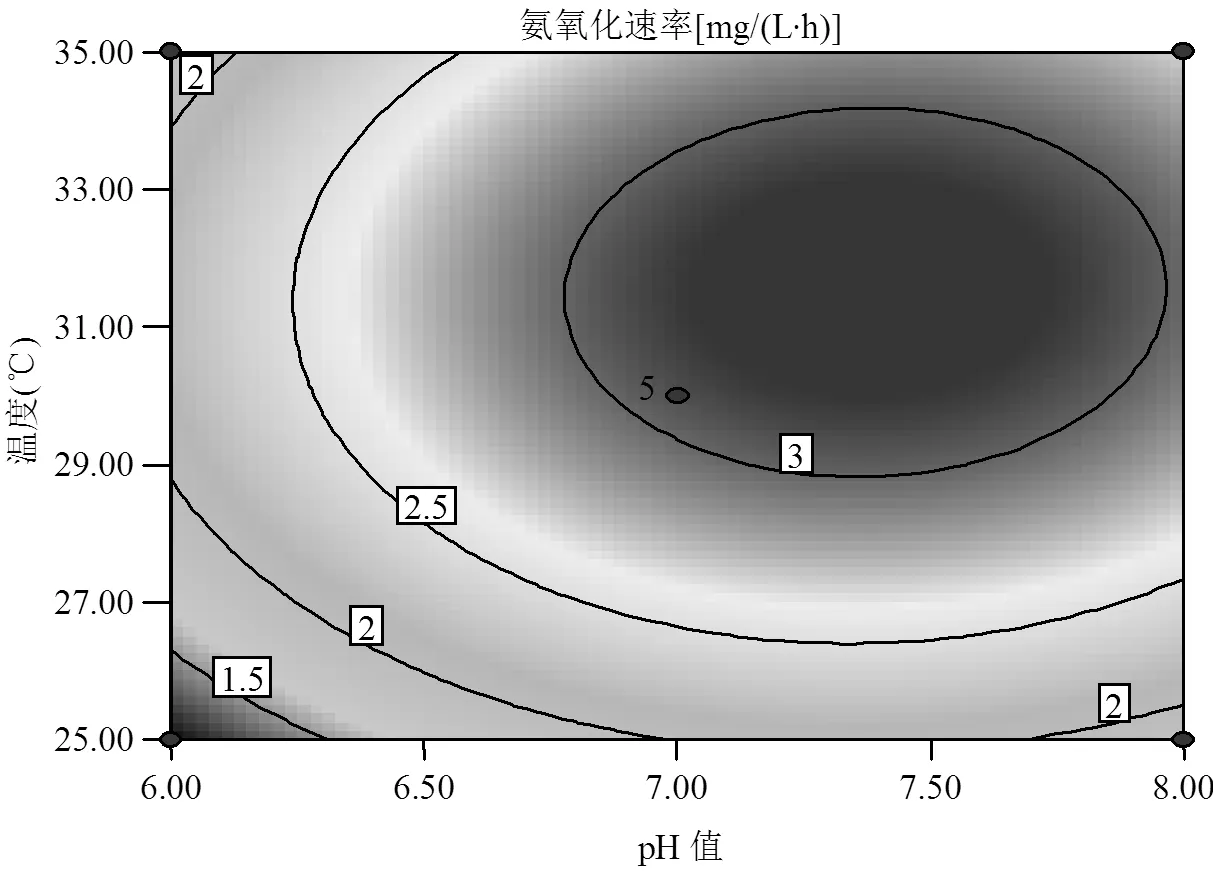
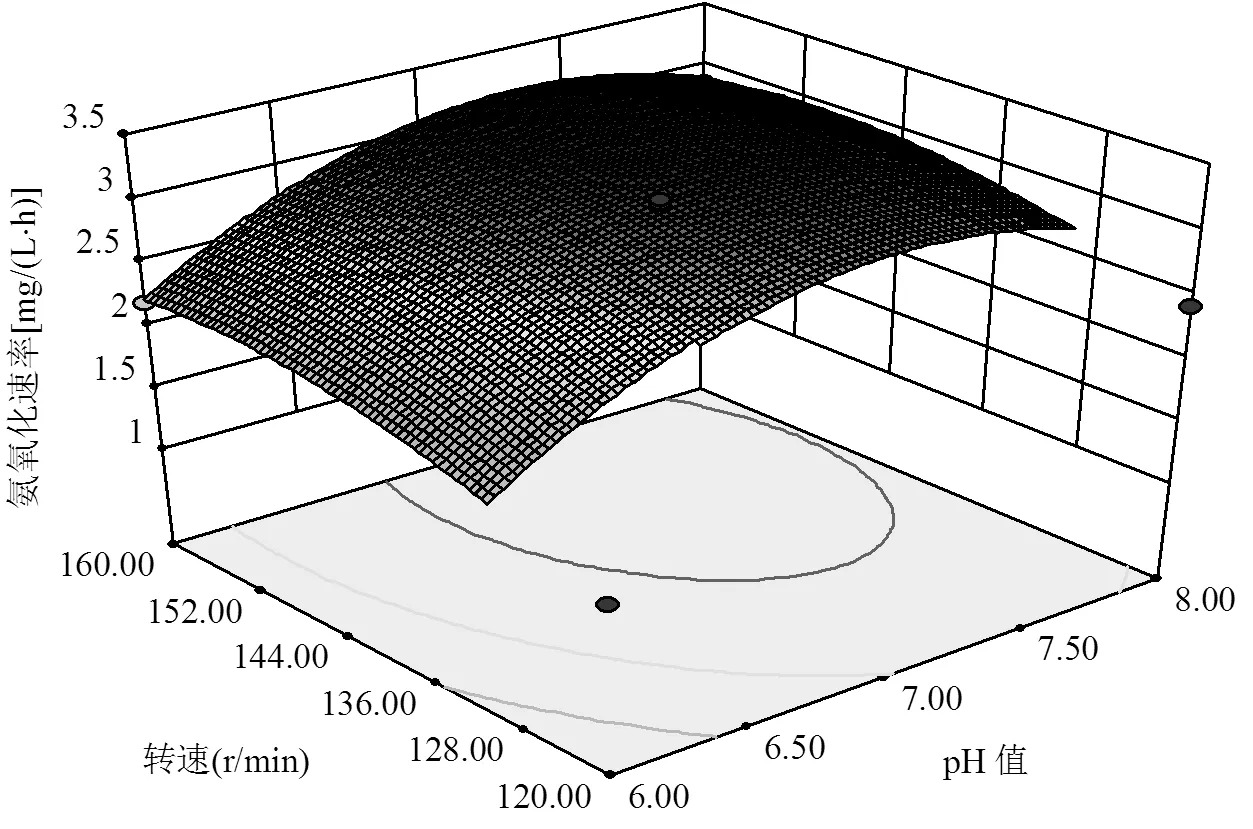
图8 pH值和温度、pH值和C/N对平均氨氧化速率影响的响应面和等高线
对构建的模型进行偏导微分处理,得到菌株JQ1004最优脱氮条件为pH=7.33;温度=31.80℃;转速=154.54r/min;C/N=7.76.此时,最大平均氨氧化速率预测值为3.31mg/(L·h).为验证模型预测的准确性和有效性,在最优条件下进行3组平行实验,为实验操作方便,将培养条件简化为:pH= 7.4;温度=32℃;转速=155r/min;C/N=7.8得到平均氨氧化速率为3.17mg/(L·h),与预测值仅相差0.14mg/(L·h).这表明回归方程比较准确的预测了各因素对菌株JQ1004脱氮特性的影响.
3 结论
3.1 从活性污泥中分离得到一株异养硝化菌JQ1004,结合菌株生理形态及16S rDNA同源性分析鉴定该菌株属于不动杆菌属(sp.).该菌株能够在好氧条件下,以有机碳为碳源,分别利用氨氮和硝酸盐氮进行代谢,且无明显亚硝酸盐氮积累.
3.2 Compertz模型能够很好地拟合菌株对于不同氮素降解特性,从拟合曲线可知菌株在利用氨氮时比利用硝酸盐氮有更短的迟滞期(分别为5.91h和12.74h)和更大的最大降解速率(分别达到m=7.93mg/(L·h)和m=4.08mg/(L·h)).另外研究结果还表明,菌株在降解硝酸盐氮时比降解氨氮时需要更高的C/N.
3.3 通过响应面优化设计实验,确定该菌株脱氮最优条件为:pH=7.33;温度=31.80℃;转速=154.54r/min;C/N=7.76,由验证试验结果可知, 回归方程比较准确的预测了各因素对菌株JQ1004脱氮特性的影响.
[1] Zhang Q L, Liu Y, Ai G M, et al. The characteristics of a novel heterotrophic nitrification-aerobic denitrification bacterium, Bacillus methylotrophicus strain L7. [J]. Bioresource Technology, 2012,108(3):35-44.
[2] Kulikowska D, Jóźwiak T, Kowal P, et al. Municipal landfill leachate nitrification in RBC biofilm - process efficiency and molecular analysis of microbial structure. [J]. Bioresource Technology, 2010,101(10):3400-3405.
[3] Lloyd D, Boddy L, Davies K J P. Persistence of bacterial denitrification capacity under aerobic conditions: The rule rather than the exception. [J]. Fems Microbiology Letters, 1987,45(3): 185-190.
[4] 梁 贤,任勇翔,杨 垒,等.异养硝化-好氧反硝化菌YL的脱氮特性[J]. 环境科学, 2015(5):1749-1756.
[5] Ahn Y H. Sustainable nitrogen elimination biotechnologies: A review. [J]. Process Biochemistry, 2006,41(8):1709-1721.
[6] W. Verstraete M A. Heterotrophic nitrification bysp. [J]. Journal of Bacteriology, 1972,110(3):955.
[7] Robertson L A, Kuenen J G.gen. nov. sp. nov. a Facultatively anaerobic facultatively autotrophic sulphur bacterium. [J]. Microbiology, 1983,129(9):2847-2855.
[8] Joo H S, Hirai M, Shoda M. Characteristics of ammonium removal by heterotrophic nitrification-aerobic denitrification byNo.4. [J]. Journal of Bioscience & Bioengineering, 2005,100(2):184-191.
[9] He T, Li Z, Sun Q, et al. Heterotrophic nitrification and aerobic denitrification by Pseudomonas tolaasii Y-11without nitrite accumulation during nitrogen conversion. [J]. Bioresource Technology, 2016,200(1):493-499.
[10] Ren Y X, Yang L, Liang X. The characteristics of a novel heterotrophic nitrifying and aerobic denitrifying bacterium Acinetobacter junii YB. [J]. Bioresource Technology, 2014,171: 1–9.
[11] Yang X P, Wang S M, Zhang D W, et al. Isolation and nitrogen removal characteristics of an aerobic heterotrophic nitrifying– denitrifying bacteriumA1. [J]. Bioresource Technology, 2011,102(2):854-862.
[12] Chen P, Li J, Li Q X, et al. Simultaneous heterotrophic nitrification and aerobic denitrification by bacterium Rhodococcus sp. CPZ24. [J]. Bioresource Technology, 2012, 116(13):266-270.
[13] Li J, Gu J D, Pan L. Transformation of dimethyl phthalate dimethyl isophthalate and dimethyl terephthalate bySa and modeling the processes using the modified Gompertz model. [J]. International Biodeterioration & Biodegradation, 2005,55(3):223-232.
[14] Fan Y, Wang Y, Qian P Y, et al. Optimization of phthalic acid batch biodegradation and the use of modified Richards model for modelling degradation [J]. International Biodeterioration & Biodegradation, 2004,53(1):57-63.
[15] 王光利,李新风,张 辉,等.CTN-4降解百菌清的条件优化及动力学模型的研究[J]. 中国环境科学, 2013,33(11):1999-2005.
[16] Chen Q, Ni J. Ammonium removal bysp. LAD9 capable of heterotrophic nitrification-aerobic denitrification. [J]. Journal of Bioscience & Bioengineering, 2012,113(5):619-623.
[17] Box G E P,Behnken D W. Some New Three level designs for the study of quantitative variables. [J]. Technometrics, 1960,2(4): 455-475.
[18] Yang L, Ren Y X, Liang X, et al. Nitrogen removal characteristics of a heterotrophic nitrifier Acinetobacter junii YB and its potential application for the treatment of high-strength nitrogenous wastewater. [J]. Bioresource Technology, 2015,193:227-33.
[19] Yao S, Ni J, Ma T, et al. Heterotrophic nitrification and aerobic denitrification at low temperature by a newly isolated bacterium Acinetobacter sp. HA2. [J]. Bioresource Technology, 2013, 139(13):80-86.
[20] Huang X, Li W, Zhang D, et al. Ammonium removal by a novel oligotrophic Acinetobacter sp. Y16capable of heterotrophic nitrification-aerobic denitrification at low temperature. [J]. Bioresource Technology, 2013,146(10):44-50.
[21] Zhao B, He Y L, Hughes J, et al. Heterotrophic nitrogen removal by a newly isolated Acinetobacter calcoaceticus HNR. [J]. Bioresource Technology, 2010,101(14):5194-5200.
[22] Zhao B, An Q, He Y L, et al. N2O and N2production during heterotrophic nitrification by Alcaligenes faecalis strain NR. [J]. Bioresource Technology, 2012,116(4):379-385.
[23] 葛启隆,岳秀萍,王国英.一株苯酚降解菌的分离鉴定及响应面法优化其固定化[J]. 中国环境科学, 2014,34(2):518-525.
[24] Muralidhar R V, Chirumamila R R. A response surface approach for the comparison of lipase production by Canida cylindracea using two different carbon sources. [J]. Biochemical Engineering Journal, 2001,9(1):17-23.
[25] 杜凤龄,王 刚,徐 敏,等.新型高分子螯合-絮凝剂制备条件的响应面法优化[J]. 中国环境科学, 2015,35(4):1116-1122.
Isolation and identification of a heterotrophic nitrifier,sp., and its characteristics of nitrogen removal.
WANG Xiu-jie, WANG Wei-qi, LI Jun*, LI Yun, ZHANG Yan-zhuo, SUN Yi-qi, WANG Si-yu, BIAN Wei
(The College of Architecture and Civil Engineering, Beijing University of Technology, Beijing 100124, China)., 2017,37(11):4241~4250
Heterotrophic bacterium, the strain JQ1004 exhibiting simultaneous nitrification and aerobic denitrification were isolated from activated sludge and identified asby 16S rDNA. This study was focused on the characteristics of nitrogen removal under aerobic condition bysp. JQ1004. Clearly, a significant decrease of ammonium and COD was observed by 33h, with 99.45% and 92.54% removal efficiency respectively while NH4+-N was used as sole N-source and sodium succinate was used as organic carbon source. Besides, while the strain utilized NO3--N as nitrogen source, the removal efficiency of NO3--N was 84.42% and total 93.11% of COD was decreased during 34h of incubation. It was interesting to note that higher C/N ratio was required in the degradation of nitrate than ammonium with the same initial concentration under aerobic conditions. Based on the description by modified Compertz model for the experimental data, it was found the isolate using ammonium as a sole nitrogen source showed higher rate of converting nitrogen than using nitrate, with 7.93mg/(L·h) and 4.08mg/(L·h) respectively. Response surface methodology (RSM) experiments proved that efficient nitrogen removal and growth of strain JQ1004occurred with succinate as the carbon source, pH 7.33, 31.80℃, and high C/N ratio of 7.76and dissolved oxygen (with shaking speed of 154.54r/min).
sp.;heterotrophic nitrification-aerobic denitrification;response surface methodology (RSM);kinetics
X172
A
1000-6923(2017)11-4241-10
王秀杰(1991-),女,山东潍坊人,北京工业大学博士研究生,主要从事污水生物脱氮研究.发表论文1篇.
2017-03-29
水体污染控制与治理科技重大专项(2015ZX07202- 013);16人才培养质量建设-双培养计划新兴专业建设(004000542216031)
* 责任作者, 教授, 18810925108@163.com
