污灌区盐分累积对外源汞在土壤中甲基化的影响
2017-11-23郑顺安薛颖昊黄宏坤段青红郑向群
郑顺安,周 玮,薛颖昊,习 斌,黄宏坤,段青红,郑向群
污灌区盐分累积对外源汞在土壤中甲基化的影响
郑顺安1,2,3,周 玮1,薛颖昊1,习 斌1,黄宏坤1,段青红1,郑向群2*
(1.农业部农业生态与资源保护总站,北京 100125;2.农业部环境保护科研监测所,天津 300191;3.农业部资源循环利用技术与模式重点实验室,北京 100125)
将汞同位素示踪剂199Hg2+(土壤背景含量的80%)加入不同盐分和盐度处理的盐渍化土壤中,利用多重标记稳定同位素示踪技术,研究盐分累积对外源汞在土壤中甲基化的影响.盐分种类为NaCl和Na2SO4,设置的盐度梯度为7个,添加质量分数为0%~5%.结果表明,外源199Hg2+加入土壤后,在培养期间,土壤中CH3199Hg+生成量变化趋势总体呈型曲线,表现出迟缓-最大速率-稳定3个阶段,用Logistic方程可以理想拟合盐处理下外源汞添加入土壤后生成甲基汞的动力学过程.在未添加盐分处理的对照土壤中,甲基汞最大生成量为0.698 μg/kg,最大甲基化速率为0.217 μg/(kg·d).NaCl处理下,随着盐度的增长,外源Hg进入土壤后汞甲基化程度总体呈现先增长后降低的趋势.0.2%~0.6%盐度下,甲基化程度显著提高,0.4%盐度下最高,最大生成量和最大甲基化速率分别达到3.589 μg/kg和0.415 μg/(kg·d).盐度在1%~2%时汞甲基化程度与对照比较接近,高盐度(5%)对汞甲基化有明显的抑制作用.Na2SO4处理下,当盐度水平超过0.2%时,会显著抑制外源汞加入土壤后甲基汞的生成.
污灌区;汞;同位素示踪;甲基化;NaCl;Na2SO4
汞是非常特殊的重金属,对动物和人而言,有机汞的毒性远大于无机汞的毒性,而甲基汞(MeHg)是有机汞最为主要的存在形式,环境中任何形式的汞(包括金属汞、无机汞和其它有机汞)都可以在一定条件下转化为MeHg,所以汞的甲基化问题备受人们关注.土壤在经历漫灌(污灌)、季节性水淹、洪水或干湿交替(稻田环境)等水分条件变化时,极有可能使土壤汞发生甲基化,造成土壤中MeHg含量增加并释放到水体或大气中,形成生物体的MeHg暴露[1-2].稻田生态系统是湿地的一种类型,水稻在生长期内因季节性灌溉,使其也成为一种特殊的湿地生态系统,为硫酸盐还原菌和铁还原细菌等提供理想的生存条件,因此稻田土壤也很有可能和湿地土壤相似,都具有很强的汞甲基化能力,从而成为陆地生态系统的MeHg源.本课题组先前对天津北排污河附近29个稻田土壤的调查显示,土壤MeHg含量为(0.87 ±0.77)μg/kg,个别汞污染较严重地块存在MeHg暴露风险[3].
利用污水进行长期灌溉(尤其是在蒸发量较大、降雨较少、排盐不畅的地区)会导致土壤盐分的累积,进而导致土壤次生盐渍化,这一问题在我国北方乃至世界范围内的污灌区都比较突出.污灌区土壤盐渍化趋势,是否会影响土壤汞甲基化,从而加剧汞污染的危害并增加其防治难度等问题,当前仍然缺乏该方面的研究.MeHg在环境介质中浓度极低,且易受基体影响和样本处理过程中形态转化的制约,分析技术难度较大.20世纪90年代以来,同位素稀释法这一强大工具被引入汞形态分析.汞有7种稳定同位素,可在实验中添加汞同位素化合物,研究转化反应,这一过程被称为稳定同位素标记示踪技术.将同位素稀释技术与气相色谱-电感耦合等离子质谱仪联用系统(GC/ICP-MS)结合起来,利用质谱仪测量待测同位素比值的改变而计算出待测物质浓度,可以追踪检测过程中土壤汞的甲基化过程,MeHg的检出限可达到pg级别[4-5].天津污灌区是我国北方最大的污灌区,也是汞污染的重灾区.2005年对天津污灌区内水田和菜田土壤样品的采样调查显示[6],灌区内土壤-作物系统中汞的污染等级达到了重度污染,部分农作物中汞的质量分数远超国家食品卫生标准.2012年的调查结果显示[7],天津污灌区内采样的22个蔬菜样品100%都受到Hg污染,且都处于重污染的情况.本研究以受盐渍化和重金属汞双重胁迫的天津污灌区土壤为研究对象,将汞同位素示踪剂199Hg2+加入不同盐分和盐度的盐渍化土壤中,利用多重标记稳定同位素示踪技术,研究盐分胁迫土壤中汞的甲基化特征,为污灌区汞污染防治及盐渍化土壤的有效管理提供理论支撑.
1 材料与方法
1.1 供试土壤
土壤样品采集自天津市郊东北方向李明庄的菜地表层潮土(0~20cm).该菜地距离天津三大排污河之一的北(塘)排污河约400m,污灌历史超过20a,属于间歇性清污混灌区,污灌口位于菜地的西南角.土壤样品经自然风干后过2mm尼龙筛冷冻储存,基本理化性质分析参照中国土壤学会提供的分析方法[8],其中:pH值为8.03,CaCO3含量为1.03g/kg,有机质含量为12.43g/kg,CEC为16.27cmol/kg,游离铁含量为8.71g/kg,无定形铁含量为0.88g/kg,黏粒(<0.002mm)含量为191.05g/kg.受长期污灌的影响,供试土壤的Hg含量(0.601mg/kg)显著高于区域土壤Hg背景含量(0.073mg/kg),但未超过土壤环境质量二级标准(pH > 7.5为1.0mg/kg,GB 15618-1995[9]).盐分总量为0.875g/kg(低于0.1%),按照盐土重量比划分标准[8],尚不属于盐渍化土壤.
1.2 盐渍化土壤制备
根据调查资料,天津污灌区内由于污灌带来的土壤盐渍化,阳离子以Na+为主,阴离子以Cl-和SO42-为主[10],因此本研究考察的盐分种类为NaCl和Na2SO4.设置的盐度梯度为7个(按盐分种类单一添加),添加质量分数依次为0%(CK)、0.2%、0.4%、0.6%、1%、2%和5%.称取供试土壤200g,按照上述处理在土壤中分别添加对应盐分溶液,充分混匀在室温下稳定180d,自然风干后过筛储藏,设置3次重复.制备结束后,采用IonPac AS11-HC分析柱及30mmol/L氢氧化钾溶液分离Cl-及SO42-,测定盐处理后土壤样品中Cl-和SO42-含量(Dionex ICS-3000型离子色谱仪),结果见表1.
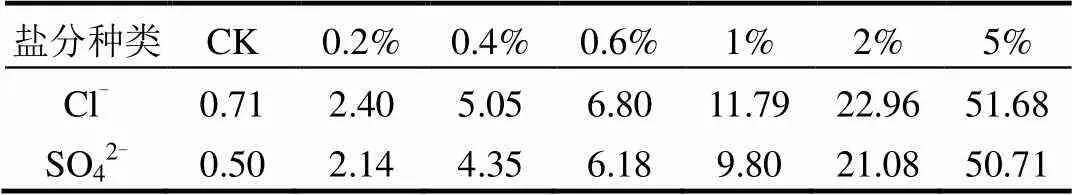
表1 不同盐处理后土壤中Cl-或SO42-含量(g/kg)
1.3 稳定富集同位素试剂
浓缩稳定同位素示踪剂使用美国剑桥同位素实验室公司生产的199HgO和201HgO.示踪剂199Hg(NO3)2和CH3201HgCl分别使用对应的无机氧化汞制备,示踪剂的精确浓度由反同位素稀释分析法测定.
1.4 培养实验及甲基化/去甲基化速率计算
先将制备好的盐渍化土壤200g放置在聚四氟乙烯烧杯中并保持一段时间淹水状态,测定土壤中总汞及MeHg含量,再加入定量示踪剂199Hg(NO3)2(土壤背景含量的80%),充分混匀后置于伊孚森恒温恒湿培养箱中(温度为25℃,湿度为75%),水分条件设置为干湿交替,在第1,2, 3,4,5,6,7,14,21,28,35d连续取样.取样后在样品中加入内标示踪剂CH3201HgCl(土壤背景含量的80%),均匀混合后采用KBr-H2SO4- CuSO4浸提,CH2Cl2萃取,氮气吹洗样本萃取物反萃取,再经NaBPh4乙基化反应生成挥发性的甲基乙基汞,由氮气吹扫捕集于Tenax采样管,使用GC/ICP- MS(Agilent 6890与Agilent 7500ce通过Agilent GC-ICP-MS type接口连接)测定MeHg含量,根据生成的CH3199Hg+速度计算盐渍化环境中汞的甲基化速率.主要操作程序见图1.

图1 稳定同位素标记示踪技术测定汞甲基化的路线
2 结果
2.1 不同盐度盐分处理下土壤CH3199Hg+含量变化趋势
NaCl处理下土壤MeHg含量随培养时间的变化趋势见图2.在未添加NaCl的对照土壤中,CH3199Hg+含量在第1d为0.498μg/kg,仅占添加外源199Hg+的0.104%,到第3d,上升到0.641μg/ kg(占添加外源199Hg+的0.134%,以下同为占添加外源19Hg+的比例),而后基本保持稳定,第35d的含量为0.654μg/kg.添加NaCl后, CH3199Hg+含量发生显著变化.0.2% NaCl处理下,CH3199Hg+含量在第1d为1.151μg/kg,比例为0.242%,在培养结束时,含量上升为1.869μg/kg,比例为0.393%,是同期对照的2.86倍;0.4% NaCl处理下,CH3199Hg+含量在第1d为1.350μg/kg,比例为0.284%,在培养结束时,含量为3.576μg/kg,比例为0.752%,是同期对照的5.47倍;0.6% NaCl处理下,CH3199Hg+含量在第1d为0.899μg/kg,比例为0.189%,在培养结束时,含量为2.62μgkg,比例为0.551%,是同期对照的4倍.1% NaCl处理下,CH3199Hg+含量在第1d为0.747μg/kg,比例为0.157%,在培养结束时,含量为0.909μg/kg,比例为0.191%,与同期对照无显著性差别(<0.05,下同);2% NaCl处理下,CH3199Hg+含量在第1d为0.623μg/kg,比例为0.131%,在培养结束时,含量为0.902μg/kg,比例为0.189%,与同期对照无显著性差别;5%处理下,CH3199Hg+含量基本保持稳定,在第1d为0.413μg/kg,比例为0.082%,在培养结束时,含量为0.435μg/kg,比例为0.093%.可以看出,与对照相比,5% NaCl处理会抑制外源汞加入土壤后MeHg的生成,1%和2%盐度下MeHg的生成量与对照较为接近.盐度0.2%~ 0.6%有利于MeHg的生成,其中0.4%盐度下MeHg的生成量最高.

图2 不同NaCl盐度梯度下土壤CH3199Hg+含量变化趋势

图3 不同Na2SO4盐度梯度下土壤CH3199Hg+含量变化趋势
Na2SO4处理下土壤MeHg含量随培养时间的变化趋势见图3.0.2% Na2SO4处理下, CH3199Hg+含量在第1d为0.561μg/kg,比例为0.118%,在培养结束时,含量为0.702μg/kg,比例为0.147%,与同期对照无显著性差别.其他盐度处理下,CH3199Hg+含量在培养期间基本保持稳定,无明显上升或下降趋势,各时期含量均显著低于同期对照,且各盐度之间的含量无显著性差别.可以看出,当土壤中Na2SO4盐度水平超过0.2%时,会显著抑制外源汞加入土壤后MeHg的生成.
2.2 对外源汞甲基化的动力学模型拟合
培养期间,土壤CH3199Hg+含量变化的总体趋势呈现型曲线变化(图2和图3),表现出迟缓阶段-最大速率阶段-稳定阶段,这与Logistic生长曲线相符合.利用Origin 8.6SR2 对MeHg生成过程进行Logistic动力学方程拟合,结果表明,曲线拟合度较好,有较高的决定系数2和较小的标准误SE
Logistic动力学模型[11]为:

式中:为时间对应的CH3199Hg+含量,μg/kg;为的极限值,即最大生成量,μg/kg;为模型参数;为反应的速率常数,即CH3199Hg+的产生(汞甲基化)速率常数.通过曲线回归得到;为培养时间,d.由模型拟合的各参数见表2.可以看出,决定系数为0.874~0.981,达到极显著水平(<0.01).
可以看出,外源199Hg2+在对照土壤中最大MeHg(CH3199Hg+)生成量为0.698μg/kg,1%、2% NaCl处理和0.2% Na2SO4处理的最大MeHg生成量与对照较为接近,分别为0.888,0.846, 0.792μg/kg,0.2%、0.4%和0.6% NaCl处理下最大MeHg生成量与对照相比显著提高,达到了1.882,3.589,2.497μg/kg,0.4% NaCl处理的最大MeHg生成量超过对照的5倍.
对公式(1)进行求导,可以得到甲基化速率[μg/(kg·d)]:
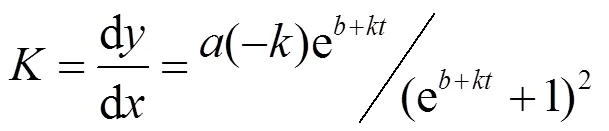
对公示(2)求极值,可得最大甲基化速率max[μg/(kg·d)]
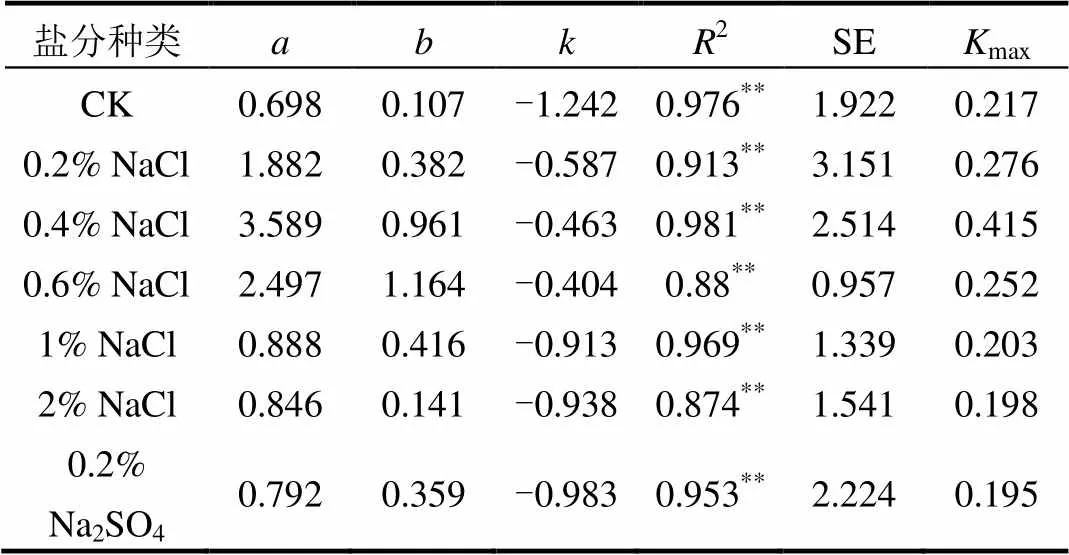
表2 Logistic动力学模型拟合参数及统计特征值
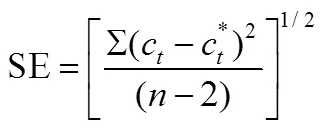
最大甲基化速率max拟合值见表2.可以看出,各处理的最大甲基化速率与最大生成量的排序基本一致.对照土壤(CK)的最大汞甲基化速率为0.217μg/(kg·d),1%、2% NaCl处理和0.2% Na2SO4处理的最大汞甲基化速率与对照比较接近,分别为0.203,0.198,0.195μg/(kg·d),0.2%、0.4%和0.6% NaCl处理下最大汞甲基化速率与对照相比显著提高,达到了0.276,0.415,0.252μg/ (kg·d),0.4% NaCl处理的最大汞甲基化速率约为对照的2倍.
3 讨论
从1969年发现微生物能使汞甲基化以来,对环境体系中汞的甲基化机制还了解的很少,目前比较主流的观点是MeHg主要由微生物甲基化产生,但近年来发现非微生物甲基化作用也广泛存在.从本研究的测定结果来看,土壤体系中汞的甲基化与去甲基化作用是一个复杂的动态过程,利用汞稳定同位素示踪剂,结合GC-ICP-MS,可以将外源汞的甲基化过程从环境的复杂综合反应体系中剖离出来,显示出强大的功能和作用,测试精度高,是定量化研究汞甲基化的有力手段,有广阔的应用前景.
已有研究证实盐度是影响海洋和河口沉积物中汞甲基化的重要因素,但这方面的文献并不多.本研究中,NaCl处理下,随着盐度的增长,汞甲基化程度总体呈现先增长后降低的趋势.盐度在0.2%~0.6%时,外源Hg进入土壤后MeHg的生成量和甲基化速率与对照相比显著提高,其中0.4%盐度下汞甲基化程度最高;盐度在1%~2%时汞甲基化程度与对照较为接近,高盐度(5%)对汞甲基化有明显的抑制作用.这可能与Cl-与Hg(II)之间的络合作用有关.已有研究表明,Cl-对于Hg(II)而言是最易移动和最常见的结合剂[12].当NaCl盐度较低时,Cl-与Hg(II)之间存在强烈的络合作用,可形成HgCl3-和HgCl42-等多种负性络合离子,使得带负电荷的腐殖物质和粘土矿物胶体对汞的专性吸附作用显著降低,进而使土壤对Hg(II)的固持量及吸附速率迅速下降[12-14], Hg在土壤中的移动性及活性增强,增加了汞甲基化的供应量,甲基化率上升;但当盐度进一步提高后,微生物可能通过溶液体系中渗透压变化而影响其物质运输过程,引起细胞质壁分离,造成细胞死亡或活性下降,从而降低汞甲基化程度[15-16].这一结果表明,一定浓度下NaCl环境可能会有利于汞的甲基化,土壤盐渍化趋势或用含NaCl的污水灌溉作物可能会提高汞的甲基化风险.本研究的结果与之前关于盐度对沉积物中汞甲基化影响的研究相一致,Compeau等[17]研究表明,在还原条件下,0.4%盐度下沉积物中汞甲基化程度较高,高盐度(2.5%)会抑制汞的甲基化,且高盐度环境下生成的MeHg不稳定,容易发生去甲基化.陈效等[18]试验结果显示,0.7%盐度条件下汞甲基化程度较高,3.5%盐度水平下汞的甲基化几乎完全被抑制.Blum等[19]发现,盐度高(3%)时的甲基化速率只有盐度低时(0.1%)的40%,且高盐度对于汞甲基化的限制主要体现在还原环境中.但Compeau等[20]对海水中汞甲基化的研究中,在海水中添加Cl-会显著降低汞甲基化程度(添加量为0.01~0.5mol/L).由于生态系统中的汞甲基化是一个受诸多因素影响的复杂过程,各环境因子间的相互作用、一个环境因子对甲基化的影响在不同环境中表现可能并不一样,每个生态系统都具有独特的环境因子组合,不同的研究可能得到相反的结论,因此需要开展更为系统深入的研究.
添加Na2SO4处理总体上使土壤汞甲基化率降低,这可能与淹水环境下土壤甲基化微生物在还原硫酸盐的过程中产生了大量难溶于水的硫化物,降低了汞甲基化的供应量有关[21-22]. Compeau等[17]的研究结果与本研究相一致,在Eh-220mV条件下,加入SO42-使盐沼沉积物中HgCl2甲基化比例大幅度下降.但也有硫(酸盐)沉降促使土壤中MeHg含量增加的报道,Jeremiason等[23]发现,在湿地喷淋硫酸盐后(5月),与未施硫酸盐的控制区相比,土壤MeHg水平升高,显示硫刺激了某些微生物,使其在呼吸时将其他形式的汞转化为MeHg.但是在7月和9月的试验中,喷淋硫酸盐后,湿地MeHg并没有显著增加,甚至低于检测下限.这2次的试验与5月的试验不同在于,他们在施雨后在测量前等了1d,说明加入硫酸盐的时间长短也是影响汞甲基化的重要因素.考虑到本研究中土壤加入硫酸盐后老化时间超过90d,Jeremiason等的研究结果与本研究相比并不矛盾.
4 结论
4.1 利用汞稳定同位素示踪剂,结合GC-ICP- MS,可以将外源汞的甲基化过程从环境的复杂综合反应体系中剖离出来,是比传统含量测定更为直观和精确的分析手段.
4.2 外源汞加入土壤后,在培养期间,土壤MeHg含量总体呈型变化趋势,表现出迟缓-最大速率-稳定3个阶段,用Logistic方程可以理想的拟合盐处理下外源汞添加入土壤后生成MeHg的动力学过程.
4.3 NaCl处理下,随着盐度的增长,汞甲基化程度总体呈现先增长后降低的趋势.0.2%~0.6%盐度下,外源Hg进入土壤后MeHg的生成量和甲基化速率与对照相比显著提高,其中0.4%盐度下汞甲基化程度最高,盐度在1%~2%时汞甲基化程度与对照比较接近,高盐度(5%)对汞甲基化有明显的抑制作用.Na2SO4处理下,当盐度水平超过0.2%时,会显著抑制外源汞加入土壤后MeHg的生成.
[1] Li P, Feng X B, Qiu G L, et al. Mercury pollution in Asia: a review of the contaminated sites [J]. Journal of Hazardous Materials, 2009,168(2):591-601.
[2] Rothenberg S E, Windham-Myers L, Creswell J E. Rice methylmercury exposure and mitigation: A comprehensive review [J]. Environmental Research, 2014,133:407-423.
[3] 郑顺安,唐杰伟,郑宏艳,等.污灌区稻田汞污染特征及健康风险评价[J]. 中国环境科学, 2015,35(9):2729-2736.
[4] Rodríguez-González P, Marchante-Gayón J M, García Alonso J I, et al. Isotope dilution analysis for elemental speciation: a tutorial review [J]. Spectrochimica Acta Part B: Atomic Spectroscopy, 2005,60(2):151-207.
[5] Di H J, Cameron K C, Mclaren R G. Isotopic dilution methods to determine the gross transformation rates of nitrogen, phosphorus, and sulfur in soil: a review of the theory, methodologies, and limitations [J]. Soil Research, 2000,38(1):213-230.
[6] 王祖伟,张 辉.天津污灌区土壤重金属污染环境质量与环境效应[J]. 生态环境, 2005,14(2):211-213.
[7] 王 婷,王 静,孙红文,等.天津农田土壤镉和汞污染及有效态提取剂筛选[J]. 农业环境科学学报, 2012,31(1):119-124.
[8] 鲁如坤.土壤农业化学分析方法[M]. 北京:中国农业科技出版社, 2000.
[9] GB 15618-1995土壤环境质量标准[S].
[10] 王美丽,李 军,岳甫均,等.天津盐渍化农田土壤盐分变化特征[J]. 生态学杂志, 2011,30(9):1949-1954.
[11] 王济川,郭志刚. Logistic回归模型:方法与应用[M]. 北京:高等教育出版社, 2001.
[12] Yin Y J, Allen H E, Li Y, et al. Adsorption of mercury (II) by soil: effects of pH, chloride, and organic matter [J]. Journal of Environmental Quality, 1996,25(4):837-844.
[13] Yin Y J, Allen H E, Huang C P, et al. Adsorption/desorption isotherms of Hg (II) by soil [J]. Soil Science, 1997,162(1):35-45.
[14] Yin Y J, Allen H E, Huang C P, et al. Kinetics of mercury (II) adsorption and desorption on soil [J]. Environmental Science & Technology, 1997,31(2):496-503.
[15] Boyd E S, Yu R Q, Barkay T, et al. Effect of salinity on mercury methylating benthic microbes and their activities in Great Salt Lake, Utah. [J]. Science of the Total Environment, 2017,495:581- 582.
[16] Laporte J M, Truchot J P, Ribeyre F, et al. Combined effects of water pH and salinity on the bioaccumulation of inorganic mercury and methylmercury in the shore crab Carcinus maenas [J]. Marine Pollution Bulletin, 1997,34(11):880-893.
[17] Compeau G, Bartha R. Methylation and demethylation of mercury under controlled redox, pH and salinity conditions. [J]. Appl. Environ. Microbiol., 1984,48(6):1203-1207.
[18] 陈 效,徐 盈,张甲耀,等.硫酸盐还原菌对汞的甲基化作用及其影响因子[J]. 水生生物学报, 2005,29(1):50-54.
[19] Blum J E, Bartha R. Effect of salinity on methylation of mercury [J]. Bulletin of Environmental Contamination and Toxicology, 1980,25(1):404-408.
[20] Compeau G, Bartha R. Effects of sea salt anions on the formation and stability of methylmercury [J]. Bulletin of Environmental Contamination and Toxicology, 1983,31(4):486-493.
[21] Barkay T, Schaefer J K, Poulain A J, et al. Microbial transformations in the mercury geochemical cycle [J]. Geochimica Et Cosmochimica Acta, 2005,69(10):A702.
[22] Hellal J, Guédron S, Huguet L, et al. Mercury mobilization and speciation linked to bacterial iron oxide and sulfate reduction: A column study to mimic reactive transfer in an anoxic aquifer [J]. Journal of Contaminant Hydrology, 2015,180:56-68.
[23] Jeremiason J D, Engstrom D R, Swain E B, et al. Sulfate addition increases methylmercury production in an experimental wetland [J]. Environmental Science & Technology, 2006,40(12):3800- 3806.
Investigating effect of salinity on methylation of exogenous mercury of soil in wastewater-irrigated area by labeling with stable isotopically enriched tracers.
ZHENG Shun-an1,2,3, ZHOU Wei1, XUE Ying-hao1, XI Bin1, HUANG Hong-kun1, DUAN Qing-hong1, ZHENG Xiang-qun2*
(1.Rural Energy & Environment Agency, Ministry of Agriculture, Beijing 100125, China;2.Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China;3.Key Laboratory of Technologies and Models for Cyclic Utilization from Agricultural Resources,Ministry of Agriculture, Beijing 100125, China)., 2017,37(11):4195~4201
This study is designed to pinpoint the effect of salinity (NaCl and Na2SO4, add at salinity levels of 0%~5%, respectively) on methylation of exogenous Hg (II) in wastewater-irrigated areas of Tianjin City. Solutions containing stable isotope tracers of199Hg2+were spiked into the soils at the concentrations of 80% of the total soil mercury. The formation of CH3199Hg+(MeHg) was measured in time series experiments using gas chromatographic separation and isotope-specific detection by inductively coupled plasma mass spectrometry. The results manifested that, generally, changes in concentrations of CH3199Hg+in soil with incubation time were similar in direction and pathways, and three regions (retarded-sharp-stable) could be distinguished. Logistic equation can well fitted kinetic experimental data of concentrations of CH3199Hg+formed during the incubation time. According to Logistic model, the maximum amount of formed MeHg of control soil (without salinity addition) was 0.698μg/kg, while the maximum methylation rate of exogenous Hg was 0.217μg/(kg·d). In NaCl spiked soils, methylation rate of exogenous Hg increased first and then decreased with the increasing salinity level of NaCl. It found that the maximal amount of formed MeHg and the methylation rate of exogenous Hg were significantly higher in 0.2%~0.6% NaCl spiked soils by comparison with control soil. The highest amounts of them were in 0.4% NaCl soil, which accounted for 3.589μg/kg and 0.415μg/(kg·d), respectively. The maximal amount of formed MeHg over incubation time and the methylation rate of exogenous Hg in 1%~2% NaCl spiked soils were close to them in control soil. It also found that high salinity level of NaCl (5%) inhibited the methylation of exogenous Hg. In Na2SO4spiked soils, salinity (>0.2%) constrained the availability of mercury for methylation. The results of these studies demonstrated higher MeHg production potentials in comparatively lower salinity environments, which may enhance Hg bioavailability in the soil and cause a hazard to human body through the food chain.
wastewater irrigated area;mercury;isotopic labeling;methylation;NaCl;Na2SO4
X53
A
1000-6923(2017)11-4195-07
郑顺安(1981-),男,安徽合肥人,副研究员,博士,从事耕地污染防治、产地环境调查监测等研究.发表论文30余篇.
2017-05-01
国家自然科学基金资助项目(41203084,41371463);国家水体污染控制与治理科技重大专项(2015zx07103-007);国家重点研发计划(2016YFD0201306,2016YFD0201200,2017YFD0801401)
* 责任作者, 研究员, xqzheng_aepi@163.com
