酿酒酵母不同培养方式和生长阶段的代谢组差异分析
2017-11-23,,,,,
,, ,, ,
(浙江工业大学 生物工程学院,浙江 杭州 310014)
酿酒酵母不同培养方式和生长阶段的代谢组差异分析
孙杰,于欣君,王微,朱有贵,姜杰,汪钊
(浙江工业大学 生物工程学院,浙江 杭州 310014)
与液态发酵相比,对固态发酵过程中酵母生长期转换前后的生理状态研究较少.细胞内的代谢物组成变化与生理状态密切相关.研究了酿酒酵母固态和液态发酵状态下,指数生长期和二次生长期菌体的胞内代谢组差异.结果表明生长阶段的转换伴随着中心代谢的复杂变化.液态和固态发酵过程中,分别检测到了131种和117种不同生长阶段的差异代谢物.两个生长阶段的主要代谢差异均反映在蛋白质合成、氨基酸代谢和三羧酸循环等代谢途径上,与培养方式无关.本研究为进一步阐明不同发酵方式下酵母的代谢调控机制奠定了基础.
酿酒酵母;代谢组分析;固态发酵;指数生长;二次生长
酿酒酵母是研究微生物生理代谢的模式生物[1],并且广泛应用于酿酒、面包烘焙和饲料工业[2]等领域.在生物催化领域也有广泛的应用[3].在酵母发酵的初始阶段,利用糖作为碳源,细胞迅速生长和分裂,生物质得到指数生长,该阶段称为指数生长阶段.当培养基中碳源为限制因素时,细胞生长速率下降,从发酵代谢转变为呼吸代谢,生长阶段转变至二次生长阶段,此时细胞开始利用培养基中产生的乙醇作为新的碳源.最终,当营养物质耗尽,细胞进入静止期,生长停滞,生物量保持恒定[4].固态发酵(Solid-state fermentation,SSF)是在无水或接近无水状态下的固态基质上进行的发酵过程[5].固态发酵经常用于发酵食品[6]、生产酶[7]以及抗生素、真菌毒素等次生代谢产物[8].与液态发酵(Submerged fermentation,SmF)相比,固态发酵过程中细胞移动、胞内代谢产物和营养物质的扩散均受到限制.另外,固态发酵期间微生物的生长、基因表达和代谢情况均不同于液态发酵[9-10],这使得两种发酵过程中微生物胞内营养状态截然不同.
与液态培养相比,对固态发酵过程中酵母生长期转换前后的生理状态研究较少.细胞内的代谢物组成变化与生理状态密切相关.笔者观察了酿酒酵母固态和液态发酵状态下,指数生长期和二次生长期菌体内代谢组差异,为进一步深入阐明固态发酵的代谢调控机制奠定了基础.
1 材料与方法
1.1 材 料
1.1.1 菌株与培养基
SaccharomycescerevisiaeWZS017,为本实验室分离得到的二倍体野生型酵母.YPD液体培养基组成为2%葡萄糖,1%酵母提取物,2%蛋白胨.
1.1.2 主要仪器
气相色谱质谱联用仪(LECO Corporation, St Joseph, MI, USA)、冷冻离心机(德国SIGMA 2-16PK)、负压烘箱(上海博迅实业有限公司).
1.1.3 主要试剂
甲氧胺盐酸盐、吡啶、2-氯苯丙氨酸、N,O-双(三甲基硅烷基)三氟乙酰胺(BSTFA)和三甲基一氯硅烷(TMCS)均购自Sigma;甲醇和正己烷为国产色谱纯.
1.2 方 法
1.2.1 酵母培养条件
酿酒酵母30 ℃过夜预培养于YPD液体培养基中.将预培养液600 nm吸光度调至0.25.在液态培养中,1 mL酵母预培养物转移至30 mL YPD液体培养基中,30 ℃,150 r/min进行培养.在固态培养中,使用直径2~3 mm的发泡聚苯乙烯颗粒作为惰性固态载体,121 ℃灭菌15 min,颗粒会缩小约2/3(Brydson,1982).将3.2 g灭菌的发泡聚苯乙烯颗粒置于100 mL三角瓶中,接种1 mLOD600调至0.25的酵母预培养物,再加入1.8 mL YPD液体培养基,接种后没有观察到游离水存在,30 ℃静置培养.
1.2.2 生长曲线绘制
通过测量600 nm的光密度进行酵母细胞的生长曲线测定.固态发酵过程中酵母生长曲线的测定是将培养物中液体加至30 mL,剧烈振荡10 min后,进行测定.生长速率计算公式为
μ=(lnX2-lnX1)/(t2-t1)
式中:X1,X2分别为培养物在培养时间t1和t2的OD600吸光度.实验重复3次.
1.2.3 胞内代谢物提取
1.2.4 GC-MS测定
取1 μL衍生化后的样品注入GC-TOF/MS系统进行测定.柱子为非极性DB-5毛细管柱(30 m×250 μm I.D., J&W Scientific, Folsom, CA),氦气作为载气,流速1.0 mL/min.GC温度程序为15 ℃/min从50 ℃升到125 ℃, 然后5 ℃/min升到210 ℃,10 ℃/min升到270 ℃,15 ℃/min升至305 ℃,305 ℃保持6 min.离子源温度230 ℃.质谱设置为全扫描模式,扫描范围为m/z=50~600.通过ChromaTOF软件使用标准质谱数据库和Feinh数据库进行代谢产物鉴定.相似度大于70%被认定为参考标准代谢物.
1.2.5 实验数据处理与统计分析
液态发酵21 h的样本个数为5个,其余每组样品个数为6个.每个样品平行测定两次.每个样品各个代谢物的峰面积除以该样品所有代谢物峰面积之和,得到该代谢物的细胞内相对量.使用SPSS 13.0对数据进行t检验.p<0.05代表差异显著,p<0.01代表差异极显著.
使用SIMCA软件(Umetrics,Umea,Sweden)进行非监督的主成分分析(PCA)区分不同培养方式下不同生长阶段的酵母样本.使用PLS-DA根据代谢物轮廓差异对样品进行分组,并指出差异代谢物.使用R2和Q2评估所构建的PCA和PLS-DA模型的质量.通过PLS-DA模型,选择VIP>1的代谢物作为指数生长和二次生长阶段的候选差异代谢物.将候选差异代谢物的相对量进行t检验.只有p<0.05的代谢物定义为差异代谢物.为进一步阐明差异代谢物的生物学意义,使用MetaboAnalyst 3.0(http://www.metaboanalyst.ca)的Enrichment Analysis模块,将差异代谢物富集在代谢途径上,使用超几何分布法计算富集p值.
2 结果与分析
2.1 酿酒酵母固态发酵和液态发酵的生长曲线
为了确定酵母指数生长和二次生长阶段代谢物提取的时间点,首先绘制了固态发酵和液态发酵的生长速率曲线.在接种量相同的条件下,固态发酵过程中酵母细胞的生物量远低于液态发酵(图1a).如图1(b)所示,酿酒酵母的生长期分为指数期和二次生长期,不同的生长阶段,生长速率差异较大.在本实验条件下,固态发酵酵母细胞在15 h结束指数生长,之后的二次生长阶段在29 h结束.而液态发酵的这两个时间点分别是17 h和33 h.两种培养方式下酵母的生长速率均在接种后7 h达到最高,在指数生长阶段,固态发酵细胞的生长速率低于液态发酵,然而到了二次生长阶段,两种培养方式的生长速率则相差不大.在两种发酵培养方式中,11 h和21 h均分别位于指数生长期和二次生长期,将这两个时间点确定为两个生长阶段的取样时间点.
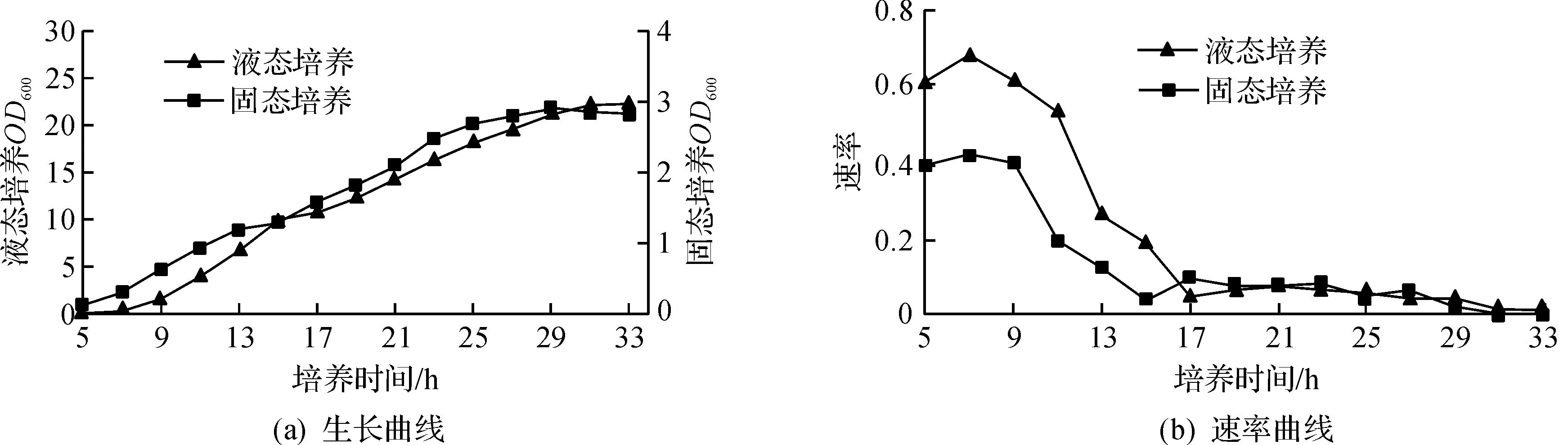
图1 酵母液态发酵和固态发酵的生长曲线和生长速率曲线Fig.1 Growth curve and growth rate of yeast in with solid-state and submerged fermentation
2.2 酵母液态和固态发酵的胞内代谢物轮廓
酵母细胞两种发酵方式下的样品进行代谢物提取和GC-MS测定后,PCA分析表明各个样品可以根据重新组合后的变量进行正确分组(R2X=0.678,Q2=0.561),由于发酵方式和生长阶段的不同导致了67.8%的样品数据差异见图2(a).
为了确定差异代谢物,进一步使用PLS-DA模型进行样品分类见图2(b,c).建立PLS-DA模型,成对比较不同培养方式下的两个生长阶段的差异代谢物.对于液态发酵的指数生长(SmF11 h)和二次生长阶段(SmF21 h)的样品组PLS-DA模型,R2X=0.656,R2Y=0.998,Q2=0.982;对于固态发酵的指数生长(SSF11 h)和二次生长阶段(SSF21 h)的样品组PLS-DA模型,R2X=0.545,R2Y=0.991,Q2=0.934.说明PLS-DA模型成功构建,具有很高的拟合度和预测能力.不同的生长阶段的代谢物具有很大的差异,可以根据变量重新组合后的主成分进行分辨.
VIP>1的代谢物的相对量差异使得不同样品在PLS-DA模型中成功分组[12].将VIP>1且p<0.05的代谢物作为指数生长和二次生长阶段的差异代谢物.基于PLS-DA的结果,液态发酵的指数生长(SmF11 h)和二次生长阶段(SmF21 h)的差异代谢物共有131种,固态发酵的指数生长(SSF11 h)和二次生长阶段(SSF21 h)的差异代谢物共有117种.
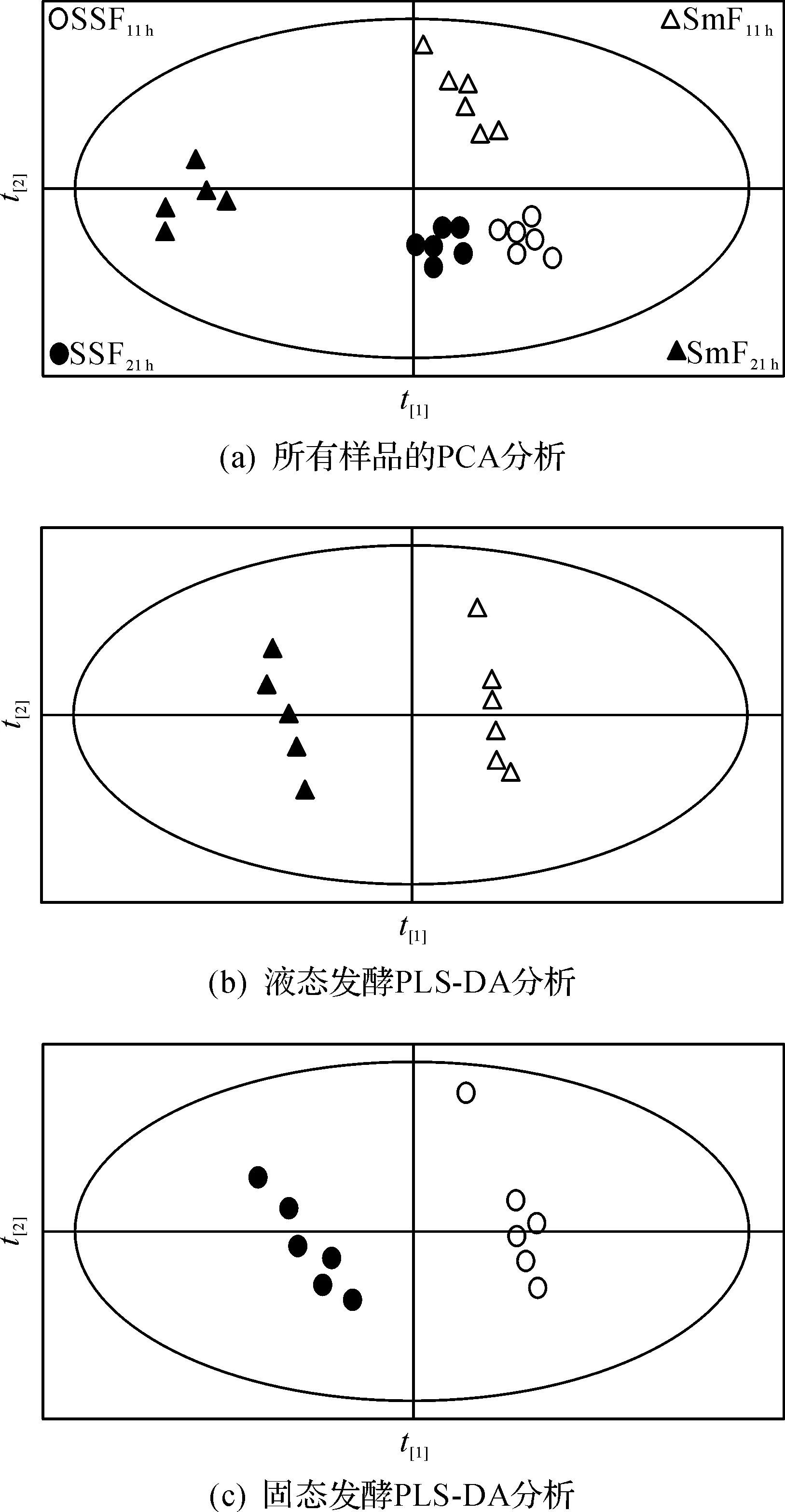
图2 酵母液态和固态培养条件下酵母胞内代谢物的主成分分析Fig.2 Scores plots for yeast metabolites of SmF and SSF
2.3 同一培养方式不同生长阶段的代谢物变化
SmF11 h与SmF21 h和SSF11 h与SSF21 h具有共同的93种差异代谢物,表1列出了其中的一些.代谢物的途径富集分析表明,这些共同差异代谢物主要涉及蛋白质合成和氨基酸代谢等与细胞生长密切相关的代谢途径(图3),因此无论是液态培养还是固态培养,蛋白质和氨基酸的代谢差异是指数生长阶段和二次生长阶段的主要代谢差异.
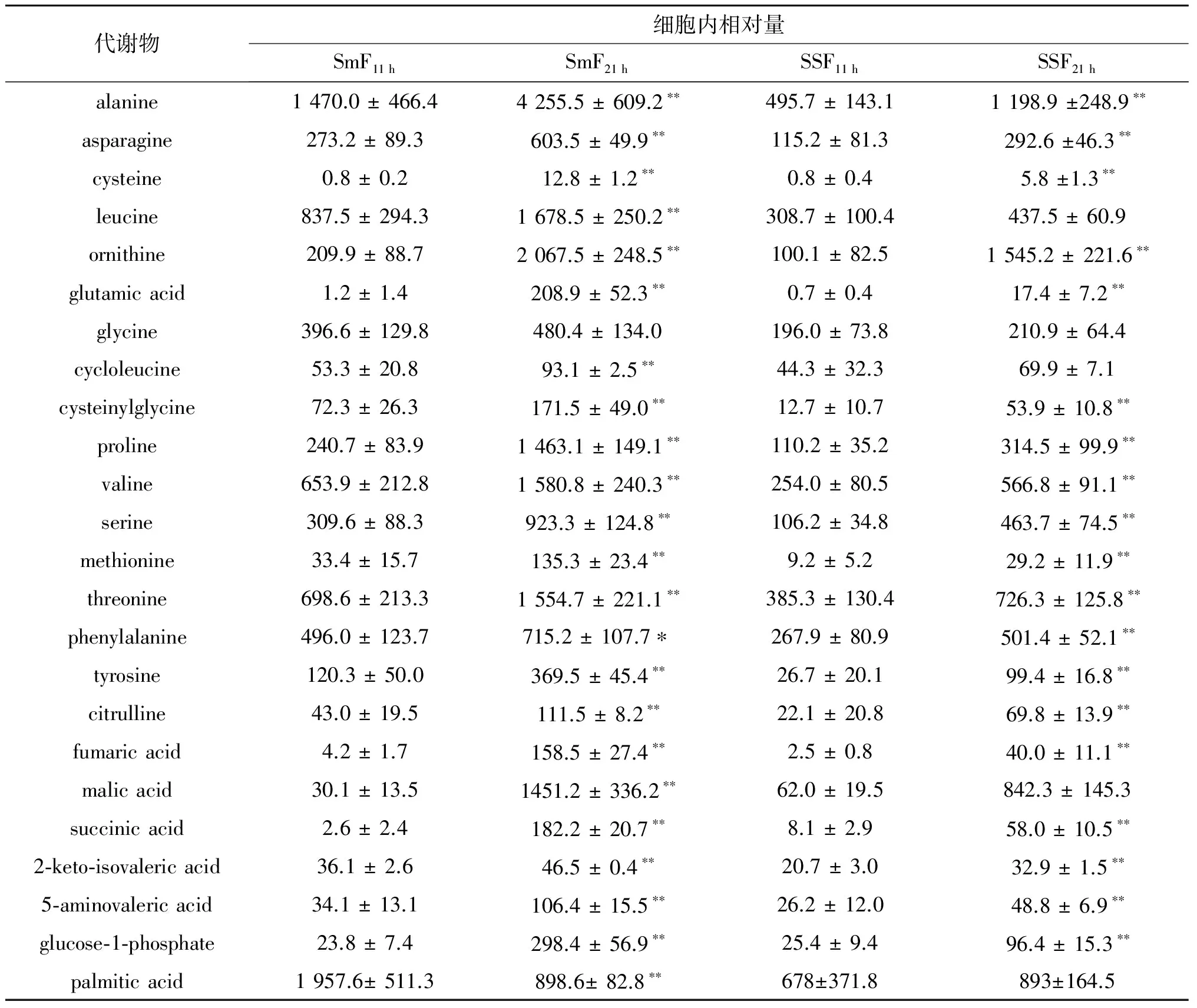
表1 SmF11 h与SmF21 h和SSF11 h与SSF21 h的一些共同差异代谢物细胞内相对量1)Table 1 The relative content of some differential metabolites shared by SmF11 h versus SmF21 h and SSF11h versus SSF21 h
注:1) *表示同一培养方式下指数增长期与二次生长期差异显著(p< 0.05);**表示差异极显著(p< 0.01).同表2,3.
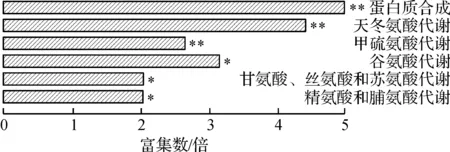
图3 SmF11 h与SmF21 h和SSF11 h与SSF21 h的共同差异代谢物代谢途径富集Fig.3 Pathway enrichment of differential metabolites shared by SmF11 h versus SmF21 h and SSF11 h versus SSF21 h
上述富集到蛋白质合成过程中的氨基酸包括酪氨酸、丙氨酸、苯丙氨酸、苏氨酸、天冬氨酸、半胱氨酸、亮氨酸、甲硫氨酸、谷氨酸和缬氨酸.与指数生长期相比,二次生长阶段菌体细胞更低的生长速率和更少的蛋白质合成量,使得氨基酸在细胞中得到积累.研究表明:上述氨基酸除半胱氨酸以外,在两种培养方式下,二次生长期和指数期的浓度之比变化不大.鸟氨酸、环亮氨酸和半胱氨酰甘氨酸等非蛋白质氨基酸或氨基酸衍生物也有类似的规律.在液态培养过程中,二次生长阶段胞内谷氨酸和半胱氨酸相对量分别为指数生长期的168.3和15.4倍,而在固态培养条件下,二次生长阶段的这两种氨基酸的量为指数生长期的25.7和7.0倍.因此,谷氨酸和半胱氨酸可能在两种不同发酵方式下的细胞代谢网络中扮演重要角色.富马酸、苹果酸和琥珀酸等三羧酸循环的中间代谢物也在二次生长阶段大量积累,这与细胞在此阶段生长速率降低、能量代谢减少和有氧呼吸受到抑制有关.这与Frick等[13]的报道一致.另外,作为细胞膜成分的饱和脂肪酸棕榈酸在液态培养时,二次生长阶段细胞内相对量显著低于指数期,而在固态培养时,则在两阶段相差不大.
除上述93种共同的差异代谢物外,SmF11 h与SmF21 h之间特有的差异代谢物的数目为38种,SSF11 h与SSF21 h之间特有的差异代谢物为24种.这些差异代谢物分别决定了液态和固态培养方式中,不同生长阶段转化前后的代谢网络差异.
如表2所示,在检测到的SmF11 h与SmF21 h之间特有的差异代谢物中,不饱和脂肪酸油酸相对量在二次生长阶段显著降低.油酸是微生物细胞膜的组成部分,其显著降低的细胞内相对量或与酵母细胞在二次生长阶段的细胞生长速率显著降低、细胞膜流动性下降有关.天冬氨酸、异亮氨酸及高丝氨酸、正亮氨酸和同型半胱氨酸等一些氨基酸衍生物在二次生长阶段胞内大量积累.4-羟基丁酸一些小分子羧酸等次生代谢产物在二次生长阶段开始合成或积累.
表2SmF11 h与SmF21 h的一些差异代谢物细胞内相对量
Table2TherelativecontentofsomedifferentialmetabolitesbetweenSmF11handSmF21h

代谢物细胞内相对量SmF11hSmF21holeicacid1435.8±531.0442.8±41.2∗∗L⁃homoserine0.6±0.24.0±0.7∗∗norleucine24.6±10.055.7±13.4∗∗homocystine—18.1±5.0∗∗asparticacid112.2±46.31108.2±115.7∗∗isoleucine324.1±112.7810.9±128.4∗∗4⁃hydroxybutyricacid—4.7±1.2∗∗adipicacid1.7±0.93.6±0.2∗∗gluconicacid20.9±7.8304.7±173.5∗∗
SSF11 h与SSF21 h之间独有的24种差异代谢物,也在生长阶段转变中发挥重要作用.表3列出了该过程中一些重要的差异代谢物.在液态培养过程中,这些代谢物对指数和二次生长的差异贡献率较低.而在固态培养过程中差异较大,可能与细胞内部水分含量较低,导致的生长状态改变有关.在固态发酵二次生长阶段,细胞内积累了更高量的葡萄糖和赤藓糖,表明该阶段的碳源利用效率与液态发酵存在较大差异.固态发酵条件下,代谢产物无法扩散出细胞,柠檬酸大量积累,是液态发酵相同培养阶段的126.4倍,或许与使用固态发酵生产柠檬酸有着相似的代谢调控机[14].上述现象表明:在固态发酵二次生长阶段,葡萄糖的有氧代谢受到了更明显的抑制.鸟嘌呤核苷、赖氨酸和琥珀酸半醛等差异代谢产物在固态发酵中所受到的调控机制现在还不清楚.
表3SSF11 h与SSF21 h的一些差异代谢物细胞内相对量
Table3TherelativecontentofsomedifferentialmetabolitesbetweenSSF11 handSSF21 h
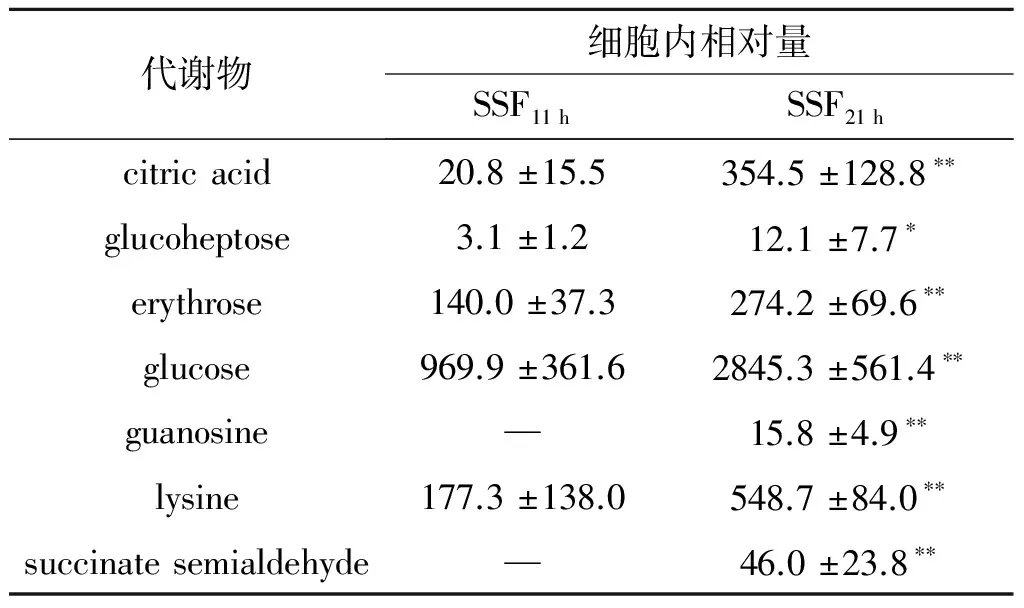
代谢物细胞内相对量SSF11hSSF21hcitricacid20.8±15.5354.5±128.8∗∗glucoheptose3.1±1.212.1±7.7∗erythrose140.0±37.3274.2±69.6∗∗glucose969.9±361.62845.3±561.4∗∗guanosine—15.8±4.9∗∗lysine177.3±138.0548.7±84.0∗∗succinatesemialdehyde—46.0±23.8∗∗
3 结 论
本研究检测到了SmF11 h与SmF21 h之间和SSF11 h与SSF21 h之间具有共同的93种差异代谢物.SmF11 h与SmF21h之间特有的差异代谢物的数目为38种,SSF11 h与SSF21 h之间的特有差异代谢物为24种.这些差异代谢物分别决定了液态和固态培养方式中,不同生长阶段转化前后的代谢网络差异.无论是液态培养还是固态培养,蛋白质和氨基酸的代谢差异是指数生长阶段和二次生长阶段的主要代谢差异.两种培养方式下富马酸、苹果酸和琥珀酸等三羧酸循环的中间代谢物也在二次生长阶段大量积累,这与细胞在此阶段生长速率降低、能量代谢减少和有氧呼吸受到抑制有关.SmF11 h与SmF21 h之间特有的38种差异代谢物中,油酸和棕榈酸的相对量在二次生长阶段显著降低.SSF11 h与SSF21 h之间特有的差异代谢物表明:在固态发酵二次生长阶段,细胞内积累了更高浓度的葡萄糖和赤藓糖.固态发酵条件下,代谢产物无法扩散出细胞,柠檬酸在胞内大量积累.
本文得到了浙江工业大学自然科学基金(1301105071408)的资助.
[1] OLIVER S G. Functional genomics: lessons from yeast[J]. Philosophical transactions-royal society B biological sciences,2002,357:17-23.
[2] 王普,杨根生,虞炳钧.糖化酵母直接发酵甘薯原料生产蛋白强化饲料[J].浙江工业大学学报,1998,26(4):282-287.
[3] 崔志峰,车智博,杨霄,等.2-苯乙醇耐受性高产酵母菌株的选育[J].浙江工业大学学报,2008,36(4):427-430.
[4] MARTINS A M, CAMACHO D, SHUMAN J, et al. A systems biology study of two distinct growth phases ofSaccharomycescerevisiaecultures[J]. Current genomics,2004,5(8):649-663.
[5] SINGHANIA R R, PATEL A K, SOCCOL C R, et al. Recent advances in solid-state fermentation [J]. Biochemical engineering journal.2009,44(1),13-18.
[6] 刘英丽,李文采,张慧娟,等.传统发酵食品产香酵母菌的筛选及其发酵产香特性研究[J].中国食品学报,2015(4):63-70.
[7] SELVAKUMAR P, ASHAKUMARY L, PANDEY A. Biosynthesis of glucoamylase from aspergillus niger by solid-state fermentation using tea waste as the basis of a solid substrate[J]. Bioresource technology,1998,65(1/2):83-85.
[8] ROBINSON T, SINGH D, NIGAM P. Solid-state fermentation: a promising microbial technology for secondary metabolite production[J]. Applied microbiology and biotechnology,2001,55(3):284-289.
[9] PANDEY A, SOCCOL C R, MITCHELL D. New developments in solid state fermentation. I. bioprocesses and products[J]. Process biochemistry,2000,35(10):1153-1169.
[12] SZETO S S, REINKE S N, SYKES B D, et al. Mutations in theSaccharomycescerevisiaesuccinate dehydrogenase result in distinct metabolic phenotypes revealed through1H NMR-based metabolic footprinting[J]. Journal of proteome research,2010,9(12):6729-6739.
[13] FRICK O, WITTMANN C. Characterization of the metabolic shift between oxidative and fermentative growth inSaccharomycescerevisiaeby comparative13C flux analysis[J]. Microbial cell factories,2005,4(1):30.
[14] KUMAR D, JAIN V K, SHANKER G, et al. Utilisation of fruits waste for citric acid production by solid state fermentation[J]. Process biochemistry,2003,38(12):1725-1729.
(责任编辑:刘 岩)
MetabolomeanalysisofSaccharomycescerevisiaeindifferentculturepatternsandgrowthphases
SUN Jie, YU Xinjun, WANG Wei, ZHU Yougui, JIANG Jie, WANG Zhao
(College of Biotechnology and Bioengineering, Zhejiang University of Technology, Hangzhou 310014, China)
Compared with submerged fermentation, the physiological status of yeast during the growth swift in solid-state fermentation caught little attention. The change of intracellular metabolite composition is closely related to physiological status. Metabolome analysis ofSaccharomycescerevisiaein exponential growth and post-diauxic growth with solid-state and submerged fermentation was performed. Principal components analysis of metabolite profiles showed that the metabolic shift between different growth phases was accompanied by complex changes of the central metabolism. The amount of the differential metabolites between the two growth stages were 131 and 117 with solid-state and submerged fermentation, respectively. The protein synthesis, amino acid metabolism and Kreb’s cycle are the main difference between the two growth stages in both processes of solid-state and submerged fermentation. This study laid a foundation for further elucidation of the metabolic regulation mechanism of yeast in different fermentation processes.
Saccharomycescerevisiae; metabolome analysis; solid-state fermentation; exponential growth; post-diauxic growth
2017-04-10
浙江省自然科学基金资助项目(LQ14C010002)
孙 杰(1981—),男,内蒙古包头人,讲师,博士,研究方向为微生物代谢,E-mail:jsun@zjut.edu.cn.
Q935
A
1006-4303(2017)06-0654-06
