2-BP对中性粒细胞趋化性的抑制作用
2017-11-22孙锦霞焦琛琛
孙锦霞,王 瑞,谭 笑,焦琛琛,黄 钟
1)深圳大学医学部中心实验室,广东深圳518060;2)聊城大学药学院,山东聊城252059;3)上海市第十人民医院中心实验室,上海200072;4)同济大学医学院,上海200072

【生物工程/Bioengineering】
2-BP对中性粒细胞趋化性的抑制作用
孙锦霞1,王 瑞2,谭 笑3,焦琛琛4,黄 钟1
1)深圳大学医学部中心实验室,广东深圳518060;2)聊城大学药学院,山东聊城252059;3)上海市第十人民医院中心实验室,上海200072;4)同济大学医学院,上海200072
为研究棕榈酰化对中性粒细胞趋化性的调节作用,利用2-溴棕榈酸(2-bromopalmitate, 2-BP)或棕榈酸(palmitate)预处理来源于骨髓的中性粒细胞.采用流式细胞术(flow cytometry, FCM)检测中性粒细胞的存活率和中性粒细胞内F-肌动蛋白(F-actin)的生成;通过免疫荧光分析中性粒细胞内F-actin的极化;利用细胞迁移试验检测中性粒细胞的迁移能力;通过免疫印迹的实验方法检测蛋白激酶B(protein kinase B,AKT)和磷酸化AKT的表达.结果发现,2-BP预处理显著抑制了中性粒细胞内F-actin极化,且抑制了中性粒细胞向趋化肽N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formylmethionyl-leucyl-phenylalanine,fMLP)迁移的能力,而棕榈酸预处理显著促进了中性粒细胞内F-肌动蛋白极化.两者对F-actin生成和AKT的磷酸化均无影响.研究结果表明,2-BP处理可能通过影响F-actin的极化抑制了中性粒细胞向fMLP的趋化活性.
中性粒细胞;2-溴棕榈酸;F-肌动蛋白极化;趋化性;免疫荧光;流式细胞术;免疫印迹;细胞迁移;磷脂酰肌醇3-激酶-蛋白激酶B信号通路
中性粒细胞是外周血中含量最多的白细胞,可参与调节急性以及一些慢性炎症反应进程. 其源自骨髓造血干细胞,寿命较短,在粒细胞集落刺激因子( granulocyte colony-stimulating factor,G-CSF)和粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage CSF,GM-CSF)的作用下,可从骨髓中释放出来,进入循环系统. 静息状态下,中性粒细胞在循环系统中约存活6 h,随后被肝脏、脾脏或骨髓清除[1-3].当感染发生时,中性粒细胞被快速且选择性的动员起来,以确保在感染部位大量聚集. 一旦中性粒细胞到达目的地,它们的短暂寿命也得到了延长[4-5].作为一线免疫细胞,中性粒细胞可快速穿过血管内皮细胞到达感染部位,通过吞噬、脱颗粒和中性粒细胞胞外网络(neutrophil extracellular traps, NET)清除病原菌,随后凋亡,被巨噬细胞清除以控制炎症进程[6-10].长期以来,科学家们认为吞噬和脱颗粒是中性粒细胞抵抗病原菌感染的唯一机制,直至中性粒NET的发现,科学家们意识到这样一个问题,针对不同的病原菌感染,中性粒细胞是否可以选择性杀伤病原菌,从而激发最优的免疫反应[11-12].
趋化性是中性粒细胞得以迁移的生物学基础,包括对趋化物浓度梯度的感应、细胞极化和定向迁移的过程,首先F-actin发生极化并在细胞前端行成伪足,后端行成腹足,F-actin的持续生成使得中性粒细胞得以向着趋化物浓度梯度发生定向迁移[13].研究表明,抑癌蛋白PTEN(phosphatase and tensin homolog)[14]、PI3K-AKT[15]信号通路、小G蛋白(Cdc42、Rac和RhoA)[15]等在细胞极化和迁移过程中发挥至关重要的调节作用.
榈酰化修饰是一种可逆的共价脂肪酸化修饰,指16碳棕榈酸(palmitate)通过不稳定硫酯键结合至细胞质特定的半胱氨酸残基侧链上. 研究表明,棕榈酰化修饰可调节蛋白质功能的所有阶段,包括蛋白质的成熟加工、胞内运输、细胞器定位、蛋白质稳定性以及与其他蛋白的相互作用[16-18].因此,棕榈酰化修饰对蛋白质功能的正常发挥、突触的可塑性和免疫调节等多种生物学过程的影响至关重要[19-20].棕榈酰化和脱棕榈酰化过程分别由蛋白质酰基转移酶和酰基蛋白硫酯酶催化[21-22].2-BP通过抑制棕榈酰酰基转移酶的活性,不可逆地抑制蛋白质发生棕榈酰化修饰[23]. 本研究就2-BP和palmitate预处理对中性粒细胞内F-actin极化、 F-actin生成、细胞迁移和AKT磷酸化(phosphorylated AKT, p-AKT)的作用展开研究,以阐明2-BP对中性粒细胞趋化性的调节作用及其潜在调控机制.
1 材料与方法
1.1 主要试剂与仪器
Hank’s平衡盐缓冲液(Hank’s balanced salt solution,HBSS) 缓冲液购自美国Gibco公司;NH4Cl、KHCO3、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)和体积分数为4%的多聚甲醛等化学试剂购自上海生工生物工程股份有限公司;Percoll细胞分离液购自美国GE Healthcare公司;二甲基亚砜(dimethyl sulfoxide, DMSO)、2-BP、palmitate、fMLP和溶血卵磷脂均购自美国Sigma公司,鬼笔环肽购自美国Invitrogen公司;染料DAPI(2-(4-amidinophenyl)-6-indolecarbamidine dihydrochloride)购自上海碧云天生物技术有限公司;碘化丙啶-膜联蛋白V(propidium iodide-annexin V,PI-Annexin V)凋亡检测试剂盒购自美国 BD公司;Trans-well购自美国Corning公司;抗p-AKT、抗AKT抗体和荧光标记二抗购自美国CST公司;倒置显微镜购自日本Olympus公司;激光共聚焦显微镜购自德国Leica公司;高速冷冻离心机购自美国Beckman公司;流式细胞仪购自美国BD公司;Odyssey双色红外成像系统购自美国LI-COR公司.
1.2 中性粒细胞提取
8~12周C57BL/6小鼠处死后,取股骨和胫骨,用10 mL HBSS 缓冲液(无Ca2+和Mg2+)(含有10 g/L牛血清白蛋白(bovine serum albumin,BSA)和5 mmol/L Hepes)冲出骨髓细胞. 经红细胞裂解液(含有0.15 mol/L NH4Cl、10.0 mmol/L KHCO3和0.1 mmol/L EDTA)裂解红细胞后,加入3 mL体积分数为45%的Percoll细胞分离液重悬骨髓细胞,置于冰上. 在15 mL离心管中依次加入3 mL体积分数分别为81%和62%的Percoll及细胞悬液. 密度梯度离心30 min后,吸取体积分数为81%和62% 的Percoll中间细胞层,即成熟中性粒细胞.
1.3 免疫荧光
HBSS 缓冲液(含Ca2+和Mg2+)稀释提取的中性粒细胞至1×106mL-1,每孔20 μL加至铺有载玻片的24孔细胞培养板,37 ℃贴壁5 min. 加入等体积浓度为20 μmol/L的N-甲酰甲硫氨酰-亮氨酰-苯丙氨酸(N-formylmethionyl-leucyl-phenylalanine,fMLP)刺激不同时间,迅速加入体积分数为4%多聚甲醛固定20 min. PBS洗涤后加入体积分数为0.1% TritonX-100孵育5 min. PBS洗涤后加入鬼笔环肽染色F-actin 30 min. PBS洗涤后加入DAPI染色细胞核5 min,洗后封片,利用激光共聚焦显微镜采集图片.
1.4 流式细胞术
用HBSS 缓冲液(含Ca2+和Mg2+)稀释提取的中性粒细胞至1×107mL-1,设7个组,分别取100 μL细胞悬液,做如下预处理,组号分别为:① 加入终浓度为1 μmol/L的2-BP;② 加入终浓度为10 μmol/L的2-BP;③ 加入终浓度为20 μmol/L的2-BP;④ 加入终浓度为40 μmol/L的2-BP;⑤ 加入终浓度为50 μmol/L的2-BP;⑥ 加入体积分数为0.1%的DMSO;⑦ 加入终浓度为50 μmol/L的palmitate.将7组细胞分别放入37 ℃孵育2 h,然后按照PI/Annexin V凋亡检测试剂盒说明书操作,加入PI和异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的AnnexinV染色15 min,通过流式细胞术检测各组样品中细胞存活率的差异.
另取100 μL细胞悬液,加入终浓度为20 μmol/L的palmitate,记做预处理⑧,分别将预处理③、⑥和⑧组细胞于37 ℃孵育2 h,经PBS洗涤后用10 μmol/L fMLP刺激不同时间,加入体积分数为4%多聚甲醛固定20 min,PBS洗涤后加入20 mg/mL溶血卵磷脂和鬼笔环肽染色F-actin 30 min,流式细胞术检测不同处理后F-actin生成的差异.
1.5 细胞迁移
分别将预处理的③、⑥和⑧组细胞于37 ℃孵育2 h,然后取20 μL细胞加入96孔Trans-well上室,下室加入60 μL的10 μmol/L fMLP,37 ℃培养1 h,倒置显微镜下随机采集5个视野,细胞计数后统计不同处理后细胞迁移的差异.
1.6 免疫印迹
HBSS 缓冲液(含Ca2+和Mg2+)稀释提取的中性粒细胞至1×108mL-1,分别将预处理③、⑥和⑧组细胞于37 ℃孵育2 h.经PBS洗涤后,于37 ℃用10 μmol/L fMLP分别刺激不同时间,加入SDS上样缓冲液终止反应并裂解细胞. 样品于100 ℃煮沸10 min,用于十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis, SDS-PAGE)凝胶电泳检测. 抗p-AKT和抗AKT一抗于4 ℃孵育过夜,荧光标记的二抗室温孵育1 h,使用Odyssey双色红外成像系统采集图片.
1.7 统计学方法
2 结果与分析
2.1 不同浓度2-BP对中性粒细胞存活率的影响
为检测棕榈酰化对中性粒细胞趋化性的调控作用,本研究先检测了2-BP和palmitate对其存活率的影响.将流式细胞术处理后的①~⑦组细胞分别进行检测,结果如图1.从图1中可见,与对照组DMSO相比,当2-BP的浓度增加至40~50 μmol/L时可以促进细胞凋亡,而浓度为50 μmol/L的palmitate对细胞存活率仍没有影响. 因此,后续实验将选用浓度为20 μmol/L 的2-BP和palmitate的预处理方式.

图1 2-BP、palmitate和DMSO对中性粒细胞存活率的影响Fig.1 Effects of f 2-BP, palmitate and DMSO on neutrophil viability
2.2 2-BP对中性粒细胞迁移的抑制作用
将1.4节预处理的③、⑥和⑧组细胞分别加入Trans-well上室,于37 ℃向含有fMLP的下室定向迁移1 h,随后通过后倒置显微镜采集图片,分析2-BP和palmitate对中性粒细胞迁移的影响,结果如图2.由图2可见,20 μmol/L 2-BP显著抑制中性粒细胞向fMLP的迁移,而20 μmol/L palmitate对中性粒细胞向fMLP的迁移则没有影响.
2.3 2-BP对中性粒细胞内F-actin极化和生成的调节作用
将预处理③、⑥和⑧组细胞于37 ℃孵育2 h,然后分作2组,1组分别加入10 μmol/L fMLP分别刺激0、1和3 min,固定后依次染色鬼笔环肽和DAPI,激光共聚焦显微镜检测F-actin极化的差异,结果如图3;另1组分别加入10 μmol/L fMLP分别刺激0、1和3 min,固定后加入20 mg/mL溶血卵磷脂和鬼笔环肽孵育30 min,流式细胞术检测F-actin生成的差异,结果如图4. 由图3可见, 2-BP预处理显著抑制fMLP介导的F-actin在伪足极化,palmitate则促进了fMLP介导的F-actin在伪足极化. 由图4可见,2-BP和palmitate预处理对F-actin的生成均无影响.
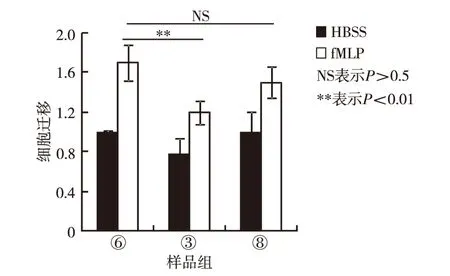
图2 2-BP、palmitat和DMSO对中性粒细胞向fMLP迁移能力的调节作用Fig.2 Regulation of 2-BP, palmitate and DMSO on neutrophil migration toward fMLP
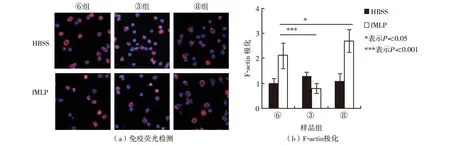
图3 2-BP、palmitate和DMSO对中性粒细胞内F-actin极化的调节作用Fig.3 Regulation of 2-BP, palmitate and DMSO on F-actin polarization in neutrophil
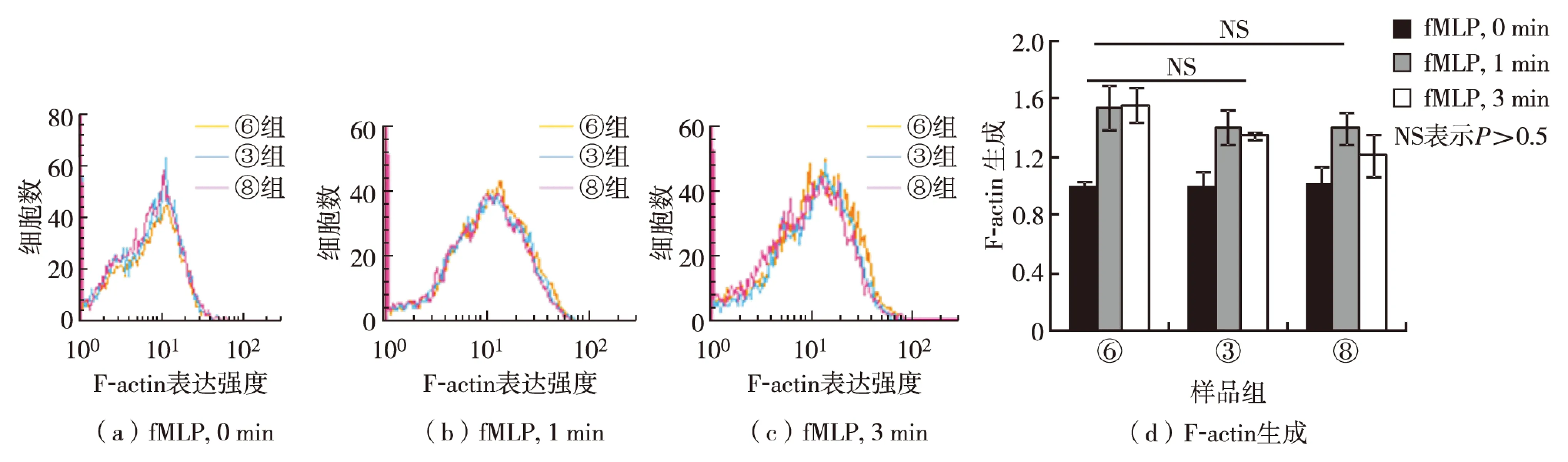
图4 2-BP、palmitate和DMSO对中性粒细胞内F-acin生成的调节作用Fig.4 Regulation of 2-BP, palmitate and DMSO on F-actin formation in neutrophil
2.4 2-BP对AKT磷酸化的调节作用
分别将预处理③、⑥和⑧组细胞于37 ℃孵育2 h,然后加入10 μmol/L fMLP分别刺激0、1和3 min,加入SDS上样缓冲液终止反应并裂解细胞,样品用于SDS-PAGE凝胶电泳,Odyssey双色红外成像系统检测p-AKT和AKT表达的差异,结果如图5.由图5可见,2-BP和palmitate预处理对AKT的磷酸化均无影响.

图5 2-BP、palmitate和DMSO对中性粒细胞内AKT磷酸化的调节作用Fig.5 Effects of 2-BP, palmitate and DMSO on AKT phosphorylation in neutrophil
3 讨 论
棕榈酰化是由榈酰酰基转移酶催化发生的一种动态翻译后修饰,1979年首次发现于水泡性口膜炎病毒跨膜糖蛋白[24]. 棕榈酰酰基转移酶为高度保守天冬氨酸-组氨酸-组氨酸-半胱氨酸(Asp-His-His-Cys, DHHC)家族蛋白,其中哺乳细胞内有23种[25]. 与豆蔻酰化和异戊希化相似,榈酰化修饰也可以增加蛋白质疏水性,介导靶蛋白定位于细胞膜,增加靶蛋白与细胞膜的结合进而调节蛋白的功能[26]. 迄今尚无棕榈酰化与中性粒细胞趋化性的报道,本研究采用2-BP和palmitate分别预处理中性粒细胞,首次证明2-BP显著抑制中性粒细胞内F-acin的极化且不影响其生成,Trans-well实验结果显示,2-BP显著抑制了中性粒细胞向fMLP的迁移. 因此,2-BP可能通过抑制F-acin极化参与调节中性粒细胞的趋化性. 此外,本研究还发现随着2-BP浓度的增高,可以不同程度的促进中性粒细胞凋亡,但其促凋亡机制尚不清楚.
中性粒细胞是先天免疫和急性炎症反应的关键效应细胞,它们在外围组织中的招募是机体发挥宿主防御功能必不可少的.由于它们具有潜在的破坏性,因此中性粒细胞进入外周组织必须受到严格的控制,以避免对机体造成不必要的伤害[27].趋化因子、白三烯、补体、炎性因子及细菌释放的多肽(如fMLP)都可以趋化中性粒细胞快速穿过血管壁到达感染部位[9]. palmitate与AKT信号通路的关系已有报道,如palmitate通过抑制PIP3K/AKT通路抑制内皮细胞介导的血管生成[28].但在中性粒细胞中,两者关系未知.研究表明,阻断PIP3K的激酶活性显著抑制中性粒细胞在体内外的迁移和向感染部位的募集,且促进了中性粒细胞的程序性死亡[29]. 此外,Rho家族小GTPase在中性粒细胞内极性分布,参与调节F-actin的定位和生成[15]. 本研究结果显示,2-BP和palmitate均对PI3K/AKT信号通路的活化没有影响,提示2-BP对中性粒细胞趋化性的抑制作用可能通过其他调控机制,如小GTPase等.
结 语
中性粒细胞参与调节宿主防御、肿瘤免疫和创伤修复等生理、病理进程,其中趋化性是中性粒细胞快速募集至感染部位行使杀伤作用所必需的,研究表明,2-BP显著抑制中性粒细胞的F-actin极化和迁移,提示棕榈酰化修饰可参与调节在中性粒细胞的趋化性,其调节机制尚待后续深入研究.
引文:孙锦霞,王 瑞,谭 笑,等. 2-BP对中性粒细胞趋化性的抑制作用[J]. 深圳大学学报理工版,2017,34(6):625-630.
/
[1] Zhang Fang, Liu Anlei, Gao Shuang, et al. Neutrophil dysfunction in sepsis[J].Chinese Medical Journal (English Edition), 2016, 129(22): 2741-2744.
[2] Furze Rebcca C, Rankin Sara M. Neutrophil mobilization and clearance in the bone marrow[J].Immunology, 2008, 125(3): 281-288.
[3] Furze R Rebcca C, Rankin Sara M. The role of the bone marrow in neutrophil clearance under homeostatic conditions in the mouse[J].The FASEB Journal, 2008, 22(9): 3111-3119.
[4] Kolaczkowska E, Kubes P. Neutrophil recruitment and function in health and inflammation[J].Nature Reviews Immunology, 2013, 13(3): 159-175.
[5] Niels Borregaard. Neutrophils, from marrow to microbes[J].Immunity, 2010, 33(5): 657-670.
[6] Schaefer A, Te Riet J, Ritz K, et al. Actin-binding proteins differentially regulate endothelial cell stiffness, ICAM-1 function and neutrophil transmigration[J]. Journal of Cell Science, 2014, 127(Pt 20): 4470-4482.
[7] Demaret J, Venet F, Friggeri A, et al. Marked alterations of neutrophil functions during sepsis-induced immunosuppression[J]. Journal of Leukocyte Biology, 2015, 98(6): 1081-1090.
[8] McDonald B, Urrutia R, Yipp B G, et al. Intravascular neutrophil extracellular traps capture bacteria from the bloodstream during sepsis[J]. Cell Host & Microbe, 2012, 12(3): 324-333.
[9] Khajah M, Andonegui G, Chan R, et al. Fer kinase limits neutrophil chemotaxis toward end target chemoattractants[J]. Journal of Immunology, 2013, 190(5): 2208-2216.
[10] Leliefeld P H, Wessels C M, Leenen L P, et al. The role of neutrophils in immune dysfunction during severe inflammation[J]. Critical Care, 2016, 20: 73.
[11] Branzk N, Lubojemska A, Hardison S E, et al. Neutrophils sense microbial size and selectively release neutrophil extracellular traps in response to large pathogens[J]. Nature Immunology, 2014, 15(11): 1017-1025.
[12] Amulic B, Cazalet C, Hayes G L, et al. Neutrophil function: from mechanisms to disease[J]. Annual Review of Immunology, 2012, 30: 459-489.
[13] Keszei M, Westerberg L S. Congenital defects in neutrophil dynamics[J]. Journal of Immunology Research, 2014, 2014(5) :303782.
[14] Billadeau D D. PTEN gives neutrophils direction[J]. Nature Immunology, 2008, 9(7): 716-718.
[15] Gambardella L, Vermeren S. Molecular players in neutrophil chemotaxis: focus on PI3K and small GTPases[J]. Journal of Leukocyte Biology, 2013, 94(4): 603-612.
[16] Yeste-Velasco M, Linder M E, Lu Yongjie. Protein S-palmitoylation and cancer[J]. Biochimica et Biophysica acta, 2015, 1856(1): 107-120.
[17] Roberts B J, Svoboda R A, Overmiller A M, et al. Palmitoylation of desmoglein 2 is a regulator of assembly dynamics and protein turnover[J]. The Journal of Biological Chemistry, 2016, 291(48): 24857-24865.
[18] Chamberlain L H, Shipston M J. The physiology of Protein S-acylation[J]. Physiological Reviews, 2015, 95(2): 341-376.
[19] Brigidi G S, Santyr B, Shimell J, et al. Activity-regulated trafficking of the palmitoyl-acyl transferase DHHC5[J]. Nature Communications, 2015, 6:8200.
[20] Liu Zheng, Yang Tangpo, Li Xin, et al. Integrative chemical biology approaches to examine ‘erasers’ for protein lysine fatty-acylation[J]. Angewandte Chemie (International Edtion in English), 2015, 54(4): 1149-1152.
[21] Zeidman R, Jackson C S, Magee A I. Protein acyl thioesterases (review)[J]. Molecular Membrane Biology, 2009, 26(1/2): 32-41.
[22] Vartak N, Papke B, Grecco H E, et al. The autodepalmitoylating activity of APT maintains the spatial organization of palmitoylated membrane proteins[J]. Biophysical Journal, 2014, 106(1): 93-105.
[23] Davda D, El Azzouny M A, Tom C T, et al. Profiling targets of the irreversible palmitoylation inhibitor 2-bromopalmitate[J]. ACS Chemical Biology, 2013, 8(9): 1912-1917.
[24] Schmidt M F, Schlesinger M J. Fatty acid binding to vesicular stomatitis virus glycoprotein: a new type of post-translational modification of the viral glycoprotein[J]. Cell, 1979, 17(4): 813-819.
[25] Blaskovic S, Adibekian A, Blanc M, et al. Mechanistic effects of protein palmitoylation and the cellular consequences thereof[J]. Chemistry and Physics of Lipids, 2014, 180: 44-52.
[26] Blaskovic S, Blanc M, van der Goot F G. What does S-palmitoylation do to membrane proteins?[J]. Febs Journal, 2013, 280(12):2766-2774.
[27] Sadik C D, Kim N D, Luster A D. Neutrophils cascading their way to inflammation[J]. Trends in Immunology, 2011, 32(10): 452-460.
[28] Ke Jing, Wei Rui, Yu Fei, et al. Liraglutide restores angiogenesis in palmitate-impaired human endothelial cells through PI3K/Akt-Foxo1-GTPCH1 pathway[J]. Peptides, 2016, 86: 95-101.
[29] Zhu Daocheng, Hattori H, Jo H, et al. Deactivation of phosphatidylinositol 3,4,5-trisphosphate/Akt signaling mediates neutrophil spontaneous death[J]. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(40): 14836-14841.
【中文责编:晨兮;英文责编:艾琳】
2016-11-14;Revised2017-09-12;Accepted2017-09-22
Professor Huang Zhong. E-mail: zhuang809@126.com
Theinhibitoryeffectof2-BPonneutrophilchemotaxis
SunJinxia1,WangRui2,TanXiao3,JiaoChenchen4,andHuangZhong1
1) Health Science Center, Shenzhen University, Shenzhen 518060, Guangdong Province, P.R.China2) College of Pharmacy, Liaocheng University, Liaocheng 252059, Shandong Province, P.R.China3) Central Laboratory of Shanghai Tenth People’s Hospital, Shanghai 200072, P.R.China4) School of Medicine, Tongji University, Shanghai 200072, P.R.China
Bone marrow derived neutrophil was pretreated with 2-BP or palmitate in order to explore regulatory roles of palmitoylation on neutrophil chemotaxis. Flow cytometry (FCM) was used to detect viability and F-actin formation of neutrophil. Polarization of F-actin in neutrophil was analyzed via immune-fluorescence (IF) analysis. Cell migration assay was performed to analyz migration ability of neutrophil. Expression of protein kinase B (AKT) and phosphorylated AKT was tested through Western Blot (WB). The results indicate that neutrophil pretreated with 2-BP display significantly reduces F-actin polarization and poor ability of migration toward chemotactic peptideN-formylmethionyl-leucyl-phenylalanine (fMLP). However, palmitate pretreatment obviously increases polarization of F-actin in neutrophil. Furthermore, both 2-BP and palmitate have no effects on F-actin formation and AKT phosphorylation. Thus, these data suggest that 2-BP pretreatment inhibition on neutrophil chemotaxis toward fMLP may be through regulating F-actin polarization.
neutrophil; 2-bromopalmitate(2-BP); F-actin polarization; chemotaxis; immuno-fluorescence; flow cytometry; western blot; cell migration; phosphatidylinositol 3-kinase-AKT signaling pathway
Foundation:National Natural Science Foundation of China (31401217); Postdoctral Science Foundation of China (2014M0560672); Shenzhen Science and Technology Basic Research Foundation (JCYJ20150403091443312)
:Sun Jinxia, Wang Rui, Tan Xiao, et al. The inhibitory effect of 2-BP on neutrophil chemotaxis[J]. Journal of Shenzhen University Science and Engineering, 2017, 34(6): 625-630.(in Chinese)
R 392
A
10.3724/SP.J.1249.2017.06625
国家自然科学基金资助项目(31401217);中国博士后科学基金资助项目(2014M0560672); 深圳市科技基础研究计划资助项目(JCYJ20150403091443312)
孙锦霞(1986—),女,深圳大学博士后研究人员. 研究方向:免疫学. E-mail:jinxia8608@126.com
