MED1的表达对卵巢癌细胞特性的影响
2017-11-22郑元慧董男男
郑元慧 董男男
MED1的表达对卵巢癌细胞特性的影响
郑元慧 董男男
目的研究卵巢癌细胞中MED1的表达对细胞生长、迁移以及侵袭能力的影响。方法通过分子手段获得MED1沉默型卵巢癌细胞B7-D5与C4-E8,进行MTT实验,细胞克隆实验以及通过流式细胞仪测定分析细胞周期实验,与MED1表达型卵巢癌细胞比较细胞生长特性;进行Transwell迁移以及侵袭实验,对比细胞迁移和侵袭能力的变化。结果MED1沉默型卵巢癌细胞胞体外生长受到抑制,克隆数目急剧降低,被阻滞在G0/G1期的细胞明显增多,S期细胞数目减少,迁移以及侵袭能力降低。结论MED1的沉默表达可以有效抑制卵巢癌细胞的生长以及迁移,为研发治疗卵巢癌的靶向药物奠定基础。
转录中介体1;卵巢癌;细胞生长特性
作者单位:250022 济南,山东济南循证医学科学研究中心基础医学部
卵巢癌是全球女性生殖系统死亡率最高的恶性肿瘤疾病。据美国癌症协会统计,2012年美国新发卵巢癌病例22,280例,新死亡病例15,500例[1]。在我国所有妇科恶性肿瘤中,卵巢癌的发病率第3位,而死亡率却居首位[2]。目前,对于卵巢癌的治疗主要分为手术和化疗两种方法。手术治疗与化疗对患者身体伤害极大,并且复发率高,这就迫切需要卵巢癌治疗的新方法。近几年,随着越来越多的证据支持肿瘤干细胞假说,干细胞疗法也逐渐成为研究卵巢癌治疗的热门领域[3-6]。与此同时,通过研究卵巢癌细胞生长以及转移的相关基因治疗方法也成为全球学者研究的重点[7]。
本文即通过细胞分子生物学的方法,获得MED1沉默型卵巢癌细胞,研究其与正常卵巢癌细胞在细胞生长特性以及迁移和侵袭能力上的改变情况,揭示MED1在卵巢癌细胞生长及转移过程中起到的作用,为研发治疗卵巢癌的靶向性药物奠定基础。
1 材料与方法
1.1 实验材料 人卵巢癌细胞OVA-1,购于美国ATCC公司;MED1沉默型人卵巢癌细胞B7-D5与C4-E8,均本实验室自行制备;胎牛血清(FBS),购于Gibco公司;DEME培养基,购买于Gibco公司;胰蛋白酶,购于OXOID公司;DMSO,购于天津希为化工有限公司;无水乙醇、甲醛以及结晶紫染液,购于天津希为化工有限公司;所有试剂皆为分析纯。
1.2 实验仪器 6孔板、24孔板与96孔板,购买于Thermo公司;酶标仪,够买于Bio-Rad公司;细胞培养箱,购买于美国施都凯仪器设备(上海)有限公司;立式压力蒸汽灭菌器,购买于上海申安医疗器械厂;流式细胞仪,购买于FACSCalibur、BD Biosciences(美国)等。
1.3 实验方法
1.3.1 细胞增殖实验(MTT) 将细胞以每个孔200 μL接种于96孔板中(5×103个/孔-8×103个/孔),分别常规培养(37oC与5%CO2)2 d、4 d与6 d后,加入MTT(5 mg/mL,20 μL/孔),继续培养4 h。吸取上清培养液,加入100 μL/孔的DMSO,振荡10 min,选取490 nm波长用酶标仪测定OD值。
1.3.2 细胞克隆实验 取细胞2×103个/mL,接种于6孔板中,毎孔2 mL,每隔3 d换液一次,常规培养3周左右,当孔中出现肉眼可见的克隆时,停止培养,吸取上清培养液,PBS洗2遍,加入4%甲醛进行固定,固定时间为15 min,吸取上清液,0.25%的结晶紫染色25 min,无菌水缓慢冲洗,置于无菌超净台中进行干燥,干燥后进行拍照、计数。
1.3.3 细胞周期实验 取细胞约1×106个,悬于PBS中,用700 μL无水乙醇(预冷)旋转固定3 h左右,500 μL PI染色液37oC温育30 min,然后用40 μm尼龙网膜进行过滤,流式细胞仪(488 nm波长处检测红色荧光)与ModfFitLT软件测量各个周期细胞所占比例。
1.3.4 细胞迁移实验 取对数生长期细胞无血清培养1 d,制备无血清细胞悬液(细胞浓度1×105个/mL),以上室加入200 μL细胞悬液,下室加入500 μL含10%FBS培养液接种于24孔板小室中,常规培养1 d左右进行固定与染色(加入4%甲醛进行固定,固定时间为15 min,吸取上清液,0.25%的结晶紫染色25 min,无菌水缓慢冲洗,置于无菌超净台中进行干燥,干燥后进行拍照、计数)。
1.3.5 细胞侵袭实验 BD Matrigel于4oC过夜,基质胶与无FBS培养液按1:5配置工作液,加入24孔板小室的上室中(60 μL/孔),37oC,2 h,其他同1.3.4。
1.4 统计学方法 采用SPSS 10.0进行数据分析,计数资料采用率(%)表示,组间比较采用χ2检验;计量资料采用均数±标准差(Mean±SD)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖实验(MTT)结果 根据实验方法1.3.1所示进行实验,以时间为横坐标,酶标仪测定的OD值为纵坐标绘制不同细胞生长曲线图,如图1所示。其中B7-D5与C4-E8为本实验室筛选的MED1沉默型卵巢癌细胞,OVA-1为MED1表达型卵巢癌细胞。由图1可知,MED1表达沉默型的卵巢癌细胞(B7-D5与C4-E8)与MED1表达型细胞相比生长明显减慢,说明MED1沉默表达对卵巢癌细胞的生长具有抑制作用。
2.2 细胞克隆实验结果 根据实验方法1.3.2所示进行实验,将细胞板倒置拍照,用肉眼计数细胞形成的克隆数,实验数据如图2所示。B7-D5和C4-E8细胞克隆数的统计与OVA-1细胞克隆数的统计比较具有统计学意义(P<0.001)。可见MED1表达沉默型的卵巢癌细胞(B7-D5与C4-E8)与MED1表达型细胞相比,在细胞培养板上形成克隆的数目急剧减少。
2.3 细胞周期实验结果 根据实验方法1.3.3所示进行实验,在同时检测光散射情况,利用ModfFitLT软件,根据FL2-A直方图分析细胞周期中G0/G1、S、G2期细胞的比例,实验结果如图3所示。可见MED1表达沉默型细胞B7-D5与C4-E8处于G0/G1期的数目明显多于MED1表达的细胞OVA-1(P<0.001),与此相对应的进入S期的细胞数目明显减少,说明MED1沉默表达对于卵巢癌细胞分裂周期起到抑制作用,因此可以抑制卵巢癌细胞的生长。
2.4 细胞迁移实验结果 根据实验方法1.3.4所示进行实验,结果如图4所示。OVA-1细胞相对迁移为1.00,B7-D5与C4-E8迁移能力分别为0.20和0.22,与OVA-1相比,差异均有统计学意义(P<0.05),可见MED1表达沉默型细胞B7-D5与C4-E8迁移能力明显降低。
2.5 细胞侵袭实验结果 根据实验方法1.3.4所示进行实验,结果如图5所示。OVA-1细胞相对迁移为1.00,B7-D5与C4-E8迁移能力分别为0.16和0.17,与OVA-1相比,差异均有统计学意义(P<0.05),表明MED1表达沉默型细胞B7-D5与C4-E8侵袭能力明显降低。
3 结论
MED1是中介体复合物(Mediator Complex)的一种,是Mediator在哺乳动物中最为重要的一个亚基,又被称之为PBP、RB18A等[8]。作为Mediator最为重要的亚基,同时也是研究最多的亚基,MED1与Mediator一样也是mRNA合成过程中起早关键性的作用[9]。它能通过MAPK、PDK/Akt途径实现磷酸化激活,并与其他共调控因子,一同调控靶基因的转录和表达,起到控制细胞生长的作用[10]。此前,有学者[11]研究完全敲除小鼠MED1基因,在培养小鼠11.5 d后,发现小鼠的胎盘以及心血管出现功能低下、发育缺陷等病症。Hasegawa[12]与Cui[13]等研究MED1沉默型乳腺癌细胞时发现,MED1沉默表达的乳腺癌细胞生长较正常细胞明显受到抑制。本研究也发现,MED1沉默型卵巢癌细胞的生长也明显受到抑制。
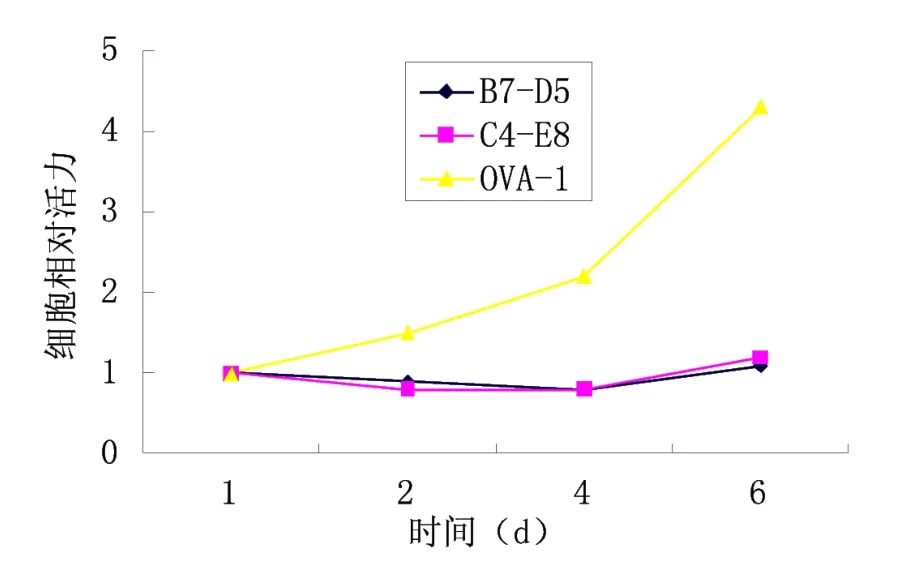
图1 MED1的表达对卵巢癌细胞体外生长的影响

图2 MED1的表达对卵巢癌细胞克隆形成的影响

图3 MED1的表达对卵巢癌细胞周期的影响

图4 MED1表达对卵巢癌细胞迁移能力的影响
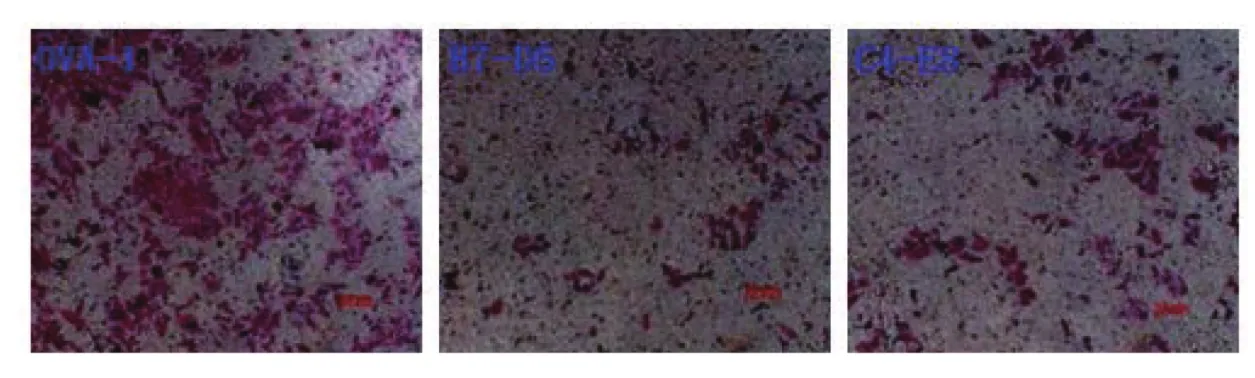
图5 MED1表达对卵巢癌细胞侵袭能力的影响
侵袭转移是造成肿瘤患者治疗失败甚至死亡的最主要因素[14]。而Shuman等[15]的研究发现,肿瘤的迁移及侵袭都与MMPS的表达和活化有关。MED1是与SCR以及CBP一样都具有LXXLL结构域,并且是核受体的共激活因子的转录因子。有研究[16-18]表明SCR、CBP可以通过控制MMPS的表达调控乳腺癌细胞的转移。本文研究MED1沉默型卵巢癌细胞时发现细胞的迁移和侵袭能力降低,说明MED1也可以调节卵巢癌细胞的转移。
综上所述,MED1在卵巢癌细胞的生长以及转移过程中起到重要的作用。MED1的沉默表达能够抑制卵巢癌细胞的生长以及转移,对治疗卵巢癌具有十分重要的意义。
1 Siegel R,Naishadham D,Jamal A.Cancer statistics,2012.CA Cancer J Clin,2012,62(1): 10-29.
2 丁滨.卵巢癌治疗研究进展.人民军医,2011,54(3): 237-239.
3 Chen SF,Chang YC,Nieh S,et al.Nonandhesive culture system as a model of rapid sphere formation with cancer stem cell properties.PLoS One,2012,7(2): e31864.
4 Perren TJ,Swart AM,Pfisterer J,et al.A phase 3 trial of bevacizumab in ovarian Cancer.N Engl J Med,2011,365(26): 2484-2496.
5 Steg AD,Bevis KS,Katre AA,et al.Stem cell pathways contribute to clinical chemoresistance in ovarian cancer.Clin Cancer Res,2012,18(3): 869-881.
6 Bapat Sa,Mali AM,Koppikar CB,et al.Stem and progenitor-like cells contribute to the aggressive behavior of human epithelial ovarian Cancer.Cancer Res,2005,65(8): 3025-3029.
7 Ishikawa A,Yamauchi M,Suzuki K,et al.Image-based quantitative determination of DNA damage signal reveals a threshold for G2checkpoint activation in response to ionizing radiation.Genome Integr,2010,1(1):10.
8 Jiang P,Hu Q,Ito M,et al.Key roles for MED1 LxxLL motifs in pubertal mammary gland development and luminal-cell differentiation.Proc Natl Acad Sci U S A,2010,107(15): 6765-6770.
9 Chen W,Roeder RG.Mediator-dependent nuclear receptor function.Semin Cell Dev Biol,2011,22(7):749-758.
10 Fondell JD.The Mediator complex in thyroid hormone receptor action.Biochim Biophys Acta,2013,183(7):3867-3875.
11 Zhu Y,Qi C,Jia Y,et al.Deletion of PBP/PPARBP,the gene for nuclear receptor coactivator peroxisome proliferatoractivated receptor-binding protein,results in embryonic lethality.J Biol Chem,2000,275(20): 14779-1482.
12 Hasegawa N,Sumitomo A,Fujita A,et al.Mediator subunits MED1 and MED24 cooperatively contribute to pubertal mammary gland development and growth of breast carcinoma cells.Mol Cell Biol,2012,32(8):1483-1495.
13 Cui J,Germer K,Wu T,et al.Cross-talk between HER2 and MED1 regulates tamoxifen resistance of human breast cancer cells.Cancer Res,2012,72(21): 5625-5634.
14 Valastyan S,Weinberg RA.Tumor metastasis: molecular insights and evolving paradigms.Cell,2011,147(2):275-292.
15 Shuman Moss LA,Jensen-Taubman S,Stetler-Stevenson WG.Matrix metalloproteinases: changing roles in tumor progression and metastasis.Am J Pathol,2012,181(6):1895-1899.
16 Qin L,Liu Z,Chen H,et al.The steroid receptor coactivator-1 regulates twist expression and promotes breast cancer metastasis.Cancer Res,2009,69(9):3819-3827.
17 Mittelstadt ML,Patel RC.AP-1 mediated transcriptional repression of matrix metalloproteinase-9 by recruitment of histone deacetylase 1 in response to interferon beta.PLoS One,2012,7(8): e42152.
18 Qin L,Liao L,Redmond A,et al.The AIB1 oncogene promotes breast cancer metastasis by activation of PEA3-mediated matrix metalloproteinase 2 (MMP2) and MMP9 expression.Mol Cell Biol,2008,28(19): 5937-5950.
Effect of the expression MED1 on ovarian cell
Yuanhui ZHENG,Nannan DONG
Department of Basic Medicine,Ji'nan Evidence Based Medical Science Research Center of Shandong,Ji'nan 250022,China
ObjectiveTo explore the effect of the expression MED1 on the cell growth,migration and invasion abilities was studied.MethodsBased on the MTT experiments,cell clones experiments,the analysis of cell cycle experiments by Flow Cytometry,Transwell migration and invasion experiments,comparing the MED1 silent and the expression of ovarian cancer in the character of cell growth and the change of cell migration and invasion.ResultsComparing with normal ovarian cancer,the MED1 silent cell growth was inhibited,the number of clones were reduced,cells in G0/G1phase were increased significantly and cells in S phase were reduced,the ability of cells migration and invasion was reduced.ConclusionSilencing the expression of MED1 can effectively inhibit ovarian cancer cell growth and migration,which layed the foundation for the development of targeted drugs to treat ovarian cancer.
MED1; Ovarian cancer; Growth characteristics of the cells
