抑制脊髓内NF-κB/p65 对骨性关节炎后期产生的痛觉过敏的影响*
2017-11-22李云泽郭金婉傅志俭赵序利张建中
李云泽 阎 芳 郭金婉 傅志俭,2 赵序利, 张建中
(1山东大学附属省立医院疼痛科,济南 250021; 2东营市人民医院疼痛科,东营257091)
抑制脊髓内NF-κB/p65 对骨性关节炎后期产生的痛觉过敏的影响*
李云泽1阎 芳1郭金婉1傅志俭1,2赵序利1,2Δ张建中2Δ
(1山东大学附属省立医院疼痛科,济南 250021;2东营市人民医院疼痛科,东营257091)
目的:研究核转录因子kappa B/p65 (nuclear factor-kappa B/p65, NF-κB/p65)在骨性关节炎(osteoarthritis, OA)导致的痛觉敏感中的作用。方法:6~8周SD雌性大鼠,体重250~300 g,随机分为生理盐水对照组、骨性关节炎模型组和鞘内给予NF-κB阻滞剂吡咯烷二硫代氨基甲酸酯(pyrrolidine dithiocarbamate,PDTC)模型组(n=30),并于造模前1天和造模后7、14、21、28天测定大鼠的机械痛阈,测定完成后处死大鼠,采用Western blotting的方法检测NF-κB/p65在各组大鼠脊髓内的表达情况。结果:模型组大鼠脊髓内NF-κB/p65的表达量较对照组明显增加,大鼠机械痛阈的变化趋势与其相一致;与模型组相比,在大鼠骨性关节炎后期鞘内注射PDTC能够明显改善机械痛敏。结论:NF-κB/p65在骨性关节炎大鼠脊髓内表达量显著增加,抑制脊髓内NF-κB/p65的表达能明显改善骨性关节炎大鼠的机械痛敏。
骨性关节炎;脊髓;NF-κB/p65;机械痛敏
骨性关节炎(osteoarthritis, OA)是一种高发的慢性退行性疾病,主要表现为关节退行性改变导致的活动障碍以及慢性疼痛。疼痛是OA最突出的临床表现,不仅严重影响关节功能同时降低患者的生活质量。OA疼痛同时还伴有局部感觉异常、情绪以及认知功能的改变。慢性疼痛是患者就医的主要原因,然而目前针对OA导致的慢性疼痛治疗效果不理想并且存在显著的不良反应[1]。因此,探索OA导致慢性疼痛的发病机制以及药物治疗的作用靶点是目前临床治疗上迫切需求。大量的临床观察和治疗发现,OA后期所产生的持续性疼痛和静息性痛是OA疼痛治疗的难点也是治疗的关键。通过关节内局麻药注射试验发现,60%左右的病人对首次关节内局麻药注射敏感,在局麻药无效的患者中中枢神经系统的异常似乎发挥了更重要的作用[2,3]。进一步的研究发现,相关脊髓节段内产生的炎性环境以及脊髓背角内感觉神经元功能的改变是OA导致痛觉过敏的主要原因,OA疼痛具备炎症性疼痛和神经病理性疼痛的特点[4]。
NF-κB/p65是炎症相关的重要信号通路,是重要的炎症因子下游信号分子,同时能够调控多种炎症因子的产生,已被证实在炎症性疼痛的过程中发挥了重要的作用。此外,作为重要的核转录因子,NF-κB/p65对其他蛋白的表达也起着重要的调控作用,在中枢敏化的过程中, NF-κB/p65能够调节疼痛相关蛋白基因的表达进而导致痛觉相关神经元功能的改变[5]。通过对OA疼痛性质和NF-κB/p65在不同疼痛模型中发挥的作用的分析,我们推测两者之间存在密切联系。首先,我们将对NF-κB/p65在OA大鼠模型脊髓内的表达情况进行检测,然后通过鞘内给予阻滞剂PDTC的方式来明确其作用。
方 法
1.实验动物及分组
健康成年雌性SD大鼠,6~8周龄,体重约250~300 g,由山东大学医学院实验动物中心提供。分笼饲养,室温23±1℃,湿度55±5%。采用随机数字法分为三组:对照组、OA模型组和PDTC鞘内给药组,每组30只。
2.鞘内置管
参照Choi等[6]的方法行鞘内置管。10%水合氯醛(300 mg/Kg, 腹腔注射)麻醉大鼠,背部备皮、消毒、铺巾。背部L2-3水平作一20 mm切口,钝性分离筋膜及肌肉,去掉L2-3上下关节突暴露椎间孔,将PE-10管由椎间孔向头端插入约15 mm并固定于周围组织,做一皮下隧道将导管引至颈部。大鼠全麻苏醒后,排除出现后肢瘫痪大鼠,导管内给予2%利多卡因0.1~ 0.15 ml ,若大鼠双后肢出现麻痹的现象则证实置管位置良好。术后单笼饲养,连续3天给予青霉素8万单位预防感染,术后观察7天,若无感染、运动障碍等可进行后续实验。
3. OA模型建立
参照Guzman[7]等的方法建立OA模型。超净工作台内,用无菌生理盐水稀释MIA (Sigma公司,美国)至浓度为80 mg/ml。10%水合氯醛(300 mg/Kg, 腹腔注射)麻醉,固定于手术台,左侧膝关节周围备皮、消毒、铺巾,1 ml注射器穿刺关节腔注射MIA 50 µl(80 mg/ml),对照组给予同等体积无菌生理盐水。
4.鞘内给药
超净工作台内,用无菌生理盐水稀释PDTC至0.2 mg/ml, 4℃冰箱保存。OA大鼠关节腔内注射完成当天起,连续鞘内给予PDTC 12 µl直至大鼠处死,注射完成后10 µl生理盐水冲洗。对照组和单纯OA模型组鞘内给予等量的生理盐水。
5.机械痛阈的测定
术前1天及术后7、14、21、28天时,依据Chaplan[8]等报道的方法进行检测:将待测大鼠置于透明的有机玻璃箱内,底部为金属网。大鼠在箱内适应约1小时,采用不同折力的von-Frey纤毛,按照从小到大的顺序依次进行测试,垂直刺激大鼠足底第二三跖骨之间位置,刺激的持续时间为8秒。大鼠出现缩足或者添足现象时记为阳性,每次间隔30秒,同一纤毛刺激5次出现3次阳性,此时记为最小刺激强度,单位是(g),即为机械刺激缩足反应阈。
6. Western blotting 检测NF-κB/p65的表达量
机械痛阈测定完成后,处死大鼠,取脊髓L3-5阶段于液氮中保存。取材完成后,将组织放入液氮中研成粉末导入EP管,EP管中加入适量组织裂解液进行震荡混匀,4℃,12 000 rpm离心30分钟, 吸取上清至新EP管,取部分上清采用BCA法测定蛋白浓度,计算40 µg上样量,剩余蛋白加入loading bu ff er, 100℃金属浴煮沸变性10 min。根据计算的上样量采用十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(sodium lauryl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)进行分离,后蛋白转膜到PVDF膜上。10%的脱脂牛奶封闭1 h后孵育一抗,兔抗大鼠NF-κB/p65(1:2 000,Abcam, USA),4℃孵育过夜。经过TBST缓冲液洗涤三遍后,室温孵育辣根过氧化物酶标记的二抗(1:5 000)1 h,最后ECL发光试剂盒(Milipore)显影。
7.统计学方法
采用SPSS 19.0进行数据分析,数据均以均数±标准误(±SEM)表示,组间数据进行比较采用单因素方差分析(one-way ANOVA)并用Dunnett后检验,两组数据之间比较采用t检验。P< 0.05表示差异有统计学意义。
结 果
1.骨性关节炎大鼠机械痛阈降低
研究发现,模型建立后大鼠产生了明显的行为学变化,模型大鼠患侧的活动频率明显降低,添足次数明显增加,痛阈检测发现关节内注射MIA后大鼠痛阈逐渐降低, 后期维持在较低水平,而模型健侧和对照组行为学则无明显变化。在造模之前对照组、模型组和阻滞剂组之间痛阈未见明显差异。造模后第7 d模型组大鼠的痛阈降低明显(P< 0.01)并于第14 d到达峰值,之后一直维持在较高水平,第14 d、21 d和28 d的机械痛阈之间无明显统计学差异。
2.骨性关节炎大鼠鞘内注射阻滞剂PDTC后NF-κB/p65表达量下降
研究中发现,在骨性关节炎大鼠模型中,大鼠相应节段脊髓内的NF-κB/p65表达量在关节腔内注射MIA后逐渐增加并保持在较高水平,并且与大鼠痛阈的变化相一致。在造模后的第7 d脊髓内的NF-κB/p65表达量已经到达很高的水平,明显高于术前(P< 0.01)和对照组(P< 0.01)的表达量;在第14 d NF-κB/p65的表达量达到一个高峰,在第21 d有明显下降,但仍大于术前以及对照组,在第28 d NF-κB/p65的表达量达到第二个峰值,并呈现出继续增长的态势(见图1)。通过对造模的同时鞘内给予阻滞剂的大鼠脊髓内NF-κB/p65的表达的检测发现,NF-κB/p65的表达量不同于模型组,并没有明显的上升(P< 0.01);与对照组相比,第7 d起NF-κB/p65的表达量呈现出下降的趋势(P<0.05),到第21 d和第28d脊髓内NF-κB/p65的表达量明显降低(见图1)。
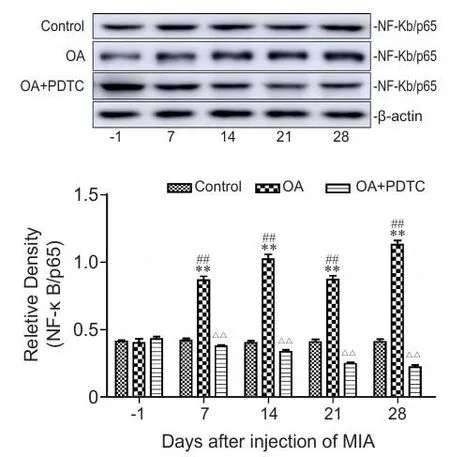
图1 NF-κB/p65 在各组大鼠脊髓内的表达情况( ±SEM )*P < 0.05,**P < 0.01,与关节内注射前相比;#P < 0.05, ##P <0.01,与生理盐水对照组相比;△△P < 0.01,与同一时间点的模型组比较。Fig.1 The expression of NF-κB/p65 in the spinal cord of three groups detected by Western blotting ( ±SEM )*P < 0.05, **P < 0.01, compared with pre-injection; #P < 0.05, ##P<0.01, compared with normal saline group; △△P < 0.01, compared with OA group in the same time points.
3.连续鞘内给予阻滞剂PDTC可改善大鼠骨性关节炎后期的机械痛阈
通过对鞘内给予阻滞剂PDTC的骨性关节炎大鼠的机械痛阈的测试发现,在骨性关节炎的早期第7 d及第14 d大鼠的机械痛阈与模型组之间未见明显的差异,然而从第21 d起阻滞剂组大鼠的机械痛阈出现改善(P< 0.05),当连续给药到第28 d时阻滞剂组的大鼠的机械痛阈相较于模型组已明显改善(P< 0.01,见图 2)。
讨 论

图2 鞘内注射阻滞剂PDTC 对骨性关节炎大鼠机械痛阈的影响( ±SEM )#P < 0.05,##P < 0.0l,与对照组相比;*P < 0.05,**P < 0.01,与模型组相比。Fig.2 Effects of intrathecal administration PDTC on the mechanical allodynia in OA rats ( ±SEM )#P < 0.05, ##P < 0.0l, compared with control group;*P < 0.05,**P < 0.01, compared with OA group.
目前,建立骨性关节炎模型的方法主要包括手术破坏和关节内注射化学药物。采用手术建立模型操作复杂、周期过长,因此许多研究采用能够快速建立模型的关节腔内药物注射的方式。MIA作为一种骨性关节炎造模药物,它能够通过干扰糖酵解导致细胞死亡的方式建立骨性关节炎模型。此外,MIA引起的软骨细胞进行性的减少导致的关节软骨的组织学和形态学的改变十分类似于骨性关节炎病人软骨内的改变[9,10]。因此,我们的研究也采用关节腔内注射MIA的方式来建立关节炎模型。此外,为更好的研究骨性关节炎难治性疼痛的特点,我们采用的高剂量的MIA (4.0 mg)建立的OA模型,该诱导模型所产生的疼痛具有非甾体抗炎药物抵抗和慢性静息痛的特点[11]。关节腔内注射之后发现,模型大鼠患侧肢体活动明显减弱,关节出现肿胀,机械痛阈明显降低,符合骨性关节炎变化的基本特点;通过对关节进行病理检测发现,大鼠膝关节关节面破坏逐渐加重,滑膜组织增生,软骨下等骨性关节炎的典型表现,进一步明确了模型的成功建立。
目前针对骨性关节炎导致的疼痛的中枢机制的研究主要集中在炎症因子、细胞生长因子及神经相关信号肽和相关受体,但针对这些靶点的治疗存在局限,对疼痛的治疗效果有限[12]。NF-κB/p65作为重要的转录调节因子已被证实在许多病理生理反应中发挥着重要的作用,其在炎症性疼痛中的重要作用被人们广泛认可,在神经病理性疼痛产生的过程中NF-κB/p65也发挥着举足轻重的作用[13,14]。因此,结合骨性关节炎导致疼痛的发病机制的特点,该信号通路的研究或许能为我们找到兼顾控制各种炎症分子和疼痛相关信号肽及受体表达的作用靶点。我们研究中发现,模型组脊髓内的NF-κB/p65的表达量明显升高,于第14 d到达第一个高峰,此时骨性关节炎大鼠的机械痛阈也降到最低,两者的变化趋势基本一致。但是,随着时间的延长,NF-κB/p65在脊髓内第21 d的表达量出现一个小的低谷,随后于第28 d又恢复到第14 d时高峰的水平。我们进一步采取阻滞剂的实验发现,在骨性关节炎的早期单纯的阻断NF-κB/p65未能改善模型大鼠的机械痛敏,但是在骨性关节炎的后期阻断NF-κB/p65可明显改善模型大鼠的机械痛敏。综上实验结果可以发现,在骨性关节炎导致疼痛产生的不同阶段NF-κB/p65可能发挥着不同的作用,在早期炎症为骨性关节疼痛主要原因的阶段,NF-κB/p65可能并非炎症因子唯一的下游信号通路,所以在缓解机械痛敏的效果上并不明显;然而对骨性关节炎大鼠进行持续的PDTC鞘内给药明显的缓解了大鼠机械痛敏,证实了NF-κB/p65在骨性关节炎后期产生的难治性疼痛中的重要作用。
综上所述,NF-κB/p65在骨性关节炎大鼠脊髓内的表达量增加,阻断该信号通路能够改善大鼠骨性关节炎后期的机械痛敏,NF-κB/p65有望成为临床上骨性关节炎难治性疼痛的作用靶点。
[1]Sharma L. Osteoarthritis Year in Review 2015: Clinical.Osteoarthritis Cartilage, 2016, 1:36 ~ 48.
[2]Dray A, Read SJ. Arthritis and Pain. Future Targets to Control Osteoarthritis Pain. Arthritis Res Ther, 2007,3:212.
[3]李云泽, 赵序利. 骨性关节炎发病机制研究进展. 中国疼痛医学杂志, 2016, 22(10): 728 ~ 733.
[4]Thakur M, Dickenson AH, Baron R. Osteoarthritis Pain: Nociceptive Or Neuropathic? Nat Rev Rheumatol,2014, 6:374 ~ 380.
[5]Niederberger E, Geisslinger G. The IKK-NF-kappaB Pathway: A Source for Novel Molecular Drug Targets in Pain Therapy? FASEB J, 2008,10:3432 ~ 3442.
[6]Choi SS, Kim YC, Lim YJ,et al. The Neurological Safety of Epidural Gabapentin in Rats: A Light Microscopic Examination. Anesth Analg, 2005, 5:1422 ~1426.
[7]Guzman RE, Evans MG, Bove S,et al. Mono-Iodoacetate-Induced Histologic Changes in Subchondral Bone and Articular Cartilage of Rat Femorotibial Joints: An Animal Model of Osteoarthritis. Toxicologic Pathology, 2003, 6:619 ~ 624.
[8]Chaplan SR, Bach FW, Pogrel JW,et al. Quantitative Assessment of Tactile Allodynia in the Rat Paw. J Neurosci Methods, 1994, 1:55 ~ 63.
[9]Bove SE, Calcaterra SL, Brooker RM,et al. Weight Bearing as a Measure of Disease Progression and Efficacy of Anti-In fl ammatory Compounds in a Model of Monosodium Iodoacetate-Induced Osteoarthritis.Osteoarthritis Cartilage, 2003,11:821 ~ 830.
[10]Ivanavicius SP, Ball AD, Heapy CG,et al. Structural Pathology in a Rodent Model of Osteoarthritis is Associated with Neuropathic Pain: Increased Expression of ATF-3 and Pharmacological Characterisation. Pain,2007, 3:272 ~ 282.
[11]Havelin J, Imbert I, Cormier J,et al. Central Sensitization and Neuropathic Features of Ongoing Pain in a Rat Model of Advanced Osteoarthritis. J Pain, 2016, 3:374 ~382.
[12]Lee AS, Ellman MB, Yan D,et al. A Current Review of Molecular Mechanisms Regarding Osteoarthritis and Pain. Gene, 2013, 2:440 ~ 447.
[13]Niederberger E, Geisslinger G. The IKK-NF-kappaB Pathway: A Source for Novel Molecular Drug Targets in Pain Therapy? FASEB J, 2008,10:3432 ~ 3442.
[14]Luo JG, Zhao XL, Xu WC,et al. Activation of Spinal NF-kappaB/p65 Contributes to Peripheral In fl ammation and Hyperalgesia in Rat Adjuvant-Induced Arthritis.Arthritis Rheumatol, 2014, 4:896 ~ 906.
INHIBITION OF SPINAL NF-KB/p65 EXPRESSION CONTRIBUTES TO END-STAGE MECHANICAL HYPERALGESIA IN OSTEOARTHRITIS*
LI Yun-Ze1, YAN Fang1, GUO Jin-Wan1, FU Zhi-Jian1,2, ZHAO Xu-Li1,2Δ, ZHANG Jian-Zhong2Δ
(1Department of Pain Medicine, Shandong Provincial Hospital Affiliated to Shandong University, Jinan 250021, China;2Department of Pain Medicine, Dongying City People's Hospital, Dongying 257091,China)
Objective:To investigate the role of NF-κB/p65 (nuclear factor-kappa B/p65) in the development of OA (Osteoarthritis)-induced hyperalgesia.Methods:Female SD rats (250~300 g) at the age of 6~8 weeks were used in this study. Rats were randomly divided into three groups: normal saline group, OA group and OA + PDTC (pyrrolidine dithiocarbamate) group (n=30). The mechanical nociceptive thresholds were assessed one day prior to surgery and 7, 14, 21, 28 days after operation. The expression of NF-κB/p65 in the spinal cord was detected by Western blotting at each time point.Results:The expression level of NF-κB/p65 in the OA model of rats was higher than the control group, which was consistent with the decreased mechanical pain threshold in the OA group. Intrathecal injection of PDTC can alleviate mechanical hyperalgesia in the end-stage of OA model of rats.Conclusion:The expression of NF-κB/p65 in the spinal cord increased signi fi cantly in OA model of rats. Inhibition of spinal NF-κB/p65 expression contributes to the relief of the end-stage mechanical hyperalgesia in OA model of rats.
Osteoarthritis; Spinal cord; NF-κB/p65; Mechanical hyperalgesia
10.3969/j.issn.1006-9852.2017.03.004
山东省自然科学基金青年基金(ZR2009CQ016);山东省中青年科学家奖励基金(BS2013YY047);中国博士后基金(2014M551922)
△通讯作者 dizzyzhaoxl@163.com; zjzzch@163.com
