池养黑鲷性逆转组织学观察
2017-11-21陈淑吟张志勇刘海林贾超峰张志伟任忠宏
陈淑吟, 张志勇, 刘海林, 许 津, 祝 斐, 贾超峰, 张志伟, 任忠宏
池养黑鲷性逆转组织学观察
陈淑吟, 张志勇, 刘海林, 许 津, 祝 斐, 贾超峰, 张志伟, 任忠宏
(江苏省海洋水产研究所江苏省海水鱼类遗传育种重点实验室, 江苏南通 226007)
黑鲷()为具性逆转的珍贵海产鱼类, 其个体在第3龄期雄性转为雌性, 但性逆转发生的详细过程尚不清楚。为了解黑鲷性腺逆转发生的过程, 作者通过对池塘养殖黑鲷3~4龄期个体进行定期跟踪取样观察, 结合组织切片显微检测性腺变化过程。结果显示: 黑鲷性腺在繁殖前后变化趋势不同; 繁殖期雌性个体约占15%; 繁殖后至7月份是性腺由雄逆转为雌主要时期; 8月份全部个体性腺外观表现为卵巢形式; 到9月底, 个别性腺的精巢组织又开始发育; 到12月底样本性腺有雄性、雌性及雌雄同体同时发育3种形式。此外, 分析了黑鲷性腺成熟系数与肝质量系数的周年变化趋势。研究获得了详细的3~4龄黑鲷性逆转发生过程及性逆转结果, 并针对与先前报道的有关研究结果差异展开分析, 为掌握不同海区黑鲷性逆转特性及育种研究提供了更多资料, 也为雌雄同体鱼类资源利用研究提供新的参考依据。
黑鲷(); 雌雄同体; 性逆转; 性腺系数; 肝脏系数
黑鲷()又称黑棘鲷, 为鲷科(Sparidae/Lobotidae)、棘鲷属()种类, 俗名黑加吉、乌格等, 是中国南北沿海及亚洲其他海区养殖的名贵经济鱼类[1-3]。黑鲷繁殖期因海区不同有一定差异, 在江苏沿海为4月初~5月底, 盛期为4月中旬~5月上旬[1]。黑鲷具天然性逆转习性, 属雄性先熟型雌雄同体[4-6]。其在第1、第2龄期全部表现为雄性功能, 3龄鱼开始逆反转为雌性[7]; 在非繁殖季节, 精巢组织退化、卵巢组织发育, 第3龄期繁殖季节有30%~50%个体以雌性的形式参与繁殖[8]。3龄期是黑鲷性别逆转发生的主要阶段, 但该鱼3+龄的性腺变化的详细过程等尚不清楚。另外, 在中国北方沿海繁育生产中, 黑鲷一直到较高龄阶段仍有不少比例的雄鱼。因此, 黑鲷3+龄性腺逆转情况仍然有待于详细研究。
鱼类的生殖是养殖鱼类新品种培育与扩群应用的前提[9]。性逆转的研究是鱼类生殖与人为调控性腺变化的重要课题[10]。目前, 有性逆转鱼类已超过350种, 分属于包括鲷科在内的23个科[11]。鲷科约有133种鱼类[12], 其中的许多经济种均具有自然性逆转现象, 如澳洲棘鲷()[13]、黄鳍棘鲷()[14]、平鲷()[15]等均是雄性先熟型雌雄同体种类, 黄牙鲷()等则为雌性先熟型种类[16]。作为广泛养殖的名贵品种和选育研究的重点鱼类, 黑鲷是性逆转研究的重点对象与模式鱼类。针对黑鲷性逆转的基因调控、人为干扰性逆转应用等方面的研究[17-19], 为研究鱼类生殖与性别控制提供了大量科学依据。
鱼类性腺发育包括一系列复杂的细胞和组织变化。性逆转过程不是即时完成, 从组织学水平可以得到较好解释[11]。实验以人工繁育、池塘养成的3~4龄期黑鲷为研究对象, 通过连续取样观察, 并运用组织切片显微观测方法, 了解黑鲷性腺逆转变化特征, 不仅为生产中该鱼类性别比例及人工性别控制诱导敏感期的确定提供更多基础资料, 也为雌雄同体鱼类的自然资源管理与利用提供科学依据。
1 材料与方法
1.1 实验材料
实验用鱼为2012年4月江苏海区人工繁育苗种进行池塘养殖的健康成鱼。取样时间为2015年1~12月。每隔15 d取样, 每次随机取3尾以上, 共取样130尾。
1.2 实验方法
样本进行体质量、体长等生物学测量, 并取性腺、肝脏进行相应的观察及检测。用Excel进行数据统计, 并分析样本的体质量、体长等的平均值及标准差(STDEVPA)。性腺成熟系数(gonado- somatic index, GSI, %)=(性腺质量/体质量)×100, 肝质量系数(hepato- somatic index, HIS, %)=(肝质量/体质量)×100。
取小块性腺组织放入10%甲醛溶液固定24 h后, 采用常规梯度乙醇脱水、石蜡包埋、包埋样连续切片(厚度为 5~6 μm), 采用Weigert铁苏木素-丽春红酸性复红染色方法, 最后中性树胶封片; Olympus CX41正置显微镜观察, 用配套摄相系统拍照及软件图像处理。性腺分期及生殖细胞时相确定主要参考已报道文献的分期方法[20]。
2 结果与分析
2.1 黑鲷不同性别比例与生殖腺变化观察
结合性腺外观形态观察与切片结果, 得到不同性别个体数量与比例(表1)。在繁殖前期, 个体性腺呈现以雄性为主的雌雄同体, 3月上旬才取到性腺为卵巢的雌性个体; 在繁殖期, 以雄性功能参与繁殖活动的个体约占85%, 雌性个体约15%(3/20)。繁殖结束后至7月初, 雄鱼性腺快速转变成以卵巢为主的雌雄同体形式, 此后的性腺生长为卵巢继续增殖而精巢退化成残迹; 到9月, 从性腺外观看全部为雌性个体; 到10月, 有4/7个体精巢组织又开始增殖生长; 到11月, 2/3个体为雌性为主的雌雄同体; 到12月底, 样本中雌性、雄性及雌雄同体各占1/3。
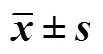
表1 黑鲷不同性别样品的体长和体质量统计(平均值±标准差)
注: “*”功能性雄鱼
黑鲷生殖腺外观形态变化, 从时间上可分为1~3月、4~5月、6~9月及10~12月几个阶段。其中: 1~3月份, 雌雄同体性腺明显分为两个区域, 精巢一侧乳白色; 卵巢区域呈透明或淡黄色, 且分布有较多血管(图1-1); 4~5月份, 雌雄同体的功能性雄鱼性腺均为乳白色、充满精液, 在精巢组织内侧边缘布有一薄层的红色血管明显的卵巢部分, 有些雌雄同体性腺的卵巢组织很小, 仅在精巢组织的小角落; 雌鱼卵巢大而饱满, 外观分布有明显而粗大的血管, 可见卵粒游离, 没有像成熟精巢中存在有较明显卵巢组织类型; 繁殖季后, 性腺中的精巢组织不断缩小退化、卵巢组织则逐渐增殖扩大; 6月份, 精巢体积缩至小于卵巢的1/3, 外观呈现卵巢为主的雌雄同体, 卵巢呈透明淡黄色(图1-2); 7月份上旬, 精巢已基本退化为仅在卵巢外缘一侧的白色薄层组织, 从性腺外观可直接判断为雌性个体; 8~9月份, 这一现象更明显, 整个生殖腺外观为卵巢; 10月份, 部分个体的精巢部分开始增殖, 性腺组织外侧缘的白色组织略有增厚; 11月份, 继续增殖的精巢组织中部有脊状突起; 12月底, 雌性个体的卵巢组织饱满、膨大(图2-1), 雌雄同体的精巢组织增厚并从卵巢外缘向内包围生长, 约占性腺体积的1/3(图2-2)。

图1 黑鲷1月(1-1)与6月(1-2)雌雄同体性腺外观差异
箭头指示卵巢组织
Arrowhead indicates ovarian tissue
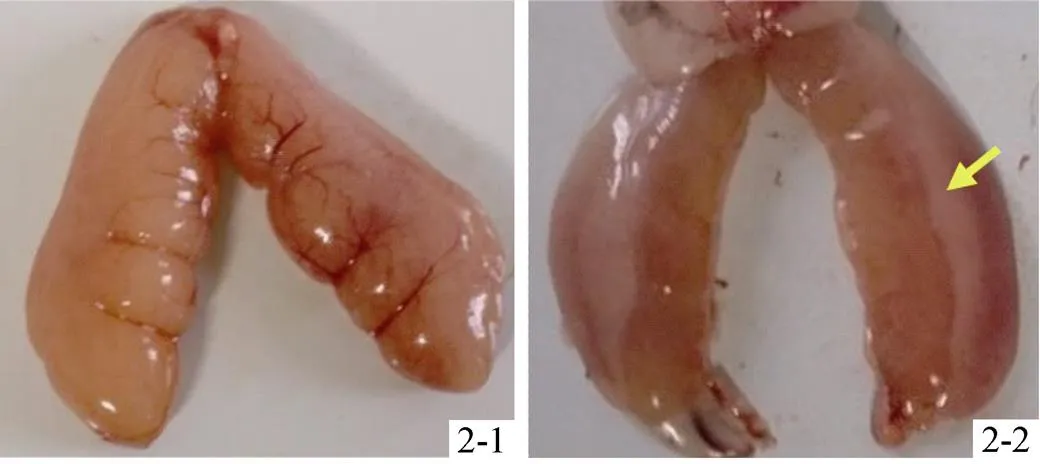
图2 黑鲷12月卵巢(2-1)与雌雄同体(2-2)性腺形态外观
箭头指雄性精巢组织
Arrowhead indicates testicular tissue
2.2 性逆转的组织学观察
切片观察显示, 1、2月份为生殖细胞处于早期时相的雌雄同体(图3-1、图3-2), 其卵巢组织位于两个精巢内侧边缘或完全被包围于当中, 精巢和卵巢之间有结缔组织隔开。3月份, 雌雄同体性腺中的卵巢生殖细胞仍处于早期时相(卵细胞直径为24~49 μm), 少数为第Ⅲ期时相早期卵母细胞, 卵径为84~96 μm (图3-3); 此时期, 雌性个体的卵巢生殖细胞主要是第Ⅲ~Ⅳ期(卵径为160~289 μm), 少数的第Ⅰ、Ⅱ时相(图3-4)。4~5月份的繁殖期, 成熟卵巢处于第Ⅳ时相晚期及第Ⅴ期, 卵细胞直径为410~558 μm, 也有少量的第Ⅱ、Ⅲ期生殖细胞并存; 功能性雄鱼性腺的成熟精巢组织间有占比很小的卵巢组织, 这种卵巢中生殖细胞为第Ⅰ、Ⅱ时相(图3-5, 3-6); 部分根据性腺外观判断为雄性的样本, 切片结果均是雄鱼为主的雌雄同体, 只是由于雌性卵细胞位于精巢角落或两精巢内侧, 不易观察到, 因此, 表中所列的雄鱼可能也为雌雄同体的功能性雄鱼。6~7月份, 全部雄性个体基本完成了往雌性的逆转, 成为卵巢为主的雌雄同体(图3-7, 3-8); 处于增殖期的卵巢有大量第Ⅰ时相早期卵母细胞; 8月份完成性逆转的性腺中精巢收缩成为附于卵巢外侧残迹, 其精小叶仍有空腔(图3-9); 9月中旬性腺中的卵巢继续增殖, 退化的精巢组织有精原细胞; 到9月底, 个别个体性腺中的精巢组织又开始发育(图3-10); 10月份, 卵巢性腺中的雌性生殖组织开始出现第Ⅲ时相早期的卵母细胞(图3-11), 而精巢增殖发育的性腺中卵巢部分的生殖细胞则仍是第Ⅰ、Ⅱ时相(图3-12); 11月份的切片两者差异比较更明显, 逐渐发育的卵巢组织有较多处于第Ⅲ时相生殖细胞(图3-13), 雌雄同体性腺中只是精巢在进一步增殖发育(图3-14); 到了12月份, 雌雄同体的精巢部分快速增殖并伴随次级精细胞及精子大量生成(图3-15)。
2.3 GSI与HSI的周年变化与相关性
GSI、HIS的变化趋势与繁殖活动密切相关, 见图4。繁殖前GSI水平呈逐渐上升趋势, 在3月中旬GSI值最大为5.09%, 此时部分雄性个体已有精液; 随着生殖细胞的不断成熟, GSI不断上升; 4月初个体的GSI均>6.11%, 个别超过8%, 4月中旬的GSI达到峰值(生殖细胞为第Ⅴ期), 平均值6.49%, 其中, 雌鱼GSI全部>7.50%, 最大值达11.87%, 雄鱼GSI水平相差较大, 最大值为8.78%。5月初检测到全部样本GSI下降至5.39%以下, 卵巢部分区域透明, 5月中旬GSI快速下降, 平均值降为0.51%。GSI的变化趋势与黑鲷繁殖盛期活动一致。繁殖后, 直至7月份, GSI才略有上升, 不过至11月份, GSI仍处于较低水平的缓慢上升态势。
HIS变化则表现为相对平稳中有波动的现象, 见图4。在3月中旬, 精巢卵巢生殖细胞变态成熟期前(Ⅳ期), HSI达到峰值, 平均达2.94%, 个别个体HIS最高达4.89%, 4月降为1.9%, 5月中旬最低降为1.23%。完成产卵后, HSI又开始略微回升, 6月中略降为1.35%, 过了夏季后随着鱼体能量积累又缓慢上升。
从12月份开始, 可能由于黑鲷全部转入室内温棚越冬不投饵料等原因, 个体的GSI及HIS数值均相应有所下降。

图3 黑鲷不同月份性腺变化与性逆转的切片观察
TT. 精巢; OT. 卵巢; RT. 退化精巢; Sp. 精子; CT. 精巢与卵巢间的连接组织
TT. testicular tissue; OT. ovarian tissue; RT. regressed testis; Sp. spermatid; CT. connective tissue
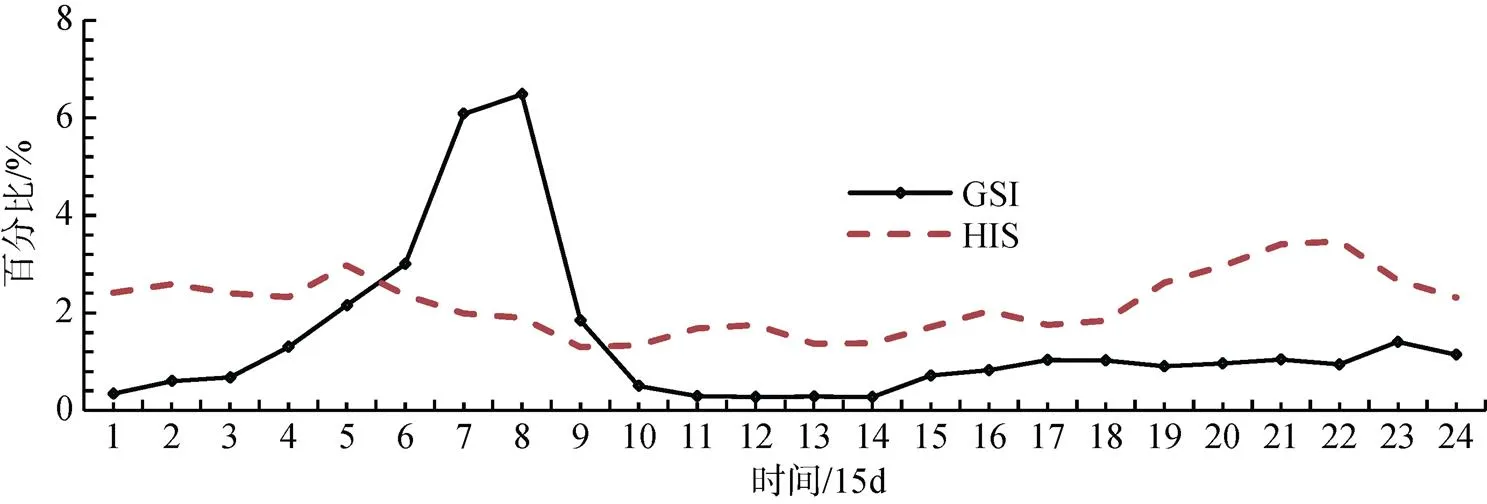
图4 黑鲷GSI与HSI的周年变化趋势
3 讨论
3.1 黑鲷的性逆转特征
性逆转是鱼类生殖对策特殊性与多样性的一个反映。本实验通过跟踪检测江苏沿海池养的黑鲷3龄期整年的性腺变化, 对性逆转发生过程有了较详细的了解。同时, 鉴于黑鲷性逆转的特殊性, 尤其在由雌往雄或雄往雌变化的初期, 通过组织切片观察能得到比单凭外观形态观察更为准确的性别判断。与先前的相关研究结果相比, 本地黑鲷的性逆转发生既有相似之处, 更有明显不同的特性。在成熟雄鱼性腺中卵巢占极小比例; 繁殖结束后至7月份是雄鱼基本完成性逆转时期; 到了第四季以卵巢为主的雌雄同体性腺中精巢组织又开始发育, 非繁殖季是性腺逆转的时期, 但这当中既有从雄往雌, 也有后期的从雌往雄的变化。这相似于Huang等[21]描述的, 在第1、2龄时黑鲷功能性雄鱼中卵巢仅占极小比例, 而在非繁殖季相反, 精卵巢变化与季节明显相关; 黑鲷在3龄期非繁殖季节以雌性卵巢为主的性腺形式, 仍与Lau等[8]描述的关于非繁殖季第1、2龄黑鲷的情况一样。从作者10月份、11月份样本切片对比中发现, 精巢再发育的性腺中卵巢的雌性生殖细胞均为较早的第Ⅰ、Ⅱ时相, 而单有雌性卵巢发育的生殖细胞有不少为第Ⅲ时相早期或中期。在第3龄期, 参与繁殖活动的雌鱼占15%的比例, 远低于先前有关报道中[7-8, 19]的30%~50%的比例。这同一批鱼在第4龄繁殖期, 检测到雌鱼比例增加了30%, 就是在非繁殖期逆转成卵巢为主的性腺中有55%再逆转成精巢为主的性腺。在第4龄期, 参与繁殖的雌鱼比例有45%, 这一比例与先前研究报道[7-8, 19]的第3龄期的比例相近。
性逆转成雌鱼的比例存在较大差异, 主要可能与黑鲷本身来源不同有关。黑鲷适应性较广, 于中国南北沿海均有分布, 由于水温、盐度等生态条件不同及季风的影响, 东海以南与黄海以北的黑鲷幼体之间的相互迁移受阻, 黑鲷存在有一定程度的南北种群差异[22]; 地理历史、海流等同样对黑鲷南北种群遗传分化产生影响[23]; 不同海区来源的黑鲷, 在体色、纹理及遗传上已有较多变化[3]。在繁殖习性上, 不同海区中鲷科鱼的繁殖季节基本是从南到北随纬度增加而延后[16]。黑鲷的繁殖期在中国的江苏、山东等北方沿海为4月~5月份, 而在南方为12月底到来年3月[14, 2, 15], 时间相差约一个季节。另一方面, 大部分硬骨鱼类的性别决定具有可塑性[24-25]; 性别决定受环境、遗传、激素等多种因素的综合作用与影响[26-27]; 甚至有环境性逆转(environmental sex reversal, ESR)的说法[10]; 环境决定模式通常为温度决定模式[28]; 如半滑舌鳎()在28℃和32℃高温下, 雄性比例分别达到69.2%和66.7%[29]。鱼类的性别比例甚至受养殖模式影响, 如日本鳗鲡()在精养池养殖的雄性比例高于在土池养殖的[30]。本实验黑鲷的人工繁殖亲本来源及苗种池塘养成均属北方的黄海海区, 之前相关的报道中[7-8, 19]样本为南方东海海区, 为了适应所栖居水环境, 黑鲷性逆转发生也可能受影响。
鱼类开始发生性逆转, 有些研究认为可能是要达到一定体长而不是年龄[24, 31-32]。本实验中不同性别形式的个体在体长与体质量上没有明显差异; Du等[2]也报道3龄雌鱼与雄鱼在个体大小与体长没有明显不同。Hughes等[33]得出平鲷成熟时的两性个体大小类似。Bhandari等[34]认为雌雄同体种类的个体大小与年龄及性别有重要关系, 它们总是保持繁殖力较高的性别形式。性逆转的发生, 可能与鱼类本身的繁殖策略有关[11, 35]; 或者是, 为了在不同环境条件时的个体生存成本损失的最小化, 性逆转可以发生在几天或几个月的时间里[36]; 再如小丑鱼()性逆转成雌鱼后, 性腺中仍有精原细胞仍然具有双向转变的潜力[37]。
3.2 鲷科鱼类的性逆转现象
鲷科中已知的主要经济种多是具有性逆转习性的雌雄同体[15], 而且性逆转形式多种多样。与黑鲷一样的雄性先熟型种类, 如金头鲷(), 在1龄期是雄性先成熟并参与繁殖, 到24个月时80%个体为雌性, 不再发生逆转; 另外的部分重复发生性逆转, 其中又有80%转为雌性[38]; 黄鳍鲷在9月~翌年l月期间, 1龄组中雄性鱼占34.64%, 雌雄同体占65.36%; 2龄组中雌性鱼占19.30%, 雌雄同体占80.70%; 3龄以上全都为雌性鱼[39]。这些鱼类的性逆转程序与黑鲷相似, 也是从雄性转变为雌雄同体再转变为雌鱼, 成熟雌鱼不再发生性逆转。黑鲷在成熟雌鱼性腺中没明显的精巢组织, 这方面与黄鳍鲷一样, 与澳洲棘鲷不同[13-14]。澳洲棘鲷性腺变化更复杂, 其在2龄时大部分为功能性雄鱼, 但也有一部分直接转化为功能性雌鱼, 有些雄鱼一生是雄鱼不转化为雌鱼[13]。雌性先熟型的黄牙鲷, 3龄前以雌性为主, 在4~5龄时雌雄同体占44%~50%, 5龄后则以雄性为主, 至8龄后全为雄鱼[16], 因此在不同时期捕获到的样品会有雌雄比例不同的情况。
黑鲷的雌雄同体阶段占据了较长生活时期, 其雌雄同体不只出现在非繁殖季节性逆转阶段, 也在繁殖期。如果照该研究得到的性逆转比例, 在黑鲷5龄鱼中就会仍有雄鱼, 具体到什么时间全部转为雌鱼或是否有类似于终生有雌雄性腺、或类似于澳洲棘鲷有一直表现为雄鱼等的状况, 仍有待进一步跟踪研究。
3.3 黑鲷GSI与HIS的周年变化趋势
性腺成熟系数和肝质量系数是衡量鱼类性腺发育的重要指标。GSI在性腺发育成熟至第Ⅴ期, GSI也达到最大值; 繁殖后GSI随着性腺的退化吸收而下降, 因而根据成熟系数水平可以判断鱼类的生殖季节时间。不同种类的GSI系数也不同。文中黑鲷的GSI在繁殖高峰时的最大值比黄鳍鲷[39]、黄鲷[16]等的要低。文中GSI当年峰值等变化趋势与黑鲷繁殖期一致; 繁殖结束后至7月期间, GSI一直处于较低水平, 此阶段黑鲷正处于卵巢与精巢间此起彼伏的性逆转状态。7月份中旬以后GSI逐渐上升, 性腺已基本转变成以卵巢增殖为主的形式。
肝脏为繁殖活动积累能量, 对性腺发育过程起着重要作用。HSI在性腺发育至第Ⅳ时达最大值; 性腺发育至第Ⅴ期时, HIS明显下降, 此时期与GSI呈一定的负相关。该变化态势与条石鲷[40]及红笛鲷[41]的相似。在黑鲷完成产卵之后, HIS略有回升后又下降, 再缓慢上升, 可能由于非繁殖季节的雌雄性腺的逆转变化影响, HIS值一直表现为波动状态。
[1] 朱德芬. 黑鲷人工养殖技术[J]. 水产养殖, 1996, 1: 30-32. Zhu Defen. The artificial cultivation technology of black porgy[J]. Aquaculture, 1996, 1: 30-32.
[2] Du J L, Lin B Y, Lee Y H, et al. The possible mechanism of sex change in the protandrous black porgy,[J]. Journal of Fishery Sciences of Taiwan, 2003, 30(2): 101-119.
[3] 吴仁协, 刘静, 樊冀蓉, 等. 黑棘鲷的命名和分类地位探究[J]. 海洋科学, 2011, 35(5): 117-119.Wu Renxie, Liu Jing, Fan Jirong, et al. A review on the nomenclature and taxonomic status of the black porgy,(Perciformes: Sparidae)[J]. Marine Sciences, 2011, 35(5): 117-119.
[4] 铃木克美, 熊国强. 硬骨鱼类的雌雄同体现象[J]. 水产科技情报, 1990, 18(1): 45-55.Suzuki Kazumi, Xiong Guoqiang. Hermaphrodite phenomenon in bony fishes[J]. Aquatic Science and Technology Intelligence, 1990, 18(1): 45-55.
[5] Chang C F, Lee M F, Chen G R. Estradiol-17β associated with the sex reversal in protandrous black porgy,[J]. Journal of Experimental Zoology, 1994, 268(1): 53-58.
[6] 孙远东, 谭立军, 唐新科, 等. 鱼类性别决定及其基因的研究进展[J]. 安徽农业科学, 2008, 36(18): 7691- 7692. Sun Yuandong, Tan Lijun, Tang Xinke, et al. Research progress in the sex determination and sexual gene of fish[J]. Agricultural Science of Anhui, 2008, 36(18): 7691-7692.
[7] Wu G C, Chang C F. Oocytes survive in the testis by altering the soma fate from male to female in the protandrous black porgy,[J]Biology Reprodution, 2013, 88 (1): 1-10.
[8] Lau E L, Lee M F, Chang C F. Conserved sex-specific timing of meiotic initiation during sex differentiation in the protandrous black porgy[J]. Biology of Reproduction, 2013, 88(6): 1-13.
[9] 陈戟, 胡炜, 朱作言. 鱼类生殖发育调控研究进展[J]. 科学通报, 2013, 58: 103-114 Chen Ji, Hu Wei, Zhu Zuoyan. Progress in studies of fish reproductive development regulation[J]. Chinese Science Bulletin, 2013, 58: 7-16.
[10] Senior A M, Nakagawa S. A comparative analysis of chemically induced sex reversal in teleosts: challenging conventional suppositions[J]. Fish & Fisheries, 2013, 14(1): 60-76.
[11] Frisch A. Sex-change and gonadal steroids in sequentially-hermaphroditic teleost fish[J]. Reviews in Fish Biology and Fisheries, 2004, 14(4): 481-499.
[12] 樊冀蓉, 吴仁协, 赵元莙, 等. 中国鲷科鱼类分类和系统发育研究进展[J]. 中国水产科学, 2011, 18(2): 472-480. Fan Jirong, Wu Renxie, Zhao Yuanjun, et al. Progresses on taxonomy and phylogeny of family Sparidae from China[J]. Journal of Fishery Sciences of China, 2011, 18(2): 472-480.
[13] 李加儿, 区又君. 深圳湾沿岸池养黄鳍鲷的繁殖生物学[J]. 浙江海洋学院学报(自然科学版), 2000, 19(2): 139-143.Li Jiaer, Ou Youjun. Studies on the reproductive biology of the pond-culturedHouttuyn in the coast of Shenzhen Bay[J]. Journal of Zhejiang Ocean University (Natural science), 2000, 19(2): 139-143.
[14] Pollock B R. The reproductive cycle of yellowfin bream,(Günther), with particular reference to protandrous sex inversion[J]. Journal of Fish Biology, 1985, 26(3): 301-311.
[15] 江世贵, 苏天凤, 夏军红, 等. 中国近海鲷科鱼类种质资源及其利用[M]. 北京: 海洋出版社, 2012: 12- 34. Jiang Shigui, Su Tianfeng, Xia Junhong, et al. Resources and utilization of the Sparidae from Chinese offshore[M]. Beijing: The Ocean Publishing Company, 2012: 12-34.
[16] 施兆鸿, 王建钢, 高露姣, 等. 南海黄鲷性腺发育的初步研究[J]. 台湾海峡, 2006, 25(3): 353-359. Shi Zhaohong, Wang Jiangang, Gao Lujiao, et al. Prelminary study on gonad development of Yellow sea bream,, in South China Sea[J].Journal of oceanography in Taiwan Strait, 2006, 25(3): 353- 359.
[17] Chang C F, Lee M F, Chen G L. Estradiol-17β associated with the sex reversal in protandrous black porgy,[J]. Journal of Experimental Zoology, 1994, 268: 53-58.
[18] 阮洪超, 黄瑞东. 已烯雌酚诱导黑鲷幼鱼性逆转[J]. 海洋科学, 1997, 21(6): 6-8.Ruan Hongchao, Huang Ruidong. Use of diethylstilbestrol to induce sex reversal of adolescent fish of black sea bream,[J]. Marine Sciences, 1997, 21(6): 6-8.
[19] Lee Y H, Wu G C, Du J L, et al. Estradiol-17beta induced a reversible sex change in the fingerlings of protandrous black porgy,Bleeker: the possible roles of luteinizing hormone in sex change[J]. Biology of Reproduction, 2015, 71(4): 1270-1278.
[20] 楼允东. 组织胚胎学[M]. 北京: 中国农业出版社, 1994: 127-135.Lou Yundong. Histoembryology[M]. Beijing: ChinaAgricultural Press, 1994: 127-135.
[21] Huang J D, Lee M F, Chang C F. The morphology of gonadal tissue and male germ cells in the protandrous black porgy,[J]. Zoological Studies, 2002, 41(2): 216-226.
[22] 赵爽, 章群, 乐小亮, 等. 中国近海5个黑鲷地理群体的遗传变异[J]. 海洋科学, 2010, 34(2): 75-79. Zhao Shuang, Zhang Qun, Yue Xiaoliang, et al. Genetic variation among 5 stocks ofin China’s coastal waters[J]. Marine Sciences, 2010, 34(2): 75-79.
[23] 施晓峰, 苏永全, 王文成, 等. 基于mtDNA控制区序列的3个黑棘鲷群体遗传结构特性研究[J]. 热带海洋学报, 2015, 34(1): 56-63.Shi Xiaofeng, Su Yongquan, Wang Wencheng, et al. Population genetic structure of three stocks ofbased on mtDNA control region sequences[J]. Journal of Tropical Oceanography, 2015, 34(1): 56- 63.
[24] Erzini K, Gonçalves J M S. The reproductive biology of(L.) from the SW Coast of Portugal [J]. Scientia Marina, 2000, 64(4): 403-411.
[25] 梅洁, 桂建芳. 鱼类性别异形和性别决定的遗传基础及其生物技术操控.中国科学: 生命科学, 2014, 44(12): 1198-1212. Mei Jie, Gui Jianfang. Genetic basis and biotechnological manipulation of sexual dimorphism and sex determination in fish[J]. Science of China: Life Science, 2014, 44(12): 1198-1212.
[26] Hesp S A, Potter I C, Hall N G. Reproductive biology and protandrous hermaphroditism in[J]. Environmental Biology of Fishes, 2004, 70(3): 257-272.
[27] Martínez P, Viñas A M, Sánchez L, et al. Genetic architecture of sex determination in fish: applications to sex ratio control in aquaculture[J]. Frontiers in Genetics, 2014, 5(340): 1-13.
[28] 梁卓, 陈松林, 张静, 等. 半滑舌鰨养殖群体雌雄比例与自然性逆转率[J]. 中国水产科学, 2013, 20(1): 44-49. Liang Zhuo, Chen Songlin, Zhang Jing, et al. Analysis of the female ratio and natural sexual reversal ratio in cultured half-smooth tongue sole families[J]. Journal of Fishery Sciences of China, 2013, 20(1): 44-49.
[29] 邓思平, 陈松林, 田永胜, 等. 半滑舌鳎的性腺分化和温度对性别决定的影响[J]. 中国水产科学, 2007, 14(5): 714-719.Deng Siping, Chen Songlin, Tian Yongsheng, et al. Gonadal differentiation and effects of temperature on sex determination in half smooth tongue-sole,[J]. Journal of Fishery Sciences of China, 2007, 14(5): 714-719.
[30] 谢仰杰, 张森, 黄良敏, 等. 人工养殖日本鳗鲡的性比及性腺发育的初步研究[C]//2011年中国水产学会学术年会论文摘要集. 厦门: 中国水产学会, 2011: 98. Xie Yangjie, Zhang Sen, Huang Liangmin, et al. Farmed Japanese eel sex ratio and the preliminary research on the gonad development[C]//Academic Chinese aquaculture association annual meeting 2011 abstract book. Xiamen: China Societ of Fisheries, 2011: 98.
[31] Devlin R H, Nagahama Y. Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influences[J]. Aquaculture, 2002, 208: 191-364.
[32] Boughamou N, Derbal F, Kara M H. Age, growth and reproduction of the black sea bream(Linnaeus) (Sparidae) in the Gulf of Annaba (Algeria)[J]. Journal of Applied Ichthyology, 2015, 31(4): 773-779.
[33] Hughes J M, Stewart J, Kendall B W, et al. Growth and reproductive biology of tarwhine(Sparidae) in eastern Australia[J]. Marine & Freshwater Research, 2008, 59(12): 1111-1123.
[34] Bhandari R K, Komuro H, Nakamura S, et al. Gonadal restructuring and correlative steroid hormone profiles during natural sex change in protogynous honeycomb grouper ()[J]. Zoology Science, 2003, 20: 1399-1404.
[35] Page Y L, Diotel N, Vaillant C, et al. Aromatase, brain sexualization and plasticity: The fish paradigm[J]. European Journal of Neuroscience, 2010, 32(12): 2105- 2115.
[36] Yamaguchi S. Time required for sex change in teleost fishes: Hormonal dynamics shaped by selection[J]. Journal of Theoretical Biology, 2016, 407: 339-348.
[37] Nakamura M, Miura S, Nozu R, et al. Opposite-directional sex change in functional female protandrous anemone fish,: effect of aromatase inhibitor on the ovarian tissue[J]. Zoological Letters, 2015, 1(1): 1-5.
[38] Zohar Y. The gonadal cycle of the captivity-reared hermaphroditic teleost(L.) during the first two years of life[J]. Annales De Biologie Animale Biochimie Biophysique, 1978, 18(4): 877-882.
[39] 洪万树, 张其永, 郑建峰, 等. 港养黄鳍鲷性腺发育和性转变研究[J]. 台湾海峡, 1991, 10(3): 221-228. Hong Wanshu, Zhang Qiyong, Zheng Jianfeng, et al. Studies on gonadal development and sex inversion of yellowfin sea bream ()[J]. Journal of Oceanography in Taiwan Strait, 1991, 10(3): 221-228.
[40] 彭志兰, 柳敏海, 傅荣兵, 等. 野生条石鲷精巢的年周期发育[J]. 海洋通报, 2013, 32(6): 700-703.Peng Zhilan, Liu Minhai, Fu Rongbing, et al. Annual development of the wildtestis[J]. Marine Science Bulletin, 2013, 32(6): 700-703.
[41] 杨春玲, 刘楚吾. 红笛鲷()性腺发育初步研究[J]. 广西农业科学, 2010, 41(4): 375-379. Yang Chunling, Liu Chuwu. Preliminary study on gonad development in[J]. Guangxi Agricultural Sciences, 2010, 41(4): 375-379.
Histological observation of sex change in the cultivated black porgy,
CHEN Shu-yin, ZHANG Zhi-yong, LIU Hai-lin, XU Jin, ZHU Fei, JIA Chao-feng, ZHANG Zhi-wei, REN Zhong-hong
(Marine Fisheries Research Institute of Jiangsu Province, Jiangsu Key Laboratory for Genetics and Breeding of Marine Fishes, Nantong 226007, China)
The black porgy,, is a popular and commonly farmed fish that undergoes a male-to-female sex change at 3 years of age. However, the process by which the black porgy changes sex remains unclear. In order to determine this process, the gonadal development and sex change ofat the 3–4 year mark was studied by collecting samples regularly and analyzing samples with histological methods. Results showed that in bisexual gonads, the testicular tissue developed more predominantly, and some oogonia and primary oocytes remained in the smaller ovarian tissue from January to May. Approximately 15% of 3-year-old black porgy were females during the spawning season. The testicular tissue then began to regress and ovarian tissue started to grow after the spawning periods (June–July), with full regression of the testis accompanying the development of vitellogenic oocytes. The trend survey of the gonad dissection showed that the testicular tissue began to grow gradually at the end of September, and remained up in November and December in a subset of fish 3 years of age and older. There was an equal distribution of fish with bisexual gonads, ovaries, and testicles (each group accounted for one third of the sample population) by the end of December. In addition, annual changes in the gonado-somatic index and hepato-somatic index were analyzed. This study outlines the natural sex change process of, and may provide guidance on breeding research for hermaphrodite fish.
; hermaphrodite; sex change; gonado-somatic index; hepato-somatic index
(本文编辑: 谭雪静)
S917.4
A
1000-3096(2017)07-0051-08
10.11759//hykx20161214005
2016-12-14;
2017-02-17
江苏省水产三新工程重大项目(D2015-17); 南通市应用基础研究计划(MS12015071, MS12015070)
[Aquatic Sanxin Engineering Major Project of Jiangsu Province, No.D2015-17; Applied Basic Research Plan of Nantong, Jiangsu Province, No.MS12015071, No.MS12015070]
陈淑吟(1966-), 女, 广东汕尾人, 研究员, 博士, 主要从事海水鱼类种质与繁育研究, 电话: 13862908366, E-mail: shuyinchen89@163.com
Dec. 14, 2016
