大菱鲆精子运动特征与精液pH的相关性研究
2017-11-21徐世宏丰程程王彦丰刘清华
安 皓, 徐世宏, 丰程程, 王彦丰, 刘清华, 李 军
大菱鲆精子运动特征与精液pH的相关性研究
安 皓1, 2, 3, 徐世宏1, 3, 丰程程1, 2, 3, 王彦丰1, 3, 刘清华1, 3, 李 军1, 3
(1. 中国科学院海洋研究所中国科学院实验海洋生物学重点实验室, 山东青岛 266071; 2. 中国科学院大学, 北京 100049; 3. 青岛海洋科学与技术国家实验室海洋生物学与生物技术功能实验室, 山东青岛 266237)
为探究大菱鲆()精液质量与pH的关系及甘油对大菱鲆精子激活的影响, 本研究通过计算机辅助精子分析系统分析检测了威海和烟台4家大菱鲆育苗场(A、B、C、D)的精子质量。研究发现, 不同育苗场的大菱鲆精子活力存在显著的差异, A2>A1>D>C>B, 精子预测寿命分别为11.7、7.1、6.8、4.6、3.3 min, 所取精子的质量的存在显著差异。研究结果发现, 大菱鲆精子运动特性与精子活化率相关性显著, 其中精子活化率与平均曲线运动速度、平均直线运动速度、平均路径速度、精子头侧摆幅度、精子平均鞭打频率呈显著正相关(<0.05), 与运动直线性、运动摆动性、运动前向性等参数无显著相关性; 大菱鲆精子运动特性受pH影响显著, 精液pH与平均曲线运动速度、平均直线运动速度、平均路径速度、精子头侧摆幅度、精子平均鞭打频率呈显著正相关(<0.05), 而与运动直线性、运动摆动性、运动前向性等参数无显著相关性。同时还发现, 精子活化率高、寿命长的大菱鲆精液pH偏弱碱性(pH=8.0), 即大菱鲆精子适宜在弱碱性环境中活动。除此之外, 向激活海水中加入梯度甘油(0.1、1、10、100、500、1 000 mmol/L), 发现可以显著提高大菱鲆精子寿命, 其中甘油浓度为100 mmol/L时, 精子寿命延长至15.17 min±0.29 min, 推测甘油在精子激活后可能被精子吸收并氧化分解提供能量。
大菱鲆(); 精子; 运动特征; pH
鱼类精子质量由于该鱼种养殖模式、个体、环境等因素的不同, 存在较大的个体差异[1-4]。精子质量对鱼类的人工繁育至关重要, 优质的精子可以显著提高受精率和孵化率, 从而提高养殖生产效益。在其他研究领域, 对精子质量的鉴定也十分重要, 如精子冷冻、品系选育、重金属污染评价等[5]。鱼类精子质量的评价方法有很多, 如精子活化率、运动时间、精子密度、受精率和生理功能等[5]。计算机辅助精子分析(computer-assisted sperm analysis, CASA)技术能对精子的动静态图像全面量化分析[6], 与常规精液分析方法(Sperm routine analysis, SRA)相比测定指标更多样、客观、准确。
甘油作为精子冷冻保存的添加剂, 在精子冷冻保存中的作用已经比较清楚, 但在精子激活后活力维持中是否有作用及其作用机制尚不清楚。在精子活力维持方面, 糖类(如葡萄糖、果糖)等外源物质能够促进精子的活力[7-8]。有研究表明, 精子细胞中的甘油能够进入糖酵解途径, 参与有氧代谢, 提供能量, 促进精子活力的维持[9-11]。
鲆鲽鱼类是中国重要的海水养殖鱼类, 其中大菱鲆()养殖产业占鲆鲽类产量和规模的80%。本实验拟以大菱鲆精子为研究对象, 采集了4个不同鱼苗场的大菱鲆精子, 通过对这些大菱鲆精子活力的检测和评价, 探究精液质量与pH的关系, 及甘油对大菱鲆精子激活的影响, 为提高大菱鲆人工繁殖的受精率提供科学依据。
1 材料与方法
1.1 亲鱼来源
实验用大菱鲆亲鱼采集于威海和烟台4家公司的繁殖用鱼, 采集时间2016年9月、10月, 其中于A公司先后采集了2次, 选取尾数分别为25(A1, 12条; A2, 13条)、8、8、8条。
1.2 药品及仪器
实验所用甘油购自青岛恒飞生物科技有限公司(分析纯), 不同浓度梯度的甘油激活剂设置为0.1、1、10、100、1 000 mmol/L, 用海水稀释, 显微镜型号Nikon-eclipse-E200, 计算机辅助分析系统(CASA)。
1.3 采集方法
随机取繁殖用鱼, 采用人工挤压腹部的方法采集精液, 操作过程中尽量避免海水、粪便、尿液等的污染。采集到的精液装入1.5 mL离心管内, 置于装有冰袋(毛巾包裹)的泡沫箱中暂存。精液采集为逐条采集, 随后立即检测精子质量, 1个个体为1个样本。
1.4 精子质量检测
精子的活力检测通过自然海水进行稀释激活精子, 在10倍显微镜下观察精子的运动情况并通过计算机软件采集相关数据并统计。活化率检测: 激活后30s时对精子的活化率进行统计, 每个样本计数的精子数大于200个, 以快速和中速运动精子个数之和与总计数精子个数的比值作为精子的活化率指标(速率指标: 快速>100mm/s、中速45~100mm/s、慢速10~45mm/s, 不动<10mm/s)[12-13]。寿命检测: 精子自激活开始到约 95%停止原处颤动, 即认为寿命终止。运动特征参数检测: 激活后30 s时记录精子运动特征参数。pH检测: 采用pH试纸检测每个样本pH值。梯度甘油激活剂激活精子, 检测不同浓度的甘油激活精子后精子的寿命。
1.5 统计分析
本实验数据均用SPSS 16软件进行分析。实验数据以平均数±SD表示, 平均数的比较采用 One- Way ANOVA 分析法和Kruskal-Wallis检验,<0.05为差异显著,<0.01为差异极显著, 相关性分析采用Pearson法。
2 结果与分析
2.1 大菱鲆精子活化率与运动特征参数
实验以自然海水激活精子, 测得激活后30 s时的8个运动特征参数: 平均曲线运动速度(curvilinear velocity, VCL)、平均直线运动速度(straight line velocity, VSL)、平均路径速度(average path velocity, VAP)、精子头侧摆幅度(amplitude of lateral head displacement, ALH)、运动的直线性(linearity, LIN)、运动的摆动性(wobble, WOB)、运动的前向性(straightness, STR)、精子平均鞭打频率(beat cross frequency, BCF), 活化率与运动特征参数关系如图1所示。
大菱鲆精子激活后活化率与运动特征参数VCL(=0.845,<0.01,=49)、 VSL(=0.664,<0.01,=47)、VAP(=0.763,<0.01,=49)、ALH(=0.695,<0.01,=43)、BCF(=0.871,<0.01,=43)呈极显著正相关关系, 与LIN、WOB、STR相关性不显著。
2.2 大菱鲆精液pH与精子运动特征参数
实验以自然海水激活精子, 用pH试纸测得从各育苗场取得的精液未激活时的pH, 同时测得激活后30 s时的8个运动特征参数: 平均曲线运动速度、平均直线运动速度、平均路径速度、精子头侧摆幅度、运动的直线性、运动的摆动性、运动的前向性、精子平均鞭打频率, pH与运动特征参数关系如图2所示。
大菱鲆未激活精液的pH与大菱鲆精子激活后的运动特征参数VCL(=0.300,<0.05,=40)、 VSL(=0.546,<0.01,=29)、VAP(=0.494,<0.01,=38)、ALH(=0.603,<0.01,=42)、BCF(=0.476,<0.01,=33)呈正相关关系, 与LIN、WOB、STR相关性不显著。ALH在各pH组之间差异显著(6.5a、7.0a、7.5b、8.0c,<0.05), VCL、VSL、VAP、BCF仅在pH 7.5和8.0两组中存在显著差异(<0.05), LIN、STR、WOB在各pH组之间无显著差异。大菱鲆精液pH越高VCL、VSL、VAP、ALH、BCF等参数的数值也越高, 精子活力也越好。
2.3 大菱鲆精液pH与精子活化率
将各个养殖场取得的精液用pH试纸测得未激活精液的pH(=37), 以激活后30 s时测得的快速(>100mm/s)和中速(45~100mm/s)运动精子占所有精子的比例作为精子活化率, pH与活化率关系如图3所示。
大菱鲆精液pH与精子活化率呈极显著正相关关系(=0.466,<0.01), 活化率在各pH组之间分别为6.5ab、7ab、7.5a、8b(<0.05)。大菱鲆精液pH越高活化率越高, 精子活力也越好。好的大菱鲆精液pH呈弱碱性, 在8.0左右。

图1 大菱鲆精子活化率与运动特征参数
2.4 精子寿命
将各养殖场采集到的精子样品取5~8个测精子寿命。将精子以自然海水激活, 30 s时测活化率, 之后每隔30 s测1次活化率, 各养殖场的样品测得的数据分别取平均后, 测得不同养殖场精子激活后时间与精子活化率关系如图4所示。
随着激活后时间的持续, 精子活化率明显下降, 各养殖场精液质量也存在明显差异(<0.01)。精液质量情况: A2>A1> D> C> B。根据图1中的拟合曲线方程得到不同养殖场精子寿命如表1所示。
2.5 大菱鲆精液pH与精子寿命
将各个养殖场取得的精液用pH试纸测得未激活精液的pH(=40), 然后将养殖场采集到的精子样品以自然海水激活, 测得精液pH与精子寿命关系如图5所示。
大菱鲆精液pH与精子寿命呈极显著正相关关系(=0.576,<0.01), 各pH组精子寿命分别为6.5a、7b、7.5bc、8c(<0.05)。大菱鲆精液pH越高寿命越长。

图2 大菱鲆精液pH与精子运动特征参数
2.6 甘油对精子激活后精子寿命的影响
用海水稀释甘油获得不同浓度梯度的甘油激活剂, 各梯度甘油激活剂分别激活精子, 测3个活力相近的精液样本后取平均值, 测得不同梯度甘油激活剂激活下的精子寿命如图6所示。
实验组与对照组有显著差异(<0.05), 不同浓度实验组之间也有显著差异(<0.05), 说明加入甘油后可以延长精子寿命, 其中甘油浓度在100 mmol/L的时候效果最好, 浓度过高会降低精子寿命。
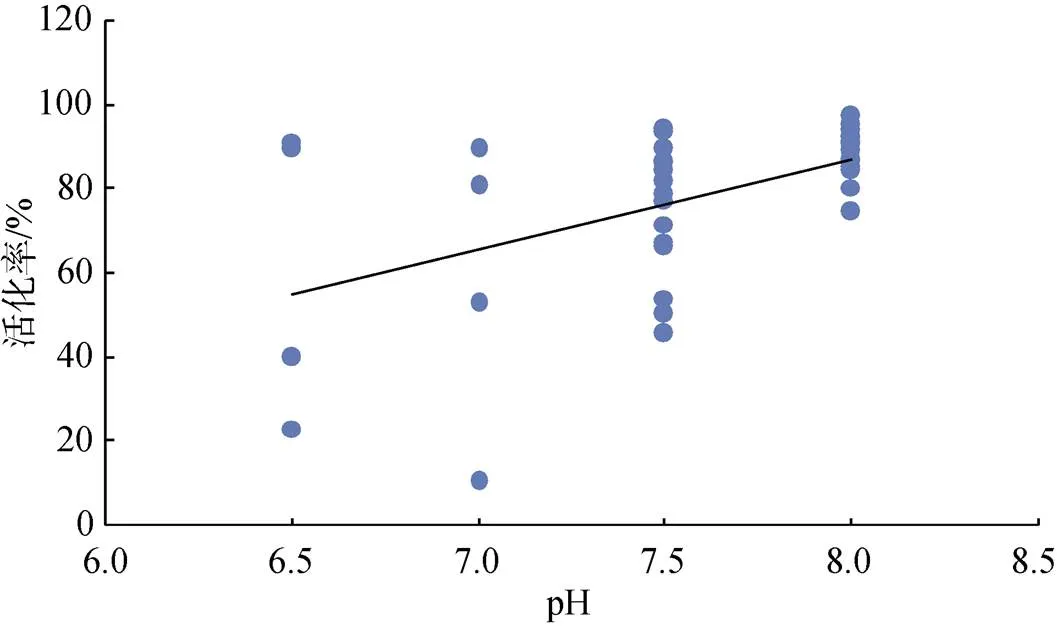
图3 大菱鲆精液活化率与pH
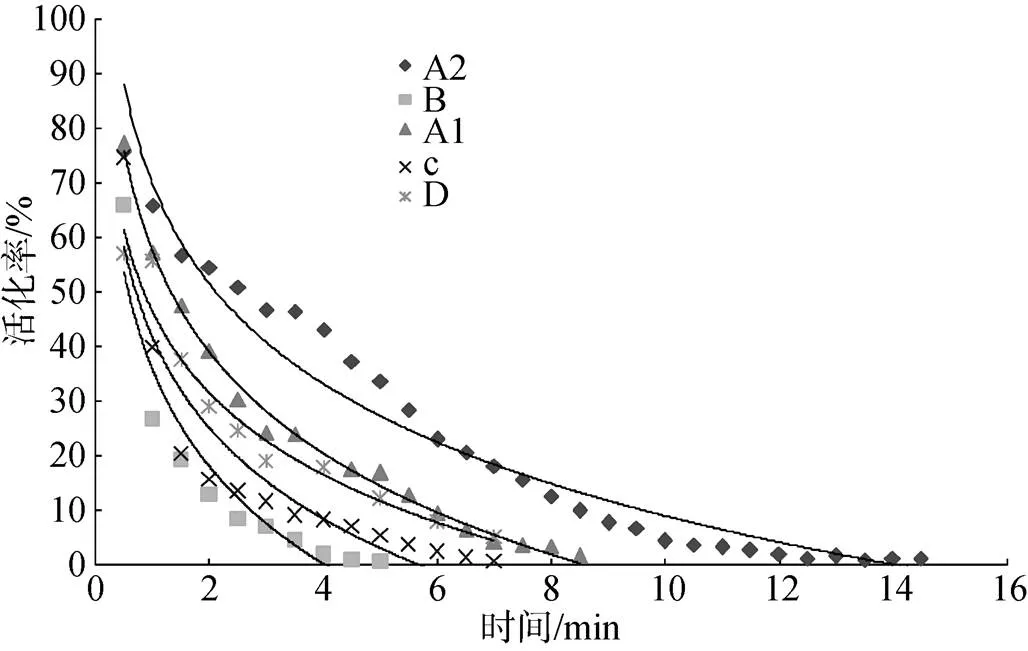
图4 大菱鲆精子活化率与激活时间

表1 不同育苗场场大菱鲆精子寿命
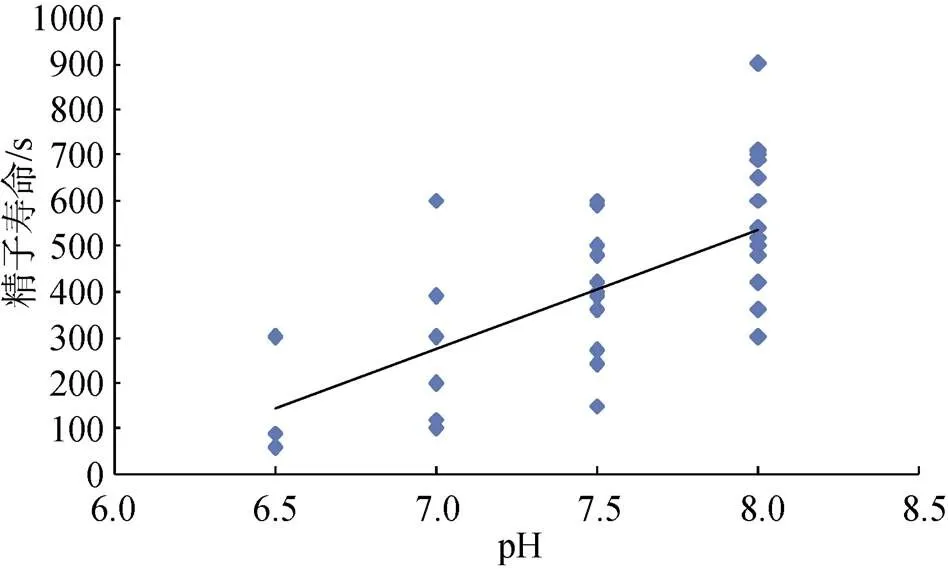
图5 大菱鲆精液pH与精子寿命
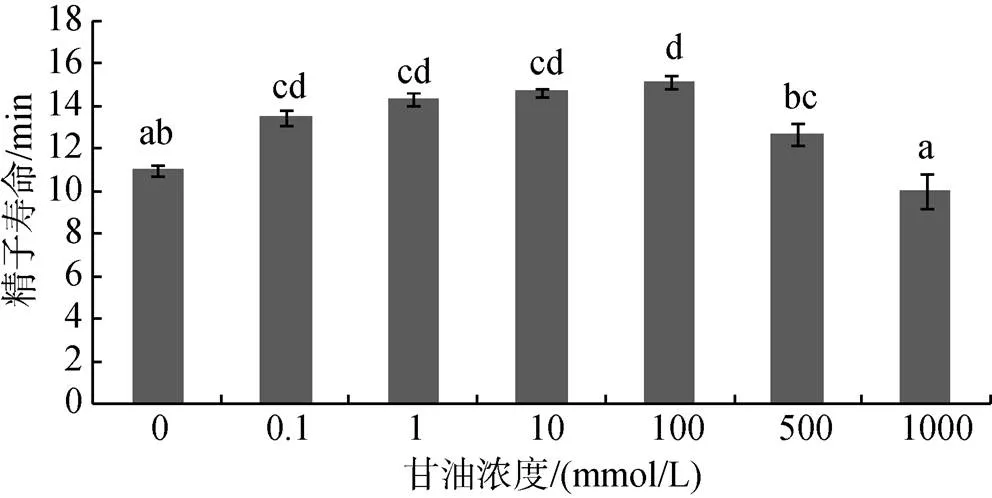
图6 大菱鲆精子活力与甘油浓度
图中字母代为多重比较结果
The letters represent the results of multiple comparison
3 讨论
鱼类精子活力的评价指标有多种, 如精子活化率、运动时间、密度、形态、受精率和生理功能等。本实验选取其中最传统的评价方法——精子活力, 其测定方便, 能较准确地评价精子质量。计算机辅助精子分析与常规精液分析方法相比, 前者能客观准确地量化精子运动状况, 通过对精子运动特征参数的捕获, 使人们对精子运动有了更深层次的了解, 并已被越来越多地用于精子质量的评估。实验检测了精子8个运动特征参数, 其中VCL、VSL、VAP、ALH、BCF与精液pH或活化率成正相关关系, LIN、STR 、WOB与精液pH或活化率相关性不显著, 这与LIN、STR、WOB是比值的定义有关。比较各运动特征参数在不同pH组之间的差异性发现, 多数运动特征参数在高pH组之间差异显著, 低pH组之间、高pH与低pH组之间差异不显著, 这可能与低pH值组有效数据太少有关。
实验共测得49尾鱼的pH, 其中pH在7.0以上的占78%。作者发现, 活化率高、精子寿命长的大菱鲆精液pH偏弱碱性, 即大菱鲆精子适宜在弱碱性环境中活动。唐天德等[14]认为, 鱼类精子均适于在中性和偏碱性环境中活动, 酸性环境会破坏精子细胞, 抑制精子活力。据报道, 草鱼()、鲤()和乌鳢()等淡水鱼类精子活力最强时的适宜pH值均在7.5~9.0, 即在弱碱性范围内[15], 眼斑拟石首鱼()、点带石斑鱼()等海水鱼类精子活力最适pH范围分别是6.5~8.5、6.5~8.0, 也在弱碱性范围内[16-17]。在本试验中大菱鲆精子活力最强时的pH为8.0, 这一结果与其他鱼类一致。实验发现激活30s时, 在较低pH组的样品中也有运动特征参数值较高的样品, 且这些精子的各运动特征参数均处于较高水平, 但是与高pH下同等活力的样品相比, 它们的寿命却明显缩短, 即低pH的精子激活后虽然在短期内活力较高但持久性较差。实验过程中还发现采集精液时尿液掺入会显著降低pH和精子活力甚至杀死精子, 因此生产中采集精液时应避免尿液的掺入。
将精子运动时间和活化率综合考虑能更好地反映精子的运动能力。实验发现, 随着激活后时间的推移, 精子活化率明显下降, 4家公司精液质量的差异可能是由于饲养条件不同所导致的。值得一提的是, 作者发现同一地点2次取样精子质量差异较大, 第二次明显好于第一次, 两次取样时间分别是大菱鲆产精初期和中期, 间隔1个月左右, 说明大菱鲆繁殖期中期精液质量高于初期, 这与韩明明等[18]研究结果相一致。
通过作者的研究发现, 甘油的加入延长了精子激活后的运动时间, 最适浓度为100 mmol/L, 浓度过低或过高都会降低精子寿命。在精子活力维持方面, 已知糖类(如葡萄糖、果糖)等外源物质能够促进精子的活力[7-8], Gardiner[19]认为, 体外受精鱼类精子具有三羧酸循环代谢的能力。鱼类可以通过氧化作用利用细胞外源性碳水化合物, 尤其是葡萄糖、半乳糖和果糖[20]获得能量。而精子细胞内的甘油氧化分解产生的中间产物能够参与糖酵解过程, 提供能量, 促进精子活力的维持[9-11]。因此, 推测外源甘油能够在大菱鲆精子激活时迅速进入精子细胞并被精子细胞氧化分解, 提供能量, 从而延长精子激活后的运动时间。
4 结论
实验检测了采自4个养殖场共5批大菱鲆精子8个运动特征参数, 其中平均曲线运动速度、平均直线运动速度、平均路径速度、精子头侧摆幅度、精子平均鞭打频率与精液pH或活化率成正相关关系, 运动的直线性、运动的前向性、运动的摆动性与精液pH或活化率相关性不显著。
实验发现活化率高、精子寿命长的大菱鲆精液pH偏弱碱性, 即大菱鲆精子适宜在弱碱性环境中活动。某些低pH的精子激活后虽然在短期内活力较高但持久性较差。尿液会显著降低精液的pH和精子活力, 甚至杀死精子。大菱鲆繁殖期中期精液质量高于初期。
甘油的加入延长了精子激活后的运动时间, 最适浓度为100 mmol/L。作者推测外源甘油能够在大菱鲆精子激活时迅速进入精子细胞并被氧化分解, 提供能量, 从而延长精子激活后的运动时间。
[1] Alavi S M, Cosson J. Sperm motility in fishes. I. Effects oftemperature andpH:areview[J].CellBiologyInternational, 2005, 29(2): 101-110.
[2] Sansone G, Fabbrocini A, Ieropoli S, et al. Effects of extender composition, cooling rate, and freezing on the motility of sea bass (L.) spermatozoa after thawing[J]. Cryobiology, 2002, 44(3): 229-239.
[3] Christ S A, Toth G P, Mccarthy H W, et al. Monthly variation in sperm motility in common carp assessed using computer-assisted sperm analysis (CASA)[J]. Journal of Fish Biology, 1996, 48(6): 1210-1222.
[4] Vladiĉ T, Jätrvi T. Sperm motility and fertilization time span in Atlantic salmon and brown trout—the effect of water temperature[J]. Journal of Fish Biology, 1997, 50(5): 1088-1093.
[5] 季相山, 陈松林, 赵燕, 等.鱼类精子质量评价研究进展[J].中国水产科学, 2007, 14(6): 1048-1054. Ji Xiangshan, Chen Songlin, Zhao Yan, et al. Review of assessing sperm quality in fish[J]. Journal of Fishery Sciences of China, 2007, 14(6): 1048-1054.
[6] Boyer S P, Davis R O, Katz D F. Automated semen analysis-current problems in obstetrics[J]. Gynecol Fertil, 1989, 12: 165-200.
[7] 张利.猪精子在液态保存过程中葡萄糖代谢的研究[D]. 哈尔滨: 东北农业大学, 2014.Zhang Li. Investigation of sperm glucose metabolism during liquid storage pig semen[D]. Haerbin: Northeast Agricultural University, 2014.
[8] 王学颖, 徐世宏, 刘清华, 等.渗透压、pH、葡萄糖及离子溶液对夏牙鲆精子激活及运动特征的影响[J].海洋科学, 2016, 40(3): 40-46.Wang Xueying, Xu Shihong, Liu Qinghua, et al. The effects of osmolality, pH, glucose and ions solutions on sperm motility of summer flounder ()[J]. Marine Sciences, 2016, 40(3): 40-46.
[9] Mann T, White I G. Metabolism of glycerol, sorbitol and related compounds by spermatozoa[J]. Nature, 1956, 178(4525): 142-143.
[10] White I G. Metabolism of glycerol and similar compounds by bull spermatozoa[J]. Amer Physio, 1957, 189: 307-310.
[11] Jones A R, Chantrill L A, Cokinakis A. Metabolism of glycerol by mature boar spermatozoa[J]. Journal of Reproduction and Fertility, 1992, 94(1): 129-134.
[12] 刘清华, 李军, 丁福红, 等.运用计算机辅助分析检测超低温保存的真鲷()精子的质量[J]. 自然科学进展, 2006, 9: 1181-1185.Liu Qinghua, Li Jun, Ding Fuhong, et al. The analysis of cryopreserved sperm quality ofby CASA[J]. Progress in Natural Science, 2006, 9: 1181-1185.
[13] 邓岳松, 林浩然.鱼类精子活力研究进展[J].生命科学研究, 1999, 4: 271-278.Deng Yuesong, Lin Haoran. Advance in fishes sperm motility[J]. Life Science Research, 1999, 4: 271-278.
[14] 唐天德, 许兴基, 李文杰, 等.几个环境因子对梭鱼精子活力影响的初步研究[J]. 热带海洋, 1985, 4(2): 91-97.Tang Tiande, Xu Xingji, Li Wenjie, et al. A preliminary study on some environmental factors influencing the vitality of mullet () spermatozoa[J]. Tropic Oceanology, 1985, 4(2): 91-97.
[15] 赵振山, 曹克驹, 杨立军.乌鳢精子生理生态特性的研究Ⅰ不同pH溶液对精子活力的影响[J]. 水利渔业, 1995, 3 : 11-12.Zhao Zhenshan, Cao Keju, Yang Lijun.A study on physiological and ecological characteristics of snakehead spermⅠthe influence of solution with different pH on sperm motility[J]. Reservoir Fisheries, 1995, 3: 11-12.
[16] 魏平, 叶霆, 吴向丹, 等. 环境因子对眼斑拟石首鱼精子活力的影响[J]. 生态科学, 2009, 5: 438-442.Wei Ping, Ye Ting, Wu Xiangdan, et al. Effect of environment factors on the vitality of sperm in[J]. Ecological Science, 2009, 5: 438-442.
[17] 王小刚.点带石斑鱼精子种质保存研究[D].海口: 海南大学, 2010.Wang Xiaogang. The germplasm preseervation of spermatozoa from Epinephelus[D]. Haikou: Hainan University, 2010.
[18] 韩明明, 丁福红, 孟振, 等.大菱鲆不同繁殖期的精子质量分析[J]. 渔业科学进展, 2013, 34(5): 31-35.Han Mingming, Ding Fuhong, Meng Zhen, et al. The analysis of turbotsemen quality during spawning season[J]. Progress in Fishery Sciences, 2013, 34(5): 31-35.
[19] Gardiner D M. Utilization of extracellular glucose by spermatozoa of two viviparous fishes[J]. Comparative Biochemistry & Physiology Part A Physiology, 1978, 59(2): 165-168.
[20] Gregory R W. Occurrence of fructose in trout seminal plasma[J]. Transactions of the American Fisheries Society, 1968, 97(2): 203-204.
Analysis of turbot () sperm motion characteristics and relationship with pH
AN Hao1, 2, 3, XU Shi-hong1, 3, FENG Cheng-cheng1, 2, 3, WANG Yan-feng1, 3, LIU Qing-hua1, 3, LI Jun1, 3
(1. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. Laboratory for Marine Biology and Biotechnology, Qingdao National Laboratory for Marine Science and Technology, Qingdao 266237, China)
This study investigated the relationship between semen quality and pH of turbot () and the impact of glycerin on turbot sperm activation using turbot sperm from different hatcheries (A, B, C, and D) through the computer-assisted sperm analysis (CASA) system. The results showed that sperm motility rates were different in the four hatcheries, A2> A1> D > C > B. The predicted sperm longevity times were 11.7, 7.1, 6.8, 4.6, and 3.3 min, respectively.
The motility rates of turbot sperm significantly positively correlated with VCL, VSL, VAP, ALH, and BCF (< 0.05), but no significant correlation was observed with LIN, WOB, and STR. We found that the pH of turbot sperm significantly positively correlated with motility, VCL, VSL, VAP, ALH, and BCF(< 0.05), whereas no significant correlation was found with LIN, WOB, and STR. In addition, high-quality sperm exhibited a weak alkalinity with a pH of 8.0.
We also found that an appropriate concentration of glycerol (100 mmol/L) in sea water was useful for maintaining the longevity.
; sperm; motion characteristics; pH
(本文编辑: 谭雪静)
Q256
A
1000-3096(2017)07-0037-07
10.11759//hykx20170119006
2017-01-19;
2017-03-22
国家自然科学基金资助项目(31472264, 31572602); 鳌山科技创新计划项目 (2015ASKJ02, 2015ASKJ02-03-03); 现代农业产业技术体系项目(CARS-47)
[National Natural Science Foundation of China, No.31472264, 31572602; the Scientific and Technological Innovation Project , No.2015ASKJ02, 2015ASKJ02-03-03; Modern Agro-industry Technology Research System, No.CARS-47]
安皓(1992-), 男, 山东日照人, 硕士研究生, 主要从事鱼类生理学研究, E-mail: anhao14@mails.ucas.ac.cn; 李军, 通信作者, 研究员, E-mail: junli@qdio.ac.cn; 刘清华, 通信作者, 副研究员, E-mail: qinghualiu@qdio.ac.cn
Jan. 19, 2017
