七彩鲑雌核发育及其倍性研究
2017-11-21张培军冷东泽巴翠玉茆安婷李月红
代 静,焦 雪,张培军,冷东泽,巴翠玉,茆安婷,李月红
(1.吉林农业大学,长春 130000;2.吉林省卫生监测检验中心,长春 130000)
七彩鲑雌核发育及其倍性研究
代 静1,焦 雪1,张培军2,冷东泽1,巴翠玉1,茆安婷1,李月红1
(1.吉林农业大学,长春 130000;2.吉林省卫生监测检验中心,长春 130000)
利用紫外线照射对七彩鲑(Salvelinusfontinalis)精子进行灭活处理,使其遗传物质失活,作为同源精子诱导源,与七彩鲑卵子进行受精,采用冷休克方法诱导雌核发育。结果表明:同源精子可以诱导七彩鲑的雌核发育,紫外照射强度为72 mJ/cm2;距离为8 cm;冷休克温度为20 ℃。七彩鲑减数分裂雌核发育倍性测定以鸡(Gallussp.)红细胞DNA含量(2.5 pg/N) 为标准、七彩鲑普通育苗子一代为参照,采用流式细胞术和微卫星标记技术对30尾七彩鲑减数分裂雌核发育鱼苗进行分析,证明了雌核发育鱼苗为雌核发育二倍体。
七彩鲑(Salvelinusfontinalis);雌核发育;流式细胞术;DNA含量;微卫星标记
七彩鲑(Salvelinusfontinalis),又称美洲红点鲑。原产于加拿大东部的拉布拉多地区,属于鲑形目鲑科红点鲑属,其背部与其它鲑鳟鱼类躯体不同之处是布满了五颜六色的斑点,因此也被誉为冰水皇后[1]。七彩鲑肉质中所富含不饱和脂肪酸18碳2烯酸和18碳3烯酸,具有极高的营养价值[2]。
近年来,由于过度捕捞和水域环境污染等人为因素造成七彩鲑资源数量下降,给七彩鲑养殖业带来巨大的损失。由于雌、雄个体生长有较大差异,已有研究表明单性化的养殖成活率高[3],可有效提高养殖产量和经济效益。
流式细胞术(Flow Cytometry,FCM)是利用流式细胞仪对处于液流中的细胞和生物颗粒的理化及生物学特性(细胞大小、DNA/RNA含量、细胞表面抗原表达等)进行快速的定量并通过设置多参数客观地对特定群体加以检测和分选的新技术[4]。其中,细胞周期检测和DNA倍体分析是一种准确鉴定鱼类倍性的理想方法[5-7]。本研究利用 FCM 测定七彩鲑减数分裂雌核发育鱼苗DNA 含量,探讨其倍性特征,并借助微卫星标记等手段对诱导的雌核发育子代进行鉴定,为建立和完善七彩鲑的种质资源数据库和资源保护提供理论基础;为进一步研究七彩鲑遗传组成及生殖方式及服务于七彩鲑的规模化繁育、人工养殖提供科学依据。
1 材料与方法
1.1 材料
七彩鲑二倍体的制备:以延边自治州青龙渔场实验站七彩鲑群亲鱼为材料,其中,雌性七彩鲑(2龄鱼,1.25 kg);雄性七彩鲑(2龄鱼,1.44 kg)分别采用人工挤压腹部的方法获取精液和卵子。取出大约500粒卵子放入柱式托盘中进行固定,取出的精液先进行2倍稀释,然后倒入托盘中与卵子充分混合,室温静置20 min后,加入20 ℃流动海水使其激活并均匀搅拌,5 min后放入网箱中孵化。用普通苗种培育方法培育。
减数分裂雌核发育二倍体(meiotic gynogenetic diploid,MGD)的诱导:雌性亲鱼为制备七彩鲑二倍体的同一批卵子;以七彩鲑作为同源精子,取2 mL精液用生理盐水进行50倍稀释,经UV灭活。其中,MGD诱导方法参照刘海金等[8]进行。
1.2 固定液制备
取70 mL无水乙醇加入 0.01 mol/L的PBS中,定容到100 mL,至终浓度为70%;0.01 mol/L的PBS (pH 7.2):NaCl 8 g,KCl 0.2 g,Na2HPO4·12H2O 3.58 g,去离子水定容至1 000 mL,调节pH 7.2[9]。
1.3 单细胞悬液的制备
在待测细胞中加入1 mL预冷的70%乙醇,轻轻吹打混匀,4 ℃固定24 h。1 000g左右离心3~5 min,沉淀细胞。小心吸除上清,加入约1 mL冰浴预冷的PBS,重悬细胞。再次离心沉淀细胞,小心吸除上清。轻轻弹击离心管底以适当分散细胞,避免细胞成团。
1.4 细胞计数
将计数板及盖片擦拭干净,并将盖片盖在计数板上。吸取20 μL细胞悬液滴加在盖片边缘,使悬液充满盖片和计数板之间,静置3 min,注意盖片下不要有气泡,也不能让悬液流入旁边槽中。然后放到光学显微镜下观察并进行计数,只计左侧和上方细胞。然后按公式细胞数/mL=四大格细胞总数/4×104计算。(注意:镜下偶见有两个以上细胞组成的细胞团,应按单个细胞计算,若细胞团在10%以上,说明分散不好,需重新制备细胞悬液)。
1.5 PI荧光染色
取制备好的胚胎单细胞悬液进行PI染色,PI染色试剂盒购自碧云天生物科技有限公司,加染色缓冲液 0.5 mL;碘化丙啶染色液(20×) 25 μL;RNase A(50×) 10 μL。缓慢并充分重悬细胞沉淀,37 ℃避光温浴30 min。随后可以4 ℃或冰浴避光存放。400目尼龙网过滤,流式细胞仪(BD- LSRFortessaTM)上机检测,波长为488 nm。
1.6 雌核发育二倍体微卫星分析
取亲本雌雄七彩鲑尾鳍鳍条并提取DNA,DNA的提取参照宝生生物有限公司DNA提取试剂盒。微卫星引物摘自文献[10],上游引物:5′-CACGAGGAGTGTTCTCAATG-3′;下游引物:5′-AGTACTCTAACCACTAGGCTAC-3′。由上海生物工程有限公司合成。PCR反应体系参照张春雷等[11]所述进行PCR扩增,显影方法按照刘梦培等[12]新的微卫星PAGE的DNA 显带方法进行操作。
1.7 数据分析与统计
应用modfit LT软件进行DNA含量分析,主要检测指标:CV值、G0/G1、SPF(S期细胞比率)和模拟细胞数。
样品鱼DNA绝对含量依照以下公式进行计算:P1=E2/E1xP2(P1代表待检七彩鲑DNA的绝对含量(pg/N);P2表示标准鸡红细胞DNA的绝对含量(2.5 pg/N),E1代表鸡红细胞的相对DNA含量,E2表示检测七彩鲑鱼苗的相对DNA含量。
2 结果
2.1 七彩鲑雌核发育DNA检测直方图
以鸡红细胞为内参,用流式细胞仪测定30尾七彩鲑鱼苗、30尾七彩鲑减数分裂雌核发育鱼苗细胞含量,由图1可知,横坐标表示七彩鲑细胞荧光频道数,即鱼细胞的相对DNA含量;纵坐标表示检测的细胞核数,(图1B)中主要出现二个峰:第一个峰最高,其DNA 的相对含量最低,但细胞频率最高,它代表细胞周期中的G0/G1期细胞;第二个峰最低,但 DNA 含量约等于前一个峰的二倍,其细胞率较低,它代表细胞周期中的G2/M 期细胞。图中的图像清晰干净,前后无杂峰出现,CV值<8% ,表明样品处理及检测方法理想,结果可靠。从图1看出鸡红细胞DNA相对含量为47.77(图1A);七彩鲑普通鱼苗细胞DNA相对含量接近48(图1B) ,七彩鲑雌核发育鱼苗DNA相对含量接近49(图1C)。
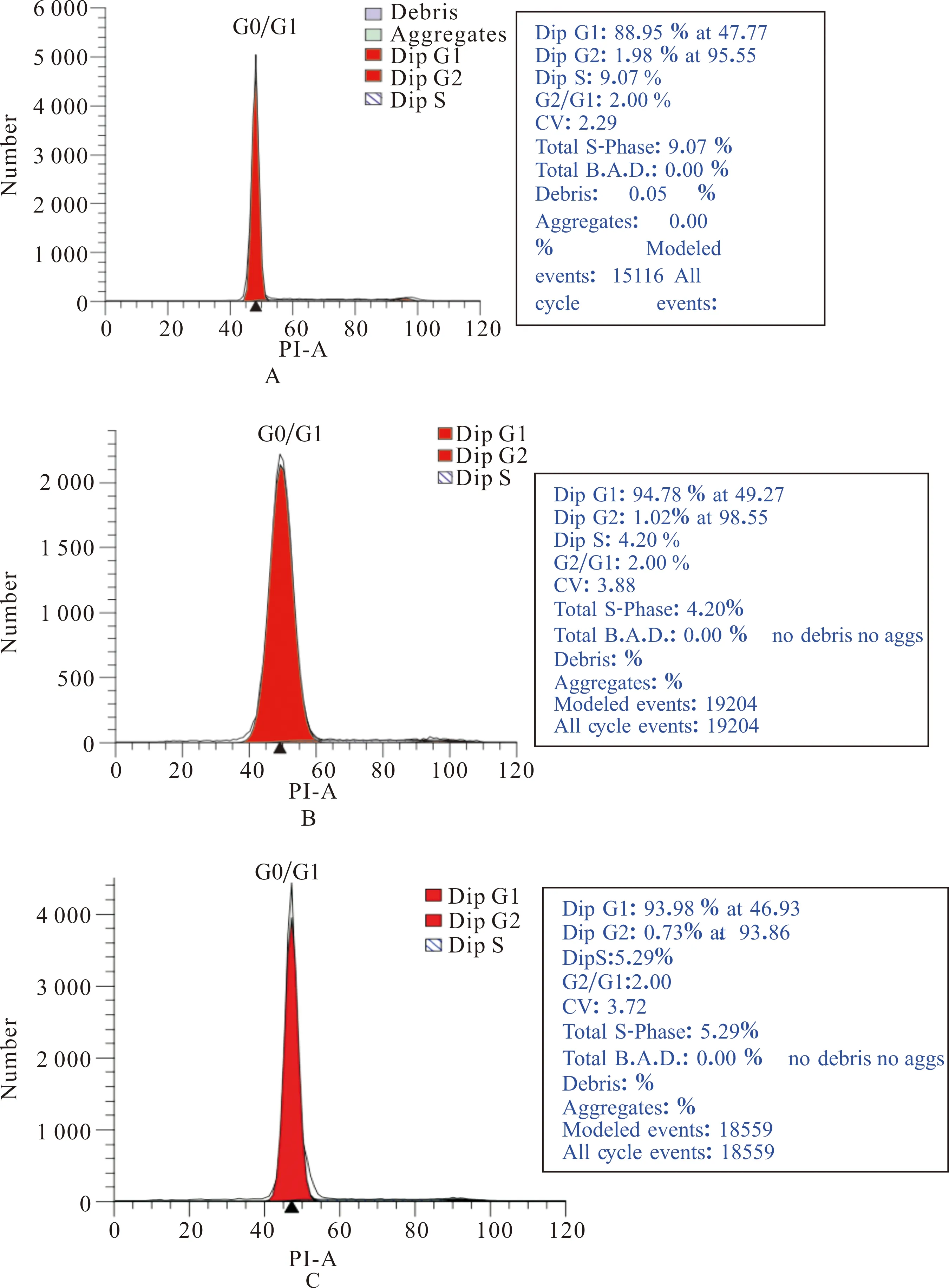
图1 不同细胞DNA含量Fig.1 DNA content in different cells
2.2 七彩鲑鱼苗、七彩鲑减数分裂鱼苗细胞DNA含量与倍性
测定的七彩鲑鱼苗与标准样参照值的红细胞核DNA绝对统计结果见表1。

表1 流式细胞仪检测七彩鲑 DNA 含量Tab.1 The content of DNA in S.fontinalis by flow cytometry
从表1可知,测定30尾七彩鲑普通鱼苗的DNA含量为2.58 pg/N,测定的30尾七彩鲑雌核发育鱼苗的DNA含量为2.46。30尾七彩鲑雌核发育鱼苗DNA=1.05∶1,比值接近1。根据DNA指数(DI)=1.0±0.1为二倍体,DI=1.5±0.15为三倍体的判断依据[13],可知检测的30尾七彩鲑雌核发育鱼苗均为二倍体,证明雌核发育减数分裂二倍体孵化成功。
2.3 微卫星结果
采用微卫星引物鉴定雌核发育家系的亲本及其子代,母本亲鱼出现DNA条带而父本亲鱼不出条带,且雌核发育幼苗存在条带证明雌核发育的遗传物质均来自于母本,异源精子(箭头指向处)经紫外线灭活后,其遗传物质已被破坏。其遗传信息并没有传给子代。
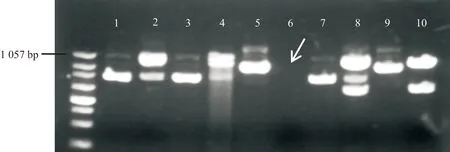
图2 微卫星引物扩增条带Fig.2 microsatellite primers amplified bandsMaker为X174 Hinc II digest;1为母本条带;6为父本条带
3 讨论
目前,鱼类倍性检测方法有染色体核型分析和流式细胞术,但染色体核型分析则需计数大量的中期分裂相细胞,方法复杂且费时。近年来,运用流式细胞术检测DNA含量发现,DNA含量越高的七彩鲑其染色体数目也越多,倍性越大;反之,含量越低的七彩鲑,染色体数目就越少,倍性也就越小[14],这与染色体核型分析的结果一致,故从核DNA含量鉴别倍性应更加可靠。
鸡红细胞是用来检测流式细胞仪变异系数(coeffience of variation,CV)稳定性的质控试剂,同时,在流式细胞仪上可将G0/G1期峰的鸡红细胞与正常细胞或超二倍体细胞完全分开,以确定正常组织细胞的二倍体DNA含量,故可以将鸡红细胞作为检测的生物标准品使用[15]。并且利用流式细胞术,以鸡红细胞为内参标记,不仅可以准确计算并识别多种待测样品DNA倍体,还可以辅助流式检测的质量控制,简便易行。
自然界中雌雄个体之间生长速度存在差异是一种普遍的现象,许多鱼类,如真鲷、虹鳟、大黄鱼、鲤等的雌性生长速度明显快于雄性,因此,在相同养殖周期下,雌性相比于雄性鱼类,具有更高的经济效益。之所以选择人工诱导七彩鲑减数分裂雌核发育,是因为减数分裂雌核发育相比有丝分裂雌核发育操作简便、易于诱导、成活率高,并在多数养殖场中获得成功。
采用同源精子激活七彩鲑卵子,利用冷休克诱导七彩鲑的减数分裂雌核发育,并与哺乳类和水生实验动物[8]相比较,MGD亲子间的遗传相似系数接近1,表明只经过一代减数分裂雌核发育即可具备很高的遗传相似度。利用鱼类雌核发育的这一特点,筛选经济性状优良的母本,通过雌核发育技术固定母本性状,可以加快新品种或新品系的培育进程,缩短选育周期。
[1]龚雪芬,苏军虎.七彩鲑PAPD反应体系的构建及优化[J].甘肃农业大学学报,2011,46(5):12-17.
[2]沈连静,李 壮.美洲红点鲑的品种优势及开发、推广前景[J].河北渔业,2014,241(1):58-59.
[3]葛永春,吴旭干,姜晓东,等.河蟹雌雄分养对其亚成体养殖性能和性腺发育的影响[J].上海海洋大学学报,2017,(2):221-226.
[4]杜立颖,冯仁青.流式细胞术[M].北京:北京大学出版社,2008:2-15.
[5]叶玉珍,吴清江.人工复合三倍体鲤与亲本相对DNA含量及倍性分析[J].水生生物学报.1998,22(2):119-122.
[6]张之晟,董成稳,赵 俊,等.基于DNA 含量的复合鲫倍性分析[J].华南师范大学学报(自然科学版),2006(1):99-103.
[7]耿 波,孙效文.流式细胞术在水生生物DNA含量和倍性分析中的应用[J].水产学杂志.2008,21(2):21-24.
[8]刘海金,侯吉伦,常玉梅,等.真鲷精子诱导牙鲆减数分裂雌核发育[J].水产学报.2010,34(4):508-514.
[9]杨翟平,刘 奕,等.虹鳟胚胎组织单细胞悬液制备方法的研究[J].水产学杂志.2010,23(3):40-43.
[10] Holm L E,Loeschcke V,Bendixen C.Elucidation of the molecular basis of a null allele in a rainbow trout microsatellite [J].Mar Biotechnol,2001,6(3):555-560.
[11]张春雷,佟广香.哲罗鱼微卫星亲子鉴定的应用[J].动物学研究.2010,31(4):394-400.
[12]刘梦培,田 敏,傅大立,等.一种新的微卫星PAGE的DNA显带方法[J].湖南农业科学,2010,17:145-148.
[13]凌山凤,黄根东,王松刚.“中科3号”异育银卿无公害清洁生产技术[J].科学养鱼,2013,(8):89-90.
[14] Hinegardner R,Rosen D E.Cellular DNA content and the evolution of teleostean fishes [J].Am Nat,1972,951(106):621-644.
[15] Darzynkiewicz Z,Juan G.DNA content measurement for DNA ploidy and cell cycle analysis.In:Current protocols in cytometry [M].New York:John Wiley & Sons,Inc,2003:861-876.
ResearchaboutgynogenesisandploidyinSalvelinusfontinalis
DAI Jing1,JIAO Xue1,ZHANG Pei-jun2,LENG Dong-ze1,BA Cui-yu1,MAO An-ting1,LI Yue-hong1
(1.JilinAgriculturalUniversity,Changchun130000,China;2.JilinProvinceHealthSurveillanceInspectionCenter,Changchun130000,China)
The use of ultraviolet irradiation onSalvelinusfontinalissperm quenching treatment,the genetic inactivation,as homologous sperm inducement and withS.fontinaliseggs were fertilized by cold shock induced gynogenesis.The results showed that the homologous sperm could induce theS.fontinalisgynogenesis,the intensity of ultraviolet irradiation for 72 mJ/cm2;distance of 8 cm;cold shock temperature is -20 ℃.S.fontinalismeiotic division female nucleus development of ploidy determination in Gallus sp..red blood cell DNA content 2.5 pg/N standards,S.fontinaliscommon raising seedling generation as a reference,using flow cytometry and micro satellite markers for the determination of 30S.fontinalismeiotic division gynogenetic fry were analyzed.Proof of the gynogenetic diploid gynogenetic fry for.
Salvelinusfontinalis;gynogenesis;flow cytometry;DNA content;microsatellite markers
2017-04-30;
2017-08-04
国家自然科学基金(30972191);吉林省留学人员创新创业项目(201523);长春市农业先进实用技术的示范推广项目(20130215)
代 静(1995- ),女,硕士,专业方向为病原微生物免疫学。E-mail:2291667665@qq.com,Tel:18844146100。
李月红。E-mail:liyhong@sina.com
S917.4
A
1000-6907-(2017)06-0021-05
