大鼠心肌细胞H9C2活性氧水平检测方法探究
2017-11-21丁雨陈雪梅吴思思
丁雨,陈雪梅,吴思思
(四川大学华西医院公共实验技术中心,四川 成都 610041)
大鼠心肌细胞H9C2活性氧水平检测方法探究
丁雨,陈雪梅,吴思思
(四川大学华西医院公共实验技术中心,四川 成都 610041)
目的 比较3种细胞内活性氧(ROS)的检测方法,分析优缺点,筛选1种合适、准确的检测大鼠心肌细胞H9C2缺氧/复氧(H/R)模型中细胞内活性氧的方法。方法 培养H9C2细胞,选择密度合适(80%~90%)的H9C2细胞进行铺板,加入2,7-双乙酸二氯荧光素(DCFH-DA)荧光探针孵育,应用荧光显微镜、流式细胞仪及荧光酶标仪3种方法检测对照组(正常含氧量培养条件,CON)和实验组(缺氧复氧处理,H/R 6h)心肌细胞的荧光强度,从而反映大鼠心肌细胞内活性氧水平,并利用数据分析软件进行统计分析。结果流式细胞仪检测分析结果:对照组(152 690±34 104)FU/μg,实验组(325 669±12 755)FU/μg;荧光酶标仪检测分析结果:对照组(282.3±12.57)FU/μg,实验组(1 274±37.05)FU/μg。实验组的 ROS 水平与对照组的ROS水平比较,差异有统计学意义(P<0.05),实验组高于对照组,而荧光显微镜观察法无法定量地分析出实验结果。结论 3种ROS检测方法中,荧光酶标仪检测方法能更好地判断大鼠心肌细胞H9C2活性氧水平。
缺氧/复氧;H9C2细胞;活性氧
真核细胞在有氧呼吸过程中,小部分氧不能被完全还原,生成了具有较强氧化作用的活性氧(reactive oxygen species,ROS),包括超氧阴离子(O2-)、羟自由基(HO)、过氧化氢(H2O2)等,正常生命过程中,活性氧维持一个正常水平,具有一定的免疫和信号转导功能,是机体的有效防御系统[1]。但过多的活性氧存在会对细胞、机体造成危害,如在受伤流血过多情况,因供血不足导致机体处于缺血状态,机体内ROS及其反应产物增加,抑制蛋白质功能,破坏细胞结构与功能,产生较大危害。ROS作为蛋白质氧化损伤的标志物,准确检测其水平显得尤为重要。
由于ROS的反应活性高,存在时间短,难以捕获,因此很难直接检测。在生命科学中较先使用到了色谱分析、顺磁共振和自旋收集等技术来检测ROS,这些技术精度高,但需要购置非常昂贵的仪器,操作时间长很难大规模推广,为阐明活性氧的作用机制,需要不断寻找新的、敏感的、特异性的检测工具。近年来,越来越多的研究采用2,7-双乙酸二氯荧光素(DCFH-DA)荧光探针,且随着高分辨率的成像系统的发展,荧光探针以其高敏感性、检测速度快、操作简单、数据简化等优点,成为了目前检测ROS水平的最佳工具[2-3]。
随着DCFH-DA荧光探针应用越来越广泛,不同的荧光检测手段也越来越多:共聚焦采图、荧光显微镜采图、流式细胞仪、分光光度计等,但并不是所有的检测手段都适用,因此针对不同的样本探究最适检测方法尤为必要。
本实验选择的荧光染料DCFH-DA,其标记细胞原理是:DCFH-DA本身没有荧光,具有亲脂性,可以自由地穿过细胞膜,进入细胞后在胞内被酯酶水解,去酰基形成有极性的DCFH,而DCFH不能透过细胞膜,从而很容易被装载到细胞内。但DCFH不产生荧光,而细胞内存在的ROS能够氧化DCFH为DCF,在525 nm处检测到绿色荧光,其DCF形成量与细胞内氧化产物水平呈正相关,因此,其荧光强度间接代表细胞内过氧化物的水平[4]。
本文利用三气培养箱复制大鼠心肌细胞缺氧模型,采用目前常用的3种检测方法,对比分析3种方法所得结果,找出1种或多种适合检测大鼠心肌细胞内ROS水平的方法。
1 材料与方法
1.1 材料与试剂
大鼠心肌细胞(H9C2)由四川大学华西医院公共实验技术中心保存,DCFH-DA购自美国Sigma公司,胎牛血清购自美国Gibco公司,DMEM高糖培养基、PBS缓冲液购自美国Hyclone公司,BCA定量试剂盒、RIPA裂解液购自广州碧云天公司,细胞培养板、细胞培养瓶及冻存管等购自美国Corning公司。
1.2 仪器与设备
Synergy Mx多功能荧光酶标仪(美国Bio-Tek公司),OBSERVER D1/AX10 cam HRC倒置荧光显微镜(德国Zeiss公司),Cytoflex流式细胞仪(美国Beckman Coulter公司),Integral 10纯水仪(美国Millipore公司),二级生物安全柜、三气培养箱(美国Thermo公司),SX-700高压灭菌锅(中国TOMY公司),二氧化碳CO2培养箱(德国Binder公司)。
1.3 方法
1.3.1 细胞培养 使用High Glucose DMEM(含10%FBS)培养 H9C2 细胞,环境条件为 37℃、5%CO2,每2天换液1次。用含EDTA的0.25%胰酶消化H9C2细胞,1 200 r/min离心5 min,弃上清液。用培养基重悬,调整细胞浓度至1×105个/ml,将细胞接种至6孔细胞培养板中,每孔1 ml;将浓度调整至5×104个/ml,并接种至12孔板中,每孔1 ml,分别置于细胞培养箱中培养,37℃、5%CO2、饱和湿度培养。
1.3.2 实验组缺氧/复氧处理 培养48 h换液,以后每2天换液1次,至细胞覆盖率达80%后,对照组(CON)细胞仍放于原培养箱进行培养,实验组[缺氧复氧处理,缺氧复氧(hypoxia/reoxygenation,H/R)6 h]细胞转至三气培养箱中,缺氧培养6 h后,将实验组细胞重新转至普通CO2培养箱中继续培养2 h,即复氧2 h。
1.3.3 细胞负载ROS荧光探针 实验组细胞培养2 h后,用DCFH-DA作为荧光探针,检测对照组与实验组细胞内ROS水平。用High Glucose DMEM(无FBS)稀释 DCFH-DA,使终浓度达到 10μm/ml。除去细胞培养液,分别加入1 ml、0.5 ml稀释后的DCFH-DA。置于37℃、5%CO2、饱和湿度的细胞培养箱内,孵育20 min。孵育完成后,用High Glucose DMEM(无FBS)洗涤细胞3次,以充分除去未进入细胞内的DCFH-DA,防止液体本底荧光强度过高。对照组、实验组全部装载探针结束后,进行细胞内ROS的定性和定量的检测。
1.3.4 荧光显微镜观察分析细胞内ROS 使用倒置荧光显微镜观察两组细胞的荧光强度,并进行荧光采图。
1.3.5 流式细胞仪检测细胞内ROS 用0.25%EDTA胰酶消化H9C2细胞,收集细胞,PBS洗2次,使用Cytoflex流式细胞仪检测各组荧光强度,即细胞内ROS的强度,并使用Cytoflex软件进行分析。平均FL1-A量(Mean FITC-A)可作为ROS强度的定量依据。
1.3.6 荧光酶标仪检测细胞内ROS 将12孔板置于Synergy Mx多功能荧光酶标仪上,设置参数直接检测孔板中H9C2细胞内的荧光强度。冰上,将检测完的细胞用RIPA缓冲液裂解细胞,13 000 r/min离心15 min,收集上清。用BCA法检测总蛋白含量,荧光值/蛋白质量(AFU/μg)使结果标准化,可作为ROS强度的定量依据。
1.4 统计学方法
采用SPSS 22.0软件进行数据处理,实验数据采用均数±标准差(±s)表示,两组比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组细胞荧光强度结果
用Zeiss倒置荧光显微镜观察对照组和实验组细胞的荧光强度,绿色荧光强度直接反映细胞内的ROS水平。同一视野内,荧光强度随着激发光照射时间的延长而逐渐增强。在软件参数完全相同(曝光时间)的情况下,激发光照射不同时间后荧光强度,结果见图1。因此,无法准确判断两组细胞内的真实ROS水平。

图1 细胞荧光强度
2.2 流式细胞仪检测结果
用Cytoflex流式细胞仪检测两组细胞H9C2内ROS水平,可见对照组与实验组曲线位置有明显区分,统计平均FITC-A值,得出对照组为(152 690±34 104)FU/μg,实验组为(325 669±12 755)FU/μg,两组比较,差异有统计学意义(P<0.05)。见图2。
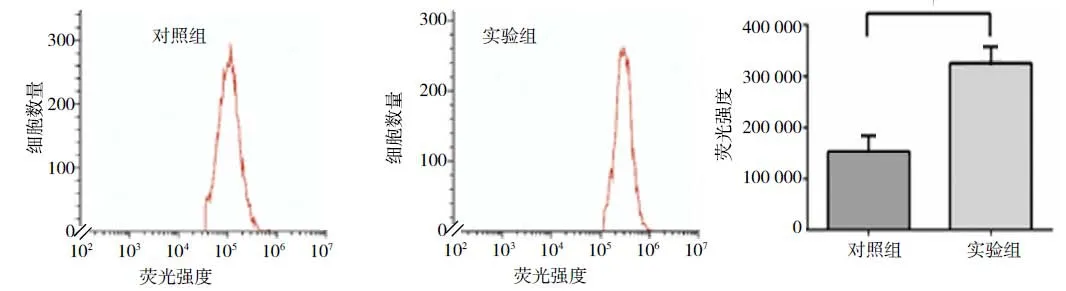
图2 细胞内ROS水平比较
2.3 多功能酶标仪检测结果
用Synergy Mx多功能荧光酶标仪检测两组H9C2细胞内ROS水平,数据分析得出实验组ROS水平[(1 274±37.05)FU/μg]与对照组ROS水平[(282.3±12.57)FU/μg]比较,差异具有统计学意义(P<0.05),对照组升高。见图3。
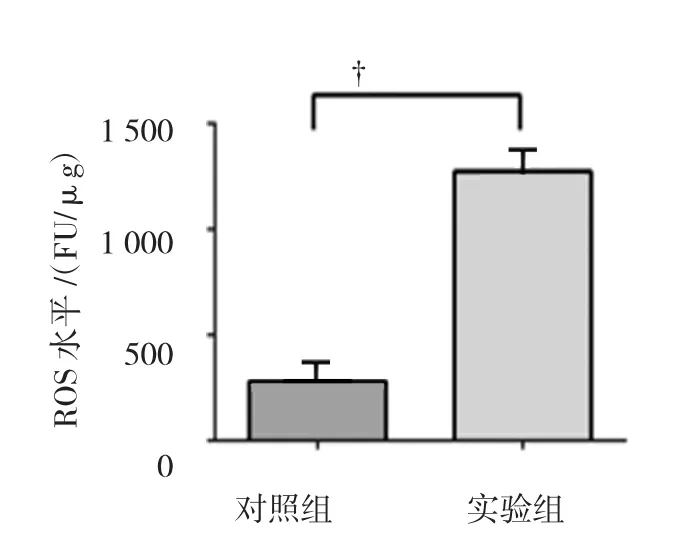
图3 细胞内ROS水平比较
3 讨论
很多疾病在治疗时会涉及到手术治疗,如心脏外科手术,此过程中因暂时失血使机体处于缺氧状态,造成线粒体和非线粒体能量代谢紊乱,加快了氧自由基的产生,且在再灌注时机体因抗氧化剂不足,进一步产生过量的氧自由基。而过量的氧自由基或非特异性氧化损伤DNA、蛋白质和脂类,造成体内细胞结构和功能的破坏,导致细胞消亡;或破坏细胞之间的粘合作用,从而破坏血管组织,导致血液病;严重者还能造成心肌损伤、收缩失调(心肌顿抑)、心律不齐以及慢性心血管疾病等,因此缺血性器官损伤是临床常见的病理生理现象[5-10]。而心脏缺血再灌注(ischemia/reperfusion,I/R)损伤是心脏缺血性疾病和心脏外科手术后常见的一种病理生理现象,心肌细胞活性氧的增加是公认的I/R损伤的一个重要的病理生理改变标志[11]。
体外心肌细胞H/R模型一直被广泛应用于心脏I/R损伤的研究,对于探讨I/R损伤的分子机制具有重要的意义。而H9C2心肌细胞来源于大鼠胚胎期的心组织,具有心肌细胞的许多重要特性和功能,是目前研究心肌细胞损伤与保护的常用模型。本实验应用三气培养箱复制大鼠心肌细胞H/R模型,采用荧光显微镜观察、流式细胞仪检测、荧光酶标仪检测3种常用检测方法检测H9C2细胞内ROS水平,探索更适合大鼠心肌细胞内ROS的检测方法。
应用荧光显微镜观察H9C2细胞荧光强度,会因某些因素导致无法准确判断实验组与对照组荧光强弱,或是荧光采图中出现同一视野随着时间延长荧光强弱出现变化的现象。在采用荧光显微镜观察方法判断强弱的过程中,需要注意到以下几点:①摸索合适的染料浓度,选择较低浓度;②DCFH-DA荧光探针自身具有光敏性,在光照存在下,会发生被氧化,或是已经氧化的产物DCF发生被还原现象,从而出现荧光增强或衰弱的现象,所以在操作过程中,需要严格的避光操作,或添加抗氧化剂,可避免此种现象[12-15]。
应用流式细胞仪排除光照因素干扰,相较于荧光显微镜采图,流式细胞仪检测结果相对可靠。但是应用流式细胞仪检测细胞内ROS需注意以下几个问题:①若处理的细胞为贴壁细胞,则需胰酶消化处理,则会导致对照组的荧光强度值相对较高,如本实验中对照组的流式检测结果;②为避免细胞碎片和死细胞对实验结果的干扰,检测时需设法将其区分,排除此部分信号干扰;③每个样品测试结束后,建议用次氯酸钠冲洗机器,避免样本间的相互污染;④样品应在染色后2 h内完成上机检测操作,避免荧光减弱,影响实验结果;⑤设立阴性对照,可避免细胞自身荧光对实验结果的干扰。
应用荧光酶标仪检测细胞荧光强弱,孵育后直接上机检测,避免了其他操作对胞内ROS水平的影响,也减少了实验过程中人为因素的干扰,其准确性及重复性更是可靠。在应用此方法检测细胞内ROS需要注意几个问题:①细胞培养使用黑色不透明的培养板,避免检测时孔间干扰;②完成荧光酶标仪检测,进行蛋白提取及浓度测定,进行荧光值/蛋白质量(AFU/μg)标准化。
本实验应用荧光显微镜观察、流式细胞仪检测、荧光酶标仪检测H9C2细胞内活性氧水平,流式细胞仪、荧光酶标仪的检测结果能够准确地反映H9C2细胞内ROS水平。但应用荧光酶标仪检测细胞荧光强弱,相对流式细胞仪检测操作更简便,干扰因素更少,分析结果相对更准确。在本实验结束后,也利用此方法检测过其他模型细胞内活性氧的水平,其检测结果与相关文献一致。
综上所述,大鼠心肌细胞H9C2缺氧/复氧H/R模型中,应用荧光酶标仪检测细胞内ROS水平结果相对更准确。
[1]VALKO M,LEIBFRITZ D,MONCOL J,et al.Free radicals and antioxidants in normal physiological functions and human disease[J].Int J Bioehem Cell Biol,2007,39(1):44-84.
[2]GOMES A,FERNANDES E,LIMA J L.Fluorescence probes used for detection of reactive oxygen species[J].J Biochem Biophys Methods,2005,65(2/3):45-80.
[3]史桂英,高飞,石学耕,等.流式细胞术检测细胞内活性氧的方法[J].上海第二医科大学学报,2001,21(2):122-124.
[4]HE Y Y,HÄDER D P.UV-B-induced formation of reactive oxygen species and oxidative damage of the cyanobacterium Anabaena sp:protective effects of ascorbic acid and N-acetyl-L-cysteine[J].J Photochem Photobiol B:Biology,2002,66(2):115-124.
[5]WU Y,ZHU W,LI Y H,et al.Aspirin and age related macular degeneration;the possible relationship[J].Med Hypothesis Discov I nnov Ophthalmol,2013,2(3):59-68.
[6]MURPHY E,STEENBERGEN C.Mechanisms underlying acute protection from cardiac ischemia-reperfusion injury[J].Physiol Rev,2008,88(2):581-609.
[7]MINAMINO T.Cardioprotection from ischemia/reperfusion injury:basic and translational research[J].Jpn Circ J,2012,76(5):1074-1082.
[8]MADUREIRA P A,WAISMAN D M.Annexin A2:the importance of being redox sensitive[J].Int J Mol Sci,2013,14(2):3568-3594.
[9]WANG A L,NIU Q,SHI N,et al.Glutamine ameliorates intestinal ischemia-reperfusion Injury in rats by activating the Nrf2 Are signaling pathway[J].Int J Clin Exp Pathol,2015,8(7):7896-7904.
[10]LAKSHMI S V,PADMAJA G,KUPPUSAMY P,et al.Oxidative stress in cardiovascular disease[J].Indian J Biochem Biophys,2009,46(6):421-440.
[11]KUMAR D,J UGDUTT B I.Apoptosis and oxidants in the heart[J].J Lab Clin Med,2003,142(5):288-297.
[12]BARTOSZ G.Use of spectroscopic probes for detection of reactive oxygen species[J].Clin Chim Acta,2006,368(1/2):53-76.
[13]MARCHESI E,ROTA C,FANN Y C,et al.Photoreduction of the fluorescent dye 2’-7’-dichlorofluorescein:a spin for oxidative stress measurements[J].Free Radic Biol Med,1999,26(1/2):148-161.
[14]BILSKI P,BELANGER A G,CHIGNELL C F.Photosensitized oxidation of 2’,7’-dichlorofluorescin:singlet oxygen does not contribute to the formation of fluorescent oxidation product 2’,7’-dichlorofluorescein.Free Radic BiolMed,2002,33(7):938-946.
[15]AFZAL M,MATSUGO S,SASAI M,et,al.Method to overcome photoreaction,a serious drawback to the use of dichlorofluorescin in evaluation of reactive oxygen species[J].Biochem Biophys Res Commun,2003,304(4):619-624.
(张蕾 编辑)
Investigation of detection method of ROS in H9C2 cells
Yu Ding,Xue-mei Chen,Si-si Wu
(Core Facility Center of West China Hospital,Sichuan University,Chengdu,Sichuan 610041,China)
Objective To compare three different methods for ROS measurement,and analyze their advantages and shortcomings so as to select a suitable and accurate one for detecting ROS in hypoxia-reoxygenation (H-R)model of rat myocardial cell line H9C2.Methods H9C2 cells were plated in an appropriate confluence(80%-90%).The experimental group(H-R 6 h)was exposed to hypoxia for 6 h followed by reoxygenation for 2 h,the control group(CON)was cultured in normoxic condition.Then DCFH-DA fluorescent probe was added into H9C2 cells.After incubation,the fluorescent intensity was detected by fluorescent microscopy,flow cytometer and fluorescence multiscan.Then these data were analyzed with appropriate analysis software.Results Compared with the control group,the results of flow cytometer[CON(152,690 ± 34,104)FU/μg,H-R 6 h(325,669 ± 12,755)FU/μg]or fluorescence multiscan[CON(282.3 ± 12.57)FU/μg,H-R 6 h(1,274 ± 37.05)FU/μg]showed that the ROS level of the experimental group was significantly higher than that of the control group(P<0.05),but the results from fluorescence microscopy could not distinguish the experimental group from the control group.Conclusions Fluorescence multiscan can better determine the ROS level in H9C2 cells.
hypoxia-reoxygenation;H9C2 cell;ROS
R-332
A
10.3969/j.issn.1005-8982.2017.25.002
1005-8982(2017)25-0008-05
2016-11-16
吴思思,E-mail:sisigia@163.com;Tel:028-85164124
