MicroRNA-29b-3p重组腺相关病毒制备及在大鼠前额叶皮质中的表达研究*
2017-11-21李茂冯建国王晓斌陈前修万运强
李茂,冯建国,王晓斌,陈前修,万运强
(西南医科大学附属医院 麻醉科,四川 泸州 646000)
基础研究·论著
MicroRNA-29b-3p重组腺相关病毒制备及在大鼠前额叶皮质中的表达研究*
李茂,冯建国,王晓斌,陈前修,万运强
(西南医科大学附属医院 麻醉科,四川 泸州 646000)
目的 获得表达microRNA-29b-3p的重组腺相关病毒(rAAV-miR-29b-3p),并检测其在大鼠前额叶皮质中的感染效果和表达水平。方法 将前体miR-29b-3p基因片段置入AAV表达质粒中构建重组AAV质粒,将重组AAV质粒、包装质粒和辅助质粒通过脂质体LipaFiterTM共转染HEK293细胞包装rAAV-miR-29b-3p。从转染的HEK293细胞中收集并通过树脂柱纯化rAAV-miR-29b-3p,通过实时荧光定量聚合酶链反应(qRT-PCR)测定rAAV-miR-29b-3p滴度。通过脑立体定位仪注射rAAV-miR-29b-3p至大鼠前额叶皮质,免疫荧光显微镜观察rAAV-miR-29b-3p的感染效果,qRT-PCR检测rAAV-miR-29b-3p表达水平。结果 成功包装的rAAV-miR-29b-3p经纯化后获得了高纯度的rAAV-miR-29b-3p,qRT-PCR检测rAAV-miR-29b-3p的病毒滴度达到1.0×1012vg/ml,经感染21 d后,脑组织前额叶皮质荧光表达明显,miR-29b-3p表达水平明显提高。结论 构建的rAAV-miR-29b-3p可使大鼠前脑皮层miR-29b-3p高表达,为进一步研究miR-29b-3p的生物学功能提供了有效工具。
腺相关病毒;miRNA-29b-3p;前额叶皮质;大鼠
MicroRNAs(miRNAs)是一类非编码蛋白质的单链小RNA分子,能编码调控基因的转录。近年来研究表明miRNAs与膀胱癌、乳腺癌、结肠腺癌等肿瘤[1],抑郁症、精神分裂症、焦虑症等精神疾病[2]的发生发展相关。前期研究结果发现氯胺酮抗抑郁作用可能通过 microRNA-29b-3p(miR-29b-3p)发挥作用(结果还未发表),然而具体机制不清楚。为了进一步研究miR-29b-3p的功能,克隆miR-29b-3p的基因片段以及高表达miR-29b-3p是重要的研究手段。重组腺相关病毒(recombination adeno-associated virus,rAAV)作为一种载体工具发挥着重要的作用。
本研究的目的是构建含有miR-29b-3p的重组腺相关病毒,并包装纯化病毒,然后通过脑立体定位仪注射rAAV-miR-29b-3p感染大鼠前额叶皮质,观察大鼠前额叶皮质感染效果及表达miR-29b-3p情况,为进一步研究奠定基础。
1 材料与方法
1.1 材料
DNA提取试剂盒、质粒小提中量试剂盒、总RNA提取试剂盒购自中国天根生化科技公司,逆转录试剂盒购自美国Premega公司,实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒购自德国Qiagen公司,XbaⅠ和AgeⅠ内切酶购自英国NEB公司,T4连接酶购自日本TaKaRa公司,pfu高保真酶购自中国天根生化科技公司,引物序列表内引物均购自生工生物工程上海有限公司,TOP10感受态细胞购自中国康 为 世 纪 公 司 ,pAAV-u6-IRES-hrGFP,pAAV-RC和pHelper质粒购自英国Cell Biolabs公司,人胚肾细胞系HEK293 cell、LipoFiterTM转染试剂购自中国汉恒生物科技公司,DMEM培养基、胎牛血清和胰酶购于美国Hyclone公司,滤膜滤器购自美国Millipore公司,SD大鼠由西南医科大学实验动物中心提供。
1.2 前体miR(pre-miR)的扩增
经查找miRBase基因组数据库(http://www.mir base.org),发现在大鼠基因组上有3个基因位点可以编码miR-29b-3p的“茎环”结构,分别为rnomiR-29b-1(MI0000864,4 号染色体58100133 bp-58100053 bp)、rno-miR-29b-2(MI0000862,1 号染色体39612388 bp-39612468 bp)和rno-miR-29b-3(MI0031777,13号染色体118329450bp-118329530bp),本研究以rno-miR-29b-1的“茎环”结构为基础,正向延长81 bp以及反向延长100 bp,即基因组定位片段为1号染色体58100214~58099953 bp,作为 pre-miR-29b-3p的基因片段。然后,选用雄性SD大鼠,正常饲养1周后,用1%戊巴比妥40 mg/kg腹腔注射麻醉后断颈处死,取出脑组织两侧前额叶皮质于灭酶EP管,放入液氮罐中,转入-80℃冰箱保存。本研究得到西南医科大学附属医院伦理委员会同意。将取得的前额叶皮质组织用DNA提取试剂盒提取全基因组DNA,以基因组为模板,用pre-miR-29b-3p的特异性引物rat-29-AgeⅠ-F和rat-29-XbaⅠ-R(见表 1),PCR 扩增出 miR-29b-3p的基因片段,PCR反应程序:95℃5 min,95℃30 s,56℃ 30 s,72℃ 1 min,32 个循环,72℃ 10 min。
1.3 重组质粒构建
用XbaⅠ和AgeⅠ内切酶同时酶切1.2中得到的pre-miR-29b-3p基因片段和pAAV-U6-IRES-hrGFP质粒,37℃酶切过夜,双酶切产物命名为:miR-29b-3p-DD,pAAV-U6-IRES-hrGFP-DD,T4连接酶 16℃连接60 min,将连接后的产物转化入TOP10感受态细胞中,37℃倒置培养12~16 h,次日挑取单个菌落,挑取的菌落进行菌落PCR,产物行1.2%琼脂糖凝胶电泳,观察目的条带,同时将挑取的菌落加入含有氨苄青霉素抗性的25 ml LB培养基,37℃摇菌过夜后,用高纯度质粒提取试剂盒,提取质粒,进行双酶切鉴定,1.2%琼脂糖凝胶电泳,观察目的条带,将菌落PCR和双酶切鉴定正确的菌落,送华大基因(中国重庆)测序,经序列比对,结果正确的重组质粒命名为pAAV-U6-miR-29b-3p-IRES-hrGFP。
1.4 rAAV包装、纯化及滴度鉴定
HEK293细胞用DMEM培养基加入10%胎牛血清在5%的二氧化碳孵箱中培养,胰酶消化HEK293细胞,将细胞接种于培养皿中,80%~90%满即可进行转染。用LipoFiterTM转染试剂,将pAAV-U6-miR-29b-3p-IRES-hrGFP重组表达质粒、pAAV-RC和 pHelper共转染到 HEK293细胞中,转染72 h后即可包装得到重组腺相关病毒rAAV-miR-29b-3p。收集所有细胞于15 ml离心管中并加入300μl的PBS,液氮及37℃水浴反复冻融3次,3 000 r/min离心5 min,收集病毒上清液,将病毒上清液于0.45μm滤膜过滤,树脂柱纯化后,最终得到纯化后的病毒约200μl,于-70℃保存,使用qITR-F和qITR-R引物(见表1)进行qRT-PCR滴度鉴定,标准品的拷贝梯度为 105、106、107、108、109和 1010,qRT-PCR 反 应 程序 :95℃ ,10 min;40 个PCR 循环[95℃,10 s,60℃,60 s(收集荧光)],根据 Ct值(average)和对应的拷贝数,做1元1次函数曲线,并换算成拷贝数10X及病毒滴度vg/ml。rAAV病毒滴度 =10X×40 000 vg/ml。

表1 引物序列表
1.5 rAAV-miR-29b-3p感染大鼠前额叶皮质
雄性SD大鼠15只,180~220 g,正常饲养1周后随机分为正常组5只:脑立体定位注射0.9%生理盐水(NS);腺相关病毒实验组5只:脑立体注射rAAV-miRNA-29b-3p腺相关病毒;腺相关病毒对照组5只:脑立体注射携带rAAV-GFP腺相关病毒。主要操作步骤为:1%戊巴比妥钠40 mg/kg腹腔注射麻醉大鼠,固定于脑立体定位仪上,以前囟为原点,根据大鼠脑立体定位图谱(Paxinos and Watson,2007)选定坐标,颅钻钻孔至脑膜见脑脊液流出,前额皮质坐标为:A/P+4.7 mm,M/L±2 mm,D/V-1mm,用2μl微量注射器吸取腺相关病毒2μl,以0.2μl/min的速度注射5 min,每侧注射1μl,每次留针10 min,缓慢出针,先行一侧注射,再按相同步骤行对侧注射,碘伏消毒切口,缝合皮肤,放回笼中继续饲养。21 d后,用1%戊巴比妥40 mg/kg腹腔注射麻醉后断颈处死,取出脑组织,一侧大鼠脑前额叶皮质迅速冷冻切片,通过固定、核染色以及封片等处理后在荧光显微镜下观察荧光强度;另一侧大鼠脑前额叶皮质于灭酶EP管,放入液氮罐中,转入-80℃冰箱保存。
1.6 qRT-PCR
使用总RNA提取试剂盒一步法提取各组前额叶皮质大脑组织的总RNA,用miR-29b-3p的特异性逆转录引物Rno-miR-29b-3p-RT(见表1)逆转录生成cDNA,U6作为内参基因,其特异性逆转录引物为Rno-U6-RT(见表1)。将所有cDNA样品分别配置Real-time PCR 10μl反应体系,qRT-PCR反应程序:95℃,10 min;40 个 PCR 循环[95℃,10 s,60℃,60 s(收集荧光)],扩增反应结束后,按 95℃,10 s;60℃,60 s;95℃,15 s,建立 PCR 产物的熔解曲线,并从60℃缓慢加热到99℃,以样品miRNA-29b-3p的特异引物rno-miR-29b-3p-qF和内参(r no-U6)的特异引物 rno-miR-U6-qR及相同的rno-miR-qR引物(见表1),分别进行Real-time PCR反应,数据采用2-△△CT法进行分析。
1.7 免疫荧光
将冷冻切片4%多聚甲醛固定30 min,PBS洗2次,每次5 min,0.2%Tritox-100溶液作用15 min,PBS洗2次,每次5 min,加1%BSA封闭液室温作用30 min,PBS洗2次,每次 5 min,DAPI浓度1︰1 000室温作用5 min,PBS洗3次,每次5 min,封片,免疫荧光显微镜观察。
2 结果
2.1 pre-miR-29b-3p扩增
根据对miR-29b-3p“茎环”结构序列的分析显示3个不同的“茎环”结构rno-miR-29b-1、rno-miR-29b-2、rno-miR-29b-3与成熟miR-29b-3p 比对具有相同的成熟miR-29b-3p序列(见图1A);构建的pre-miR-29b-3p基因片段约280 bp,红色序列为“茎环”结构,红色序列中下划线的序列为成熟的miR-29b-3p的编码序列,整个基因序列两端下划线部分为引物序列(见图1B)。提取的大鼠前额叶皮质基因组经PCR扩展及纯化后经1.2%的琼脂糖凝胶电泳,在250 bp处上方可见明显条带(见图2A),与预期的约300 bp基因片段大小相符。

图1 pre-miR-29b-3p扩增结果
2.2 pAAV-U6-miR-29b-3p-IRES-hrGFP质粒构建结果
PCR目的基因产物与pAAV-U6-IRES-hrGFP载体质粒双酶切、连接后得到的重组质粒pAAV-U6-miR-29b-3p-IRES-hrGFP(见图 2D),转化后得到的5个菌落,经PCR扩增、琼脂糖凝胶电泳后可见菌落编号为U6-5的菌落250 bp处上方有明显条带(见图2B)。菌落U6-5提取出的质粒经XbaI和AgeI双酶切、琼脂糖电泳后,在5 500 bp左右和250 bp上方有明显条带(见图2C)。对菌落U6-5质粒上重组片段进行基因测序和比对,比对结果与目的pre-miR-29b-3p基因序列完全一致(见图 2E)。
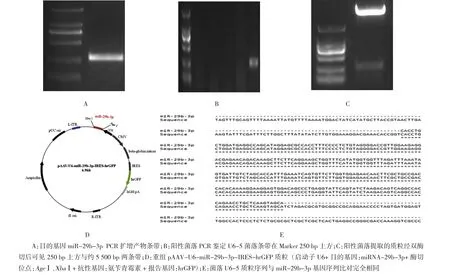
图2 pAAV-U6-miR-29b-3p-IRES-hrGFP质粒构建结果
2.3 rAAV-miR-29b-3p包装、纯化及滴度鉴定结果
根据qRT-PCR法测得得样品Ct值(见图3A),以每组AAV标准品的Ct值其对应拷贝数的对数做回归曲线,计算标准曲线的函数公式及R2值,通过函数公式计算待测AAV样品对应的拷贝数对数,换算成拷贝数10X及病毒滴度vg/ml,得到图3B标准曲线,计算rAAV-miR-29b-3p病毒滴度如下:rAAV-miR-29b-3p 滴度 =107.41×40 000=1.0×1012vg/ml。
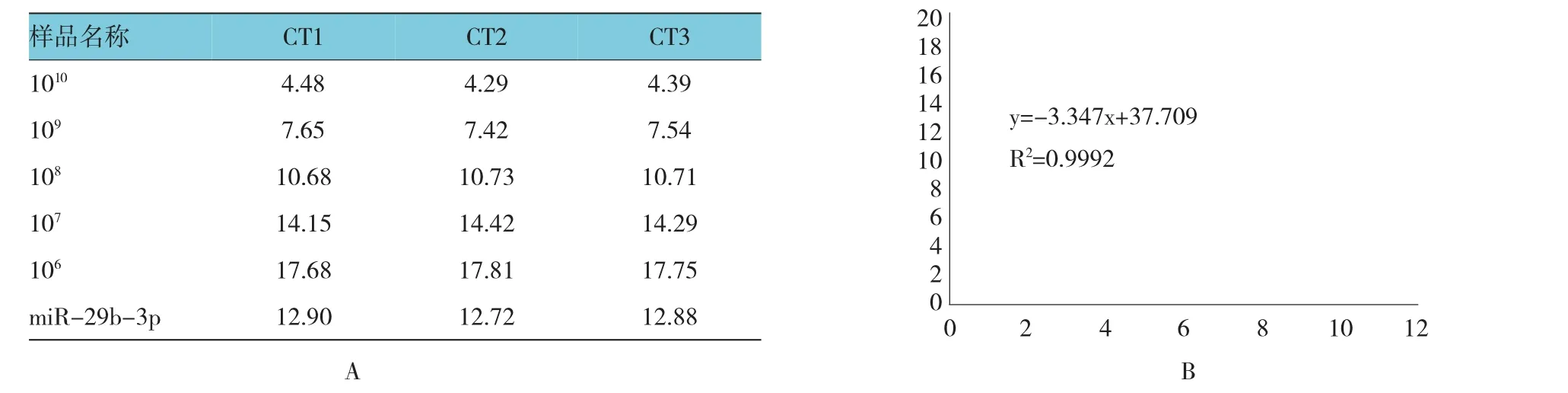
图3 rAAV-miR-29b-3p滴度鉴定
2.4 大鼠前额叶皮质rAAV-miR-29b-3p感染情况
大鼠前额叶皮质冷冻切片,通过固定、核染色以及封片等处理后在荧光显微镜下观察到rAAV-GFP和rAAV-miR-29b-3p组绿色荧光表达明显,而正常组未见绿色荧光表达。见图4。

图4 大鼠前额叶皮质rAAV-miR-29b-3p感染情况 (×400)
2.5 rAAV-miR-29b-3p感染的前额皮质miR-29b-3p表达
qRT-PCR检测rAAV-miR-29b-3p感染的前额皮质miR-29b-3p相对表达量,结果发现腺相关病毒实验组大鼠前额皮质miR-29b-3p表达水平较腺相关病毒对照组上调约4倍(见图5)。
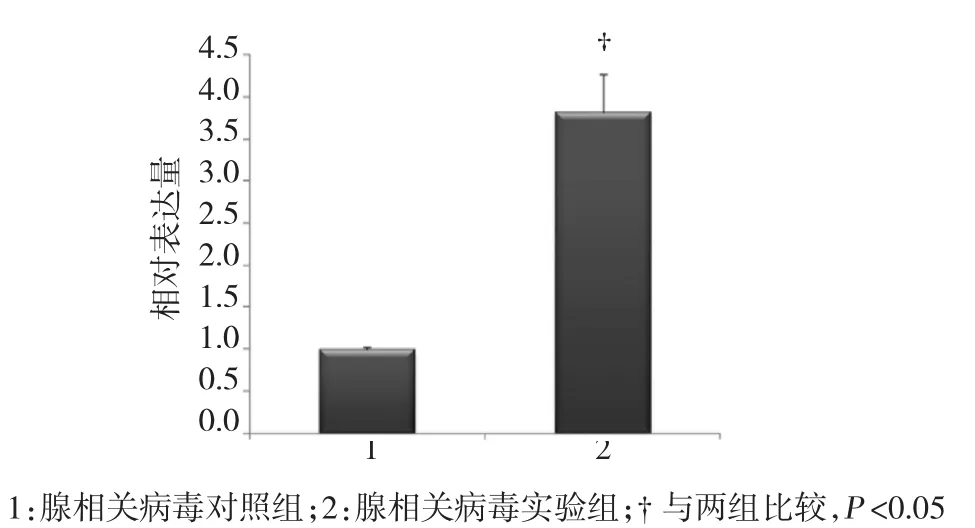
图5 大鼠前额皮质miR-29b-3p相对表达量
3 讨论
抑郁症是一种慢性精神疾病,到2030年,将成为全球第一致残的疾病,严重影响患者生活质量,增加经济负担[3]。虽然目前已进行了很多研究,但具体与抑郁症相关的细胞和分子机制仍不清楚。目前在抑郁症与miRNA的研究已经证实miR与突触可塑性障碍、神经发生、单核苷酸多态性、应激以及多种抗抑郁药相关[4-7]。
与其他病毒相比,rAAV具有低免疫原性[8],与逆转录病毒或者慢病毒不一样,rAAV不整合入宿主基因组[9],还能快速使特定区域相关基因缺失[10],因此rAAV比逆转录病毒或者慢病毒能更好研究基因缺失或者表达。rAAV具有不同的血清型,目前人的血清型有12种[11],不同人源血清型对脏器组织的亲和力不同,对脑组织高的血清型是2、4、7~9、rh10,VINCENT[12]已经证实 AAV2/9 比 AAV2/2、AAV2/5更有效用于基因删除或者基因过表达,所以本研究中选择的血清型为AAV2/9型。随着AAV载体的不断发展完善,其在基因治疗中的应用也越来越广泛,目前rAAV相关的临床试验已经得到国际的广泛关注,AAV1、AAV2携带α1抗胰蛋白酶通过肌内注射治疗α1抗胰蛋白酶缺陷症处于临床Ⅰ、Ⅱ期;AAV2、AAVrh10携带CLN直接颅内给药治疗神经元蜡样质脂褐质沉积病处于临床Ⅰ期;AAV2携带囊性纤维化跨膜传导调节蛋白CFTR支气管喷雾给药治疗囊性纤维化病临床Ⅰ、Ⅱ期(共完成150个病例);AAV2携带AADC、GAD、神经营养蛋白颅内给药治疗帕金森病(临床Ⅰ、Ⅱ期)等疾病[13-14],并取得了较好的疗效。
本实验先根据miRBase数据库得到pre-miR-29b-3p基因片段大小约280 bp。大鼠基因组中编码miR-29b-3p“茎环”结构的基因位点有3个,理论上3个基因位点的“茎环”结构经过加工均可以形成成熟的miR-29b-3p。本研究选定了miR-29b-1的“茎环”结构作为扩增pre-miR-29b-3p的模板。提取大鼠的全基因组,PCR特异性扩增出miR-29b-3p基因,由于基因片段上带有酶切位点,因此miR-29b-3p的基因大小约300 bp与目的条带相吻合。双酶切目的基因和载体质粒,连接转化后菌落PCR,经琼脂糖凝胶电泳可以看到图2B中U6-5菌落条带在250bp上方,与miR-29b-3p目的基因大小吻合,为了再次确认U6-5菌落是不是真阳性菌落,双酶切该菌落的质粒,可以看到1条在250 bp上方,1条约5 500 bp,250 bp上方的条带是miR-29b-3p基因,5 500 bp条带是质粒骨架,为了明确U6-5菌落质粒上的基因序列,测序比对结果与基因库的miR-29b-3p基因序列完全一致,说明pre-miR-29b-3p构建和重组的质粒是成功的。
重组的质粒、辅助质粒、包装质粒,3质粒共转染HEK293细胞,纯化以后的病毒滴度达到了1.0×1012vg/ml,高于感染大鼠脑组织的最低浓度是1.0×109vg/ml,在理想的浓度1.0×1011~1.0×1013vg/ml之间[15],适用于大鼠脑组织的感染。重组的腺相关病毒注射大鼠前额叶皮质21 d后可以看到明显的绿色荧光表达,说明载体质粒上的报告基因hrGFP已经表达绿色荧光蛋白,但是为了确定携带的premiR-29b-3p是否可以加工成成熟的miR-29b-3p及检测其表达水平,通过qRT-PCR检测到miR-29b-3p的表达水平,发现miR-29b-3p表达增强,表明构建的腺相关病毒成功感染脑组织并使miR-29b-3p表达增加。
目前在精神疾病方面通过AAV载体的基因治疗已经有很多报道,BAI[16]研究证明AAV-proBDNF感染大鼠海马可以上调抑郁样大鼠海马BDNF的水平,MARONGIU[17]通过AAV-sh-p11阻断P11基因的表达治疗帕金森大鼠,但是没有腺相关病毒携带miR基因治疗抑郁症的相关文献,本研究制备的rAAV-miR-29b-3p感染抑郁症模型大鼠前额叶皮质后,抑郁症大鼠行为学出现改变(数据未显示),这将为进一步研究miR-29b-3p的生理学功能以及抑郁症的基因治疗提供有效的手段与方法。
[1]PILETIC K,KUNEJ T.MicroRNA epigenetic signatures in human disease[J].Archives of Toxicology,2016,90(10):2405-2419.
[2]ISSLER O,CHEN A.Determining the role of microRNAs in psychiatric disorders[J].Nature Reviews Neuroscience,2015,16(4):201-212.
[3]MATHERS C D,EZZATI M,LOPEZ A D.Measuring the burden of neglected tropical diseases:the global burden of disease framework[J].PLoS Neglected TropicalDiseases,2007,1(2):e114.
[4]YANG X,YANG Q,WANG X,et al.MicroRNA expression profile and functional analysis reveal that miR-206 is a critical novel gene for the expression of BDNF induced by ketamine[J].Neuromolecular Med,2014,16(3):594-605.
[5]MOUILLET-RICHARD S,BAUDRY A,LAUNAY J M,et al.MicroRNAs and depression[J].Neurobiology of Disease,2012,46(2):272-278.
[6]DWIVEDI Y.Evidence demonstrating role of microRNAs in the etiopathology of major depression[J].J Chem Neuroanat,2011,42(2):142-156.
[7]WANG X.Antidepressant effect of the first electroconvulsive therapy with ketamine and/or propofol:response[J].the Journal of ECT,2013,29(2):149.
[8]BURGER C,GORBATYUK O S,VELARDO M J,et al.Recombinant AAV viral vectors pseudotyped with viral capsids from serotypes 1,2,and 5 display differential efficiency and cell tropism after delivery to different regions of the central nervous system[J].Molecular Therapy:the Journal of the American Society of Gene Therapy,2004,10(2):302-317.
[9]LAI C M,LAI Y K,RAKOCZY P E.Adenovirus and adeno-associated virus vectors[J].Dna&Cell Biology,2003,21(12):895-913.
[10]AURICCHIO A,HILDINGER M,O'CONNOR E,et al.Isolation of highly infectious and pure adeno-associated virus type 2 vectors with a single-step gravity-flow column[J].Hum Gene Ther,2001,12(1):71-76.
[11]DAYA S,BERNS K I.Gene therapy using adeno-associated virus vectors[J].Clinical Microbiology Reviews,2008,21(4):583-593.
[12]VINCENT M,GAO G,JACOBSON L.Comparison of the efficacy of five adeno-associated virus vectors for transducing dorsal raphe nucleus cells in the mouse[J].J Neurosci Methods,2014,235:189-192.
[13]GRIEGER J C,SAMULSKI R J.Adeno-associated virus as a gene therapy vector:vector development,production and clinical applications[J].Adv Biochem Eng Biotechnol,2005,99:119-145.
[14]MINGOZZI F,HIGH K A.Therapeutic in vivo gene transfer for genetic disease using AAV:progress and challenges[J].Nature Reviews Genetics,2011,12(5):341-355.
[15]HUANG Z J,TANIGUCHI H,HE M,et al.Cre-dependent adeno-associated viruspreparation and delivery forlabeling neurons in the mouse brain[J].Cold Spring Harbor protocols,2014,2014(2):190-194.
[16]BAI Y Y,RUAN C S,YANG C R,et al.Probdnf signaling regulates depression-like behaviorsin rodentsunderchronic stress[J].Neuropsychopharmacology:Official Publication of the American College of Neuropsychopharmacology,2016,41(12):2882-2892.
[17]MARONGIU R,ARANGO-LIEVANO M,FRANCARDO V,et al.Gene therapy blockade of dorsal striatal p11 improves motor function and dyskinesia in parkinsonian mice[J].Proceedings of the National Academy ofSciencesofthe United Statesof America,2016,113(5):1423-1428.
(张蕾 编辑)
Construction of recombinant adeno-associated virus expressing miRNA-29b-3p and its expression in prefrontal cortex of rats*
Mao Li,Jian-guo Feng,Xiao-bin Wang,Qian-xiu Chen,Yun-qiang Wan
(Department of Anesthesiology,the Affiliated Hospital,Southwest Medical University,Luzhou,Sichuan 646000,China)
Objective To obtain the recombinant adeno-associated virus expressing miRNA-29b-3p(rAAV-miRNA-29b-3p),and examine the infection effect and expression level of rAAV-miRNA-29b-3p in the prefrontal cortex of rats.Methods The pre-miRNA-29b-3p gene fragment was inserted into AAV expression plasmid to construct a recombinant AAV plasmid.The recombinant AAV plasmid,packaging plasmid and helper plasmid were co-transfected into HEK293 cells by LipofiterTMfor rAAV-miRNA-29b-3p packaging.The rAAV-miRNA-29b-3p was harvested from transfected HEK293 cells and purified by a resin column,and the titer of the rAAV-miRNA-29b-3p was tested by qRT-PCR.The rAAV-miRNA-29b-3p was injected to the prefrontal cortex of rats using stereotactic apparatus.The infection effect was observed under immunofluorescence microscope,the expression level of miRNA-29b-3p was detected by qRT-PCR.Results High titer of rAAV-miRNA-29b-3p was obtained after successful packaging.The rAAV-miRNA-29b-3p was purified,the virus titer reached 1.0×1012vg/ml.Strong green fluorescence and high level of miRNA-29b-3p were detected in the infected prefrontal cortex after 21 days of infection.Conclusions The constructed rAAV-miRNA-29b-3p can greatly increase the expression level of miRNA-29b-3p in the prefrontal cortex of rats,which provides a useful tool for further study of the biological function of miRNA-29b-3p.
adeno-associated virus;miRNA-29b-3p;prefrontal cortex;rat
R338;R-332
A
10.3969/j.issn.1005-8982.2017.25.001
1005-8982(2017)25-0001-07
2016-12-24
国家自然科学基金(No:81271478)
王晓斌,E-mail:wangxiaobin67@163.com;Tel:13708280087
