基因多态性与羟考酮个体差异相关性的研究进展*
2017-11-21刘金玉张程亮吴红艳游如旭
刘金玉 刘 东 张程亮 桂 玲 吴红艳 游如旭
(1华中科技大学同济医学院附属同济医院药学部,武汉430033;华中科技大学同济医学院附属协和医院2护理部;3药学部,武汉430022)
基因多态性与羟考酮个体差异相关性的研究进展*
刘金玉1刘 东1张程亮1桂 玲1吴红艳2游如旭3△
(1华中科技大学同济医学院附属同济医院药学部,武汉430033;华中科技大学同济医学院附属协和医院2护理部;3药学部,武汉430022)
羟考酮是一种半合成的强效阿片类药物,临床上已广泛应用于各种急慢性疼痛的治疗,但是在临床使用中,羟考酮的有效剂量、镇痛效果和不良反应表现出极大的个体差异,这在一定程度上限制了羟考酮的使用。近年来,研究表明这种个体差异可能来源于基因多态性对羟考酮药代动力学和药效学的影响。因此,对有关羟考酮的基因组学研究,从代谢酶基因多态性、阿片受体基因多态性、转运蛋白基因多态性三个方面进行综述,以期为羟考酮的临床个体化用药提供参考依据。
羟考酮;基因多态性;代谢酶;阿片受体;P-糖蛋白
羟考酮是一种半合成的强效阿片类药物,其药理作用和持续时间类似于吗啡,但比吗啡起效快、生物利用度高,在许多国家已取代吗啡成为术后疼痛和癌痛的治疗药物。然而,羟考酮有着极大的个体差异性,在不同病人中,其有效镇痛剂量可在10~ 1 040 mg/d之间波动。同时,羟考酮可引起多种不良反应,如恶心呕吐、便秘、呼吸抑制等。在治疗中,医生需经常通过调整羟考酮的给药剂量,来平衡镇痛效果和不良反应之间的关系。羟考酮的这种用药剂量及不良反应在个体间的差异严重阻碍了其在镇痛治疗上的安全有效实施,也增加了药物滥用的危险性。
药物基因组学是在药物遗传学基础上发展起来的新兴学科,是分子药理学与功能基因组学结合的产物,从基因水平进一步解释药物疗效差异的原因。它主要研究与药物代谢、转运及作用受体有关的基因多态性对药物疗效的影响。药物基因组学(pharmacogenomics)研究表明,基因多态性与阿片类药物的个体差异性密切相关。目前,国外已经有多个研究发现,包括阿片受体、细胞色素P450酶(cytochrome P450, CYP450)、儿茶酚-O-甲基转移酶(catechol-O-methyltransferase, COMT)、ATP-结合盒转运体(ATP-binding cassette subfamily B member 1,ABCB1)等多个相关基因多态性与羟考酮的有效镇痛剂量、药物滥用以及不良反应的严重程度密切相关,但国内相关研究很少。本文将通过对国内外相关文献进行系统综述,从整体上探讨基因多态性对羟考酮镇痛效果和不良反应的影响,旨在为羟考酮的临床个体化用药提供参考依据。
1.代谢酶基因多态性
(1)CYP450 酶系
CYP450酶系是最重要的药物代谢酶系,该酶系广泛分布于肝、肾、脑、胃肠道及胎盘等组织器官,但以肝脏为主。CYP450酶系在体内主要进行Ⅰ相代谢转化,除使少数前体药物代谢成活性产物起作用外,CYP450酶系可使绝大多数药物的作用减弱或消失,是实现肝脏灭活解毒功能的主要酶系。在人类CYP450超家族中主要有 CYP 1 ~ 33个家族酶系在体内参与外源性物质的转化。
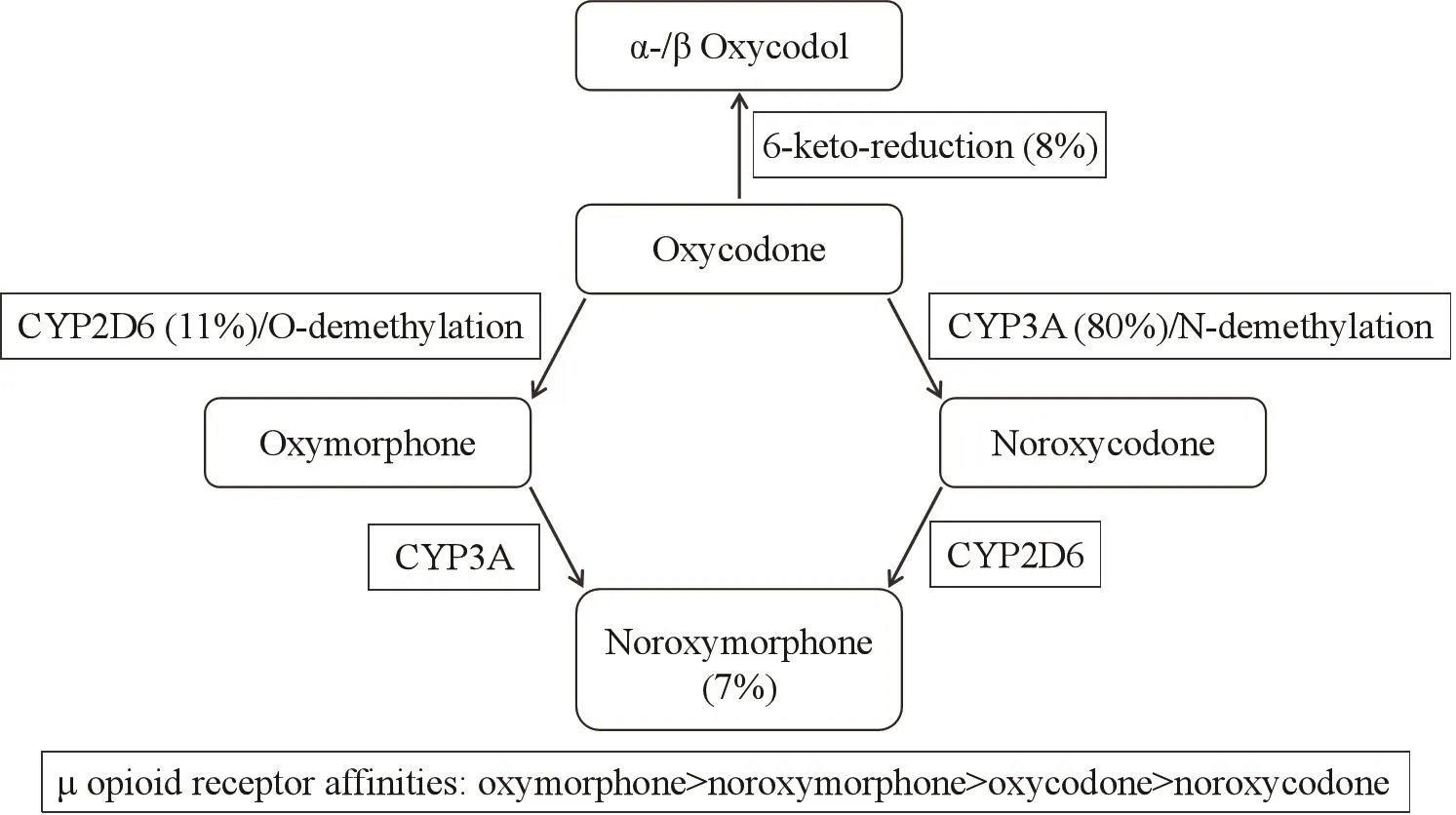
图1 羟考酮的代谢过程
羟考酮主要是在肝脏和肠壁通过CYP2D6和CYP3A4/5分别代谢为氧吗啡酮和去甲羟考酮,具体途径见图1[1,2]。CYP2D6是最重要的氧化代谢酶之一,可催化 30 多类药物的代谢。编码CYP2D6的基因位于22号常染色体上,此基因约有70多个等位基因突变位点,这种多态性影响了药物的反应、代谢、转运以及个体间阿片类药物的浓度。根据CYP2D6 基因型不同可将个体分为慢代谢型(poor metaboliser, PM)、中间代谢型(intermediate metaboliser, IM)、快代谢型(extensive metaboliser,EM)和超快代谢型(ultra-rapid metaboliser, UM),50%的亚洲人属于IM型。研究表明,不同个体间CYP2D6酶活性差别可达10000倍之多。羟考酮进入体内后,11%通过CYP2D6进行O-去甲基化转化为氧吗啡酮,氧吗啡酮对µ受体有着很高的亲和力,是羟考酮的10 ~ 60倍。多项研究表明,给予相同剂量的羟考酮,UM型个体羟考酮和去甲羟考酮血药浓度显著低于PM型,氧吗啡酮和去氧吗啡酮血药浓度显著高于PM型[1]。从理论上来说,CYP2D6基因型的存在可能影响羟考酮的镇痛效果。研究表明,UM型的镇痛效果是EM型的1.5 ~ 6倍,PM型的镇痛效果较UM型降低2 ~ 20倍;同时UM型承受的不良反应也更为频繁且严重[3]。而另一方面,Zwisler等人一项关于CYP2D6基因型对羟考酮的术后镇痛效果及不良反应发生率的研究表明,PM组与EM组并无显著性差异[4],但该研究仅入组270人。同样的,最近研究发现,癌痛病人在服用羟考酮后其疼痛强度、恶心、疲倦以及认知功能等在PM,EM,和UM组均没有显著性差异[5]。此外,Lemberg等在慢性非癌痛和癌痛病人身上也得到了类似的结果[6]。Zwisler等也发现EM组氧吗啡酮血药浓度显著高于PM组,这与CF Samer等研究相符,但由于其含量非常低,仅羟考酮的1/(400 ~ 1 000),以致对羟考酮的镇痛效果几乎没有影响。目前,已经有多项研究证实CYP2D6基因型对羟考酮的代谢有着显著的影响,但在镇痛效果及不良反应发生率方面是否有临床意义还需进一步大样本的研究。
CYP3A 是细胞色素 P450 最重要的亚族,能氧化一系列CYP家族的底物,也是人体中含量最丰富的P450酶,临床中60%的药物都是经过CYP3A代谢。CYP3A4/5是羟考酮的主要代谢途径,80%的羟考酮通过CYP3A4/5进行N-去甲基化转化为去甲羟考酮,该代谢物对µ受体的亲和力较低。在药理学的研究中,单独抑制CYP2D6,静脉中的羟考酮含量几乎没有变化,但如果同时抑制CYP3A和CYP2D6参与的氧化代谢途径,静脉中的羟考酮含量将大幅增加(3倍左右)[7],该研究表明这两条途径有代偿,CYP2D6抑制后,CYP3A活性加强。也有研究用酮康唑、伏立康唑、伊曲康唑等抑制CYP3A4活性后,CYP2D6代谢途径稍有增强,羟考酮和氧吗啡酮血药浓度增加1.5倍左右[8];Liukas等研究用克拉霉素抑制CYP3A4后,老年人羟考酮的药时曲线下面积(area under the concentration-time curve, AUC)增加在1.1~3.8倍,而AUC增加了3.8倍的病人镇痛效果有所增强,但同时经历了恶心、呕吐等副反应[9]。因此,CYP3A基因多态性可能对羟考酮治疗的病人有着重要的临床意义。
CYP3A4/5野生基因型为超速代谢(UM),CYP3A4*1G和CYP3A5*3是亚洲人群中最常见的突变,该突变可分别导致CYP3A4 和CYP3A5的活性降低,因此从理论上讲,CYP3A4*1G和CYP3A5*3可能会导致羟考酮治疗效果增强或仅需要更小的剂量就能达到疗效[10]。但有研究却发现,CYP3A4*1G不同基因型的分布和等位基因的频率并无明显差异,进而推断 CYP3A4*1G基因多态性与羟考酮疗效没有明显联系。这可能是由于CYP3A4*1G基因多态性降低CYP3A4的活性的机制,不同于用药物直接抑制CYP3A4的氧化代谢途径。Takafumi研究表明癌痛病人CYP3A5*3/*3组去甲羟考酮C12和去甲羟考酮C12/羟考酮C12显著低于CYP3A5*1/*1组,而羟考酮和氧吗啡酮的血氧浓度没有差异;另外,CYP3A5*3/*3组阿片剂量指数(opioid escalation index, OEI)显著高于CYP3A5*1/*1组[11]。近年来,阿片剂量指数已被广泛应用于癌痛管理中阿片类药物耐受性的标志,该结果表明携带CYP3A5*3/*3基因型个体更容易对羟考酮产生耐受性。
(2)儿茶酚-O-甲基转移酶
COMT主要参与儿茶酚胺类物质的代谢,是多巴胺能和肾上腺素能神经递质的主要调节器。依据基因型不同,可将COMT酶活性分为高活性(V/V)、中等活性(V/M)和低活性(M/M)。目前已经发现COMT多态性与疼痛的多个方面相关,如实验性伤害刺激的敏感性、阿片类药物的镇痛效应、阿片类药物的副反应和慢性疼痛易感性等。研究较多的多态性位点是V158M(rs4680),V158M可使COMT酶活性降低3 ~ 4倍;此外,COMT SNPs(rs6269A > G、rs4633T > C、rs4818C > G和rs4680G > A)可使COMT活性升高4.8~11.4倍。疼痛敏感性与COMT活性相反,因为低COMT酶活性可使多巴胺能神经传递活化提高,疼痛敏感性受神经元内脑腓肽含量影响,脑腓肽含量下降随之引起μ阿片受体上调。虽然多项研究表明[12,13],携带COMT M/M基因型个体疼痛敏感度显著高于COMT V/V基因型个体,但Oleg Kambur等却发现rs165774与热痛觉和rs887220与冷痛觉有显著的相关性,表现为携带次要等位基因者疼痛程度更低[14],而没有得到V158M与冷、热刺激敏感性的阳性结果。目前研究COMT多态性与羟考酮的相关性报道还不多,但据目前证据来看,COMT多态性与羟考酮用于术后镇痛和癌痛的用量及成功率方面都没有相关性。
2. 阿片受体基因多态性
阿片类药物的镇痛作用及不良反应主要是通过 μ、κ 及δ 三种阿片受体介导完成的。μ阿片受体是目前使用的大多数阿片类药物的主要作用受体,也是发挥镇痛、耐受和依赖等效应的关键性靶位因素。因此编码μ阿片受体的OPRM1基因是影响阿片类药物疗效的主要候选基因。OPRM1基因有多个位点发生突变,与镇痛相关的位点有rs1799971A/G、rs589046C/T、rs563649C/T、rs9479757G/A、rs533586C/T,其中rs1799971A/G(A118G)是最常见的SNPs,高加索人群突变频率在10% ~ 14%之间,而中国人群在30%左右。A118G突变导致了μ阿片受体细胞外N-末端第40位氨基酸由天冬氨酸取代天冬酰胺,使μ 阿片受体丢失了一个糖基化位点,进而使受体亲和力及内源性β内啡肽的效能增加3倍,而对阿片类药物的结合却不受影响。研究发现,G118等位基因携带者阿片类药物的镇痛作用明显下降,且呼吸抑制、恶心呕吐等不良反应也较A118等位基因携带者少,Mague等发现G118携带者疼痛敏感性增加。
目前关于OPRM1基因型对羟考酮的用量和疗效方面的研究结论还各不相同。Zwisler研究发现,G118 等位基因携带者对电刺激更为敏感,且对羟考酮的镇痛反应也明显减弱,而Olesen进行一项相似的研究却没有得到阳性结果。Olesen研究还发现,对于内脏压痛,携带rs589046T,rs1799971 A,rs9479757A或 rs533586C等位基因对羟考酮有更好的镇痛效果,而对于皮肤热刺激痛,携带rs589046T或rs563649T等位基因对羟考酮有更好的镇痛效果[15]。李擎等研究显示,对于未用过阿片类药物的重度癌痛病人,携带118G等位基因的受试者比未携带者需要更多的羟考酮来控制疼痛,但所观察到的不良反应(包括恶心呕吐、便秘、眩晕)却没有差异。而另一项临床试验对比缓解组和难治组癌痛病人A118G的基因型,发现其基因分布没有明显差异,因此推断A118G位点的多态性对造成羟考酮治疗癌痛病人疗效的差异没有作用。也有研究表明,携带118G等位基因与降低疼痛的敏感性有关仅仅是在白种人中,在西班牙裔中却出现了相反的趋势[16]。
此外,δ和κ受体基因多态性对羟考酮的镇痛效果也可能有一定的影响。目前有关δ和κ受体基因多态性的研究要较μ受体少得多。OPRD1编码δ受体1,其中rs2236857T/C、rs419335A/G和rs2234918C/T是常见的SNPs,rs2236857T/C突变可增加疼痛敏感性;另有研究表明rs419335A/G和rs2234918C/T与羟考酮对肌肉压力刺激和内脏热刺激的镇痛反应有关[15]。羟考酮已被证实对内脏痛有一定的效果,可能是κ-阿片受体介导的,这是它与其他阿片类药物的不同之处。Nielsen研究发现OPRK1(rs6473799T/C )与疼痛的敏感性有关,携带C等位基因的受试者较未携带者其机械性内脏痛耐受阈提高30.4%,但该研究却未得到OPRD1基因多态性与疼痛敏感性的阳性结果[17]。
3. 转运蛋白基因多态性
细胞膜上的ATP-结合盒转运蛋白(adenosine triphosphate-binding cassette transporters, ABC转运蛋白)家族在病原体耐药和肿瘤细胞多药耐药中起着关键作用。ABCB1(MDR1)基因编码的P-糖蛋白(P-glycoprotein, P-gp)是典型的ABC转运蛋白,主要分布在肠道、肾脏和血脑屏障。P-gp作为ATP供能的药物外排泵,影响体内多种药物的吸收和分布,其功能的缺失会导致美沙酮、芬太尼、吗啡和羟考酮等底物经肠道吸收增加、肾脏清除率降低以及脑中浓度上升,进而表现为临床效应增加或所需剂量减少。ABCB1基因有30多个SNPs,如C1236T、C3396T、G2677T/A、G2667A和C3435T等,其中位于26号外显子区的3435C > T和21号外显子区的G2677T/A与P-gp的表达与功能密切相关。研究表明,3435TT基因型P-gp表达量比野生基因型降低2 ~ 3倍。
一项关于ABCB1基因多态性对实验性疼痛的研究表明[18],3435C > T突变并不影响实验性疼痛各个方面,如疼痛检测阈值、疼痛耐受阈值以及不适评分等;但有些不良反应却显著降低,如恶心/呕吐、困倦、瘙痒等。G2677T/A突变对于实验性疼痛的结果与上述相似,唯一不同的是,对于冷刺激,相比于野生型,G2677T/A突变基因型疼痛评分及不适评分降低更为显著。结合C3435T与G2677A两个SNPs来看,基因突变组冷刺激的不适评分降低更为显著,其发生的不良反应也更少。Zwisler等一项纳入266名术后镇痛的病人临床试验却没有得到阳性的结果,该研究表明相比于3435CC组,3435CT和3435TT组在羟考酮的用量、解救处理、无应答率以及不良反应的发生等方面均没有显著性的差异,同时,G2677T/A突变对以上几个指标也没有影响,即使联合考虑CYP2D6基因分型,结果仍然没有显著性差异[19]。另外,Jessica等研究G2677T/A突变与羟考酮导致的中枢抑制相关性发现,G2677T/A基因突变会增加哺乳妈妈服用羟考酮后的中枢抑制风险,但对接受哺乳的新生儿却没有影响[20]。
4.小结与展望
羟考酮的药学效应,并不是通过某一种酶或一种受体而发挥作用,而是多种药物代谢途径相互作用的最终结果。因此,分析不同的基因组合是否对羟考酮止疼效果有影响是十分必要的。综上所述,药物代谢酶、作用受体、转运体等基因多态性对羟考酮的疗效有一定的影响,但要实现指导临床个体化用药以达到提高疗效、避免不良反应的最终目标还任重道远。
目前,我们还需解决以下几个关键问题:①药物基因组学研究结果重现性很差,不同研究中心研究结果往往差异很大,甚至相互矛盾;②目前基因多态性的研究主要集中在单个基因上,个体对阿片类药物的反应是有多基因遗传所决定的,任何单一基因起的作用都是有限的;③药物代谢动力学(pharmacokinetics, PK)与药物效应动力学(pharmacodynamics, PD)结果不一致,如何将PK/PD联合起来指导临床用药是关键。因此,我们将来的研究应更多的考虑多个基因的联合作用,以及环境与基因间的相互作用,PK/PD的关系,进行多中心、多种族、大规模的研究。总之,羟考酮用于镇痛的个体间差异及其引起这种差异的遗传因素和生物学机制还需要进一步研究。
[1] Klimas R, Witticke D, El Fallah S,et al.Contribution of oxycodone and its metabolites to the overall analgesic effect after oxycodone administration. Expert Opin Drug Met, 2013, 9(5): 517~528.
[2] Andreassen TN, Klepstad P, Davies A,et al.In fl uences on the pharmacokinetics of oxycodone: a multicentre cross-sectional study in 439 adult cancer patients. Eur J Clin Pharmacol, 2011, 67(5): 493~506.
[3] Samer CF, Daali Y, Wagner M,et al.Genetic polymorphisms and drug interactions modulating CYP2D6 and CYP3A activities have a major effect on oxycodone analgesic ef fi cacy and safety. Brit J Pharmacol, 2010,160: 919~930.
[4] Zwisler ST, Enggaard TP, Mikkelsen S,et al.Impact of the CYP2D6 genotype on post-operative intravenous oxycodone analgesia. Acta Anaesth Scand, 2010, 54(2):232~240.
[5] Andreassen TN, Eftedal I , Klepstad P,et al.Do CYP2D6 genotypes re fl ect oxycodone requirements for cancer patients treated for cancer pain a cross-sectional multicentre study. Eur J Clin Pharmacol, 2012, 68: 55~64.
[6] Lemberg KK, Heiskanen TE, Neuvonen M,et al.Does co-administration of paroxetine change oxycodone analgesia: an interaction study in chronic pain patients.Scand J Pain, 2010, 1(1):24~33.
[7] Meng H, Guo G, Ren J,et al.Effects of ABCB1 polymorphisms on plasma carbamazepine concentrations and pharmacoresistance in Chinese patients with epilepsy.Epilepsy Behav, 2011, 21(1): 27~30.
[8] Tverdohleb T, Dinc B, Knezevic I,et al.The role of cytochrome P450 pharmacogenomics in chronic noncancer pain patients. Expert Opin Drug Metab Toxicol,2016 Jul 15, [Epub ahead of print].
[9] Liukas A, Hagelberg NM, Kuusniemi K,et al.Inhibition of Cytochrome P450 3A by Clarithromycin Uniformly Affects the Pharmacokinetics and Pharmacodynamics of Oxycodone in Young and Elderly Volunteers. J Clin Psychopharmacol, 2011, 31(3): 302~308.
[10] Zhang W, Chang YZ, Kan QC,et al.CYP3A4*1G genetic polymorphism in fl uences CYP3A activity and response to fentanyl in Chinese gynecologic patients.Eur J Clin Pharmacol, 2010, 66(1): 61~66.
[11] Takafumi N, Yoshiaki T, Keisuke Y,et al.CYP3A5*3 Affects Plasma Disposition of Noroxycodone and Dose Escalation in Cancer Patients Receiving Oxycodone. J Clin Pharmacol, 2011, 51: 1529~1538.
[12] Loggia ML, Jensen K, Gollub RL,et al.The catechol-o-methyltransferase (COMT) val158met polymorphismaffects brain responses to repeated painful stimuli. PLoS One, 2011, 6: e27764.
[13] Mobascher A, Brinkmeyer J, Thiele H,et al.The val158met polymorphism of human catechol-O-methyltransferase (COMT) affects anterior cingulate cortex activation in response to painful laser stimulation. Mol Pain, 2010, 6: 32.
[14] Kambur O, Kaunisto MA, Tikkanen E,et al.Effect of Catechol-o-methyltransferase-gene (COMT) Variants on Experimental and Acute Postoperative Pain in 1,000 Women undergoing Surgery for Breast Cancer.Anesthesiology, 2013, 119: 1422~1433.
[15] Olesen AE, Sato H, Nielsen LM,et al.The genetic influences on oxycodone response characteristics in human experimental pain. Fund Clin Pharmacol, 2015,29(4): 417~425.
[16] Hastie BA, Riley JL, Kaplan L,et al.Ethnicity interacts with the OPRM1 gene in experimental pain sensitivity. Pain, 2012, 153(8): 1610~1619.
[17] Nielsen LM , Olesen AE, Sato H,et al.Association between Gene Polymorphisms and Pain Sensitivity Assessed in a Multi-Modal Multi-Tissue Human Experimental Model - An Explorative Study. Basic Clin Pharmacol Toxicol, 2016, 119(4): 360~366.
[18] Zwisler ST, Enggaard TP, Noehr-Jensen L,et al.The antinociceptive effect and adverse drug reactions of oxycodone in human experimental pain in relation to genetic variations in the OPRM1 and ABCB1 genes.Fund Clin Pharmacol, 2010, 24(4): 517~524.
[19] Zwisler ST, Enggaard TP, Mikkelsen S,et al.Lack of association of OPRM1 and ABCB1 single-nucleotide polymorphisms to oxycodone response in postoperative pain. J Clin Pharmacol, 2012, 52(2): 234~242.
[20] Lam J, Kelly L, Matok I,et al.Putative association of ABCB1 2677G.T/A with Oxycodone-Induced central nervous system depression in breastfeeding mothers.Ther Drug Monit, 2013, 35(4): 466~472.
10.3969/j.issn.1006-9852.2017.09.010
湖北省自然科学基金项目(2016CFB67)
△通讯作者 游如旭 youruxu2008@163.com
