GCH1基因多态性与肺癌中晚期病人癌痛程度的相关性研究*
2017-11-21潘志强
张 璐 朱 敏 张 慧 潘志强 申 文
(1徐州医科大学江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,徐州 221004;2徐州医科
大学附属医院疼痛科,徐州 221002)
GCH1基因多态性与肺癌中晚期病人癌痛程度的相关性研究*
张 璐1朱 敏1张 慧1潘志强1申 文2△
(1徐州医科大学江苏省麻醉学重点实验室,江苏省麻醉与镇痛应用技术重点实验室,徐州 221004;2徐州医科
大学附属医院疼痛科,徐州 221002)
目的: 探讨三磷酸鸟苷环化水解酶1 (GTP cyclohydrolase 1, GCH1) 基因多态性与肺癌中晚期病人癌痛程度的相关性。方法应用基因芯片技术检测207例肺癌中晚期病人和160例对照者GCH1-rs3783641位点的基因型。采用视觉模拟评分法(visual analogue scale, VAS)评估病人治疗前的癌痛程度,记录阿片药物需要量。通过对这些分析探讨GCH1基因多态性与癌痛程度的相关性。结果①不同癌痛程度病人基因型及等位基因分布差异有统计学意义(P< 0.05),AA、AT、TT基因型病人的疼痛发生率和疼痛评分依次降低(P< 0.05);②与AA相比,AT、TT型病人的阿片药物需要量降低;AT与TT相比阿片药物需要量差异无统计学意义;与等位基因A相比,等位基因T携带者的疼痛发生率、疼痛评分和阿片药物需要量降低(P< 0.05);③GCH1-rs3783641等位基因T与治疗前VAS评分呈负相关(P< 0.05)。结论GCH1基因多态性与肺癌中晚期病人癌痛程度密切相关。
GCH1;癌痛;基因多态性;肺癌
疼痛是癌症病人常见的临床症状,大约70%的中晚期癌症病人在病程中经历着不同程度的癌痛,严重影响病人的生活质量。临床上发现肺癌中晚期病人癌痛程度有明显个体差异,研究表明癌症病人疼痛程度的个体差异可能与基因遗传变异有关[1]。而临床上的癌痛治疗手段往往不能取得非常满意的疗效,每种方法都存在一定缺陷和不良反应,目前基因靶向治疗已成为肿瘤治疗的发展趋势[2]。由于影响癌痛的基因目前仍在寻找中,因此使得基因多态性与癌痛之间关系的研究对解释癌痛个体差异以及癌痛基因治疗方面都有重要意义。通过特异性干预相关疼痛位点的多态性有可能为癌痛的临床治疗提供有效的方案。
三磷酸鸟苷环化水解酶1 (GTP cyclohydrolase 1, GCH1) 基因是近年来发现可能与疼痛相关的基因[3]。GCH1基因编码的三磷酸鸟苷环化水解酶1是合成四氢生物蝶呤(tetrahydrobiopurine, BH4)的起始酶及限速酶,而BH4则是儿茶酚胺、5-羟色胺、一氧化氮等多种致痛物质合成的辅因子,因此BH4对疼痛的敏感性和持续性有着内在调节作用[4]。GCH1基因的遗传变异会影响三磷酸鸟苷环化水解酶1的活性[5],GCH1基因可能通过BH4介导来影响疼痛。研究发现GCH1基因一个单倍型(包含rs3783641位点)与实验性疼痛的敏感性有关[3],Campbell等人[6]也证实GCH1-rs3783641遗传变异后会降低辣椒素引起的炎性痛的敏感性。但目前关于rs3783641位点多态性在癌痛中的作用研究较少,因此选取GCH1-rs3783641位点作为研究对象,探讨GCH1基因多态性与肺癌中晚期病人癌痛程度的相关性,为揭示临床癌痛个体差异及寻找干预癌痛的基因治疗靶点的研究工作提供参考。
方 法
1.一般资料
本研究已取得徐州医科大学附属医院伦理委员会的批准,所有入选者均已签署知情同意书,自愿纳入本项研究。选取2015年9月至2016年10月在徐州医科大学附属医院就诊的肺癌中晚期(Ⅲ、Ⅳ期)病人(n= 207,非连续入组),男115例,女92例,平均年龄60.9±10.2岁;对照组选取来自徐州医科大学附属医院体检中心非肿瘤的体检者(n= 160),男86例,女74例,平均年龄58.6±12.7岁,两组研究对象的性别和年龄差异无统计学意义。
纳入标准 :①经病理学诊断为肺癌中晚期(Ⅲ、Ⅳ期)的肿瘤病人;②近3个月均未接受阿片药物或其他镇痛药物治疗;③18≤年龄(周岁)≤85,性别不限;④病人生存期预计在2个月以上;⑤中国汉族人群。
排除标准:①伴有中枢神经系统疾病者;②合并其他慢性疼痛病人;③吗啡耐受病人;④病情突然恶化者;⑤入选前3个月参加过其他药物试验者;⑥合并其他明显的躯体疾病者。
2.试验方法及样本采集
于入院当天采用视觉模拟评分法(visual analogue scale, VAS)评估病人治疗前的癌痛程度,根据临床特征进行癌痛病理生理学分类[7]。
(1)疼痛程度:0为无痛,1~3为轻度疼痛,4~6为中度疼痛,7~10为重度疼痛。
(2)癌痛分类:根据病人描述的疼痛部位、性质、影像学表现等由医生做出诊断,分为:骨痛、内脏痛、神经病理性痛和软组织痛。①骨痛:疼痛定位确切,描述为钝痛、胀痛,常由活动诱发,影像学有骨破坏表现;②内脏痛:发生在身体中轴部位,定位模糊、弥散,酸痛、绞痛,常伴有自主神经功能紊乱;③神经病理性痛:描述为麻木、放射性疼痛,表现为过敏痛、自发痛、超敏痛等,常由神经受损导致;④软组织痛:疼痛定位确切,描述为酸痛、胀痛,体表常有压痛,肌肉、关节等软组织常有肿瘤浸润。
记录病人治疗前VAS评分以及治疗后VAS≤3分时阿片药物日均需要量(为便于计算,根据公式换算成等效吗啡当量,曲马多200 mg/d = 羟考酮30 mg/d = 芬太尼0.6 mg/d = 吗啡60 mg/d)[8]。参考 2012年2月欧洲姑息治疗委员会《癌痛的阿片类药物治疗指南》[9]给予阿片类药物镇痛。给予药物的第1个24 h应用VAS评估病人疼痛程度和舒适度,若疼痛控制不佳,按照指南相应增加药物剂量。比较肺癌组与对照组的基因型及等位基因分布;比较不同癌痛程度病人间的基因型及等位基因分布;比较不同基因型及等位基因病人的疼痛发生率、疼痛评分和阿片药物需要量。
抽取受试对象外周静脉血2 ml作为样本,注入EDTA抗凝试管,储存于-80℃冰箱备用。
3. 基因分型
(1) DNA提取:采用上海赛百盛基因技术有限公司基因组DNA抽提试剂盒抽提基因组DNA,紫外分光光度计检测DNA纯度。
(2)引物设计与合成:引物由生工生物工程(上海)股份有限公司设计和合成,引物序列见表1。
(3)PCR扩增:①PCR反应体系,共25 μl,包括2×Taq Master Mix 12.5 μl ,上下游引物各1 μl(10 μmol/L),DNA模板2 μl ,无核酶水8.5 μl 。②PCR反应条件:95 ℃预变性4 min;94 ℃变性30 s,56 ℃退火30 s,72 ℃延伸30 s,循环35次;最后72 ℃延伸10 min。
(4)探针设计:由生工生物工程(上海)股份有限公司设计和合成13个碱基左右长度的探针,5’端标记Cy3、Cy5双色荧光,野生型标记为Cy3,变异型标记为Cy5,探针序列见表1。
(5)扫描分型:应用基因芯片技术检测病人的基因型,分为野生型纯合子(AA)、突变型杂合子(AT)、突变型纯合子(TT)。具体方法如下:每管PCR产物中分别加入60 μl点样液(点样液配方:4%的丙烯酰胺溶液,1%过硫酸铵、20%甘油,用无核酶水配齐至60 μl)。每管取55 μl移入384孔点样板置于点样仪中(晶芯® SmartArrayerTM 48 微阵列芯片点样仪,博奥生物有限公司),点样完成后将玻片置于真空干燥器,同时放置新鲜的TEMED(四甲基乙二胺溶液),密闭容器静置60 min。取出玻片表面覆盖探针浓度为2 pmol/μl的杂交液(杂交液配方:20×SSC杂交缓冲溶液3 μl ,野生型荧光探针与突变型荧光探针各1 μl ,加无核酶水至60 μl),37℃下杂交时间为2~3 h,最后用双蒸水冲洗干净并吹干玻片后进行扫描分型,使用芯片激光扫描仪(LuxScan 10K芯片扫描仪,博奥生物有限公司)对玻片上的样本进行扫描分型。
4. 统计学分析
用SPSS 19.0 进行统计分析,正态计量资料以均数±标准差(±SD)表示,非正态分布资料采用中位数(四分位间距)[M(Q)]或中位数(范围)[M( range)]表示;计数资料比较和Hardy-Weinberg遗传平衡分析采用X2检验,正态分布资料比较应用单因素方差分析,偏态分布资料比较采用秩和检验。采用Spearman等级相关分析病人等位基因T与病人治疗前VAS评分的相关性。检验水准α = 0.05,P< 0.05认为差异有统计学意义。
结 果
1. Hardy-Weinberg遗传平衡
总计入组肺癌病人207例,经检测 AA/AT/TT基因型分别为91/84/32例,等位基因频率T为35.7%;对照组共160例,AA/AT/TT基因型分别为75/67/18例 ,等位基因T频率为32.2%。两组研究对象GCH1 -rs3783641基因型及等位基因分布符合Hardy-Weinberg遗传平衡,说明研究对象具有良好的群体代表性。
2. 肺癌组与对照组基因型及等位基因分布的比较
癌症组与对照组相比基因型及等位基因分布差异无统计学意义,提示肺癌对GCH1基因的遗传变异没有影响(见表2)。
3. 不同组别病人的一般资料和临床特征的比较
(1)不同癌痛程度病人的一般资料和临床特征比较
不同癌痛程度病人的一般资料和临床特征比较差异无统计学意义,提示本研究中不同癌痛病人间具有可比性(见表3)。
(2)不同基因型及等位基因病人的一般资料和临床特征比较
不同基因型及等位基因病人的一般资料和临床特征比较差异无统计学意义,提示本研究中不同基因型及等位基因病人间具有可比性(见表4)。

表1 引物和探针设计序列Table 1 Design of primer and probe
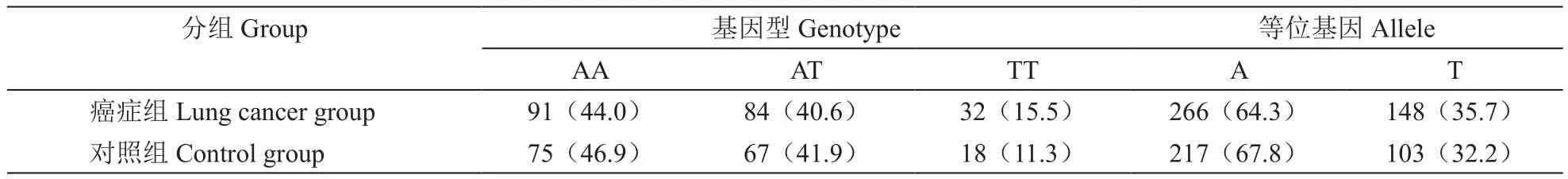
表2 癌症组和对照组基因型及等位基因分布的比较[N(%)]Table 2 Comparison of the genotype and allele distribution between lung cancer group and control group[N (%)]
表3 不同癌痛程度病人的一般资料和临床特征(±SD)Table 3 General data and clinical features of the patients with different levels of cancer pain (±SD)
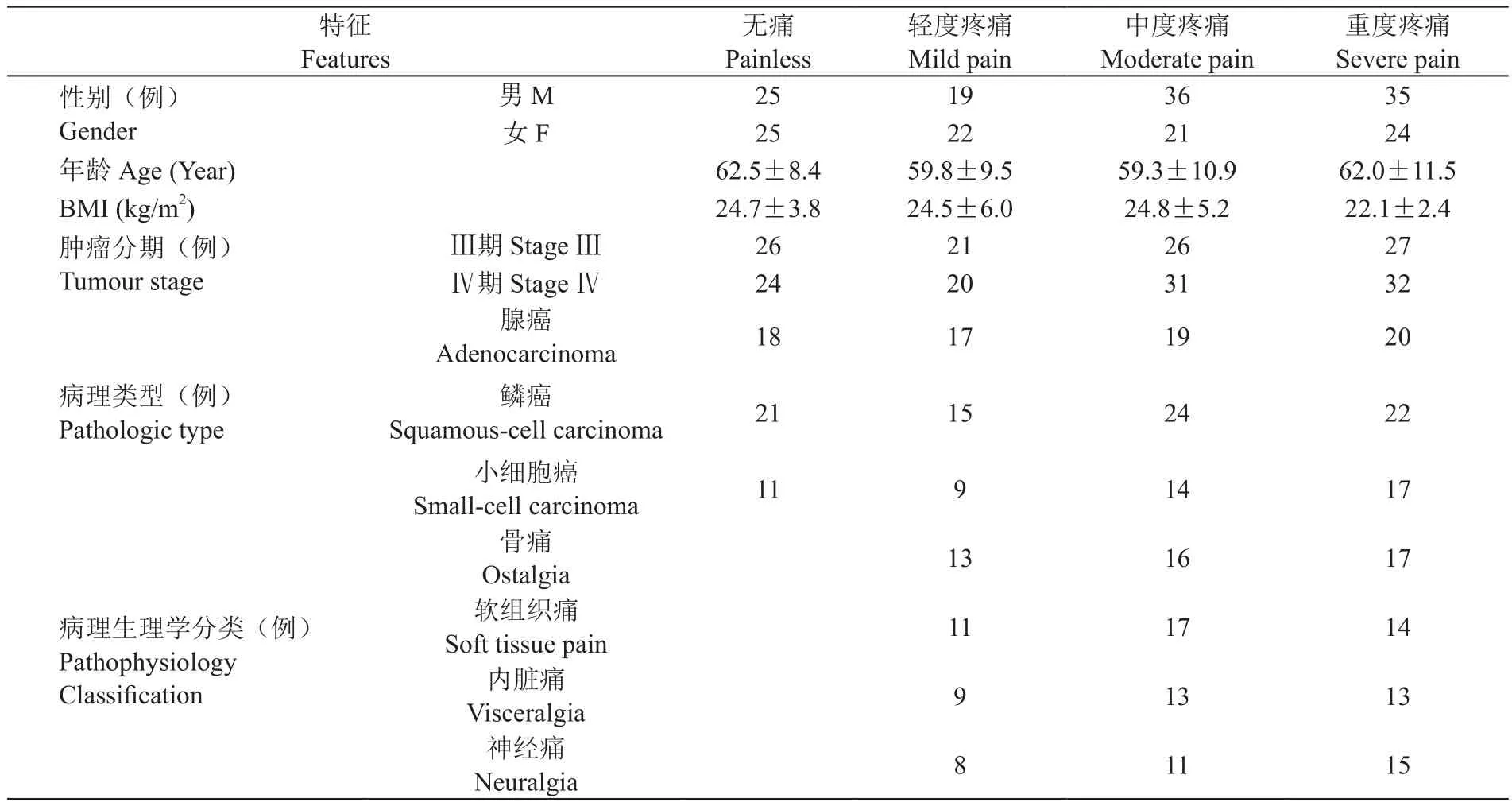
表3 不同癌痛程度病人的一般资料和临床特征(±SD)Table 3 General data and clinical features of the patients with different levels of cancer pain (±SD)
重度疼痛Severe pain性别(例)Gender特征Features无痛Painless轻度疼痛Mild pain中度疼痛Moderate pain男M25193635女F25222124年龄Age (Year)62.5±8.459.8±9.559.3±10.962.0±11.5 BMI (kg/m2)24.7±3.824.5±6.024.8±5.222.1±2.4肿瘤分期(例)Tumour stageⅢ期Stage Ⅲ26212627Ⅳ期Stage Ⅳ24203132腺癌Adenocarcinoma18171920病理类型(例)Pathologic type鳞癌Squamous-cell carcinoma21152422小细胞癌Small-cell carcinoma1191417骨痛Ostalgia 131617病理生理学分类(例)Pathophysiology Classi fi cation软组织痛Soft tissue pain111714内脏痛Visceralgia91313神经痛Neuralgia81115
4. GCH1-rs3783641对病人癌痛程度的影响
不同癌痛程度病人基因型及等位基因分布差异有统计学意义(P< 0.05,见表5);AA、AT、TT型病人的疼痛发生率和疼痛评分依次降低(P< 0.05);与AA相比,AT、TT型病人阿片药物需要量较少(P< 0.05),AT与TT相比阿片药物需要量的差异无统计学意义,与等位基因A相比,等位基因T携带者的疼痛发生率、疼痛评分与阿片药物需要量均降低(P< 0.05,见表6)。
将GCH1-rs3783641等位基因T代入叠加模型,设定AA = 1,AT = 2,TT = 3,病人等位基因T频率与病人治疗前VAS评分呈负相关(r= - 0.345,P< 0.05)。
讨 论
影响癌痛的因素有很多,不仅涉及肿瘤类型、病人心理、环境等方面,基因遗传方面在癌痛中的作用越来越被重视。人对疼痛的感知涉及到很多相关分子的调控,编码相关分子的基因遗传变异后会引起基因表达的变化,从而会直接或间接的影响神经敏感物质的产生和释放,最终引起疼痛阈值的变化[10],因此我们推测,临床上癌症病人疼痛程度存在明显个体差异可能与基因遗传变异有关。本研究发现,携带GCH1基因rs3783641位点野生型纯合子(AA)、突变型杂合子(AT)、突变型纯合子(TT)肺癌中晚期病人的疼痛程度依次降低,等位基因T与病人治疗前的VAS评分呈负相关,提示GCH1-rs3783641基因多态性与肺癌中晚期病人的疼痛程度密切相关。
本研究进一步发现AT型和TT型病人虽然癌痛程度不同但缓解疼痛时阿片药物日均需要量无明显差异。这与流行病学的研究相一致,即基因遗传变异在阿片药物镇痛效应的个体差异中有重要作用,疼痛程度已不是最重要的影响因素[11]。此外,为达到适当镇痛效果所需的阿片药物需要量在不同病人间存在很大差异,甚至在相似癌痛程度阶段,阿片药物需要量在不同病人间会有三倍的差异[12]。因此,AT和TT型病人阿片药物需要量无差异的原因可能有很多种,例如,不同的疼痛程度会对阿片药物需要量有影响,另外基因遗传变异也可能对阿片药物的镇痛疗效有影响。最终在多种因素的综合作用后,导致了不同癌痛程度病人出现阿片药物需要量无明显差异的现象。至于GCH1基因遗传变异在阿片药物镇痛疗效中产生何种影响还有待进一步研究。
GCH1基因多态性与疼痛的相关性研究较多,但至今结论仍有争议。Inna等人发现GCH1和COMT基因多态性的遗传变异与疝修补术后持续性疼痛有关[13];Kim等[14]研究发现GCH1基因非编码区的一个单倍型与椎间盘切除术后持续性背部疼痛的减少显著相关。Campbell等人也证实携带有GCH1基因rs3783641位点遗传变异的基因型人群对辣椒素引起的炎性痛的敏感性较低[6];Lotsch J等[15]发现GCH1-rs3783641基因遗传变异后会延长病人确诊肺癌到开始使用阿片药物阵镇痛的时间,也就是说可以推迟癌痛的发生时间。然而,等位基因频率在不同种族群体中存在着显着差异,不同种族的研究可能出现不同的结论。例如Dionne等人[16]发现GCH1-rs3783641基因多态性在欧美人群中对疼痛的敏感性是没有影响的;lazarev等人研究同样发现GCH1基因多态性对慢性胰腺炎或急性复发性
胰腺炎病人的疼痛无影响[17]。另外,考虑到疼痛类型因素,GCH1基因多态性可能影响某一个特定的疼痛类型。有研究认为GCH1基因多态性是通过改变三磷酸鸟苷环化水解酶1的活性来影响疼痛[18],GCH1基因多态性因为在调节位点表现出一个变化,导致该酶的产生或功能有一个适当的减少,而三磷酸鸟苷环化水解酶1是BH4合成的关键酶,因此BH4的产生相对下降。携带与疼痛相关位点基因遗传变异的人群体内三磷酸鸟苷环化水解酶1的活性稍低,在受到刺激后表达的升高水平也相对较低,从而导致BH4的浓度相对变化较小,多种致痛物质的合成相对下降,因此表现出对疼痛的敏感性下降。影响该酶活性的因素很多,就GCH1基因而言,多个位点的多态性均可影响,本试验只是对rs3783641位点多态性进行研究,对影响癌痛程度的解释尚不全面,进一步研究仍有待开展。
表4 不同基因型及等位基因病人的一般资料和临床特征(±SD)Table 4 General data and clinical features of the patients with different genotype and allele distribution(±SD)
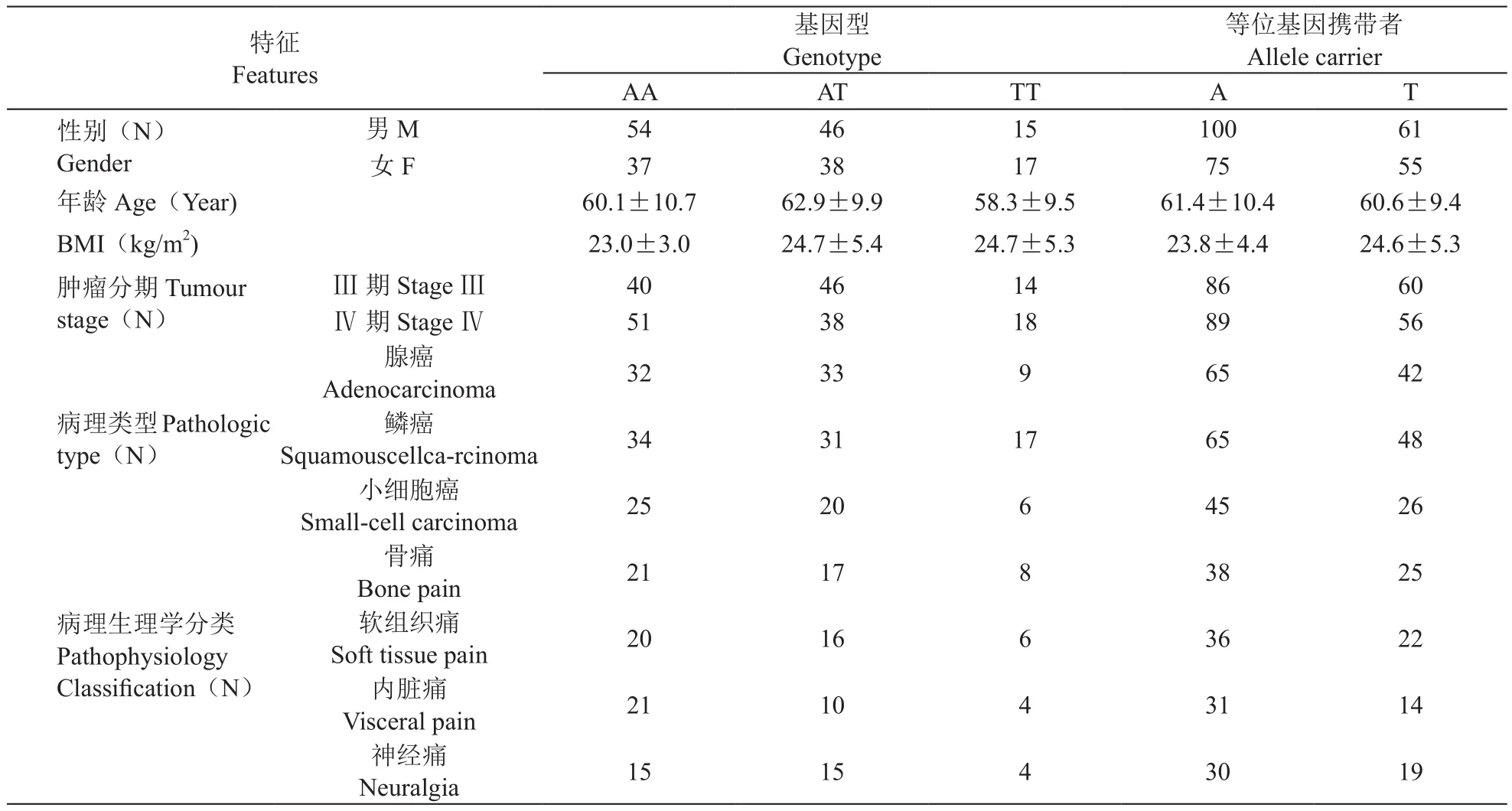
表4 不同基因型及等位基因病人的一般资料和临床特征(±SD)Table 4 General data and clinical features of the patients with different genotype and allele distribution(±SD)
等位基因携带者Allele carrier AAATTTAT性别(N)Gender特征Features基因型Genotype男M54461510061女F3738177555年龄Age(Year)60.1±10.762.9±9.958.3±9.561.4±10.460.6±9.4 BMI(kg/m2)23.0±3.024.7±5.424.7±5.323.8±4.424.6±5.3肿瘤分期Tumour stage(N)Ⅲ 期Stage Ⅲ4046148660Ⅳ 期Stage Ⅳ5138188956腺癌Adenocarcinoma323396542病理类型Pathologic type(N)鳞癌Squamouscellca-rcinoma3431176548小细胞癌Small-cell carcinoma252064526骨痛Bone pain211783825病理生理学分类Pathophysiology Classi fi cation(N)软组织痛Soft tissue pain201663622内脏痛Visceral pain211043114神经痛Neuralgia151543019
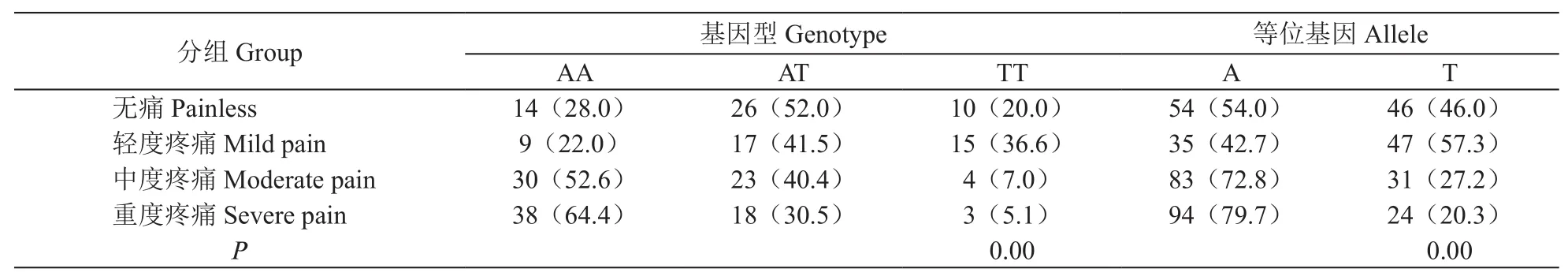
表5 不同癌痛程度病人的基因型和等位基因分布的比较[例(%)]Table 5 Comparison of the genotype and allele distribution among patients with different levels of cancer pain[N (%)]

表6 不用基因型及等位基因病人疼痛发生率、疼痛评分及阿片药物需要量的比较Table 6 Comparison of the pain score before treatment and the daily requirements of opioid among the different genotypes and incidence of pain and alleles
癌痛存在复杂遗传学机制,基因多态性对癌痛发挥着重要而复杂的作用[19]。我们这项研究虽然不能确定GCH1基因多态性在肺癌中晚期病人癌痛程度中的重要性和作用,但是结果提示GCH1基因多态性与肺癌中晚期病人癌痛程度有相关性。这为寻找癌痛基因治疗靶点的工作提供参考,为揭示癌痛病人个体差异及阿片药物用于癌痛病人的个体化治疗提供依据。
[1] Yao P, Ding YY, Wang ZB,et al. Effect of gene polymorphism of COMT and OPRM1 on the preoperative pain sensitivity in patients with cancer. IntJ Clin ExpMed, 2015, 8(6):10036.
[2] Kibaly C, Loh HH, Law PY. A Mechanistic Approach to the Development of Gene Therapy for Chronic Pain.IntRev Cell Mol Biol, 2016, 327:89.
[3] Alban L, Michael C. GCH1, BH4 and pain. Curr Pharm Biotechno, 2011, 12(10):1728 ~ 1741.
[4] Costigan M, Latremoliere A, Woolf CJ. Analgesia by inhibiting tetrahydrobiopterin-synthesis. Curr Opin Pharmacol, 2012, 12(1):92 ~ 99.
[5] 李庆伟, 梁啸, 孟纯阳. GCH1基因和神经源性疼痛以及相互作用机制方面的研究进展. 中华临床医师杂志:电子版, 2014, 8(9):104 ~ 108.
[6] Campbell CM, Edwards RR, Carmona C,et al.Polymorphisms in the GTP cyclohydrolase gene(GCH1) are associated with ratings of capsaicin pain.Pain, 2009, 141(2):114 ~ 118.
[7] 邵月娟, 王昆. 310例中重度癌痛患者临床特征分析.中国肿瘤临床, 2014, 41(15):989 ~ 992.
[8] National comprehensive cancer network clinical practice guidelines in oncology. Adult cancer pain(version 2),2011:PAIN.E.
[9] Caraceni A, Hanks G, Kaasa S,et al. Use of opioid analgesics in the treatment of cancer pain: evidencebased recommendations from the EAPC. Lancet Oncology, 2012, 13(2):58 ~ 68.
[10] Shi Q, Pedersen NL. Erratum to: Biological pathways and genetic variables involved in pain. Quality of Life Research, 2010, 19(10):1407 ~ 1417.
[11] Soto EJL, Catanesi CI. Human population genetic structure detected by pain-related mu opioid receptor gene polymorphisms. Genet Mol Biol, 2015, 38(2):152 ~155.
[12] Lotsch J, Skarke C, Liefhold J,et al. Genetic predictors of the clinical response to opioid analgesics: clinical utility and future perspectives. Clin Pharmacokinet,2004, 43(14):983 ~ 1013.
[13] Inna B, Feng D, Henrik K,et al. Association of functional variations in COMT and GCH1 genes with postherniotomy pain and related impairment. Pain,2015, 156:273 ~ 279.
[14] Kim DH, Dai F, Belfer I,et al. Polymorphic variation of the guanosine triphosphate cyclohydrolase 1 gene predicts outcome in patients undergoing surgical treatment for lumbar degenerative disc disease. Spine,2010, 35(21):1909 ~ 1914.
[15] Lotsch J, Klepstad P, Doehring A,et al. A GTP cyclohydrolase 1 genetic variant delays cancer pain.Pain, 2010, 148(1):103 ~ 106.
[16] Kim H, Dionne RA. Lack of in fl uence of GTP cyclohydrolase gene (GCH1) variations on pain sensitivity in humans. Mol Pain, 2007, 3(1):6.
[17] Lazarev M, Lamb J, Barmada MM,et al. Does the painprotective GTP cyclohydrolase haplotype signi fi cantly alter the pattern or severity of pain in humans with chronic pancreatitis? Mol Pain, 2008, 134(1):1 ~ 8.
[18] Tegeder I, Costigan M, Grif fi n R,et al. GTP cyclohydrolase and tetrahydrobiopterin regulate pain sensitivity and persistence. Nat Med, 2006, 12:1269 ~ 1277.
[19] Ahlers SJGM, Elens LL, Gulik LV,et al. The Val158-Met polymorphism of the COMT, gene is associated with increased pain sensitivity in morphine-treated patients undergoing a painful procedure after cardiac surgery. Brit J Clin Pharmaco, 2013, 75(6):1506 ~1515.
ASSOCIATION OF GCH1 GENE POLYMORPHISM AND THE DEGREE OF CANCER PAIN IN PATIENTS WITH ADVANCED LUNG CANCER*
ZHANG Lu1, ZHU Min1, ZHANG Hui1, PAN Zhi-Qiang1, SHEN Wen2△
(1Key Laboratory of Anesthesiology in Jiangsu Province,Key Laboratory of Anesthesia and Analgesia Application Technology in Jiangsu Province,Xuzhou Medical University,Xuzhou 221004, China;2Department of Pain Management,the Affiliated Hospital of Xuzhou Medical University, Xuzhou 221002,China)
Objective: To investigate the association of GCH1 gene polymorphism and the degree of cancer pain in patients with advanced lung cancer.MethodsA total of 207 patients with advanced lung cancer and 160 patients of control group were included to determine their genotypes at rs3783641 of the GCH1 gene with the gene chip technique. The visual analogue scale (VAS) was used to evaluate the pain degree of patients before treatment, and the daily requirements of opioid were recorded. The analysis of these indexes was used to investigate the association of GCH1 gene polymorphism and the degree of cancer pain in patients with advanced lung cancer.Results①There was statistical difference in genotypes and alleles distribution of patients with different degree of cancer pain (P< 0.05); ②The incidence of pain and pain score of patients with AA, AT, TT gene types decreased in turn (P< 0.05). Compared with AA, the opioid requirements of patients with AT and TT gene types decreased (P< 0.05). There was no statistical difference in the opioid requirements of patients between patients with AT and TT gene types. The incidence of pain, pain score and opioid requirements of allele T carriers was lower than allele A carriers (P< 0.05); ③The allele T was negatively correlated with the VAS score before treatment.ConclusionGCH1 gene polymorphism is associated with the degree of cancer pain in patients with advanced lung cancer.
GCH1; Cancer pain; Gene polymorphism; Lung cancer
10.3969/j.issn.1006-9852.2017.09.005
江苏省自然科学基金社会发展-面上项目(BE2015626)
△通讯作者 shenwen1598@sina.com
