PSE猪肉肌原纤维蛋白的氧化变性
2017-11-20李文采刘飞田寒友邹昊王辉张振琪李家鹏乔晓玲
李文采+刘飞+田寒友+邹昊+王辉+张振琪+李家鹏+乔晓玲

摘 要:为探讨白肌肉(pale,soft and exudative meat,PSE肉)形成时肌原纤维蛋白结构和功能的变化,以PSE猪肉为研究对象,从氧化还原体系失衡和钙激活蛋白酶活性变化两方面进行研究。结果表明:与正常肉(red,firm and non-exudative meat,RFN肉)相比,PSE肉的超氧化物歧化酶抑制率显著降低(P<0.05),谷胱甘肽过氧化物酶活性显著增加(P<0.01),钙激活蛋白酶活性显著增加(P<0.05);随着氧化还原体系失衡和钙激活蛋白酶活性的增加,PSE肉十二烷基硫酸钠-聚丙烯酰胺凝胶电泳图谱的肌间线蛋白、肌动蛋白和Ⅰ-肌钙蛋白条带变淡、变细;肌原纤维蛋白的表面疏水性显著增大(P<0.05),溶解性显著降低(P<0.01),结构和功能特性发生改变。
关键词:抗氧化酶;钙激活蛋白酶;肌原纤维蛋白氧化;PSE肉
Oxidative Denaturation of Myofibril Protein in Pale, Soft and Exudative (PSE) Pork
LI Wencai, LIU Fei, TIAN Hanyou, ZOU Hao, WANG Hui, ZHANG Zhenqi, LI Jiapeng, QIAO Xiaoling*
(Beijing Key Laboratory of Meat Processing Technology, China Meat Research Center, Beijing 100068, China)
Abstract: The objective of this study was to discuss the structural and functional changes of myofibril protein during the formation of pale, soft and exudative (PSE) pork. The focus was on the correlations of these changes with redox imbalance and changes in calpain activity. The results were showed that compared with red, firm and non-exudative (RFN) meat, the activity of superoxide dismutase (SOD) was significantly lower (P < 0.05), while the activities of glutathione peroxidase (GSH-Px) (P < 0.01) and calpain (P < 0.05) were significantly higher in PSE pork. As redox imbalance occurred and ccalpain activity increased, desmin, actin and troponin Ⅰ bands became lighter in color and thinner in the sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) pattern, the surface hydrophobicity of myofibril protein was significantly increased (P < 0.05) and solubility was decreased significantly (P < 0.01), implying the structural and functional changes of myofibril protein in PSE pork.
Key words: antioxidant enzymes; calpain; myofibril protein oxidation; pale, soft and exudative meat
DOI:10.7506/rlyj1001-8123-201710002
中圖分类号:TS251.1 文献标志码:A 文章编号:1001-8123(2017)10-0006-06
白肌肉(pale,soft and exudative meat,PSE肉)与正常肉(red,firm and non-exudative meat,RFN肉)相比,其蒸煮损失较高,感官品质特性,如硬度、弹性、黏聚性、咀嚼性和回弹力较低。PSE肉呈灰白色,表面有汁液渗出,具有持水力偏低、营养物质随水分的流失而降低等特征,严重影响肉的品质,同时也降低了肉本身能给人类带来的益处[1]。近年来随着世界范围内猪肉消费量的不断增长,肉品质缺陷带来的问题也随之严重化。Oneill等[2]发现用PSE猪肉加工制得的火腿与正常猪肉相比,其经济损失高达50%以上。
PSE猪肉的形成受品种、饲养环境、屠宰前后处理方式、运输条件及胴体加工过程中的环境条件等一系列复杂内外因素的影响[3-4],目前还不能完全杜绝PSE猪肉的产生,其产生机理是目前的研究热点。Bowker等[5]指出肌肉宰后pH值的快速下降和高温加速了糖酵解过程,糖酵解是导致PSE肉形成的主要原因之一。陈茂[6]也认为在低pH值和宰前高温条件下,肌纤维膜变性,肌原纤维和肌浆蛋白凝固收缩,肌肉保水性下降,肌肉细胞内的游离水渗出,使得肌肉色泽变淡、切面多汁等,从而导致PSE肉产生。Hammelman等[7]发现电击致晕屠宰方法不当时会加快肌肉宰后糖酵解的代谢速率,在一定程度上导致PSE肉的发生。Barbut等[8]从基因、生物化学及代谢方面指出宰前应激和宰后早期胴体环境能够引起蛋白质变性,从而导致PSE猪肉的产生。钙激活蛋白酶是一种钙离子依赖性半胱氨酸蛋白水解酶,是调节细胞病理性死亡的半胱氨酸蛋白酶家族成员之一,它的表达与细胞凋亡也具有密切关系[9]。蛋白质氧化是细胞凋亡的途径之一,蛋白质发生氧化损伤后将失去原有的生理功能。郭守立等[10]指出肌原纤维蛋白氧化变性是PSE猪肉形成的主要表现之一。目前针对机体内氧化还原体系失衡和钙激活蛋白酶活性增加导致PSE猪肉产生的机理研究鲜见报道,本研究从氧化还原体系失衡和钙激活蛋白酶活性增加的角度探讨PSE猪肉中肌原纤维蛋白的氧化变性,为降低PSE猪肉的发生率,提高宰后猪肉品质提供参考。
1 材料与方法
1.1 材料与试剂
猪背最长肌购自北京中瑞食品有限公司,生猪品种为6 月龄的杜长大三元杂交(杜洛克×长白猪×大约克夏)去势公猪,体质量(100±10) kg,运输前以自由采食、饮水饲养为主,无明显禁食、禁水时间,生猪运输时均有间隔,宰杀方式为三点式麻电击晕。
超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、
过氧化氢酶(catalase,CAT)测定试剂盒、乙二醇-双-(2-氨基乙醚)四乙酸(ethylene glycol-bis-(2-aminoethyl)tetraacetic acid,EGTA)、溴酚蓝、过硫酸铵、牛血清白蛋白、考马斯亮蓝G-250、甲叉双丙烯酰胺、三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane,Tris)、十二烷基硫酸钠(sodium dodecyl sulfate,SDS) 美国Sigma公司;甘氨酸、甘油、考马斯亮蓝R-250、丙烯酰胺 美国Amersco公司;标准蛋白Marker 北京天根生化科技有限公司;其他试剂 国药
集团化学试剂有限公司;实验所用试剂均为分析纯。
1.2 仪器与设备
SG8-ELK便携式pH计、AL104电子天平 梅特勒-托利多仪器(上海)有限公司;DZKW-4电子恒温水浴锅 北京中兴伟业仪器有限公司;Synergy H4全功能酶标仪 美国伯腾仪器有限公司;Sorvall LYNX4000高速落地离心机 美国Thermo公司;Bio-Rad凝胶成像仪
美国伯乐公司;DYCZ-24DN电泳仪 北京六一仪器厂。
1.3 方法
1.3.1 PSE肉的制备及判定
宰后0.5 h从3 头猪取背最长肌3 份,将每份猪背最长肌平均分为2 份,1 份为实验组,另1 份為对照组。PSE肉的制备参考Lesiów等[11]的方法。将实验组肌肉置于35 ℃水浴锅中7 h,然后放置于4 ℃冰箱中17 h;对照组肌肉于4 ℃冰箱中放置24 h。在2 组实验开始进行0.5 h,即宰后1 h时,使用便携式肉用pH计对背最长肌的pH值进行测定,每份肉样测3 个位点,取平均值作为该时间点的pH值。
实验进行24 h时,采用异质肉判别装置对实验组和对照组肌肉进行分级,参考刘文营等[12]的方法,采用日本肉色分级标准比色板进行比对,满足宰后1 h时pH值小于6且宰后24 h时肉色分值为1或2判定为PSE肉,宰后1 h时pH值小于6且宰后24 h时肉色分值为3或4判定为RFN肉。结合比色板比对分级和pH值判定PSE肉是否制作完成。
1.3.2 抗氧化酶活力测定
采用SOD试剂盒法和GSH-Px试剂盒法进行测定。
1.3.3 钙离子浓度和钙激活蛋白酶系活性测定
钙离子浓度测定:参照GB/T 5009.92—2003《食品中钙的测定》[13]中的滴定法。
钙激活蛋白酶系粗酶液的提取及活性测定参照杨巧能等[14]的方法。一个单位的钙激活蛋白酶系活性定义为25 ℃反应60 min,在278 nm波长处增加1.0吸光度单位催化反应所需要的酶量。
1.3.4 肌原纤维蛋白的制备
参照Wu Mangang等[15]的方法。
1.3.5 肌原纤维蛋白的结构特性测定
SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE):参照李艳青[16]的方法,并稍作修改。本研究中的凝胶由12.5%分离胶和4.5%浓缩胶组成;电泳结束后,将电泳胶片置于凝胶成像仪中,结合软件进行分析和处理。
表面疏水性测定:参照李艳青[16]的方法。将提纯的肌原纤维蛋白溶于磷酸盐缓冲液(20 mmol/L,pH 6.0)中,使蛋白质的质量浓度为5 mg/mL;取上述肌原纤维蛋白溶液1 mL,加入200 μL溴酚蓝溶液
(1 mg/mL),混匀,室温条件下搅拌10 min后离心(7 000 r/min、15 min),取上清液,在595 nm波长处测定吸光度(A)。用磷酸盐缓冲液(20 mmol/L,pH 6.0)代替肌原纤维蛋白溶液,作为空白样。以溴酚蓝为指示剂,通过测定溴酚蓝与肌原纤维蛋白表面疏水性氨基酸的结合量来表征肌原纤维蛋白表面疏水性的大小。表面疏水性按照公式(1)计算。
式中:A1为空白样上清液的吸光度;A2为样品上清液的吸光度。
1.3.6 肌原纤维蛋白溶解性测定
参照Benjakul等[17]的方法,并稍作修改。称取一定量的肌原纤维蛋白,置于50 mmol/L的NaH2PO4缓冲溶液(pH 6.0,包含0.6 mol/L NaCl)中,使其最终质量浓度达5 mg/mL;吸取8 mL上述肌原纤维蛋白溶液,置于15 mL离心管中,5 000×g、4 ℃条件下离心15 min。考马斯亮蓝法测定蛋白质浓度,肌原纤维蛋白的溶解性用溶解度表示,按照公式(2)计算。
式中:ρ1为上清液中的蛋白质质量浓度/(g/mL);ρ2为样品中的总蛋白质质量浓度/(g/mL)。
1.4 数据处理
采用Excel 2007软件对实验数据进行处理和绘图,采用SPSS 21.0软件对数据进行显著性分析。
2 结果与分析
2.1 PSE肉判定
由表1可知,宰后1 h时,实验组和对照组肌肉样品的pH值均小于6。采用异质肉判别装置对肉进行肉色分级,图1为肉色判定图片分析界面。由表2可知,实验组肌肉样品宰后24 h时的级别为1或2 级,对照组为3或4 级,结合宰后1 h时的pH值和宰后24 h时的肉色分值得出实验组和对照组肌肉样品分别为PSE肉和RFN肉。
2.2 肌原纤维蛋白的结构特性
2.2.1 SDS-PAGE分析
由图2可知,与RFN肉相比,PSE肉的肌间线蛋白、肌动蛋白和Ⅰ-肌钙蛋白条带变淡、变细,而Ⅰ-肌球蛋白重链、7-肌球蛋白重链、C-蛋白、α-辅肌动蛋白、ATPase-1、Ⅰ-肌集钙蛋白、T-肌钙蛋白、原肌球蛋白和
C-肌钙蛋白条带均无差异。张冬怡等[18]指出肌间线蛋白连接肌原纤维和Z盘以及细胞膜骨架,起到固定肌原纤维的作用,肌间线蛋白完整度越低,降解越多,汁液流失越多。Chen等[19]指出与RFN肉相比,肌间纤维蛋白有明显降解时,PSE肉的持水性也较低。王志峰[20]发现在高压作用下,牛骨骼肌G-肌动蛋白的SDS-PAGE电泳条带颜色变淡、变细,同时蛋白稳定性降低,发生降解。本研究中,PSE猪肉肌原纤维蛋白的肌间线蛋白、肌动蛋白和肌球蛋白轻链条带变淡、变细,表明肌原纤维蛋白发生变性,从而造成损失。
2.2.2 表面疏水性的变化
由图3可知,PSE肉和RFN肉肌原纤维蛋白与溴酚蓝的结合量分别为(116.06±0.64)、(111.82±0.69) μg,PSE肉显著高于RFN肉(P<0.05)。
曹姬倩蕊[21]认为与RFN猪肉相比,PSE猪肉肌原纤维蛋白的聚集程度低、具有较高的表面疏水性、结构松散。吕彤等[22]也证实肌原纤维蛋白的疏水性随着蛋白质的氧化变性而增强,与本研究结果一致。
2.2.3 肌原纤维蛋白的功能特性
SDS-PAGE和表面疏水性的实验结果已证实PSE肉形成过程中肌原纤维蛋白的结构发生了改变,而结构的改变必然引起蛋白溶解度的变化[23-24]。由图4可知,PSE肉形成过程中,其肌原纤维蛋白的溶解性显著降低
(P<0.01),PSE肉和RFN肉肌原纤维蛋白的溶解度分别为(49.20±0.81)%和(80.65±1.18)%。蛋白溶解性是反映蛋白变性程度的重要指标,PSE肉中肌原纤维蛋白溶解性的降低说明其已经发生了一定程度的变性。
Molette等[25]对宰后高温(40 ℃)所致PSE肉的研究发现,类PSE肉的肌原纤维蛋白溶解度降低了46.4%;
Joo等[26]对PSE猪肉的研究也表明,RFN肉的蛋白溶解度可达169 mg/mL,而PSE肉仅为111 mg/mL。Sosnicki等[27]研究证实宰后初期猪肉的pH值较低,胴体温度较高的条件下,粗丝与细丝间距减小,肌球蛋白发生不可逆变性,改变了其溶解性;在被氧化的过程中,肌原纤维蛋白的蛋白质大分子断裂成小片段,氧化后期纤维蛋白趋向于聚集和共价连接,溶解性降低。
2.3 引起肌原纤维蛋白变性的因素
2.3.1 体内氧化还原体系失衡
当生猪处于正常生理状态时,体内的氧化还原体系处于动态平衡状态,能有效地清除活性氧(reactive oxygen species,ROS);而当生猪发生应激反应时,体内的生化构成发生变化,再加上pH值的下降使得细胞组成发生改变,此时机体内ROS清除体系失去平衡,ROS会对蛋白质进行一定程度的攻击[28-31]。
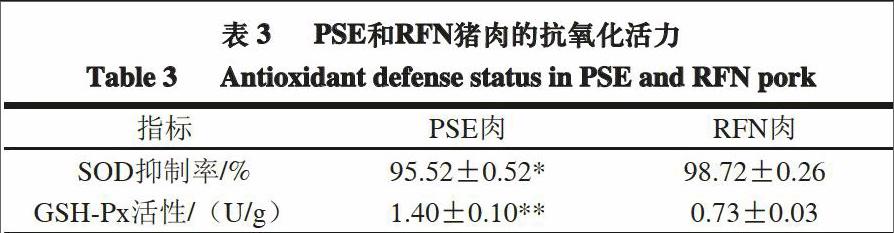
由表3可知,与RFN肉相比,PSE肉的SOD抑制率显著降低(P<0.05),抑制率越低,说明PSE肉中SOD的活性越低;PSE肉的GSH-Px活性增加极显著
(P<0.01),PSE肉和RFN肉中分别为(1.40±0.10)、(0.73±0.03) U/g,表明与正常生理条件下的RFN肉相比,PSE肉中的还原体系失去平衡。Chen Tao等[32]测定PSE猪肉中抗氧化酶的活性时发现,PSE肉中SOD和GSH-Px的活性均低于RFN肉;而Sárraga等[33]的研究结果表明,与RFN肉相比,PSE肉的GSH-Px活性较高;而肌肉的结构组织越好,GSH-Px活性就越低。一般情况下,生猪发生应激反应时产生的抗氧化酶浓度和活性较高,以作为防御性体系,但是内源性抗氧化酶在机体内的作用是相互独立的,且其酶活与肉的品种和类型有很大关系,抗氧化酶的浓度和活性也有可能会降低。有研究表明,在羟自由基模拟体系中,鱼肉肌原纤维蛋白发生显著氧化,其结构和生化指标均发生改变[34-36]。本研究中,与RFN肉相比,PSE肉的肌原纤维蛋白结构和功能发生明显改变,这可能与PSE肉中还原体系失衡有密切关联。
2.3.2 钙激活蛋白酶活性变化
当生猪处于正常生理狀态下时,肌肉中三磷酸腺苷充足,钙离子在肌质网和线粒体中以结合状态存在,肌浆中无游离钙离子存在[37]。当生猪发生应激反应时,细胞结构发生改变,肌纤维萎缩,肌质网膜和线粒体膜功能失常,发生破裂,肌浆网中的钙泵作用消失,Ca2+外泄。钙离子浓度较低时,钙激活蛋白的酶活性中心被封闭,酶无活性,随着肌浆中Ca2+浓度不断上升,酶的活性中心暴露,表现出活性[38]。
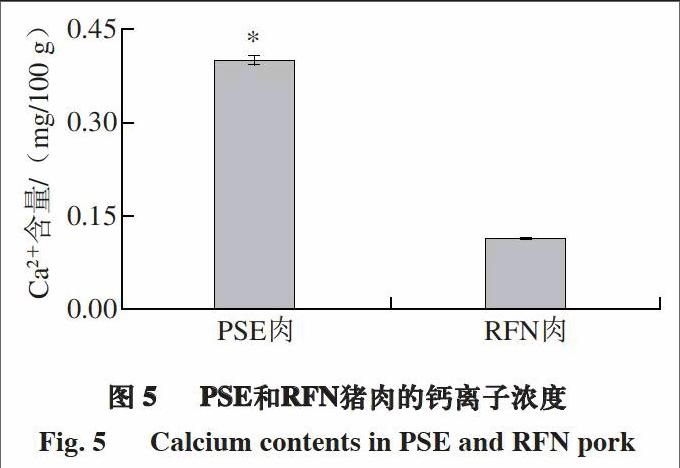
由图5可知,PSE肉和RFN肉肌浆中Ca2+含量分别为(0.40±0.008)、(0.11±0.003) mg/100 g,其中PSE肉显著高于RFN肉。Guo等[39]的研究表明,基于心肌细胞肌浆网Ca2+通道的蛋白表达水平,PSE肉与RFN肉相比具有较高的Ca2+浓度,这与本研究中PSE肉Ca2+浓度较高的结论一致。
由图6可知,与RFN肉相比,PSE肉的钙激活蛋白酶活性显著增加(P<0.05),PSE肉和RFN肉肌浆中钙激活蛋白酶系的活性分别为(0.10±0.002)和(0.04±0.002)。张冬怡等[40]发现PSE肉的钙激活酶活性较RFN肉高;Pomponio等[41]发现在高温条件下,猪通脊肉的μ-钙激活酶和m-钙激活酶的活性均被激活。机体正常机能遭到破坏,温度和早期pH值的快速下降都会造成钙激活蛋白酶系酶活性的下降[42],但是随着肌浆网破裂,Ca2+外泄,Ca2+浓度的升高又会大大激活钙激活蛋白酶系的活性。从酶活性的作用机理可知,Ca2+激活是钙激活蛋白酶系表现活力的途径之一[43]。RFN肉中钙激活蛋白酶活性较低的原因可能是肌浆中的Ca2+浓度太低,只能激活μ-钙激活酶,而难以激活m-钙激活酶[44]。张英君等[45]发现并证实钙激活蛋白酶是降解肌原纤维骨架蛋白的主要因子。本研究中PSE猪肉的Ca2+浓度较大,钙激活蛋白酶活性较高,理论上细胞发生凋亡,肌原纤维蛋白将发生氧化变性,这与本研究中测得的PSE猪肉的肌原纤维蛋白结构和功能发生明显改变相符。
3 结 论
与RFN肉相比,PSE肉的SOD活性较低,GSH-Px活性较高,还原体系失衡;Ca2+外泄,大大激活了钙激活蛋白酶的活性,钙激活蛋白酶控制着肌原纤维蛋白的降解,PSE肉SDS-PAGE图谱中肌间线蛋白、肌动蛋白和Ⅰ-肌钙蛋白条带变淡、变细,肌原纤维蛋白表面疏水性增大,蛋白溶解性降低,PSE肉的肌原纤维蛋白结构和功能特性发生改变。本研究从内源性氧化还原体系失衡和钙激活蛋白酶活性增加两方面阐述了PSE肉中肌原纤维蛋白结构和功能特性发生的变化,为PSE肉的形成机理研究提供一定的参考。
参考文献:
[1]孙皓, 徐幸莲, 王鹏. 鸡肉类PSE肉与正常肉流变、质构特性的比较[J]. 食品与发酵工业, 2013, 39(5): 194-199. DOI:10.13995/j.cnki.11-1802/ts.2013.05.044.
[2]ONEILL D J, LYNCH P B, TROY D J, et al. Effects of PSE on the quality of cooked hams[J]. Meat Science, 2003, 64(2): 113-118. DOI:10.1016/S0309-1740(02)00117-1.
[3]罗清发, 瞿轶, 谭明轩, 等. 生猪应激产生的原因及防制对策[J].
中国畜牧兽医文摘, 2014, 30(9): 115; 120.
[4]孙露霜. 猪的应激综合征及综合防控措施[J]. 中国畜牧兽医文摘, 2016, 32(10): 128.
[5]BOWKER B C, GRANT A L, FORREST J C, et al. Muscle metabolism and PSE pork[J]. American Society of Animal Science, 2000, 79(1): 1-8.
[6]陈茂. PSE肉与DFD肉的感官鉴别、发生机理及处理[J]. 检验检疫, 2004(7): 12.
[7]HAMMELMAN J E, BOWKER B C, GRANT A L, et al. Early postmortem electrical stimulation simulates PSE pork development[J]. Meat Science, 2003, 63(1): 69-77. DOI:10.1016/S0309-1740(02)00057-8.
[8] BARBUT S, SOSNICKI A A, LONERGAN S M, et al. Progress in reducing the pale, soft and exudative (PSE) problem in pork and poultry meat[J]. Meat Science, 2008, 79(1): 46-63. DOI:10.1016/j.meatsci.2007.07.031.
[9]张瑜, 常明, 韩威, 等. 钙激活蛋白酶与蛋白酶体抑制剂诱导细胞凋亡的机制[J]. 中国老年学杂志, 2008, 28(1): 26-28.
[10]郭守立, 魏健, 郭晓峰, 等. 猪宰后不同部位PSE肉与正常肉蛋白质变化的比较[J]. 畜牧与兽医, 2017, 49(2): 28-34.
[11]LESI?W T, XIONG Y L. A simple, reliable and reproductive method to obtain experimental pale, soft and exudative (PSE) pork[J]. Meat Science, 2013, 93: 489-494. DOI:10.1016/j.meatsci.2012.11.022.
[12]刘文营, 田寒友, 邹昊, 等. 异质冷却猪肉快速判别装置的设计及验证[J]. 食品科学, 2015, 36(2): 184-187. DOI:10.7506/spkx1002-6630-201502035.
[13]中國预防医学科学院营养与食品卫生研究所. GB/T 5009.92—2003 食品中钙的测定[S]. 北京: 中国标准出版社, 2003.
[14]杨巧能, 梁琪, 文鹏程, 等. 不同年龄牦牛宰后钙激活酶活性及其嫩度指标变化[J]. 食品科学, 2016, 37(1): 45-49. DOI:10.7506/spkx1002-6630-201601009.
[15]WU Mangang, XIONG YoulingL., CHEN Jie. Rheology and microstructure of myofibrillar protein-plant lipid composite gels: effect of emulsion droplet size and membrane type[J]. Journal of Food Engineering, 2011, 106(4): 318-324. DOI:10.1016/j.jfoodeng.2011.05.022.
[16]李艳青. 蛋白质氧化对鲤鱼蛋白结构和功能性的影响及其控制技术[D]. 哈尔滨: 东北农业大学, 2013: 22.
[17]BENJAKUL S, BAUER F. Physicochemical and enzymatic changes of cod muscle proteins subjected to different freeze-thaw cycles[J]. Journal of the Science of Food and Agriculture, 2000, 80(8): 1143-1150.
DOI:10.1002/1097-0010(200006)80.
[18]张冬怡, 陈韬, 吴霞, 等. 猪宰后正常肉与PSE肉中肌间线蛋白和钙激活酶的变化与持水性的关系[J]. 食品科技, 2015, 40(6): 130-135. DOI:10.13684/j.spkj.2015.06.032.
[19]CHEN L, LI C Y, ULLAH N, et al. Different physicochemical, structural and digestibility characteristics of myofibrillar protein from PSE and normal pork before and after oxidation[J]. Meat Science, 2016, 121: 228-237. DOI:10.1016/j.meatsci.2016.06.010.
[20]王志峰. 超高压处理对牛骨骼肌G-肌动蛋白结构的影响[D]. 呼和浩特: 内蒙古农业大学, 2009: 19-21.
[21]曹姬倩蕊. 氧化前后PSE猪肉肌原纤维蛋白中特性的研究[D]. 杨凌: 西北农林科技大学, 2016: 16-20.
[22]吕彤, 林俊杰, 周昌瑜, 等. 热处理强度对猪肉肌球蛋白结构及风味成分吸附特性的影响[J]. 农业工程学报, 2016, 32(8): 285-291. DOI:10.11975/j.issn.1002-6819.2016.08.040.
[23]CARVALHO R H, IDA E I, MADRUGA M S, et al. Underlying connections between the redox system imbalance, protein oxidation and impaired quality traits in pale, soft and exudative (PSE) poultry meat[J]. Food Chemistry, 2017, 215(15): 129-137. DOI:10.1016/j.foodchem.2016.07.18.
[24]闫利国, 唐善虎, 王柳, 等. 冷冻贮藏过程中氧化诱导牦牛肉肌原纤维蛋白结构的变化[J]. 食品科学, 2015, 36(24): 337-342. DOI:10.7506/spkx1002-6630-201524062.
[25]MOLETTE C, R?MIGNON H, BABIL? R. Maintaining muscles at a high post-mortem temperature induces PSE-like meat in turkey[J]. Meat Science, 2003, 63(4): 525-532. DOI:10.1016/S0309-1740(02)00114-6.
[26]JOO S T, KAUFFMAN R G, KIM B C, et al. The relationship of sarcoplasmic and myofi brillar protein solubility to colour and
water-holding capacity in porcine Longissimus muscle[J]. Meat Science, 1999, 52(3): 291-297. DOI:10.1016/S0309-1740(99)00005-4.
[27]SOSNICKI A A, GREASER M L, PIETRZAK M, et al. PSE-like syndrome in breast muscle of domestic turkeys: a review[J]. Journal of Muscle Foods, 1998, 9(1): 13-23. DOI:10.1111/j.1745-4573.1998.tb00640.x.
[28]EST?VEZ M. Oxidative damage to poultry: from farm to fork[J]. Poultry Science, 2015, 94(6): 1368-1378. DOI:10.3382/ps/pev094.
[29]王詠梅. 谷胱甘肽过氧化物酶及其合成机制[J]. 生物物理学报, 2013, 29(10): 724-734. DOI:10.3724/SP.J.1260.2013.30119.
[30]徐靖. 超氧化物歧化酶及其应用的研究进展[J]. 食品工业科技, 2013, 34(12): 387-391.
[31]张伟, 秦秀军, 许超琪, 等. γ射线照后不同时间点人肝细胞基因差异表达谱的研究[J]. 癌变·畸变·突变, 2011, 23(6): 416-420. DOI:10.3969/j.issn.1004-616x.2011.06.003.
[32]CHEN Tao, ZHOU Guanghong, XU Xinglian, et al. Phospholipase A2 and antioxidant enzyme activities in normal and PSE pork[J]. Meat Science, 2010, 84: 143-146. DOI:10.1016/j.meatsci.2009.08.039.
[33]S?RRAGA C, CARRERAS I, REGUEIRO J A. Influence of meat quality and NaCl percentage on glutathione peroxidase activity and values for acid-reactive substances of raw and dry-cured Longissimus dorsi[J]. Meat Science, 2002, 62(4): 503-507. DOI:10.1016/S0309-1740(02)00039-6.
[34]陈霞霞, 杨文鸽, 吕梁玉, 等. 羟自由基氧化体系对银鲳肌原纤维蛋白生化特性及其构象单元的影响[J]. 食品科学, 2016, 37(23): 123-128.
DOI:10.7506/spkx1002-6630-201623021.
[35]岳开华, 张业辉, 黄永春, 等. 羟自由基氧化对海鲈鱼肌原纤维蛋白生化特性及其乳化性能的影响[J]. 现代食品科技, 2016, 32(10): 143-150; 197. DOI:10.13982/j.mfst.1673-9078.2016.10.023.
[36]李学鹏, 周凯, 王金厢, 等. 羟自由基对六线鱼肌原纤维蛋白的氧化规律[J]. 中国食品学报, 2014, 14(6): 19-27.
[37]K?CHENMEISTER U, KUHN G, ENDER K. Preslaughter handling of pigs and the effect on heart rate, meat quality, including tenderness, and sarcoplasmic reticulum Ca2+ transport[J]. Meat Science, 2005, 71(4): 690-695. DOI:10.1016/j.meatsci.2005.05.020.
[38]马俪珍, 王永辉, 范三红. 猪宰后肌肉中钙激活蛋白酶活性变化的研究[J]. 农业工程学报, 2007, 23(2): 239-243.
[39]GUO B, ZHANG W G, TUME R K, et al. Disorder of endoplasmic reticulum calcium channel components is associated with the increased apoptotic potential in pale, soft, exudative pork[J]. Meat Science, 2016, 115: 34-40. DOI:10.1016/j.meatsci.2016.01.003.
[40]張冬怡, 陈韬, 吴霞, 等. 猪宰后正常肉与PSE肉中肌间线蛋白和钙激活酶的变化与持水性的关系[J]. 食品科技, 2015, 40(6): 130-135. DOI:10.13684/j.spkj.2015.06.032.
[41]POMPONIO L, ERTBJERG P, KARLSSON A H, et al. In?uence of early pH decline on calpain activity in porcine muscle[J]. Meat Science, 2010, 85(1): 110-114. DOI:10.1016/j.meatsci.2009.12.013.
[42]LIU J, RUUSUMEN M, PUOLANNE E, et al. Effect of pre-rigor
temperature incubation on sarcoplasmic protein solubility, calpain activity and meat properties in porcine muscle[J]. LWT-Food Science and Technology, 2014, 55(2): 483-489. DOI:10.1016/j.lwt.2013.10.001.
[43]TYKERG A, WOODSL F J. 酶在食品加工中的应用[M]. 北京: 中国轻工业出版社, 2002: 115-116.
[44]黄明, 赵莲, 徐幸莲, 等. 钙离子和钙激活酶外源抑制剂对牛肉钙激活酶活性和超微结构的影响[J]. 南京农业大学学报, 2004, 27(4): 101-104.
[45]张英君, 陈有亮. 钙激活蛋白酶在肉成熟中的作用机理[J]. 肉类工业, 2000(8): 31-36.
