鸡血发酵工艺条件的优化
2017-11-20梁肖娜叶馨阳韩宏娇吴尚吴尚仪康世墨陶冬冰岳喜庆
梁肖娜+叶馨阳+韩宏娇+吴尚+吴尚仪+康世墨+陶冬冰+岳喜庆


摘 要:以鸡血为原料,利用从发酵鸡血中筛选出的优势菌株苏云金芽孢杆菌(Bacillus thuringiensis)、希瓦氏菌(Shewanella sp.)、青霉菌属(Penicillium citreonigrum)和塔宾曲霉(Aspergillus tubingensis)发酵鸡血液体肥料,以游离氨基酸态氮含量为评价指标,采用单因素试验和响应面优化试验确定鸡血发酵的最佳工艺条件。结果表明:根据所建立模型得到发酵鸡血的最佳工艺条件为摇床转速160 r/min、接种量10%、培养温度32 ℃、培养时间5 d,在此条件下发酵鸡血中的游离氨基酸态氮含量最高。
关键词:鸡血;发酵工艺;响应面优化;游离氨基酸态氮
Optimization of Fermentation Conditions of Chicken Blood
LIANG Xiaona, YE Xinyang, HAN Hongjiao, WU Shang, WU Shangyi, KANG Shimo, TAO Dongbing, YUE Xiqing*
(College of Food Science, Shenyang Agricultural University, Shenyang 110866, China)
Abstract: The fermentation of chicken blood by Bacillus thuringiensis, Shewanella sp., Penicillium citreonigrum and Aspergillus tubingensis, the dominant bacteria isolated from spontaneous fermentation of chicken blood, for producing liquid fertilizer was optimized using one-factor-at-a-time method and response surface methodology. Free amino acid nitrogen concentration was used as response variable. The optimal conditions obtained from the model developed in this study were as follows: shaking speed 160 r/min, inoculum amount 10%, culture temperature 32 ℃, and culture time 5 d. Under these conditions, the highest free amino acid nitrogen concentration was obtained.
Key words: chicken blood; fermentation process; response surface optimization; free amino acid nitrogen
DOI:10.7506/rlyj1001-8123-201710005
中圖分类号:TS201.1 文献标志码:A 文章编号:1001-8123(2017)10-0025-06
动物血液是肉类屠宰加工过程中的主要副产物之一,鸡血约占机体质量的5%~10%,我国鸡血资源丰富,但是大部分被浪费,只有极少部分被开发和利用。王文婷等[1]的研究表明,鸡血中富含蛋白质、氨基酸、氮、磷、钾等生物活性物质,利用现代微生物技术可以将鸡血中的大分子物质降解为小分子,提高鸡血的活性,同时也可以较好地将畜禽屠宰场废弃的动物血液发酵制成营养丰富、成本较低的发酵食品、动物饲料和液体肥料等多种产品;此外,还可以从鸡血中提取生物活性多肽等物质。
近年来,随着人们生活水平的提高,肉制品的需求量日益增加,动物血液资源也随之逐渐增多,但是我国对于动物血液资源,尤其是对鸡血资源的研究很少,将鸡血加工成食品、饲料和肥料等方面的研究更是少之又少。本研究以鸡肉副产物中的鸡血为原料,利用优势菌株发酵鸡血,制成液体肥料,采用单因素试验和响应面优化试验法确定适合发酵的最佳条件[2],并对鸡血液体肥料的肥效进行研究。该研究不仅有利于资源的综合开发和利用,同时也将在一定程度上为畜禽产品的开发和利用提供参考。
1 材料与方法
1.1 材料与试剂
新鲜鸡血(采集鸡血的玻璃容器经灭菌消毒后,将鸡肉屠宰场的新鲜鸡血在无菌状态下装入玻璃容器内,期间不加入任何抗凝剂等试剂) 沈阳市伟峰肉鸡加工厂。
苏云金芽孢杆菌(Bacillus thuringiensis)、希瓦氏菌(Shewanella sp.)、青霉菌属(Penicillium citreonigrum)、塔宾曲霉(Aspergillus tubingensis) 沈阳农业大学实验室分离筛选。
牛肉膏、蛋白胨、琼脂、氯化钠、硫酸铵、甲醛、乙酰丙酮、乙酸(均为分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
LDZX-50 KBS立式压力蒸汽灭菌锅 郑州南北仪器设备有限公司;HZQ-F160全温振荡培养箱 太仓市豪成实验仪器制造有限公司;722G可见分光光度计 上海精密科学仪器有限公司;TDL-SA离心机 上海菲恰尔分析仪器有限公司;BL-500电子天平 上海亚津电子科技有限公司。
1.3 方法
1.3.1 游离氨基酸态氮含量的测定
标准曲线的绘制:称取0.472 0 g硫酸铵于100 mL容量瓶中,加蒸馏水溶解并定容,充分振荡混匀后置于4 ℃冰箱中备用,该溶液含氮量为1.0 mg/mL。移取10 mL上述溶液并定容至100 mL,则该溶液含氮量为
100 μg/mL。准确吸取0、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0 mL上述氮质量浓度为100 μg/mL的溶液,分别置于10 mL具塞比色管中,分别加入4 mL乙酸铵缓冲溶液(将40 mL乙酸和60 mL 1 mol/L乙酸钠混合后定容至100 mL,pH 6.0)和4 mL显色剂(将7.8 mL乙酰丙酮和15 mL 37%甲醛混合后定容至100 mL,振荡后放置12 h),用蒸馏水定容至10 mL;混匀后剧烈振荡1 min,100 ℃水浴加热15 min,取出后冷却至室温。零管作为空白对照,测定各比色管中的溶液在400 nm波长处的吸光度,以硫酸铵质量浓度为横坐标,对应的吸光度为纵坐标,绘制标准曲线[3]。
样品测定:吸取待测样品1 mL,定容至1 000 mL,充分振荡、混匀备用。吸取上述样品稀释液1 mL,置于10 mL具塞比色管中,分别加入4 mL乙酸铵缓冲溶液和4 mL显色剂,用蒸馏水定容至10 mL,混匀后剧烈振荡1 min,100 ℃水浴加热15 min,取出后冷却至室温,在400 nm波长处测定其吸光度。
1.3.2 种子液的制备
用与各菌株相适应的液体培养基对其进行活化,并在适宜的温度和培养时间条件下进行活化培养;活化后将各菌株接入装有50 mL相应液体培养基的三角瓶中,在160 r/min的条件下摇床培养至对数生长期,并且反复采用离心机进行离心和无菌水重悬3 次以上,最后采用菌落计数法将菌液浓度调整到108 CFU/mL。
1.3.3 单因素试验[4-8]
吸取2.5 mL新鲜鸡血于250 mL锥形瓶中,加入22.5 mL蒸馏水,用封口膜密封,于121 ℃条件下灭菌20 min(液态鸡血),在无菌条件下将4 株优势菌的种子液按照接种量为5%和接种比例为1∶1∶1∶1(V/V)接种到灭菌的鸡血中,自然pH值条件下均匀混合,摇床培养,28 ℃条件下恒温发酵5 d,测定发酵鸡血中游离氨基酸态氮的含量。
其中选择摇床转速分别为80、120、160、200、240 r/min,研究摇床转速对发酵鸡血中游离氨基酸态氮含量的影响;选择摇床转速为160 r/min,接种量分别为1%、5%、10%、15%和20%,研究接种量对发酵鸡血中游离氨基酸态氮含量的影响;选择接种量为5%、摇床转速为160 r/min,摇床培养温度分别为26、28、30、32、34 ℃,研究培养温度对发酵鸡血中游离氨基酸态氮含量的影响;选择接种量为5%、摇床转速为160 r/min、培养温度为28 ℃,培养时间分别为2、3、4、5、6 d,研究培养时间对发酵鸡血中游离氨基酸态氮含量的影响。
1.3.4 响应面优化试验
選取对发酵鸡血中游离氨基酸态氮含量影响最大的摇床转速、接种量、培养温度和培养时间4 个试验因素,根据Box-Behnken设计原理,以游离氨基酸态氮含量为响应值,利用Design Expert 8.0.6软件设计四因素三水平的响应面优化试验。
1.3.5 验证实验
根据响应面优化法得到发酵鸡血的最佳工艺条件后,在最佳工艺条件下进行3 次重复实验,验证响应面优化法确定的实验参数是否准确可靠。
1.4 数据处理
实验均平行测定3 次,结果以平均值±标准差表示,采用Excel、Design Expert 8.0.6软件对实验数据进行分析。
2 结果与分析
2.1 游离氨基酸态氮的标准曲线
游离氨基酸态氮测定的回归方程为y=0.007 3x+
0.006 2(R2=0.998 5),游离氨基酸态氮含量在0~100 μg/mL范围内的线性关系良好。
2.2 单因素试验结果
2.2.1 摇床转速的确定
由图1可知,摇床转速为80 r/min时样品的游离氨基酸态氮含量较低,随着转速增加,游离氨基酸态氮含量逐渐升高,当转速达160 r/min时,其值达到最大,约为46.86 μg/mL;随着转速的继续增加,游离氨基酸态氮含量逐渐降低并趋于平缓。这可能是由于随着摇床转速逐渐增加,发酵液的流体速率增大,溶解氧的速率也相应增加,这对于微生物生长和其产物的转化有利[8];但是当摇床转速继续增加时,发酵液中的溶解氧浓度达到上限,转速的增加不会加大溶解氧的浓度,产物转化也达到平衡。因此确定160 r/min为最适摇床转速。
2.2.2 接种量的确定
由图2可知,接种量在1%~5%之间时,样品中游离氨基酸态氮的含量随着接种量的增大迅速增加,接种量为5%时,游离氨基酸态氮含量达最大值,约为43 μg/mL;随着接种量的进一步增大,游离氨基酸态氮含量开始逐渐减少,并趋于平稳,几乎达到恒定值。这可能是由于微生物的繁殖和生长速率与接种量有关,接种量较大时可以缩短鸡血发酵的时间,但是随着微生物的生长,菌体生长繁殖较快,菌种的含量增加,其发酵产物增多,菌体生长繁殖所需的各种养分供给不足,导致菌种之间的竞争乃至营养的缺乏,所游离出来的氨基酸又会被菌体再次利用[9-12],因此随着接种量的增大游离氨基酸态氮含量反而降低。最终确定5%为最适接种量。
2.2.3 培养温度的确定
由图3可知,培养温度为30 ℃时有利于发酵鸡血产生游离氨基酸态氮,其含量达到最大,约为39.71 μg/mL。这可能是由于温度过低时鸡血中微生物菌种的生长代谢过于缓慢,酶活力受到影响,导致产生的游离氨基酸态氮的含量较低;但是当温度升高时也会阻碍微生物的正常生长繁殖[13-19],因此确定30 ℃为最适发酵温度。
2.2.4 培养时间的确定
由图4可知,培养时间为2~4 d时,随着培养时间的延长,游离氨基酸态氮的含量呈上升趋势,发酵第4天时达最大值,约为49.56 μg/mL,随后缓慢下降并趋于平缓。这可能是由于在较短时间内,鸡血发酵不完全,发酵过程中产生的酶类不能够充分分解蛋白质而产生氨基酸,在长时间的发酵过程中,发酵成熟的酶会将氨基酸降解为生物胺类物质,导致游离氨基酸态氮的含量降低[20-22],因此确定4 d为最适培养时间。
2.3 响应面法优化试验结果
2.3.1 试验结果及方差分析
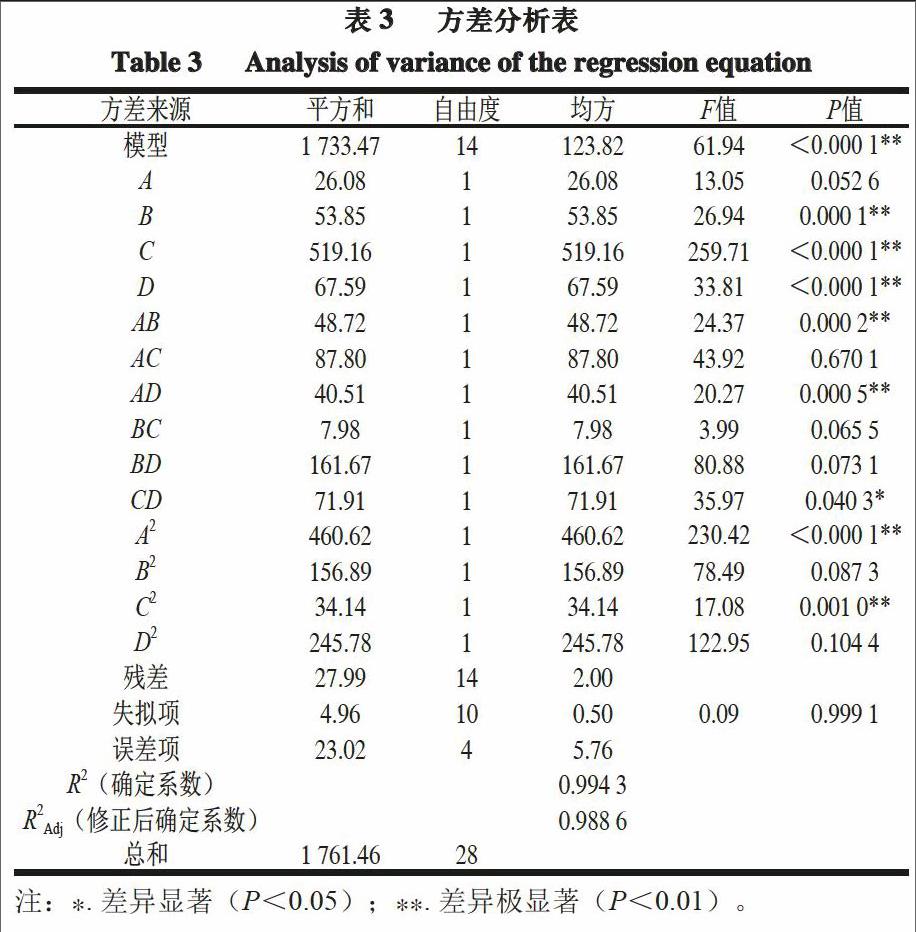
利用Design Expert 8.0.6软件对表2的响应值进行二次多项回归拟合分析,预测模型值为游离氨基酸态氮含量,回归方程为Y=33.53+1.47A+2.12B+6.85C-2.37D-3.49AB+4.68AC+3.18AD+1.41BC-6.63BD-4.24CD+8.43A2-4.92B2+2.28C2-6.16D2。
由表3可知,模型为极显著(P<0.000 1),说明自变量之间的线性关系显著,修正后的确定系数R2Adj=0.988 6,说明该模型可以解释98.86%的变化,拟合程度良好;其中失拟项P>0.25,影响不显著,说明非实验因素对实验结果的影响不大。综上所述,模型的可信度较高,可以用于拟合设计发酵工艺的效果和分析。对于因素B、C、D,P<0.01说明接种量、培养温度和培养时间对游离氨基酸态氮含量的影响极显著;对于AB、AD、A2和C2,P<0.01说明摇床转速和培养温度具有极显著的二次效应;影响游离氨基酸态氮含量的因素从大到小依次为培养温度>培养时间>接种量>摇床转速,即培养温度对游离氨基酸态氮含量的影响最为显著。
2.3.2 响应面交互作用分析
由图5~10可知,摇床转速和接种量曲面的变化幅度较为明显,说明摇床转速和接种量对游离氨基酸态氮含量的影响较为显著,与二次回归拟合方差的分析结果一致,同时响应面的最高点也是等高线中最小图形的中心点;摇床转速和培养温度的曲面变化幅度不大,交互作用不明显,与二次回归拟合方差的分析结果一致;摇床转速和培养时间的等高线相交条数较为密集,说明二者的交互作用非常显著,对游离氨基酸态氮含量的影响较大,当转速达160 r/min时,游离氨基酸态氮含量随着培养时间的增加而显著增加;接种量曲面的变化幅度不大,培养时间曲面的变化幅度较大,说明培养时间对游离氨基酸态氮含量的影响显著;当温度达到30 ℃时,游离氨基酸态氮含量随着接种量的增大而增加,当接种量增大到一定程度时,游离氨基酸态氮含量又开始降低;温度保持在30 ℃时,游离氨基酸态氮的含量随着培养时间的延长而增加,随后又开始逐渐降低;培养时间达4 d时,游离氨基酸态氮含量达到最大值。
2.4 验证实验结果
根据Box-Benhnken响应面优化试验和二次回归方程分析结果,得出最佳发酵条件为摇床转速158.81 r/min、
接种量10.00%、培养温度32.00 ℃、培养时间5 d,在此最优条件下测得的样品中游离氨基酸态氮含量为43.25 μg/mL。
为了验证回归模型的有效性和可靠性,并且考虑到实际操作,将最佳工艺条件确定为转速160 r/min、
接种量10%、培养温度32 ℃、培养时间5 d。在此最优条件下重复测定3 次,最终得到样品中的平均游离氨基酸态氮含量约为42.89 μg/mL,与预测的理论值接近,说明优化得到的发酵鸡血工艺条件具有可靠性。
3 结 论
本研究以鸡血为原料,利用优势菌株苏云金芽孢杆菌(Bacillus thuringiensis)、希瓦氏菌(Shewanella sp.)、
青霉菌属(Penicillium citreonigrum)和塔宾曲霉(Aspergillus tubingensis)进行鸡血的发酵工艺研究,以发酵产物中游离氨基酸态氮含量为指标,对发酵工艺中的摇床转速、接种量、培养温度和培养时间进行单因素试验,并在此基础上进行响应面优化试验,最终得到最佳发酵工艺条件为转速160 r/min、接种量10%、培养温度32 ℃、培养时间5 d,此时样品的游离氨基酸态氮含量约为42.89 μg/mL。本研究建立的数学模型可靠、合理,不仅可以有效提高工作效率和减少工作的盲目性,而且能为鸡血发酵工艺条件的研究、动物副产品的开发和
利用[23-25]提供一定的参考。
参考文献:
[1]王文婷, 侯成立, 宋璇, 等. 动物血浆蛋白水解物功能及应用研究进展[J]. 食品科学, 2017, 38(7): 309-314. DOI:10.7506/spkx1002-6630-201707049.
[2]张安宁, 刘连成. 响应面法优化香菇液体发酵条件[J]. 江苏农业科学, 2014, 42(3): 200-203.
[3]宋敏, 罗红宇, 刘为, 等. 下脚料制备生物菌肥的工艺优化及养分测定[J]. 环境工程学报, 2016, 10(5): 2647-2654. DOI:10.12030/j.cjee.201412173.
[4]秦鵬, 王龙, 路等学, 等. 响应面法优化蛹虫草菌液体发酵条件[J]. 北方园艺, 2016(8): 138-141. DOI:10.11937/bfyy.201608038.
[5]陈文强, 乔艳明. 响应面法在香菇液体种生产工艺优化中的应用[J]. 食品工业科技, 2015, 36(18): 290-294; 319.
[6]胡升, 梅乐和, 姚善泾. 响应面法优化纳豆激酶液体发酵[J]. 食品与发酵工业, 2003(1): 13-17. DOI:10.3321/j.issn:0253-990X.2003.01.004.
[7]CHATTERJEE A K, GHOSH B B. Effect of riboflavin deficiency on free amino acid nitrogen concentrations of liver, muscle and plasma[J]. Experientia, 1968, 24: 786-787.
[8]王文秀, 于佳, 李钐, 等. 不同条件对纳豆菌发酵蛤蜊产物中游离氨基酸态氮含量及纳豆激酶活性的影响[J]. 食品科学, 2015, 36(9): 113-116. DOI:10.7506/spkx1002-6630-201509021.
[9]魏玉西, 殷邦忠, 刘淇, 等. 扇贝裙边氨基酸营养粉的制备工艺研究[J]. 渔业科学进展, 2009, 30(3): 112-116. DOI:10.3969/j.issn.1000-7075.2009.03.019.
[10]曾王旻. 草鱼水解氨基酸液的研制[J]. 食品工业科技, 2005(7): 128-130.
DOI:10.3969/j.issn.1002-0306.2005.07.049.
[11]BUTTS C A, MOUGHAN P J, SMITH W C. Protein nitrogen, peptide nitrogen and free amino acid nitrogen in endogenous digesta nitrogen at the terminal ileum of the rat[J]. Journal of the Science of Food and Agriculture, 2010, 59: 291-298.
[12]DHAR A, GHOSAL B, BANERJEE P K. Changes in free amino acid nitrogen concentration and transaminases in lead treated rats[J]. International Journal for Vitamin and Nutrition Research, 1980, 50: 416-421.
[13]KUMAR G V, AGARWAL S, ASIF M, et al. Application of response surface methodology to optimize the adsorption performance of a magnetic graphene oxide nanocomposite adsorbent for removal of methadone from the environment[J]. Journal of Colloid and Interface Science, 2017, 497: 193-200. DOI:10.1016/j.jcis.2017.03.006.
[14]SILK D B, FAIRCLOUGH P D, CLARK M L, et al. Use of a peptide rather than free amino acid nitrogen source in chemically defined “elemental” diets[J]. Journal of Parenteral and Enteral Nutrition, 1980, 4(6): 548-553. DOI:10.1177/0148607180004006548.
[15]COURI D, ABDELRAHMAN M S. Effect of chlorine dioxide and metabolites on glutathione dependent system in rat, mouse and chicken blood[J]. Journal of Environment Pathology, Toxicology and Oncology, 1979, 3(1/2): 451-460.
[16]杨葆春, 靳义超, 李全, 等. 动物血液资源的开发利用研究进展[J]. 青海畜牧兽医杂志, 2011, 41(5): 44-46. DOI:10.3969/j.issn.1003-7950.2011.05.030.
[17]GREENBERG J A, DIMENNA M, HANELT B, et al. Analysis of post-blood meal flight distances in mosquitoes utilizing zoo animal blood meals[J]. Journal of Vector Ecology, 2012, 37: 83-89.
[18]VUDATHALA D, CUMMINGS M, MURPHY L. Analysis of multiple anticoagulant rodenticides in animal blood and liver tissue using principles of QuEChERS method[J]. Journal of Analytical Toxicology, 2010, 34: 273-279.
[19]MISSOTTEN J A M, GORIS J, MICHIELS J, et al. Screening of isolated lactic acid bacteria as potential beneficial strains for fermented liquid pig feed production[J]. Animal Feed Science and Technology, 2009, 150: 122-138.
[20]陈畑, 彭婷婷, 王尧, 等. 响应面法优化从丝状真菌中制取壳聚糖的研究[J]. 广州化工, 2014, 42(20): 80-82. DOI:10.3969/j.issn.1001-9677.2014.20.027.
[21]竹文坤, 牟涛, 段涛, 等. 响应面法优化微生物诱导碳酸钙沉积培养基[J]. 化工进展, 2014, 33(6): 1533-1538. DOI:10.3969/j.issn.1000-6613.2014.06.029.
[22]LI Q, FU C. Application of response surface methodology for extraction optimization of germinant pumpkin seeds protein[J]. Food Chemistry, 2005, 92: 701-706.
[23]SANTANNA M R V, ALEXANDR N, BRUCE A, et al. Chicken blood provides a suitable meal for the sand fly Lutzomyia longipalpis and does not inhibit Leishmania development in the gut[J]. Parasites and Vectors, 2010, 3(1): 1-11. DOI:10.1186/1756-3305-3-3.
[24]劉仲敏, 何伯安, 曹友声, 等. 猪、牛血固态发酵生产蛋白质饲料的研究[J]. 微生物学通报, 1995(6): 351-354.
[25]鲁云风, 杨柯金, 梁子安, 等. 响应面分析法优化菌株B10发酵牛血条件的研究[J]. 饲料广角, 2010(21): 29-31; 40. DOI:10.3969/j.issn.1002-8358.2010.21.009.
