溃疡性结肠炎患者β-内啡肽表达与免疫功能变化的相关性
2017-11-20赵东强刘学臣
刘 琳,刘 丽,张 蕊,赵东强,刘学臣,张 迪
(1.河北医科大学第二医院 消化内科,河北 石家庄 050000;2.邯郸市中心医院 消化内科,河北 邯郸 056000)
·论著·
溃疡性结肠炎患者β-内啡肽表达与免疫功能变化的相关性
刘 琳1,2,刘 丽1,张 蕊1,赵东强1,刘学臣1,张 迪1
(1.河北医科大学第二医院 消化内科,河北 石家庄 050000;2.邯郸市中心医院 消化内科,河北 邯郸 056000)
目的探讨β-内啡肽(β-EP)对溃疡性结肠炎(UC)患者免疫机制的调节作用。方法UC患者30例,轻度活动期8例,中度活动期10例,重度活动期12例。同期结肠息肉患者15例为对照组。采用放射免疫法检测血液中β-EP、白细胞介素1β(IL-1β)的表达水平,同时应用免疫组织化学染色方法检测结肠黏膜组织中β-EP 、IL-1β的表达水平;采用流式细胞术对血浆中的T细胞亚群 (CD3+、CD4+、CD4+/CD8+)表达进行检测。结果病例组血液中β-EP、IL-1β、CD4+、CD4+/CD8+各项指标的表达水平均明显高于对照组(P<0.05);且随病情严重程度不同,其表达水平也有差异,依次为:轻度活动组<中度活动组<重度活动组(P<0.05)。血浆中β-EP分别在活动期和缓解期的变化与IL-1β、CD4+、CD4+/CD8+的变化呈正相关(r=0.522,P<0.01;r=0.532,P<0.05;r=0.964,P<0.01)。结论β-EP通过调节T细胞亚群及IL-1β的分泌参与了UC免疫机制的调节,在一定程度上可以反映UC患者病情的严重程度。
结肠炎, 溃疡性;β内啡肽;白细胞介素1β;T淋巴细胞亚群;免疫调节
溃疡性结肠炎(ulcerative colitis, UC)是一种病因尚不十分明确的慢性非特异性炎症性肠道疾病,其特点是病情常反复发作,难以治愈,且有一定的恶变率。其病因学的研究一直是热点和难点[1],包括氧化应激[2]、肠道菌群失调[3-4]、细胞凋亡、遗传、免疫、饮食等方面。目前大部分研究表明免疫调节紊乱是UC发病的中心环节,T细胞亚群及细胞因子失调在UC发病中起着重要的作用。
β-内啡肽(β-endorphin, β-EP)是人体内生成的阿片活性物质, 可通过与免疫细胞表面的阿片受体及非阿片受体结合,介导免疫调节作用,在自身免疫性疾病及脑血管疾病等方面的研究较多,但关于β-EP在UC中的研究目前国内外鲜有报道。
通过检测UC患者结肠组织及血浆中β-EP的表达,分析UC活动期及缓解期血浆中β-EP的变化与T细胞亚群、白细胞介素1β(IL-1β)变化的相关性,探讨β-EP在UC免疫调节中可能的作用机制。
1 资料与方法
1.1病例选择 收集2011年3月至2012年2月就诊于河北医科大学第二医院消化内科门诊及病房的UC患者共30例,留取患者处于病情活动期时的外周静脉血及结肠黏膜活检组织,并收集病情缓解期的外周静脉血。其中男14例,女16例,年龄17~59岁,平均年龄38.1岁。入选病例均符合2012年中华医学会消化病学分会对炎症性肠病诊断与治疗的共识意见中UC的诊断标准[5]。按照Southerland DAI标准分为轻度、中度以及重度活动期,其中包括轻度活动期患者8例,中度活动期患者10例,重度活动期患者12例。另外,选取同时期结肠息肉患者15例作为对照组,留取其外周静脉血及正常结肠黏膜组织。其中男7例,女8例,年龄21~62岁,平均年龄40.1岁,对照组血常规、生化全项、结肠镜、病理学等检查均无明显异常,并排除糖尿病、心脑血管疾病、恶性肿瘤及已经确诊的自身免疫性疾病等。各组性别、年龄差异无统计学意义(P>0.05)。
1.2研究方法
1.2.1主要试剂 人β-EP放免试剂盒购自第二军医大学神经生物学教研室;人碘[125]IL-1β放免试剂盒购自北京北方生物技术研究所;荧光标记单克隆抗体和溶血素购自美国Beckman Coulter公司;鼠抗人β-EP单克隆抗体和鼠抗人IL-1β单克隆抗体购自武汉博士得生物工程有限公司。
1.2.2放射免疫分析测定血液中β-EP和IL-1β的表达 晨起空腹条件下取肘静脉血4 ml,β-EP采血管中加入0.3 M EDTA-Na2溶液40 μl、抑肽酶30 μl,IL-1β采血管中加入EDTA-K2溶液轻缓混匀, 迅速低温离心机离心(3 000 r/min,10分钟),取血浆,于-80 ℃冰箱保存。测定时在室温下自溶。试管编号;加样,IL-1β依照平衡饱和操作,β-EP依照顺序饱和加样程序加样;孵育24小时;分离剂分离,弃上清;γ-放射免疫计数器上测量每管沉淀的cpm值。
1.2.3免疫组织化学法测定结肠黏膜组织中β-EP和IL-1β的表达 由内镜医师行电子结肠镜检查及黏膜活检,于UC和对照组患者直肠和乙状结肠交界处,取活检组织2块,置入4%的多聚甲醛溶液固定24小时;常规石蜡包埋连续切片。一块组织行HE染色,另一块组织行免疫组织化学染色:滴加山羊血清封闭液;滴加一抗 (稀释1∶100), 4 ℃过夜;滴加生物素标记二抗 (羊抗鼠);滴加辣根过氧化物酶标记链酶卵白素工作液;DAB显色,苏木精复染,盐酸酒精分化;脱水、透明、封片、镜检。
1.2.4流式细胞术测定血浆中T细胞亚群的水平 清晨空腹取肘静脉血1 ml,EDTA-K2抗凝,室温下不超过18小时检测。取流式专用试管1支,分别加入5 μl CD3-PC5、10 μl CD4-FITC、10 μl CD8-PE,立刻加抗凝血50 μl;后加入溶血素及PBS混匀,离心(1 500 r/min,5分钟),弃上清,留细胞沉淀;上机分析,采用CellQuest软件进行上样,由软件自动统计出所需结果。
2 结 果
2.1血液中各细胞因子水平的表达
2.1.1血液中β-EP、IL-1β的表达水平 UC患者活动期与缓解期患者血液中β-EP、IL-1β的表达水平明显高于对照组(P<0.05);且活动期β-EP、IL-1β的表达水平为:重度活动组>中度活动组>轻度活动组,差异具有统计学意义(P<0.05)。见表1、2。
2.1.2血液中CD3+、CD4+、CD4+/CD8+的表达水平 UC患者活动期与缓解期患者血液中CD3+、CD4+、CD4+/CD8+的表达水平均较正常对照组明显升高,差异具有统计学意义(P<0.05);且活动期CD4+、CD4+/CD8+的表达水平为:轻度活动组<中度活动组<重度活动组,差异有统计学意义(P<0.05)。见表1,2。
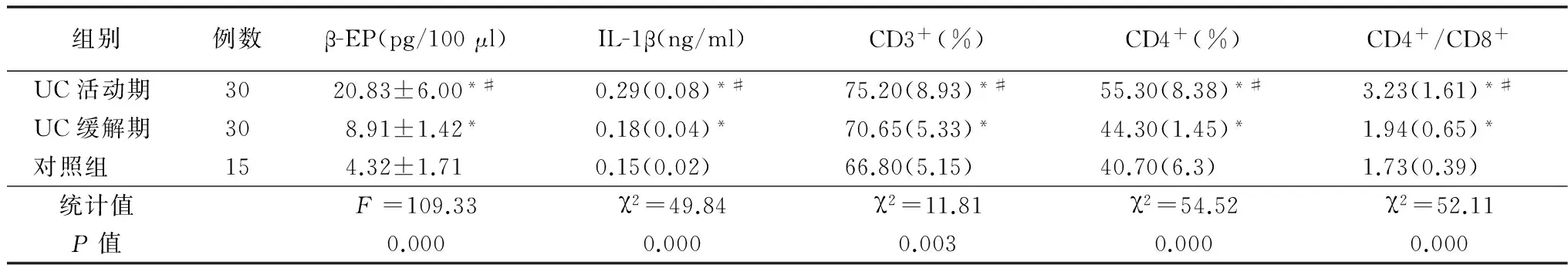
表1 血液中UC活动期、缓解期与对照组各细胞因子表达水平比较
注:与对照组比较,*P<0.05; 与UC缓解期比较,#P<0.05

表2 UC各组与对照组血液中各细胞因子表达水平比较
注:与对照组比较,*P<0.05;与轻度活动组比较,#P<0.05;与中度活动组比较,△P<0.05
2.2结肠组织中细胞因子的表达
2.2.1光学显微镜下表现 对照组结肠黏膜上皮完整,固有层内可见少量炎性细胞浸润,腺体排列整齐;UC各组结肠黏膜镜下表现为弥漫性炎症,固有层内可见大量炎性细胞浸润,如中性粒细胞、嗜酸性粒细胞、淋巴细胞、浆细胞、单核细胞等,并且隐窝结构紊乱,部分破坏,隐窝内及隐窝上皮均可见大量中性粒细胞等炎性细胞浸润,并可见潘氏细胞化生。见图1。
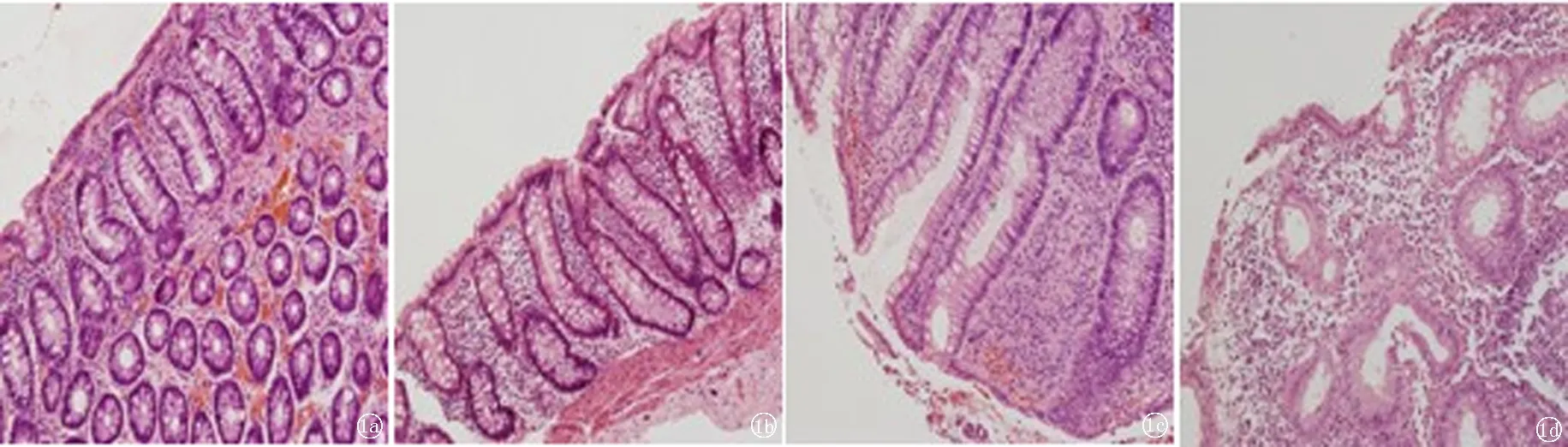
图1 各组结肠黏膜组织HE染色(×200) a.对照组;b.轻度活动组;c.中度活动组;d.重度活动组
2.2.2免疫组织化学染色结果 在对照组结肠黏膜中,β-EP及IL-1β主要表达在黏膜的上皮细胞及腺上皮细胞,胞浆呈棕黄色; UC结肠黏膜中可见大量炎性细胞浸润,伴有不同程度的隐窝结构破坏,β-EP及IL-1β在UC患者结肠黏膜组织中也主要表达在上皮细胞及腺上皮细胞,阳性细胞要比正常结肠黏膜组织染色深,且阳性细胞的数目明显增多。见图2,3。

图2 UC患者结肠黏膜β-EP免疫组织化学染色(×400) a.对照组;b.轻度活动组;c.中度活动组;d.重度活动组

图3 UC患者结肠黏膜IL-1β免疫组织化学染色(×400) a.对照组;b.轻度活动组;c.中度活动组;d.重度活动组
2.2.3结肠黏膜组织中β-EP、IL-1β的表达水平 UC结肠黏膜组织中β-EP、IL-1β的表达明显高于对照组(P<0.05);各组β-EP和IL-1β表达水平均依次为:轻度活动组<中度活动组<重度活动组,差异具有统计学意义(P<0.05)。见表3。

表3 UC各组与对照组结肠黏膜组织中β-EP、IL-1β表达水平比较
注:与对照组比较,*P<0.05;与轻度活动组比较,#P<0.05;与中度活动组比较,△P<0.05
2.3相关性分析 血浆中β-EP在UC活动期与缓解期的变化与CD4+的变化呈正相关(y=0.0365x-11.056,r=0.532,P=0.032);与CD4+/CD8+的变化呈正相关(y=0.0891x-0.3226,r=0.964,P=0.000);与IL-1β的变化呈正相关(y=0.0055x-0.0453,r=0.522,P=0.003)。
3 讨 论
UC是一种病因以及发病机制尚不完全明确的慢性炎症性肠病,其内镜下特点为病变呈连续性、弥漫性分布,绝大多数起病于直肠,逆行向近段结肠进展,严重者甚至累及全结肠以及末端回肠。临床特点为慢性反复发作性,常累及全身多个系统和器官,如眼部病变及皮肤受损[6]。目前国内外尚没有针对UC的根治性治疗措施。UC的发病机制一直都是研究焦点与热点,主要集中在免疫[7]、遗传、氧化应激[8-9]等方面。
研究发现UC患者中其他免疫相关性疾病的发生率也是上升的[10],如类风湿性关节炎、银屑病、强直性脊柱炎等[11]。自身免疫性胰腺炎较其他原因引起的胰腺炎患者UC的发病率要高[12-13]。有研究表明,由结肠黏膜免疫系统的异常反应所导致的急慢性炎症反应在UC的发生、发展及转归过程中起着重要作用,有可能是由于抗原的持续刺激或(及)免疫调节紊乱,免疫反应表现出过度亢进和(或)难以自限性。研究发现免疫抑制药物在治疗UC方面有很好的效果,进一步说明了UC的发生发展与免疫反应失调、活跃有关[14]。T淋巴细胞作为免疫反应环节中抗原递呈的核心,同时又是非常重要的免疫调节剂之一。另外,血管内皮细胞、上皮细胞等肠道非免疫细胞也都参与了免疫炎症反应。在UC发病中T细胞功能异常起着非常重要的作用[15-16]。有研究结果显示CD4+T细胞介导的组织损伤与UC的免疫异常或紊乱有一定的相关性[17]。本研究结果表明UC患者中存在着CD4+T细胞的异常活化,CD4+T、CD4+/CD8+参与了UC的发病过程,在一定程度上反映疾病的严重程度。肠黏膜中的CD4+T细胞异常活化,可激活巨噬细胞等效应细胞,释放IL-1β、IL-6、IL-13等促炎细胞因子,使T淋巴细胞在受损肠黏膜和固有层内大量集聚,两者共同作用使T淋巴细胞凋亡抵抗增加,肠道黏膜稳态削弱,进一步导致炎症细胞和炎症递质异常,引起肠黏膜的损伤,成为UC发病过程中的中心环节。
IL-1β作为诱导UC肠道炎症反应极其重要的细胞因子之一,大量试验研究和临床研究均表明了IL-1β的升高与UC的发生发展有着密不可分的关系[17]。本试验结果证实了UC中确实存在着IL-1β等促炎细胞因子增多、免疫调节紊乱,这种异常不仅仅存在于结肠黏膜组织中,同时也存在于血浆中,其免疫紊乱程度与疾病严重程度相关,可以在一定程度上反映病情的严重程度。
β-EP是阿片类激素中最具活性和功能的代表,与类风湿性关节炎、系统性红斑狼疮等多种自身免疫性疾病有关[18]。β-EP在UC中的表达及作用,目前国内外研究结果尚不十分明确。仅姬培震等[19],周天宇等[20]报道UC大鼠模型中β-EP水平较正常组明显升高。本研究结果对外周血的检测与之相符,且更进一步发现β-EP在UC患者中的表达水平随着病情严重程度的加重而进一步的升高。其可能的机制是,在UC活动期,机体的免疫功能亢进,CD4+、CD4+/CD8+表达较对照组明显升高;免疫调节紊乱,促使促炎细胞因子分泌增多,IL-1β较对照组明显升高。机体受到亢进的免疫系统进一步损伤,为了维持机体的免疫平衡状态,机体代偿性分泌β-EP介导对免疫功能的负向调节,下调分泌增多的促炎性细胞因子及免疫介质,抵抗其对机体的免疫损伤,因此β-EP在UC活动期患者中的表达上调,且随着病情炎症程度的加重逐渐升高。组织中β-EP的表达水平反映了结肠组织受到免疫损伤的程度。而血浆中β-EP的表达可能是机体对抗免疫亢进、免疫紊乱的防御反应,反映了全身炎症反应程度、免疫损伤的程度和调节免疫的能力。
为了进一步评价β-EP对UC免疫功能的影响,本研究发现β-EP变化与CD4+、CD4+/CD8+、IL-1β的变化在一定程度上呈正相关。这表明β-EP在UC的发生、发展过程中,发挥了一定的免疫抑制作用,其原因可能是通过影响CD4+、CD4+/CD8+、IL-1β来参与免疫反应调节。但是,β-EP进行细胞免疫功能的抑制性调节的分子学机制,以及它在这种抑制性调节中起多大作用需进一步研究证明。
[1] 孙健,高文艳,林一帆. 溃疡性结肠炎病因和发病机制研究进展[J]. 辽宁中医药大学学报, 2017, 19(4): 94-97.
[2] 周艳利,刘丽,宋淑霞,等. Nrf2在溃疡性结肠炎患者中的表达及其与氧化应激的关系[J]. 中华消化杂志, 2014, 34(6): 401-403.
[3] 金博. 肠道菌群移植与溃疡性结肠炎[J]. 世界华人消化杂志, 2017, 25(1): 23-30.
[4] Sjöberg F, Barkman C, Nookaew I, et al. Low-complexity microbiota in the duodenum of children with newly diagnosed ulcerative colitis[J]. PLoS One, 2017, 12(10): e0186178.
[5] 中华医学会消化病学分会炎症性肠病学组. 炎症性肠病诊断与治疗的共识意见(2012年广州) [J]. 中华内镜杂志, 2012, 51(10): 818-831.
[6] 杨红,张慧敏,金梦,等. 溃疡性结肠炎诊断与鉴别诊断要点解析[J]. 临床荟萃, 2016, 31(8): 813-816.
[7] 高鸿亮,周禾,姚萍. 溃疡性结肠炎患者血清γ-干扰素、白细胞介素10(IL-10),IL-17、辅助性T细胞17表达的荟萃分析[J]. 临床荟萃, 2017, 32(10): 891-895.
[8] Aslan M, Nazligu Y, Bolukbas C, et al. Peripheral lymphocyte DNA damage and oxidative stress in patients with ulcerative colitis[J]. Pol Arch Med Wewn, 2011, 121(7-8): 223-229.
[9] Zhang YZ, Li YY. Inflammatory bowel disease:Pathogenesis[J]. World J Gastroenterol, 2014, 20(1): 91-99.
[10] Wallace KL, Zheng LB, Kanazawa Y, et al. Immunopathology of inflammatory bowel disease[J]. World J Gastroenterol, 2014, 20(1): 6-21.
[11] Halling ML, Kjeldsen J, Knudsen T, et al. Patients with inflammatory bowel disease have increased risk of autoimmune and inflammatory diseases[J]. World J Gastroenterol, 2017, 23(33): 6137-6146.
[12] Kim JW, Hwang SW, Park SH, et al. Clinical course of ulcerative colitis patients who develop acute pancreatitis[J]. World J Gastroenterol, 2017, 23(19): 3505-3512.
[13] Lorenzo D, Maire F, Stefanescu C, et al. Features of autoimmune pancreatitis associated with inflammatory bowel diseases[J]. Clin Gastroenterol Hepatol, 2017, Aug 4 [E pub ahead of print]
[14] 袁柏思,金鑫鑫,路又可,等. 溃疡性结肠炎外周血CD3+、CD4+、CD8+T细胞的活化及其与炎症标志物的关系[J]. 胃肠病学和肝病学杂志, 2015, 24(8): 939-942.
[15] 戴娟,张光波,高楠,等. 炎症性肠病患者外周血辅助性T细胞1和辅助性T细胞17水平及临床意义[J]. 中华内科杂志, 2013, 52(5): 375-378.
[16] Mann ER, Bernardo D, Ng SC. Human gut dendritic cells drive aberrant gut-specific T-cell responses in ulcerative colitis, characterized by increased IL-4 production and loss of IL-22 and IFNγ[J]. Inflamm Bowel Dis, 2014, 20(12): 2299-2307.
[17] 罗晓婷,刘懿. 调节性T细胞与炎症性肠病[J]. 国际消化病杂志, 2011, 31(2): 63-67.
[18] Toth K, Barna I, Nagy G, et al. Synovial fluid β-endorphin level in avascular necrosis, rheumatoid arthritis, and osteoarthritis of the femoral head and knee. A controlled pilot study[J]. Clin Rheumatol, 2011, 30(4): 537-540.
[19] 姬培震,张怡,李雪萍,等. 附子理中汤灌肠对脾肾阳虚型溃疡性结肠炎大鼠NF-B,TNF-,IL-1表达的影响[J]. 中国实验方剂学杂志, 2015, 21(14): 124-128.
[20] 周天羽,周博,王俊江,等. 清肠愈疡汤对溃疡性结肠炎大鼠血清IL-1β及IL-6的影响[J]. 中华中医药杂志, 2015, 30 (3) : 849-851.
β-endorphinexpressionandimmunefunctioninpatientswithulcerativecolitis
Liu Lin1,2, Liu Li1, Zhang Rui1, Zhao Dongqiang1, Liu Xuechen1, Zhang Di1
1.DepartmentofGastroenterology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China;2.DepartmentofGastroenterology,HandanCentralHospital,Handan056000,China
LiuLi,Email:loraliu@163.com
ObjectiveTo explore the immune mechanism of β-endorphin(β-EP) in ulcerative colitis(UC) patients.MethodsThirty UC patients were enrolled, including mild activity 8 cases, moderate activty 10 cases and severe activity 12 cases. In the same period,15 patients with colon polyps served as control group. Blood β-EP and interleukin-1β(IL-1β) were measured by radioimmunoassay. After peripheral blood lymphocyte separation, CD3+T cells, CD4+T cells and CD4+/CD8+T cells percentage were detected by flow cytometry. β-EP and IL-1β in colon mucosa were measured by immunohistochemistry.ResultsPlasma expressions of β-EP, IL-1β, CD4+T cells, CD4+/CD8+T cells percentage in patients with UC were significantly higher than those of control group (P<0.05). And the expressions showed significant difference with the disease severity: patients with mild UC colitis, ulcerative; beta-endorphin; interleukin-1beta; T-lymphocyte subsets; immunomodulation 刘丽, Email:loraliu@163.com R574.62 A 1004-583X(2017)11-0969-05 10.3969/j.issn.1004-583X.2017.11.013 2017-09-28 编辑:张卫国
