提取方法对天麻多糖提取率及其抗氧化活性的影响
2017-11-16李丹丹潘芸芸
王 庆 李丹丹 - 潘芸芸 - 吴 卫
(四川农业大学农学院,四川 成都 611130) (Agronomy College, Sichuan Agricultural University, Chengdu, Sichuan 611130, China)
提取方法对天麻多糖提取率及其抗氧化活性的影响
王 庆WANGQing李丹丹LIDan-dan潘芸芸PANYun-yun吴 卫WUWei
(四川农业大学农学院,四川 成都 611130) (AgronomyCollege,SichuanAgriculturalUniversity,Chengdu,Sichuan611130,China)
分别采用热水浸提、超声辅助提取和酶法提取对四川平武乌天麻多糖进行提取,并对天麻多糖提取率及其抗氧化化活性进行比较,为筛选适合天麻多糖提取的方法提供参考。结果表明:3种提取方法对天麻多糖提取率及其抗氧化活性影响较大,其中酶法提取天麻多糖提取率最高(为50.315%),与其他2种提取方法间差异达到极显著水平(P<0.01);在DPPH和FRAP法抗氧化评价体系中,多糖抗氧化活性表现为超声辅助提取>酶法提取>热水浸提法,而在ABTS抗氧化评价体系中,其活性顺序是酶法提取>超声辅助提取>热水浸提。综合分析,超声辅助提取和酶法提取有利于天麻多糖提取,且能保持其高效的抗氧化活性。
天麻;多糖;热水浸提;超声辅助提取;酶法提取;抗氧化活性
多糖作为生物大分子物质存在于植物、动物和微生物中,是自然界含量最丰富的生物大分子聚合物之一[1],在医药、食品以及材料等方面有着重要应用。研究表明,多糖具有抗氧化[2]、抗肿瘤[3]和免疫调节[4-5]等多种生理功能,此外,多糖来源广泛且毒副作用极低。目前关于多糖的研究逐渐成为了热点。
天麻为兰科真菌营养型多年生草本植物天麻(GastrodiaelataBl.)的干燥块茎,是中国传统名贵中药材之一。具有息风止痉、平抑肝阳和祛风通络的功效,主要应用于小儿惊风、癫痫抽搐、破伤风、头痛眩晕、手足不遂、肢体麻木以及风湿痹痛等症状[6]。经现代药理研究表明,天麻具有增智健脑[7]、清除自由基、延缓衰老[8]、保护心血管[9-10]的作用,对神经系统性疾病[11-12]、老年性痴呆症等有一定疗效[13-14]。自20世纪50年代以来,在天麻中发现的化学成分主要包括酚类、有机酸类、多糖类以及甾体类等[15]。
人体生活的环境必然要与外界接触,所以必定会因呼吸、环境污染、射线等因素不断在体内产生自由基。现代自由基医学研究证明,生物体的衰老、免疫性疾病,甚至癌变等都与自由基过量产生有关。抗氧化主要是指抗氧化自由基。已有研究表明枸杞多糖[16]、赤灵芝多糖[17]、牛蒡多糖[18]、石斛多糖[19]、银杏叶多糖[20]等均具有清除自由基的作用。张梦娟[21]对天麻多糖进行研究发现其具有一定抗氧化活性。有研究[22]报道,提取方式对多糖活性具有一定的影响。传统针对植物多糖提取多采用热水提取法,此方法具有操作简便、使用仪器少等特点[23],随着新的提取工艺不断出现,在天麻多糖研究中,已有关于超声辅助提取[24]、酶解提取[25]、微波提取[26]等方面的报道,但关于其对抗氧化活性的影响尚未见报道。尽管这些方法均各具优缺点,但是否适宜于天麻多糖提取,需进一步研究,故本试验拟采用3种提取方法,对天麻多糖提取率及其抗氧化活性进行比较,以期筛选出适合天麻多糖提取的方法,并为进一步开发利用天麻多糖提供理论依据。
1 材料与方法
1.1 试验材料
天麻:来自四川平武,经四川农业大学吴卫教授鉴定为乌天麻(G.elataBl.f.glaucaS. Chow)。将其蒸至透心,烘干至恒重,粉样,过60目筛,备用。
1.2 试验仪器和试剂
电子分析天平:CP224S型,德国赛多利斯公司;
电子恒温水浴锅:DZKW-4型,北京中兴伟业仪器有限公司;
粉样机:FW-100型,北京市永光明医疗仪器有限公司;
电热鼓风干燥箱:101-3AB型,天津市泰斯特仪器有限公司;
高速冷冻离心机:Allegra X-30R Centrifuge型,美国Beckman Conlter公司;
超声波清洗机:SB25-12DTDN型,宁波新芝生物科技股份有限公司;
冷冻干燥机:SJIA-10N型,宁波双嘉仪器有限公司;
紫外-可见光光度计:UV2450型,日本Shimadzu公司;
酶标仪:Multiskan GO型,美国Thermo Scientific公司;
纤维素酶、1,1-二苯基-2-三硝基苯肼(DPPH)、2`-联胺-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、2,4,6-三吡啶基三嗪(TPTZ): 美国Sigma公司;
苯酚、硫酸、乙醇、石油醚(60~90 ℃)、无水葡萄糖、Vc等:分析纯,成都市科龙化工试剂厂。
1.3 试验方法
1.3.1 样品预处理 称取天麻粉样,加入3倍量石油醚回流脱脂4 h,重复2次,45 ℃烘干后,再加入80%乙醇以1∶8 (g/mL)的比例,于80 ℃回流提取2 h,用真空抽滤机滤去液体,重复2次,得滤渣,45 ℃烘干,备用。
1.3.2 天麻多糖提取
(1) 热水浸提法:参考文献[24~25]提取方法,修改如下:取经过预处理的天麻样品约10 g,按料液比1∶37 (g/mL),提取温度70 ℃,提取时间2.5 h,提取3次。待冷却至室温后,于4 ℃、10 000 r/min离心10 min,将上清液过滤,合并滤液并浓缩,再向提取液中缓慢加入无水乙醇至混合液乙醇终浓度为80%,置于4 ℃沉淀过夜,离心得天麻多糖沉淀,经 -50 ℃ 冷冻干燥后,-20 ℃低温保存。
(2) 超声辅助提取法:准确称取经过预处理的天麻样品约10 g,在超声波功率250 W条件下,按料液比1∶25(g/mL),超声温度40 ℃,超声时间35 min,重复提取3次[26]。其余步骤与“1.3.2(1)”相同,得到天麻多糖沉淀。
(3) 酶法提取:参考文献[27],修改如下:称取预处理天麻样品约10 g,加入pH 5的柠檬酸缓冲液,使总体积为500 mL,加入纤维素酶20 mg,50 ℃水浴提取60 min,80 ℃水浴10 min使酶灭活。其余步骤与“1.3.2(1)”相同,得到天麻多糖沉淀。
1.3.3 天麻多糖含量测定
(1) 多糖标准曲线制作:参考文献[18]。以葡萄糖浓度(x)为横坐标、吸光度值(y)为纵坐标绘制葡萄糖标准曲线,计算出标准曲线的线性回归方程为:y=5.372x-0.012,R2=0.998,葡萄糖对照品浓度的线性范围为0.020 2~0.161 7 mg/mL。其标准曲线见图1。
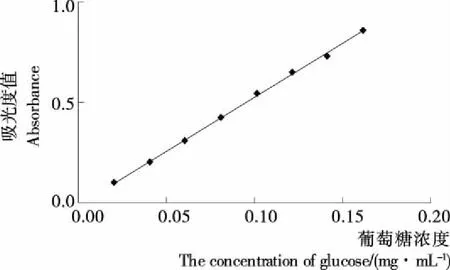
图1 多糖标准曲线Figure 1 Standard curve of Polysaccharides
(2) 天麻多糖提取液制备:称取经过预处理的天麻样品1 g,按照“1.3.2”项提取得不同天麻多糖溶液,合并滤液,定容于250 mL的容量瓶中,每种提取方法重复3次。
(3) 天麻多糖含量测定:用移液管吸取1.0 mL粗多糖提取液置于试管中,依次加入蒸馏水2 mL, 5%苯酚1 mL,摇匀,滴加浓硫酸5 mL,摇匀,在室温下静置10 min,沸水浴15 min,冷却至室温,于490 nm处检测其吸光度。按式(1)计算天麻多糖含量。
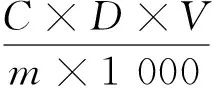
(1)
式中:
W——多糖含量,%;
C——多糖的葡萄糖浓度,mg/mL;
D——多糖稀释倍数;
V——提取液体积,mL;
m——原料干重,g。
1.3.4 抗氧化活性测定
(1) DPPH自由基清除:参照文献[28],修改如下:用无水乙醇配制成0.04 mg/mL DPPH溶液(现配现用)。分别吸取70 μL不同质量浓度的多糖溶液和200 μL DPPH溶液于96孔酶标板,27 ℃孵育10 min,每份样品平行操作3次,在517 nm处用酶标仪测定吸光值(A);以去离子水70 μL和200 μL DPPH溶液的吸光度值作对照(A0);空白为供试待测液70 μL和无水乙醇200 μL的吸光度值(B);以不同浓度的Vc溶液作阳性对照。按式(2)计算DPPH自由基清除率。
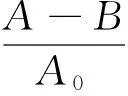
(2)
式中:
D——DPPH自由基清除率,%;
A——70 μL多糖溶液和200 μL DPPH溶液的吸光度值;
B——70 μL多糖溶液和200 μL无水乙醇的吸光度值;
A0——70 μL去离子水和200 μL DPPH溶液的吸光度值。
(2) ABTS自由基清除:参照文献[29]配制ABTS工作液。参考文献[30]并略作修改:将不同方法提取的天麻多糖配制成梯度浓度的样品溶液,分别吸取30 μL多糖溶液、180 μL ABTS工作液于96孔酶标板,37 ℃下孵育30 min。蒸馏水调零后,在734 nm处用酶标仪测定其吸光度。空白处理:30 μL去离子水和180 μL ABTS工作液。每份供试样品操作3次。以不同浓度的Vc溶液作阳性对照。按式(3)计算ABTS自由基清除率。

(3)
式中:
R——ABTS自由基清除率,%;
A1——30 μL多糖溶液与180 μL ABTS液的吸光度值;
A0——30 μL去离子水与180 μL ABTS液的吸光度值。
(3) FRAP铁离子还原能力:参照文献[31]配制FRAP工作液(现配现用)。参照文献[32]绘制FeSO4标准曲线。总还原能力测定:吸取70 μL不同质量浓度的多糖溶液,加入200 μL 37 ℃预热的FRAP工作液于96孔酶标板,摇匀后,37 ℃反应30 min,用酶标仪在593 nm测定其吸光度值。空白为供试液溶剂代替供试液加入FRAP工作液。根据FeSO4标准曲线,在标准曲线上求得相应FeSO4的浓度(μmol/L)为FRAP值。每个稀释浓度做3次平行试验,求平均值。以不同浓度的Vc溶液作阳性对照。
1.4 数据分析
试验数据处理及作图均采用Microsoft Excel 2007进行,利用SPSS 20.0统计分析软件对清除自由基活性数据进行方差分析与显著性检验。
2 结果与分析
2.1 不同提取方法的天麻多糖提取率
由图2可知,3种提取方法对天麻多糖提取率影响较大,彼此间差异均达到极显著水平(P< 0.01),其中酶法的提取率最高。
本试验通过热水浸提法提取多糖得率为22.380%,与宗露[33]对平武乌天麻多糖测定含量25.02%结果基本一致;超声辅助提取法天麻多糖得率为33.089%,该结果与杨天友等[26]以超声波辅助提取60目德江天麻粉末,多糖得率为33.4%结果一致;酶法提取天麻多糖得率为50.315%,远高于目前报道[34]的38.34%,可能与两者所选材料有关。
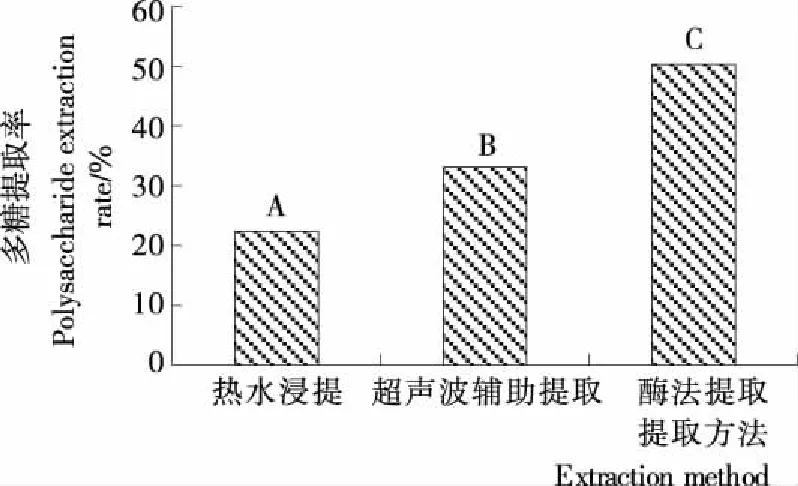
不同大写字母表示差异极显著(P<0.01)图2 不同提取方法天麻多糖提取率Figure 2 The extraction rates of polysaccharides from different extraction methods
2.2 不同提取方法所得粗多糖抗氧化活性的差异
2.2.1 DPPH自由基清除活性 由图3可知,3种提取方法得到的天麻粗多糖与Vc的DPPH自由基清除活性存在较大差异。在2.5 mg/mL浓度下,酶法提取粗多糖的DPPH自由基清除率显著高于同浓度其他2种提取方法的,但在4,5 mg/mL浓度下,超声辅助提取粗多糖的DPPH自由基清除活性显著高于其他提取方法的。在一定浓度范围内,3种提取方法得到的粗多糖对DPPH自由基清除率随粗多糖浓度升高而升高,且存在一定的线性关系(见表1),通过计算,热水浸提、超声辅助提取、酶法提取的多糖溶液和Vc溶液的DPPH自由基清除率的IC50分别为5.057,4.437,4.993,0.051 mg/mL。由于IC50值越小,多糖对DPPH自由基清除率越高,3种方法提取的粗多糖中,以
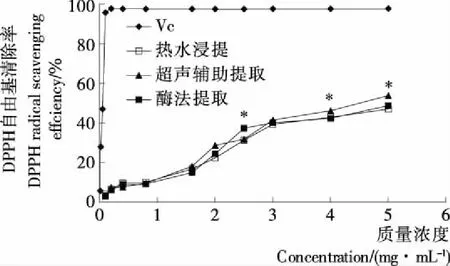
*表示在同浓度下与其他方法提取的多糖差异显著(P<0.05)图3 不同提取方法所得粗多糖对DPPH自由基清除能力
Figure 3 The DPPH free radical scavenge capacities of crude polysaccharides from different extraction methods
表1不同提取方法所得粗多糖及VC对DPPH自由基清除率的IC50
Table 1IC50of crude polysaccharides from different extraction methods and Vc on DPPH free radical scavenge capacities

样品回归方程R2IC50/(mg·mL-1)热水浸提多糖y=7.566x+11.7400.8645.057超声辅助提取多糖y=8.357x+12.9200.9584.437酶法提取多糖y=6.668x+16.7100.8084.993VCy=935.900x+2.0910.9800.051
超声辅助提取的粗多糖对DPPH自由基清除率最高,其活性最强。这可能与超声波强烈的机械剪切作用致多糖分子结构改变有关[35]。
2.2.2 ABTS自由基清除活性 由图4可知,不同提取方法提取的天麻粗多糖均表现出一定的ABTS自由基清除活性,在粗多糖浓度为5 mg/mL时,酶法提取的粗多糖ABTS自由基清除率最高 (47.449%),与其他2种方法提取的粗多糖差异达到显著水平(P<0.05)。此外,在一定浓度范围内具有明显的量效关系(见表2),且所有回归方程的R2均>0.9,表明方程的拟合度很高。依据所得线性方程计算各多糖溶液的ABTS自由基清除率的IC50分别为6.130,5.406,4.917 mg/mL,阳性对照Vc对ABTS自由基清除率的IC50为0.040 mg/mL。可见,在ABTS抗氧化评价体系中,其活性顺序是酶法提取粗多糖>超声辅助提取粗多糖>热水浸提粗多糖。唐小琴[36]研究发现酶提法提取的温和条件能更好保全多糖的生物活性,本试验同样显示酶法提取天麻多糖活性较高,可能与此有关。
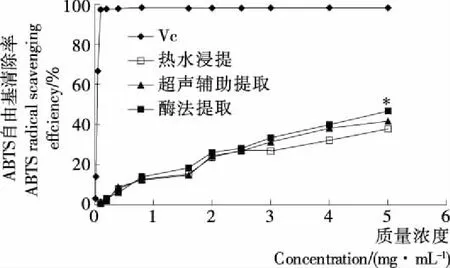
*表示在同浓度下与其他方法提取的多糖差异显著(P<0.05)图4 不同提取方法所得粗多糖对ABTS自由基清除能力
Figure 4 The ABTS free radical scavenge capacities of crude polysaccharides from different extraction methods
表2不同提取方法所得粗多糖及VC对ABTS自由基
清除率的IC50
Table 2IC50of crude polysaccharides from different extraction methods and Vc on ABTS free radical scavenge capacities
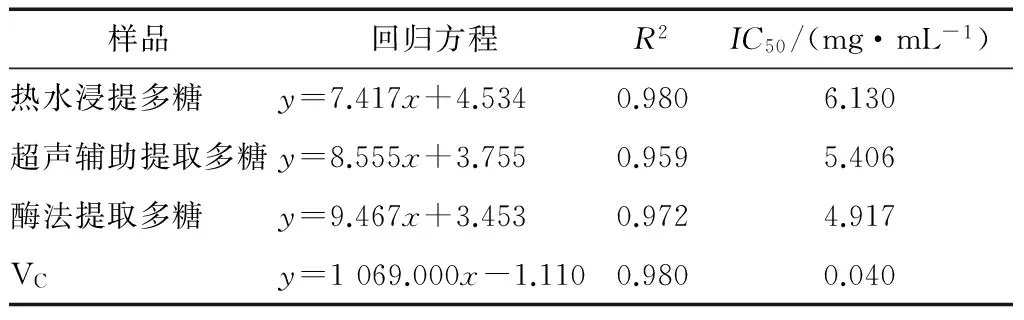
样品回归方程R2IC50/(mg·mL-1)热水浸提多糖y=7.417x+4.5340.9806.130超声辅助提取多糖y=8.555x+3.7550.9595.406酶法提取多糖y=9.467x+3.4530.9724.917VCy=1069.000x-1.1100.9800.040
2.2.3 FRAP铁离子还原能力 由图5可知,在所测质量浓度范围内,各组粗多糖还原Fe3+的能力随浓度的升高而增大,且呈现一定线性关系,所有线性回归方程R2值均>0.960,表明方程的拟合度很高(表3)。在质量浓度2.5 mg/mL时,超声辅助提取的粗多糖还原Fe3+的能力显著高于同浓度下其他提取法的;在质量浓度3,4,5 mg/mL时,超声辅助提取的粗多糖还原Fe3+的能力极显著高于同浓度下其他提取法的。总体来看,超声辅助提取的粗多糖还原Fe3+的能力最强,但各组粗多糖还原Fe3+的能力都较弱,均低于同浓度的阳性对照。
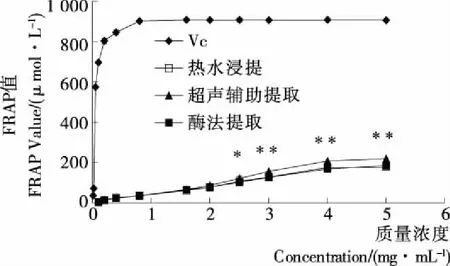
**表示在同浓度下与其他方法提取的多糖差异极显著(P<0.01); *表示在同浓度下与其他方法提取的多糖差异显著(P<0.05)图5 不同提取方法所得粗多糖的FRAP值Figure 5 FRAP values of crude polysaccharides from different extraction methods表3 不同提取方法所得粗多糖及VC对Fe3+还原能力的回归方程
Table 3 The regression equations of crude polysaccharides from different extraction methods and Vc on Fe3+reducing capacity

样品回归方程R2热水浸提多糖y=38.410x+6.0180.980超声辅助提取多糖y=46.760x+2.7270.981酶法提取多糖y=38.020x+6.3280.990VCy=14179.000x-151.90.966
3 结论
不同提取方法对天麻多糖提取率及其抗氧化活性影响不同,其中酶法提取率最高,其次为超声辅助提取;超声辅助提取法和酶法提取均可保持天麻多糖高效的抗氧化活性。3种提取方法得到的天麻粗多糖与阳性对照Vc相比,抗氧化活性相对较低,但多糖作为生物大分子化合物,和Vc相同质量浓度时,多糖物质的量浓度显著低于Vc。由此,天麻多糖也仍具有良好的抗氧化活性,可以作为一种抗氧化剂进一步深入研究。
[1] FAN Tao, HU Jian-guo, FU Li-dan, et al. Optimization of enzymolysis-ultrasonic assisted extraction of polysaccharides fromMomordicacharabtiaL. by response surface methodology[J]. Carbohydrate Polymers, 2015, 115: 701-706.
[2] ZENG Hong-liang, MIAO Song, ZHANG Yi, et al. Isolation, preliminary structural characterization and hypolipidemic effect of polysaccharide fraction fromFortunellamargarita(Lour.)[J]. Food Hydrocolloids, 2016, 52: 126-136.
[3] ZHENG Yan-fei, ZHANG Qiang, LIU Xiong-ming, et al. Extraction of polysaccharides and its antitumor activity onMagnoliakwangsiensisFiglar & Noot[J]. Carbohydrate Polymers, 2016, 142: 98-104.
[4] 李钦, 胡继宏, 高博, 等. 黄芪多糖在免疫调节方面的最新研究进展[J]. 中国实验方剂学杂志, 2017, 32(2): 199-206.
[5] CHEN Rui-zhan, LI Hai-ping, LI Shi-zhe, et al. Extraction optimization, preliminary characterization and immunological activity of polysaccharides from figs[J]. International Journal of Biological Macromolecules, 2015, 72: 185-194.
[6] 国家药典委员会. 中华人民共和国药典: 一部[S]. 2015年版. 北京: 中国医药科技出版社, 2015: 58-59.
[7] 刘智慧, 马浩, 王伟平, 等. 天麻素及派立辛改善东莨菪碱致学习记忆障碍的构效关系[J]. 药学学报, 2016, 51(5): 743-748.
[8] 谢学渊, 晁衍明, 杜珍, 等. 天麻多糖的抗衰老作用[J]. 解放军药学学报, 2010, 26(3): 206-210.
[9] 苗凯, 王美, 谢祎. 天麻素治疗冠心病心绞痛临床效果的观察[J]. 天津药学, 2009, 21(6): 26-27.
[10] TANG Chun-lan, WANG Li, LIU Xin-xin, et al. Pharmacokinetic study ofGastrodiaelatain rats[J]. Analytical and Bioanalytical Chemistry, 2015, 407(29): 8 903-8 910.
[11] LIU Zhi-hui, WANG Wei-ping, FENG Nan, et al. Parishin C`s prevention of Abeta 1-42-induced inhibition of long-term potentiation is related to NMDA receptors[J]. Acta Pharmaceutica Sinica B, 2016, 6(3): 189-197.
[12] 王灿, 于滨, 孔维佳. 天麻和天麻素改善糖脂代谢紊乱的药理学研究进展[J]. 中国医药导报, 2016, 13(27): 51-54, 58.
[13] HUANG Guang-biao, ZHAO Tong, MUNA Sushama-shrestha, et al. Therapeutic potential ofGastrodiaelataBl. for the treatment of Alzheimer’s disease[J]. Neural Regeneration Research, 2013, 8(12): 1 061-1 070.
[14] DOO Ah-reum, KIM Seung-nam, HAHM Dae-hyun, et al.GastrodiaelataBl. alleviates L-DOPA-induced dyskinesia by normalizing FosB and ERK activation in a 6-OHDA-lesioned Parkinson’s disease mouse model[J]. BMC Complementary and Alternative Medicine, 2014, 14: 107-115.
[15] 李云, 王志伟, 刘大会, 等. 天麻化学成分研究进展[J]. 山东科学, 2016, 29(4): 24-29.
[16] 郑玲利, 李燕, 黄玲, 等. 枸杞多糖的微波提取及抗氧化性分析[J]. 解放军药学学报, 2016, 32(1): 1-5.
[17] 徐雪峰, 李桂娟, 闫浩, 等. 赤灵芝多糖分离纯化及体外抗氧化性研究[J]. 食品与机械, 2017, 33(1): 143-147.
[18] 喻俊, 张利, 李亚波, 等. 干燥方式对牛蒡多糖理化性质及抗氧化活性的影响[J]. 食品与机械, 2016, 32(6): 160-163.
[19] 严慕贤, 周雅亮, 蓝义琨, 等. 两种石斛的水溶性多糖和碱溶性多糖体外抗氧化活性的研究[J]. 广东药学院学报, 2016, 32(1): 88-91.
[20] ZHANG Chang-wei, WANG Cheng-zhang, TAO Ran. Characterization and antioxidant activities of polysaccharides extracted from enzymatic hydrolysate ofGikgobilobaleaves[J]. Journal of Food Biochemistry, 2017, DOI: 10.1111/jfbc.12 352.
[21] 张梦娟. 天麻多糖的提取、纯化及活性研究[D]. 西安: 西北农林科技大学, 2007: 51-60.
[22] ZHANG Qin, DONG Lan-fang, TONG Tong, et al. Polysaccharides in Sipunculus nudus: Extraction condition optimization and antioxidant activities[J]. Journal of Ocean University of China, 2017, 16(1): 74-80.
[23] WANG Chen-yu, ZHANG Jing, WANG Fei, et al. Extraction of crude polysaccharides fromGomphidiusrutilusand their antioxidant activitiesinvitro[J]. Carbohydrate Polymers, 2013, 94: 479-486.
[24] 张梦娟, 徐怀德, 牛素哲, 等. 天麻多糖水提取工艺优化研究[J]. 食品工业科技, 2006, 27(11): 119-121.
[25] 朱洁平, 李峰, 沈业寿. 天麻多糖的提取工艺及含量测定研究[J]. 安徽农业科学, 2012, 40(18): 9 648-9 650.
[26] 杨天友, 刘金涛, 李刚凤. 超声波辅助提取德江天麻多糖工艺优化[J]. 中国酿造, 2015, 34(12): 117-121.
[27] 王勋, 罗珊珊, 蒋嘉烨, 等. 酶解法提取天麻多糖的研究[J]. 中药材, 2013, 36(1): 137-140.
[28] MA Qing, XIE Hai-hui, LI Sha, et al. Flavonoids from the pericarps ofLitchichinensis[J]. Journal of Agricultural and Food Chemistry, 2014, 62: 1 073-1 078.
[29] THAIPONG Kriengsak, BOONPRAKOB Unaroj, CROSBY Kevin, et al. Comparison of ABTS, DPPH, FRAP, and ORAC assays for estimating antioxidant activity from guava fruit extracts[J]. Journal of Food Composition Analysis, 2006, 19(6/7): 669-675.
[30] YANG Dan, XIE Hai-hui, JIANG Yue-ming, et al. Phenolics from strawberry cv. Falandi and their antioxidant andα-glucosidase inhibitory activities[J]. Food Chemistry, 2016, 194: 857-863.
[31] WOOTTON-BEARD Peter-c, MORAN Aisling, RYAN Lisa. Stability of the total antioxidant capacity and total polyphenol content of 23 commercially measured by FRAP, DPPH, ABTS and Folin-ciocalteu methods[J]. Food Research International, 2011, 44(1): 217-224.
[32] ZHANG Shan-shan, LIU Xiao-qian, YAN Li-hua, et al. Chemical compositions and antioxidant activities of polysaccharides from the sporophores and cultured products ofArmillariamellea[J]. Melecules, 2015, 20(4): 5 680-5 697.
[33] 宗露. 平武产栽培天麻的品质评价研究[D]. 成都: 成都中医药大学, 2013: 41-43.
[34] 叶文斌. 响应面法与酶法联用提取天麻素和天麻多糖的优化工艺研究[J]. 食品研究与开发, 2015, 36(12): 25-30.
[35] 王小梅. 超声对麦冬多糖结构,溶液行为及生物活性影响的研究[D]. 西安: 陕西师范大学, 2013: 91-94.
[36] 唐小琴. 川白芷多糖提取、结构和活性研究[J]. 成都: 四川农业大学, 2016: 52-53.
EffectofdifferentextractionmethodsontheextractionratioandantioxidantactivityofpolysaccharidesfromGastrodiaelataBl.
In order to screen a suitable extraction method for polysaccharides fromGastrodiaelataBl., the hot water extraction, ultrasound extraction and enzymatic hydrolysis were applied to extracting polysaccharides fromG.elataBl.f.glaucaS. Chow from Pingwu in Sichuan province, then the polysaccharides extraction ratios and their antioxidant activities were compared. The polysaccharides extraction ratios and antioxidant activities were obviously influenced by the extraction methods. Of them, the extraction ratio of enzymatic hydrolysis was the highest with the value of 50.315%, which was extremely different from the other extraction methods (P<0.01). The antioxidant activities were in the following order: ultrasound extraction, enzymatic hydrolysis and hot water extraction by using DPPH free radical scavenge capacity and FRAP values. However, the antioxidant activities were in the following order: enzymatic hydrolysis, ultrasound extraction and hot water extraction by using ABTS free radical scavenge capacity. In conclusion, due to the higher extraction rate and antioxidant activity, ultrasound extraction and enzymatic hydrolysis were efficient to extract polysaccharides fromG.elata.
GastrodiaelataBl.; polysaccharides; hot water extraction; ultrasound extraction; enzymatic hydrolysis; antioxidant activities
四川省科技支撑计划子课题(编号:2014SZ0131)
王庆,男,四川农业大学在读硕士研究生。
吴卫(1970—),女,四川农业大学教授,博士生导师,博士。E-mail:ewuwei@sicau.edu.cn
2017—05—04
10.13652/j.issn.1003-5788.2017.09.031
