鱼鳔胶原肽抗氧化稳定性研究
2017-11-16郑婷婷涂宗财唐平平沙小梅
郑婷婷 - 涂宗财, -, 唐平平 - 张 露 沙小梅 - 王 辉
(1. 江西师范大学功能有机小分子教育部重点实验室,江西 南昌 330022;2. 江西师范大学生命科学学院,江西 南昌 330022;3. 南昌大学食品与科学技术国家重点实验室,江西 南昌 330047) (1. Key Laboratory of Functional Small Organic Molecule, Jiangxi Normal University, Nanchang, Jiangxi 330022, China; 2. Ministry of Education, College of Life Science, Jiangxi Normal University, Nanchang, Jiangxi 330022, China; 3. State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang, Jiangxi 330047, China)
鱼鳔胶原肽抗氧化稳定性研究
郑婷婷1,2ZHENGTing-ting1,2涂宗财1,2,3TUZong-cai1,2,3唐平平1,2TANGPing-ping1,2张 露1,2ZHANGLu1,2沙小梅1,2SHAXiao-mei1,2王 辉3WANGHui3
(1. 江西师范大学功能有机小分子教育部重点实验室,江西 南昌 330022;2. 江西师范大学生命科学学院,江西 南昌 330022;3. 南昌大学食品与科学技术国家重点实验室,江西 南昌 330047) (1.KeyLaboratoryofFunctionalSmallOrganicMolecule,JiangxiNormalUniversity,Nanchang,Jiangxi330022,China; 2.MinistryofEducation,CollegeofLifeScience,JiangxiNormalUniversity,Nanchang,Jiangxi330022,China; 3.StateKeyLaboratoryofFoodScienceandTechnology,NanchangUniversity,Nanchang,Jiangxi330047,China)
以DPPH自由基、OH自由基清除能力和还原力为评价指标,探究pH、温度、食品配料、金属离子、防腐剂以及体外模拟胃、肠道消化对鱼鳔胶原肽抗氧化稳定性的影响。结果表明:鱼鳔胶原肽在酸性环境中抗氧化活性保持得较好,在碱性条件下丧失较快;鱼鳔胶原肽具有较强的耐热性,高温不会降低其抗氧化活性;蔗糖、葡萄糖以及防腐剂(苯甲酸钠和山梨酸钾)对鱼鳔胶原肽的活性影响不明显,但添加高浓度的食盐会降低鱼鳔胶原肽的抗氧化活性;金属离子Zn2+、Cu2+对鱼鳔胶原肽抗氧化活性的影响较大,Ca2+的影响较小,K+、Mg2+无显著影响;模拟胃肠道消化对鱼鳔胶原肽抗氧化活性无显著影响。
鱼鳔;胶原肽;抗氧化活性;稳定性
肽类物质是安全性较高的一类抗氧化剂,目前有关抗氧化肽的研究也越来越多,但多集中于抗氧化肽的制备[1-2]、分离纯化和多肽序列鉴定方面[3-4],而关于多肽在加工、贮藏过程中抗氧化稳定性的研究相对较少。目前,已有少部分生物活性肽作为保健食品与药物实现工业化生产[5]。多肽类物质在不同的加工贮藏条件下,如高温、酸碱、金属离子、食品配料、防腐剂等易发生水解、氧化、脱酰胺、环化等化学反应,导致多肽结构和性质变化,造成活性降低甚至缺失[6-7]。You等[8]研究发现,多肽与糖发生美拉德反应可以增强其抗氧化活性。另外,多肽被加工成功能食品或药物后,最后还是要在人体环境中发挥作用,人体消化环境较为复杂,消化过程中多肽活性的稳定性对其能否发挥作用至关重要。已有研究[9-10]报道,多肽在模拟胃肠道消化过程中,抗氧化活性会发生改变。因此研究其在胃液和肠液的抗氧化稳定性具有重要意义。
鱼鳔富含胶原蛋白,含量高达80%以上,是胶原蛋白肽制备的良好原料[11]。课题组[12]前期研究表明鱼鳔胶原肽具有较强的抗氧化活性,但目前还没有关于加工贮藏条件对鱼鳔胶原肽抗氧化活性影响的相关研究报道。本试验以DPPH自由基清除活性、OH自由基清除活性、还原力3种为评价指标,研究pH、温度、食品配料、金属离子、防腐剂和体外模拟胃肠道消化对鱼鳔胶原肽抗氧化稳定性的影响,为鱼鳔胶原肽功能性食品或者抗氧化剂的开发提供理论参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
草鱼鱼鳔:平均长度(20.3±1.4) cm、质量(15.29±2.50) g,南昌市鄱阳湖农牧渔产业发展股份有限公司;
胰蛋白酶(2.67×105U/g )、胃蛋白酶:(3 000 U/g ):江苏锐阳生物技术有限公司;
DPPH:分析纯,美国Sigma公司;
葡萄糖、NaCl、蔗糖、KCl、无水CaCl2、MgSO4、ZnSO4、苯甲酸钠、山梨酸钾、95%乙醇、磷酸二氢钠、磷酸氢二钠、FeSO4、水杨酸、H2O2、K3FeCN6、FeCl3:分析纯,国药集团化学试剂有限公司。
1.1.2 主要仪器和设备
酶标仪:synergH1型,美国伯腾仪器有限公司;
电子天平:ESJ200-4型,沈阳龙腾电子有限公司;
冷冻干燥机:LGJ-1D-80型,北京亚泰科隆仪器技术有限公司;
紫外可分光光度计:UV-3200型,上海美谱达仪器有限公司;
数显恒温水浴锅:HH-8型,国华电器有限公司;
pH计:DELTA 320型,梅特勒-托利多仪器有限公司;
离心机:5430R型,艾本德中国有限公司。
1.2 方法
1.2.1 鱼鳔胶原肽的制备工艺
草鱼鱼鳔→解冻清洗→剪碎(1 cm×1 cm)→0.15% NaOH浸泡1 h→0.15%硫酸浸泡1 h→中性80 ℃热水浸提2 h→冷冻干燥(样品温度-5 ℃,冷阱温度-80 ℃,真空度1.0 Pa)得鱼鳔明胶→调节底物(浓度3.09%、温度50 ℃和pH 6.0)→加风味蛋白酶酶解79.34 min→沸水浴灭酶10 min→7 500 r/min离心10 min→上清液过45 μm水相膜后冷冻干燥(样品温度-5 ℃,冷阱温度-80 ℃,真空度1.0 Pa)→鱼鳔胶原肽粉
1.2.2 pH对鱼鳔胶原肽抗氧化稳定性的影响 将鱼鳔胶原肽配制成20 mg/mL的溶液,用适宜浓度的HCl和NaOH溶液将鱼鳔胶原肽溶液pH分别调至2.0,4.0,6.0,8.0,10.0,12.0,室温下放置2 h后将溶液pH调回中性7.0。分别测定鱼鳔胶原肽的DPPH自由基清除能力、OH自由基清除能力和还原力。
1.2.3 温度对鱼鳔胶原肽抗氧化稳定性的影响 将鱼鳔胶原肽配制成20 mg/mL的溶液,分别在20,40,60,80,100 ℃水浴条件下保持2 h,再用冰水快速冷却至室温[(25±2) ℃]。分别测定鱼鳔胶原肽的DPPH自由基清除能力、OH自由基清除能力和还原力。
1.2.4 食品配料对鱼鳔胶原肽抗氧化稳定性的影响 将鱼鳔胶原肽配制成20 mg/mL的溶液,分别单独添加不同溶度(2%,4%,6%,8%,10%)的 NaCl、葡萄糖、蔗糖,混合均匀后室温放置2 h。分别以相应浓度的 NaCl、葡萄糖、蔗糖的去离子水溶液为对照,排除NaCl、葡萄糖、蔗糖对鱼鳔胶原肽抗氧化检测的干扰。分别测定鱼鳔胶原肽的DPPH自由基清除能力、OH自由基清除能力和还原力。
1.2.5 金属离子对鱼鳔胶原肽抗氧化稳定性的影响 将鱼鳔胶原肽配制成20 mg/mL的溶液,分别添加不同浓度(1,2,3,4,5 mmol/L)的K+、Ca2+、Mg2+、Cu2+、Zn2+离子,室温放置2 h。以相应浓度K+、Ca2+、Mg2+、Cu2+、Zn2+离子的去离子水溶液为对照,排除金属离子本身对鱼鳔胶原肽抗氧化检测的干扰。分别测定鱼鳔胶原肽的DPPH自由基清除能力、OH自由基清除能力和还原力。
1.2.6 防腐剂对鱼鳔胶原肽抗氧化稳定性的影响 将鱼鳔胶原肽配制成20 mg/mL的溶液,分别添加0.05%,0.10%,0.15%,0.20%,0.25%的苯甲酸钠和山梨酸钾,混合均匀后室温放置2 h,以相应浓度的苯甲酸钠和山梨酸钾的去离子水溶液为对照,排除防腐剂对鱼鳔胶原肽抗氧化检测的干扰。分别测定鱼鳔胶原肽的DPPH自由基清除能力、OH自由基清除能力和还原力。
1.2.7 模拟胃、肠道消化对鱼鳔胶原肽抗氧化稳定性的影响
在37 ℃用胃蛋白酶酶解模拟胃部消化,再用胰液素酶解模拟肠道消化。配制20 mg/mL的鱼鳔胶原肽溶液用1 mol/L的HCl调pH至 2.0,按酶与底物比([E]/[S])为1%加入胃蛋白酶,震荡酶解2 h。酶解结束后,沸水浴10 min灭酶,快速冷却至室温后,7 500 r/min离心15 min,取上清液分为2份,一份用于抗氧化活性测定,一份用于模拟肠道消化。用0.9 mol/L的NaHCO3溶液将pH调为5.3,再用NaOH进一步将pH调至7.5,按[E]/[S]为1%加入胰液素,震荡酶解2 h,沸水浴10 min灭酶,测定抗氧化活性。分别以相同条件未加鱼鳔胶原肽的胃蛋白酶、胰液素灭活溶液为对照,排除灭活后胃蛋白酶、胰液素的干扰[13-14]。
1.2.8 DPPH自由基清除能力的测定 根据文献[15]修改如下:用95%乙醇配制0.2 mmol/L DPPH溶液,各取100 μL鱼鳔胶原肽溶液与DPPH溶液于96孔酶标板混合均匀,常温避光反应30 min,于517 nm处测定吸光值(A1)。以100 μL 95%乙醇代替DPPH溶液与100 μL去离子水反应为空白组(A0),以100 μL DPPH溶液与100 μL去离子水反应为对照组(A2)。按式(1)计算DPPH自由基清除率。

(1)
式中:
E——DPPH自由基清除率,%;
A2——DPPH与去离子水反应的吸光值;
A1——DPPH与样品反应的吸光值;
A0——95%乙醇与样品反应的吸光值。
1.2.9 OH自由基清除能力的测定 根据文献[16]修改如下:取1.0 mL鱼鳔胶原肽溶液依次加入2 mL 1.8 mmol/L FeSO4、1.5 mL 1.8 mmol/L 水杨酸—乙醇和0.1 mL 8.8 mmol/L H2O2,37 ℃水浴30 min。反应结束后取200 μL混合液于96孔酶标板,于510 nm处测定样品吸光值(Ai),以去离子代替样品液的吸光值(A0)。按式(2)计算OH自由基清除率。
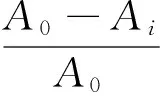
(2)
式中:
E——OH自由基清除率,%;
Ai——样品反应的吸光值;
A0——去离子水代替样品反应的吸光值。
1.2.10 还原力的测定 根据文献[17]修改如下:取鱼鳔胶原肽溶液2 mL、磷酸盐缓冲液(0.2 mol/L,pH 6.6)2 mL、1% K3FeCN6溶液2 mL,混合均匀后50 ℃水浴20 min,反应结束后加入10%三氯乙酸2 mL,3 000 r/min离心10 min,溶液由黄色变为蓝色,于700 nm处测定吸光值。
1.2.11 活性保持率的测定 分别测定鱼鳔胶原肽处理前抗氧化活性和处理后的抗氧化活性,按式(3)计算活性保持率。

(3)
式中:
R——活性保持率,%;
A0——处理前抗氧化活性;
A1——处理后的抗氧化活性。
2 结果与讨论
2.1 pH对鱼鳔胶原肽抗氧化稳定性的影响
由图1可知,在pH为2~6时,鱼鳔胶原肽的DPPH、OH自由基清除活性保持率较高,但在pH为8~12时,活性保持率下降迅速,pH为12时最低,DPPH自由基、OH自由基清除活性保持率均低于10%,失去大部分活性,可能是碱性条件下,多肽易发生消旋作用,造成一些L-型氨基酸变成D-型氨基酸,进而引起极性和空间位阻等结构性质变化,降低生物活性[18]。因此,酸性条件有利于鱼鳔胶原肽DPPH自由基、 OH自由基清除活性保持,强碱环境容易造成活性损失。Zhang等[19]研究大黄鱼肉多肽的抗氧化稳定性,结果发现多肽在酸性条件活性较高,碱性环境活性易损失,与本研究结果一致。当pH为2~12时,鱼鳔胶原肽还原力活性保持率较高,并且pH对其无显著影响(P>0.05),可能是还原力主要反映的是得失电子和还原能力,与酸碱环境无关[20]。此结果与吴静等[21]的研究结果一致。综上所述,在加工利用过程中,建议鱼鳔胶原肽在偏酸性中使用,避免处于强碱性环境下。

图1 pH对鱼鳔胶原肽抗氧化活性的影响Figure 1 Effect of pH on antioxidantactivity of collagen peptides from swimming bladders
2.2 温度对鱼鳔胶原肽抗氧化稳定性的影响
高温和热处理是食品加工常用的手段之一,在温度较高的条件下,功能性食品是否能保持高活性,是评价其能否作为具有商业潜力产品的重要因素之一[22]。由图2可知,在20~80 ℃时,DPPH自由基清除活性保持率和还原力保持率基本无明显变化(P>0.05),且100 ℃时,2种活性保持率均有显著提高(P>0.05)。这可能是高温可以在一定程度改变多肽的空间构象,进而使活性发生一定的变化[23]。而温度对鱼鳔胶原肽OH自由基清除活性保持率无显著影响(P>0.05),活性保持率均在97.73%以上。综上所述,鱼鳔胶原肽具有很好的耐热性,高温不会降低其抗氧化活性,100 ℃高温时,DPPH自由基清除活性和还原力反而有所升高。
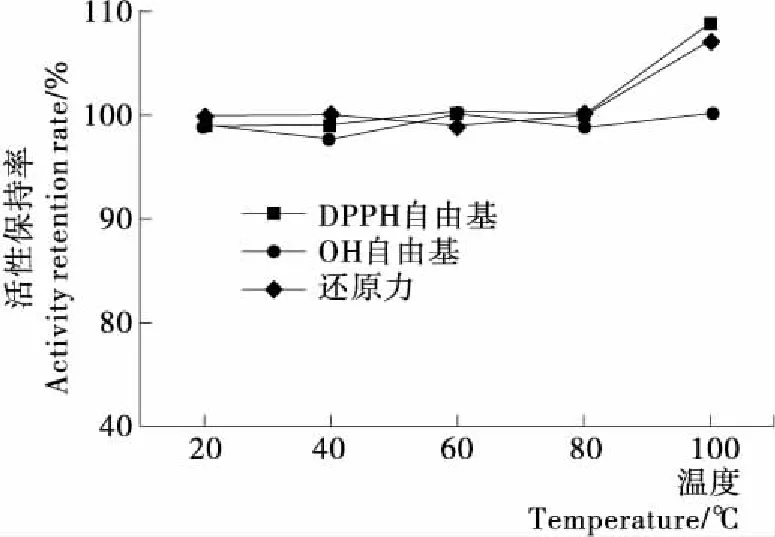
图2 温度对鱼鳔胶原肽抗氧化活性的影响Figure 2 Effect of temperature onantioxidant activity of collagen peptides from swimming bladders
2.3 食品配料对鱼鳔胶原肽抗氧化稳定性的影响
由图3(a)、(b)可知,添加2%~10%的葡萄糖和蔗糖对鱼鳔胶原肽的DPPH、OH自由基清除活性保持率没有显著影响(P>0.05),可能是在室温、短时(2 h)条件下,葡萄糖和蔗糖与多肽相互作用较弱,发生美拉德反应程度也非常低。此结果与李致瑜等[24]的研究一致。由图3(c)可知,随着葡萄糖浓度的增大,还原力保持率也逐渐升高,当葡萄糖浓度10%时,还原力相比未添加葡萄糖的样品增加了15%;蔗糖的添加对鱼鳔胶原肽还原力无显著影响(P>0.05)。NaCl浓度低于4%,鱼鳔胶原肽的抗氧化活性保持率依然较高,损失较少,但随着NaCl浓度的提高,鱼鳔胶原肽的DPPH、OH自由基清除活性保持率和还原力保持率均逐渐下降,而且NaCl浓度对OH自由基清除活性保持率的影响最大。当NaCl浓度10%时,活性保持率降低为62.61%;DPPH自由基清除活性保持率次之,降低为72.10%;还原力保持率最小,活性保持率为81.02%。这可能是盐离子电荷屏蔽效应中和肽的静电排斥力,进而导致其聚集凝结,降低了鱼鳔胶原肽的作用浓度及抗氧化活性[19]。综上所述,在利用鱼鳔胶原肽作功能食品加工时,蔗糖和葡萄糖的添加,对鱼鳔胶原肽的抗氧化活性没有影响,而应避免添加高浓度的食盐。
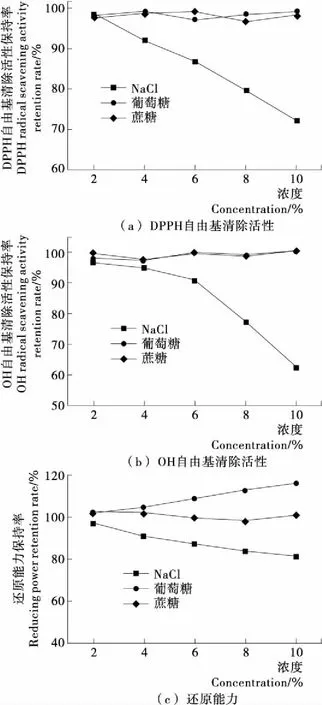
图3 食品配料对鱼鳔胶原肽DPPH自由基清除活性、OH自由基清除活性、还原能力的影响
Figure 3 Effect of food auxiliary on DPPH radical scavening activity, OH radical scavening activity, reducing power of collagen peptides from swimming bladders
2.4 金属离子对鱼鳔胶原肽抗氧化稳定性的影响
一些金属离子(如Ca2+,K+,Cu2+,Mg2+,Zn2+等)广泛存在食品体系中,适量摄入金属离子有利于维持机体的生理平衡,但是过量的金属离子易损害机体健康。因此,研究金属离子对鱼鳔胶原肽的抗氧化稳定性具有重要意义。由图4可知,K+和Mg2+对鱼鳔胶原肽的DPPH自由基清除活性无显著影响(P>0.05),随着浓度增大,Ca2+对DPPH自由基清除活性保持率有小幅降低,但活性仍然保持在91.78%以上。Ca2+,K+,Mg2+对鱼鳔胶原肽OH自由基清除活性和还原力保持率无显著影响。Cu2+和Zn2+会显著降低鱼鳔胶原肽的抗氧化活性,其DPPH、OH自由基清除能力和还原力保护率均有不同程度的降低,还原力保持率降低最多,DPPH 自由基清除活性次之。当Cu2+和Zn2+浓度为5 mmol/L 时,还原力分别降低至28.67%和18.92%,可能是Cu2+和Zn2+能和鱼鳔胶原肽发生螯合作用,形成螯合物,导致抗氧活性降低[25]。此结果与胡晓等[26]研究的金属离子对鸢乌贼肽的抗氧化稳定性结果一致。综上所述,金属离子Zn2+、Cu2+对鱼鳔胶原肽抗氧化稳定性的影响较大,Ca2+的影响较小,K+、Mg2+无显著影响,加工过程中应避免鱼鳔胶原肽与铜和锌制器皿接触,防止抗氧化活性损失。

图4 金属离子对鱼鳔胶原肽DPPH自由基清除能力、OH自由基清除活性、还原能力的影响
Figure 4 Effect of metal ions on DPPH radical scavening activity, OH radical scavening activity, reducing power of collagen peptides from swimming bladders
2.5 防腐剂对鱼鳔胶原肽抗氧化稳定性的影响
防腐剂被广泛用于食品加工以防止产品发生腐败,延长产品的货架期。因此,研究防腐剂对鱼鳔胶原肽抗氧化稳定性的影响十分有必要。苯甲酸钠、山梨酸钾对鱼鳔胶原肽抗氧化活性保持率的变化规律见图5。苯甲酸钠和山梨酸钾对鱼鳔胶原肽DPPH自由基清除活性保持率有一定的升高,但各浓度之间无显著差异(P>0.05),而对OH自由基清除活性和还原力保持率无显著影响(P>0.05)。赵明谋等[27]发现苯甲酸钠对蓝圆鲹多肽抗氧化稳定性的影响较小,而且随着浓度增加,变化也不明显。因此,在加工鱼鳔胶原肽时,合理范围使用防腐剂山梨酸钾和苯甲酸钠对其抗氧化活性无显著影响。
2.6 模拟胃、肠道消化对鱼鳔胶原肽抗氧化稳定性的影响
由图6可知,胃蛋白酶消化2 h后,鱼鳔胶原肽的DPPH、OH自由基清除活性和还原力保持率变化均不显著(P>0.05)。经肠道酶胰蛋白酶消化2 h后,鱼鳔胶原肽的抗氧化活性保持率无明显变化(P>0.05),说明鱼鳔胶原肽具有很好的消化稳定性,胃肠道酶对其没有影响。

图5 防腐剂对鱼鳔胶原肽DPPH自由基清除能力、OH自由基清除活性、还原能力的影响
Figure 5 Effect of preservatives on DPPH radicalscavening activity, OH radical scavening activity, reducing power of collagen peptides from swimming bladders
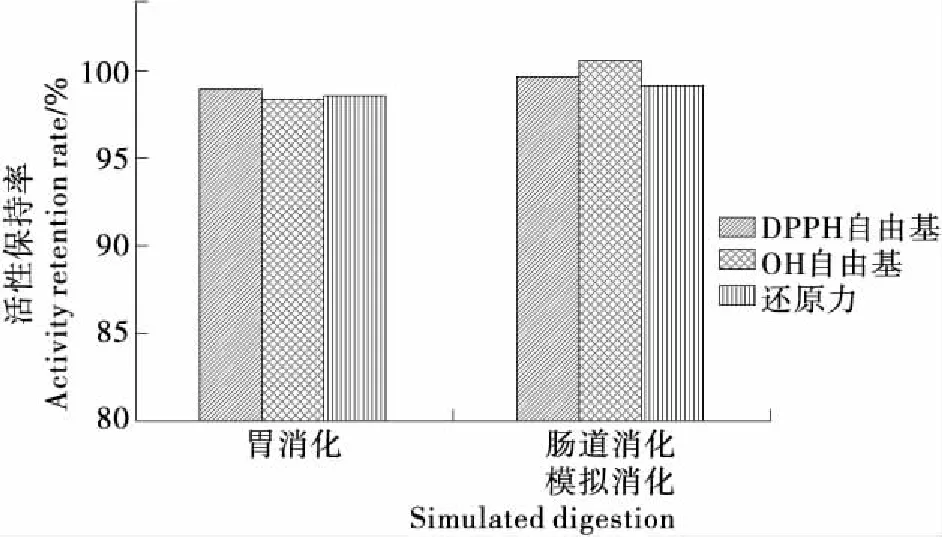
图6 体外模拟胃肠道消化对鱼鳔胶原肽抗氧化活性的影响
Figure 6 Effect ofsimulated gastrointestinal digestion in vitro on antioxidant activity of collagen peptide from swimming bladder
3 结论
本试验以DPPH自由基清除活性、OH自由基清除活性和还原力3种抗氧化模型为评价体系,研究多种加工贮藏条件和模拟胃肠道消化对鱼鳔胶原肽抗氧化稳定性的影响。结果表明,鱼鳔胶原肽对碱的耐受性差,中性偏酸性条件有利于其抗氧化活性的保持;耐热性好,高温不会降低其活性;金属离子Zn2+、Cu2+对鱼鳔胶原肽抗氧化稳定性的影响较大,Ca2+的影响较小,K+、Mg2+无显著影响。蔗糖和葡萄糖的添加对鱼鳔胶原肽的抗氧化活性影响不显著,而食盐会降低其活性;防腐剂苯甲酸钠、山梨酸钾对鱼鳔胶原肽抗氧化活性的影响较小;鱼鳔胶原肽具有较好的耐消化性,胃肠道酶对其抗氧化活性无显著影响。因此,鱼鳔胶原肽具有较好的抗氧化稳定性,本研究可为鱼鳔胶原肽合理加工利用提供一定的理论依据。后续可对鱼鳔胶原肽进行分离纯化,深入研究鱼鳔胶原肽的抗氧化组分。
[1] ZHUANG Yong-liang, ZHAO Xue, LI Ba-fang. Optimization of antioxidant activity by response surface methodology in hydrolysates of jellyfish (Rhopilemaesculentum) umbrella collagen[J]. Journal of Zhejiang University Science B, 2009, 10(8): 572-579.
[2] YOU Li-jun, REGENSTEIN J M, LIU Rui-hai. Optimization of hydrolysis conditions for the production of antioxidant peptides from fish gelatin using response surface methodology[J]. Journal of Food Science, 2010, 75(6): C582-C587.
[3] CAI Lu-yun, WU Xiao-sa, ZHANG Yu-hao, et al. Purification and characterization of three antioxidant peptides from protein hydrolysate of grass carp (Ctenopharyngodonidella) skin[J]. Journal of Functional Foods, 2015, 16: 234-242.
[4] JIANG Hai-ping, TONG Tian-zhe, SUN Jian-hua, et al. Purification and characterization of antioxidative peptides from round scad (Decapterusmaruadsi) muscle protein hydrolysate[J]. Food Chemistry, 2014, 154: 158-163.
[5] BRANDELLI A, DAROIT D J, CORREA A P F. Whey as a source of peptides with remarkable biological activities[J]. Food Research International, 2015, 73: 149-161.
[6] SANNAVEERAPPA T, WESTLUND S, SANDBERG A S, et al. Changes in the antioxidative property of herring (Clupeaharengus) press juice during a simulated gastrointestinal digestion[J]. Journal of Agricultural and Food Chemistry, 2007, 55(26): 10 977-10 985.
[7] SILA A, BOGATEF A. Antioxidant peptides from marine by-products: Isolation, identification and application in food systems: A review[J]. Journal of Functional Foods, 2016, 21: 10-26.
[8] YOU Juan, LUO Yong-kang, SHEN Hui-xing, et al. Effect of substrate ratios and temperatures on development of Maillard reaction and antioxidant activity of silver carp (Hypophthalmichthysmolitrix) protein hydrolysate-glucose system[J]. Interna-tional Journal of Food Science & Technology, 2011, 46(12): 2 467-2 474.
[9] KETNAWA S, MARTINEZ-ALVAREZl O, BENJAKUL S, et al. Gelatinhydrolysates from farmed Giant catfish skin using alkaline proteases and its antioxidative function of simulated gastro-intestinal digestion[J]. Food Chemistry, 2016, 192: 34-42.
[10] DELGADO M C O, GALLEANO M, ANON M C, et al. Amaranth peptides from simulated gastrointestinal digestion: antioxidant activity against reactive species[J]. Plant Foods for Human Nutrition, 2015, 70(1): 27-34.
[11] 段振华. 鱼鳔加工应用的研究进展[J]. 中国食物与营养, 2009(6): 34-36.
[12] 涂宗财, 唐平平, 郑婷婷, 等. 响应面优化鱼鳔胶原肽制备工艺及其抗氧化活性研究[J]. 食品与发酵工业, 2017, 43(5): 160-166.
[13] HIMAYA S W A, NGO D H, RYU B M, et al. An active peptide purified from gastrointestinal enzyme hydrolysate of Pacific cod skin gelatin attenuates angiotensin-1 converting enzyme (ACE) activity and cellular oxidative stress[J]. Food Chemistry, 2012, 132(4): 1 872-1 882.
[14] YOU Li-jun, ZHAO Mou-ming, REGENSTEIN J M, et al. Changes in the antioxidant activity of loach (Misgurnusanguillicaudatus) protein hydrolysates during a simulated gastrointestinal digestion[J]. Food Chemistry, 2010, 120(3): 810-816.
[15] LEE J K, YUN J H, JEON J K, et al. Effect of antioxidant peptide isolated from Brachionuscalyciflorus[J]. Journal of the Korean Society for Applied Biological Chemistry, 2010, 53(2): 192-197.
[16] 王运改, 林琳, 李明辉, 等. 鮰鱼皮明胶抗氧化肽的制备工艺研究[J]. 食品科学, 2010(19): 254-258.
[17] UDENIGWE C C, LU Yeh-lin, HAN Chuan-hsiao, et al. Flaxseed protein-derived peptide fractions: Antioxidant properties and inhibition of lipopolysaccharide-induced nitric oxide production in murine macrophages[J]. Food Chemistry, 2009, 116(1): 277-284.
[18] LIARDONY R, JOST R. Racemization of free and protein-bound amino acids in strong mineral acid[J]. Chemical Biology & Drug Design, 1981, 18(5): 500-505.
[19] ZHANG Chong, ZHANG Ning-ning, LI Zhi-yu, et al. Stability of antioxidant peptides prepared from large yellow croaker (Pseudosciaenacrocea)[J]. Current Topics in Nutraceuticals Research, 2016, 14(1): 37-48.
[20] 胡晓, 武琼, 杨贤庆, 等. 裂壶藻渣酶解产物的抗氧化稳定性[J]. 食品科学, 2015, 36(11): 21-26.
[21] 吴静, 胡晓, 杨贤庆, 等. 鸢乌贼酶解产物的抗氧化稳定性与功能特性[J]. 南方水产科学, 2016, 12(5): 105-111.
[22] MOREIRA S A, DUARTE R V, FERNANDES P A R, et al. Hyperbaric storage preservation at roomtemperature using an industrial-scale equipment: Case of two commercial ready-to-eat pre-cooked foods[J]. Innovative Food Science & Emerging Technologies, 2015, 32: 29-36.
[23] CHEN Hua-ming, MURAMOTO K, YAMAUCHI F. Structural analysis of antioxidative peptides from Soybean. beta.-Conglycinin[J]. Journal of Agricultural and Food Chemistry, 1995, 43(3): 574-578.
[24] 李致瑜, 张翀, 田玉庭, 等. 大黄鱼内脏抗氧化肽的稳定性研究[J]. 现代食品科技, 2016, 32(1): 151-158.
[25] 吴燕燕, 王晶, 李来好, 等. 添加剂和光照对合浦珠母贝肉酶解液抗氧化活性的影响[J]. 食品工业科技, 2015, 36(2): 149-156.
[26] 胡晓, 吴静, 杨贤庆, 等. 添加物和体外模拟胃肠道消化对鸢乌贼抗氧化肽稳定性的影响[J]. 食品与发酵工业, 2016, 42(11): 91-96.
[27] 赵谋明, 何婷, 赵强忠, 等. 蓝园鲹抗氧化肽抗氧化稳定性研究[J]. 食品科学, 2009, 30(1): 128-130.
Studyonantioxidationstabilityofcollagenpeptidespreparedfromswimmingbladders
The change of scavenging activity on DPPH radical, hydroxyl free radical, and reducing power capacity was selected as the index to investigate the effects of pH, temperature, sucrose, preservatives, metal ions and gastrointestinal digestion in vitro on the antioxidant stability of collagen peptides from swimming bladders. The results showed that collagen peptides from swimming bladders kept high activity in acidity environment but lose it in alkaline condition; however, the strong heat-resistance was found; sucrose, NaCl and preservatives (sodium Benzoate and Sodium sorbate) had little effects on its antioxidation stability, but high levels of salt made it lost antioxidation stability partially. Metal ions Cu2+and Zn2+had a larger effect on the antioxidant stability of collagen peptides from swimming bladders than Ca2+, and Mg2+and K+showed no significant effect. collagen peptides from swimming bladders had a good digestibility, and gastrointestinal enzymes had no effects on its activity.
swimming bladders; collagen peptides; antioxidant activity; stability
江西省重大生态安全问题协同创新中心项目(编号:JXS-EW-00);江西省现代农业产业技术体系建设专项(编号:JXARS-03)
郑婷婷,女,江西师范大学在读硕士研究生。
涂宗财(1965—),男,江西师范大学教授,博士。
E-mail:tuzc_mail@aliyun.com
2017—05—02
10.13652/j.issn.1003-5788.2017.09.003
