TSNAs降解菌05-5402的筛选及其降解特性研究
2017-11-16雷丽萍吴玉萍莫笑晗周骏夏振远
雷丽萍,吴玉萍,莫笑晗,周骏,夏振远
1 云南省烟草农业科学研究院 昆明 630021;
2 上海烟草集团北京卷烟厂 北京 010000
生物技术
TSNAs降解菌05-5402的筛选及其降解特性研究
雷丽萍1,吴玉萍1,莫笑晗1,周骏2,夏振远1
1 云南省烟草农业科学研究院 昆明 630021;
2 上海烟草集团北京卷烟厂 北京 010000
为分离筛选能够降解TSNAs的微生物,探讨其降解特性,本研究采用替代底物平板稀释法分离和靶标底物点接法筛选相结合的分离筛选策略,筛选到能够利用NNK为唯一碳源和氮源而生长的细菌05-5402菌株,鉴定为短小芽孢杆菌(Bacillus pumilus)。白肋烟浸提液经05-5402菌株处理后,TSNAs含量降低了22.2%,其中NNK和NAT的含量分别降低了47.4%和55.7%。晾制的烟叶经05-5402菌株处理后,TSNAs降低17.3%,其中,NAB的含量降低了52.2%。发酵过程中的烟丝经05-5402菌株处理,TSNAs含量下降12.2%。05-5402菌株能实现烟草特有亚硝胺的高效定向降解,具有较大的应用潜力。
烟草;烟草特有亚硝胺;短小芽孢杆菌;降解特性
烟草特有亚硝胺(TSNAs)是烟草特有的N-亚硝基类化合物,是烟叶中重要的有害成分[1],NNN、NNK、NAB、NAT是烟草和烟气中主要的TSNAs[2-3]。烟叶是卷烟的主要原料,也是卷烟烟气中TSNAs的主要来源[4]。影响烟叶中TSNAs含量的因素很多,其中主要有烟草类型[5]、烟草组织[6]、栽培方式[7]、调制方法[8]、微生物降解[9]、氮肥施用量[10]、硝酸还原酶及亚硝化酶的活性等。目前已有的有效方法通过改变上述影响因子从而降低TSNAs的含量,例如选育良种、控制氮肥、适时采收等农业栽培措施,及利用马来酰肼、维生素C和α-生育酚等化学制剂等。利用微生物也是一个具有应用前景的TSNAs调控措施,日本烟草产业株式会社[11]利用少动鞘氨醇单胞菌和荧光假单胞菌减少烟叶中TSNAs含量;张玉芹等[9]利用反硝化细菌降低烟丝中硝酸盐、亚硝酸盐和TSNAs含量;张玉玲等[12]用放线根瘤菌(Rhizobium radiobacter)对烟株进行灌根处理,采收时喷洒烟叶处理,结果为两种处理的烟叶TSNAs含量明显降低。据现有的研究,推测某些微生物能够降低烟草TSNAs含量的机制主要包括两个方面,一是这些微生物具有还原硝酸盐和亚硝酸盐的能力,使TSNAs合成的前体物质减少,导致烟草TSNAs含量下降;另一种可能是接种微生物数量大或产生抗生素类物质,抑制引起TSNAs积累的微生物类群,从而降低TSNAs的含量[13]。综上,目前有关微生物降低烟草TSNAs含量的研究主要集中在微生物对TSNAs合成的环节,而对TSNAs降解的作用未见报道。本研究试图从微生物降解TSNAs的角度出发,研究降低烟草TSNAs微生物的资源和降解特性,为通过微生物降低烟草TSNAs含量提供理论依据。
1 材料与方法
1.1 材料
1.1.1 培养基
分离培养基(g/L):琼脂15.0、K2HPO41.5、KH2PO40.4、NaCl 0.1、MgSO4.7H2O 0.1、CaCl20.04、MnSO4.H2O 0.002、CuSO4.5H2O 0.001、ZnSO4.7H2O 0.002、NaMoO4.2H2O 0.002、 尼 古 丁1.0。
筛选培养基:上述分离培养基中的尼古丁替换为NNK。
1.1.2 仪器与器材
恒温恒湿箱(德国 Memmert公司)、高效液相色谱及三重四级杆质谱检测器(美国Waters公司)、PCR仪(美国Life Technologies公司)、高速大容量冷冻离心机(德国Eppendorf公司)、恒温摇床(瑞士 INFORS公司)。
1.1.3 试剂
NNK、NNN、NAT、NAB( ≥ 98%,Toronto Research Chemicals)、乙腈(色谱纯,MERCK)、其他试剂(分析纯,国产)、Taq酶及细菌基因组提取试剂盒(大连TaKaRa公司)。
1.1.4 烟丝
由上海烟草集团北京卷烟厂提供。
1.2 方法
1.2.1 05-5402菌株的分离筛选
将烟叶或植烟土壤研磨后加入无菌水,于室温下振荡提取30min,将提取悬浊液用稀释平板的方法25℃培养48 h,挑取能在分离培养基上旺盛生长的菌株;共计分离137个样品,得到869个菌落。将这些菌株以点接的方式转接到筛选培养基平板上,25℃培养48 h,有122株细菌能够生长,一株长势最旺盛的细菌标记为05-5402,菌株已在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏编号为CGMCC No.7418。
1.2.2 菌株鉴定
通过常规生物学、生理生化特性检测和分子生物学方法对菌株05-5402进行鉴定。菌株05-5402的形态特征及生理生化性状分析按照文献[14]进行。16S rRNA 基因序列测定分析方法如下:细菌基因组DNA的提取用TaKaRa MiniBEST Bacterial Genomic DNA Extraction Kit Ver.2.0,方法参见试剂盒说明书。PCR扩增选用引物F27(5′-AGAGTTTGATCCTGGCTCAG-3′) 和 R1492(5'-GGTTACCTTGTTACGACTT-3'),常规条件扩增,扩增产物经TaKaRa Agarose Gel DNA Puri fi cation Kit Ver.2.0回收后,连接于载体pMD18-T Vector,转化入感受态细胞E.coliDH5α,阳性克隆委托上海英骏生物技术有限公司进行序列测定。测得的16S rDNA全序列经EzTaxon server(http://www.ezbiocloud.net/)同源性搜索[15],并用Mega 4.0软件将该序列与常见的芽孢杆菌菌株的16S rDNA全序列构建立系统发育树。
1.2.3 烟草浸提液中TSNAs的降解
按白肋烟末∶蒸馏水=1∶10的比例混匀,超声波浸提30min后过滤,滤液调节pH至7.2~7.4,300mL三角瓶分装100mL灭菌。挑取05-5402一环接种,以不接菌作为对照(CK),各处理重复3次。150 rpm振荡培养48 h后,浸提液8000 rpm常温离心10min,经0.22 μm水相滤膜过滤,采用UPLCMS / MS 进行TSNAs含量分析[16]。
1.2.4 调制烟叶TSNAs的降解
采用半叶法进行调制烟叶TSNAs的降解实验,在调制前,一半叶片喷施4%叶重的05-5402发酵液,另一半喷施无菌水作为对照(CK)。将烟叶置于培养箱内,在30℃、相对湿度80%的条件下调制7 d,使叶片干燥。
TSNAs含量检测。将烟叶在65℃烘干研磨后过100目筛,称取烟末1.0 g(精确到0.1mg),置于100mL的锥形瓶中,加入20mL 100mmol/L的乙酸铵水溶液,超声萃取60min。静置后取2mL上层清液经0.2 μm水相滤膜过滤,进行UPLC-MS/MS检测TSNAs含量[16]。
1.2.5 烟丝中TSNAs的降解
05-5402菌株经LB培养基液体培养,离心去培养基后用无菌水重新悬浮,悬浮液含菌量为0.8×1010cfu/mL。烟丝充分混合均匀后分成处理和对照(CK)两组。处理组喷施烟丝重量4%的05-5402菌悬液,对照组喷施等量的无菌水,处理和对照各设3次重复。将烟丝的水分含量调整到30%(m/m),放置于30℃,相对湿度为80%的恒温恒湿培养箱内处理5d。处理后烟丝TSNAs含量检测方法同1.2.4。
1.2.6 统计方法
检测数据采用PAST V.3.14进行标准偏差计算和t检验分析。
2 结果与分析
2.1 05-5402菌株的鉴定
05-5402菌株于28℃在NA平板上培养24 h,菌落呈圆形,直径2~3 mm,扁平无凸起,乳白色,有光泽,边缘不整齐,为好氧菌。菌株为革兰氏阳性,芽孢椭圆形中生或端生,不膨大,芽孢比菌体小,存在于菌体中,菌体平均大小为0.61~0.68 μm×2.2~2.8 μm。该菌株过氧化氢酶实验、VP实验、产H2S实验、明胶液化实验、卵磷脂酶实验反应呈阳性;水解淀粉实验、产NH3实验、甲基红实验、吲哚实验、水解脂肪实验、硝酸盐还原实验反应呈阴性。
05-5402菌株经核酸提取后,16s rDNA扩增测序得到1513 bp的核酸序列,Genbank注册号KY427112,经EzTaxon server(http://www.ezbiocloud.net/)同源性搜索,该菌16s rDNA序列与芽孢杆菌同源性最高,相似性为99.52%。在Ribosomal Database数据库中选取10株属于Bacillus属的不同种的芽孢杆菌模式菌株构建系统发育树,查看属种间的遗传进化关系(图1)。从系统发育树看,05-5402与B.pumilus、B.australimaris和B.zhangzhouensis处 于同一分支,说明它们的遗传进化关系最近,结合05-5402菌株的生理生化特性,将其鉴定为短小芽孢杆菌(B.pumilus)。
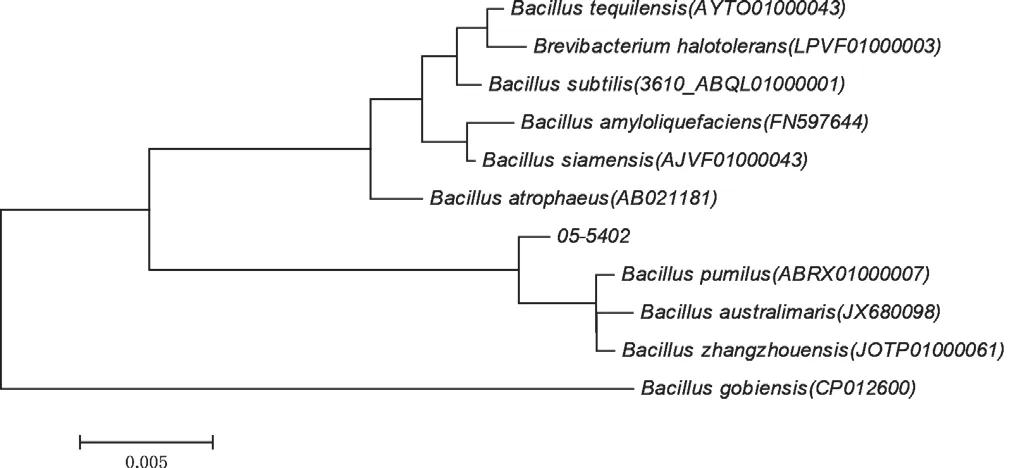
图1 菌株05-5402的16S rDNA序列系统发育树Fig.1 Neighbour-joining phylogenetic tree based on 16S rDNA sequence of 05-5402
2.2 05-5402菌株对烟草浸提液TSNAs的降解
由表1的实验结果数据可知,菌株05-5402对白肋烟浸提液中的TSNAs具有降解效果。经48 h处理,浸提液中TSNAs含量较对照降低了22.2%,处理与对照达到了极显著的差异水平,NNK和NAT的含量分别降低了47.4%和55.7%。
2.3 05-5402菌株对烟叶TSNAs的降解
通过半叶法评价05-5402在烟叶晾制阶段对TSNAs的降解作用,由表2数据可知,菌株05-5402能使烟叶中的TSNAs含量明显下降,总体下降幅度为17.3%,t检验结果显示差异显著。NAB的含量降低了52.2%,达极显著水平,其他3种TSNAs也有降低,但t检验差异不显著。
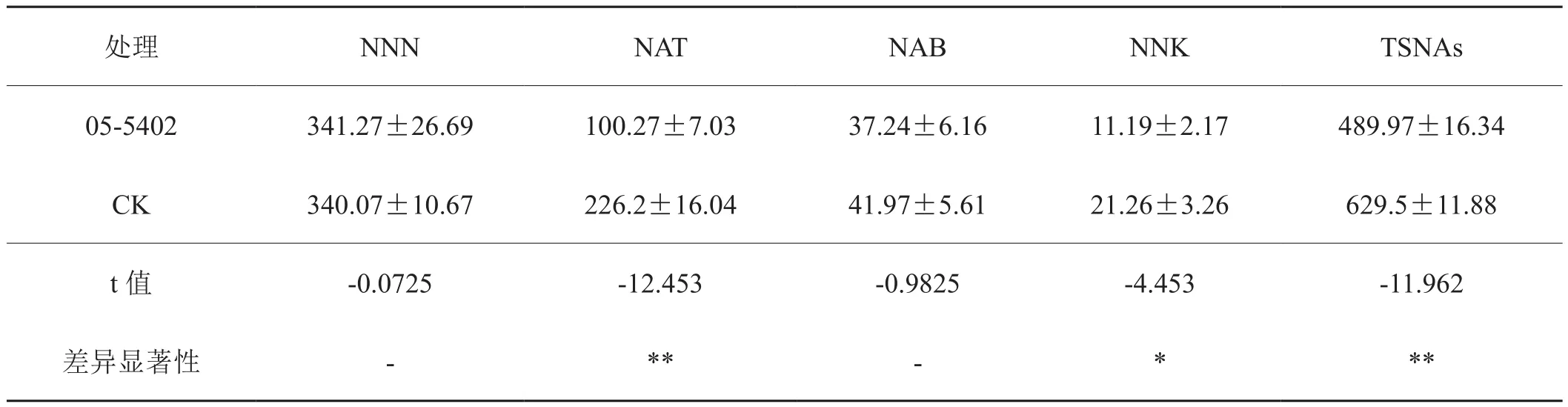
表1 菌株05-5402对烟草浸提液中TSNAs的降解效果Tab.1 Effect of strain 05-5042 on the contents of TSNAs of burley tobacco extracts ng/g
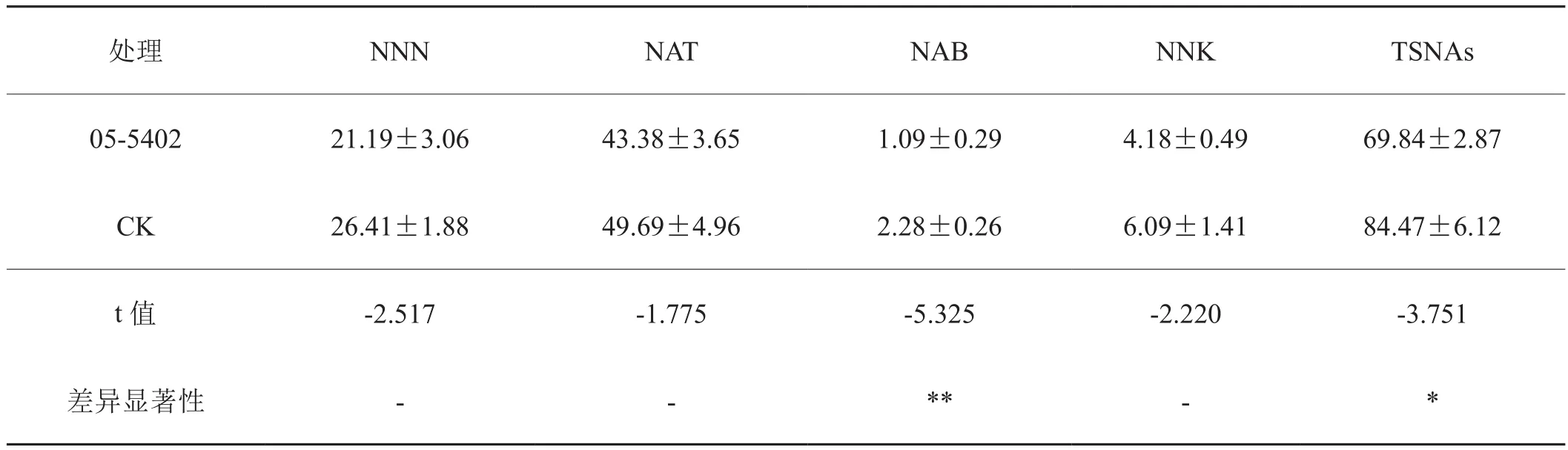
表2 菌株05-5402对调制期烟叶中TSNAs的降解效果Tab.2 Effect of strain 05-5042 on the contents of TSNAs of tobacco during air-curing ng/g
2.4 05-5402菌株对发酵烟丝中TSNAs的降解
由表3数据可知,菌株05-5402能使烟丝中的TSNAs含量明显下降,总体降低了12.2%,对4种TSNAs均有降解效果。其中,NNN、NAT和NAB的含量分别降低了12.9%、11.0%和10.3%。经t检验,NNN和TSNAs在05-5402菌株处理和对照之间差异达到了极显著水平。

表3 菌株05-5402对烟丝中TSNAs的降解效果Tab.3 Effect of strain 05-5042 on the contents of TSNAs in cut tobacco ng/g
3 讨论与结论
以往的研究[17-20],多以细菌的硝酸还原能力来筛选降解菌株,喷施微生物能降低烟叶中的TSNAs含量,这些研究是建立在TSNAs的形成是以亚硝酸盐以及氮氧化物(NOX)为底物的理论基础上,通过微生物的作用降低烟叶中的亚硝酸盐,而降低烟叶中TSNAs的合成数量。已有研究证明,某些微生物可以降解TSNAs[21],按照微生物降解TSNAs的思路,本研究利用替代底物平板稀释法分离和靶标底物点接法筛选相结合,筛选到能够利用NNK为唯一碳源和氮源而生长的细菌。以尼古丁替代TSNAs作为培养基进行微生物分离,以靶标底物点接法进行功能筛选,避免了研究过程中使用大量的靶标TSNAs,利于降低研究成本。本研究从有降解尼古丁功能的869株细菌中筛选到以NNK为唯一碳源和氮源的菌株122株,说明在自然界中存在着大量的能降解NNK的微生物。此结果将丰富应用微生物降低烟草TSNAs含量的资源和途径。本研究通过对烟叶浸提液、烟叶和烟丝处理后的TSNAs含量检测,证明05-5402菌株均能降低TSNAs含量,其降解TSNAs的效率表现为溶液中大于烟丝发酵,其原因可能与菌株增殖和降解环境有关。有关05-5402菌株降解TSNAs的降解途径和机理等问题有待于进一步研究。
[1]Spiegelhalder B,Bartsch H.Tobacco-specific nitrosamines[J].European Journal of Cancer Prevention,1996,5(S1):33-38.
[2]Brunnemann K D,Hoffmann D.Analytical studies on tobacco speci fi c N-nitrosamines in tobacco and tobacco Smoke[J].Critical Reviews in Toxicology,1991,21(4):235-240.
[3]Hecht S S.Biochemistry,biology,and carcinogenicity of tobaccospecific N-nitrosamines[J].Chemical Research inToxicology,1998,11(6):559-603.
[4]Wu J C,Joza P,Sharifi M,et al.Quantitative method for the analysis of tobacco-specific nitrosamines in cigarette tobacco and mainstream cigarette smoke by use of isotope dilution liquid chromatography tandem mass spectrometry[J].Analytical Chemistry,2008,80(4):1341-1345.
[5]余义文,夏岩石,李荣华,等.不同类型及品种烟草特有亚硝胺含量的分析[J].烟草科技,2013,4:46-51.YU Yiwen,XIA Yanshi,LI Ronghua,et al.Analysis of TSNA contents in tobacco leaves of different types and cultivars[J].Tobacco Science & Technology,2013,4:46-51.
[6]孙榅淑,王俊,周骏,等.硝态氮含量对烟叶高温贮藏过程中TSNA形成的影响[J].中国烟草学报,2015,21(2):53-58.SUN Wenshu,WANG Jun,ZHOU Jun,et al.Effect of nitrate nitrogen level in tobacco leaves on TSNAs formation during high temperature storage[J].Acta Tabacaria Sinica,2015,21(2):53-58.
[7]李宗平,覃光炯,陈茂胜,等.不同栽培方式对白肋烟烟碱转化率及TSNA 含量的影响[J].中国烟草科学,2015,36(6):62-67.LI Zongping,QIN Guangjiong,CHEN Maosheng,et al.In fluence of different cultivation Methods on nicotine conversion and TSNA content of burley tobacco[J].Chinese Tobacco Science,2015,36(6):62-67.
[8]李宗平,覃光炯,陈茂胜,等.不同调制方法对烟草烟碱转化及TSNA 的影响[J].中国生态农业学报,2015,23(10):1268-1276.LI Zongping,QIN Guangjiong,CHEN Maosheng,et al.E ff ects of curing methods on conversion rate of nicotine and TSNAs contents of tobacco[J].Chinese Journal of Eco-Agriculture,2015,23(10):1268-1276.
[9]张玉芹,宫玮,刘开启,等.反硝化细菌对烟草特有亚硝胺的降解作用[J].仲恺农业技术学院学报,2007,20(1):5-8.ZHANG Yuqin,GONG Wei,LIU Kaiqi,et al.Degradation of tobacco—specific nitrosamines by denitrifying bacteria[J].Journal of Zhongkai University of Agriculture and Technology,2007,20(1):5-8.
[10]彭丽丽,韩富根,解莹莹,等.氮用量对烤烟叶片TSNA 前体物含量及硝酸还原酶活性的影响[J].中国烟草学报,2009,15(3):35-38.PENG Lili,HAN Fugen,XIE Yingying,et al.E ff ects of nitrogen level on TSNA precursors content and nitrate reductase activities in flue-cured tobacco[J].Acta Tabacaria Sinica,2009,15(3):35-38.
[11]古贺一治,胜屋聪.减少亚硝胺类的微生物和用其减少亚硝胺类的方法:中国,CN1652702.[P].2008-1-2.Koga Kazuharu,Katsuya Satoshi.Microorganism which reduces nitrosamines and method of reducing nitrosamines using the same:China,CN1652702.[P].2008-1-2.
[12]张玉玲,黄琼,汪安云,等.施用细菌菌株(WB5)对烟草特有亚硝胺含量变化的初步研究[J].中国烟草学报,2004,10(6):29-32.ZHANG Yuling,HUANG Qiong,WANG Anyun,et al.Research on reducing tobacco-specfic nitrosamines by spraying bacteria WB-5[J].Acta Tabacaria Sinica,2004,10(6):29-32.
[13]雷丽萍.烟草内生芽孢杆菌降低烟叶亚硝胺类物质含量的研究[J].西南农业学报,2007,20(3):515-520.LEI Liping.Reduction of tobacco spec if ic nitrosamine in aircured tobacco leaves by a bacterial endophyte(Bacillussp.)[J].Southwest China Journal of Agricultural Sciences,2007,20(3):515-520.
[14]东秀珠,蔡妙英.常见细菌鉴定系统手册[M].北京:科学出版社,2001:162-171.DONG Xiuzhu,CAI Miaoying.Manual of systematic and determinative bacteriology[M].Beijing:Science Press,2001:162-171.
[15]Chun J,Lee J H,Jung Y,et al.EzTaxon:a web-based tool for the identification of prokaryotes based on 16S ribosomal RNA gene sequences[J].IJSEM,2007,57:2259-2261.
[16]范多青,刘秀明,朱保昆,等.超高效液相色谱串联质谱快速检测卷烟主流烟气及烟丝中的TSNAs[J].中国烟草学报,2012,18(6):10-16.FAN Duoqing,LIU Xiuming,ZHU Baokun,et al.Rapid determination of TSNAs in cut tobacco and mainstream cigarette smoke by UPLC-MS/MS[J].Acta Tabacaria Sinica,2012,18(6):10-16.
[17]祝明亮,李天飞,汪安云.白肋烟内生细菌的分离鉴定及降低N-亚硝胺含量研究[J].微生物学报,2004,44(4):422-425.ZHU Mingliang,LI Tianfei,WANG Anyun.Isolation and identification of endophytic bacteria in burley tobacco and reduction to TSNA contents of burley tobacco[J].Acta microbiologica Sinica,2004,44(4):422-425.
[18]单宏英,陈德鑫,李晶,等.一株源于醇化烟叶表面高效降解TSNA菌株AS97的分离筛选、鉴定及应用[J].微生物学报,2011,51(10):1326-1333.SHAN Hongying,CHEN Dexin,LI Jing,et al.Identi fi cation and primary application of TSNA degrading bacterial strain AS97 isolated from aging tobacco leaves[J].Acta microbiologica Sinica,2011,51(10):1326-1333.
[19]汪安云.细菌对白肋烟叶片硝酸盐、亚硝酸盐和烟草特有亚硝胺含量的影响[J].中国烟草学报,2007,13(4):45-49.WANG Anyun.E ff ects of bacteria on nitrate,nitrite,and TSNAs content in burley tobacco[J].Acta Tabacaria Sinica,2007,13(4):45-49.
[20]雷丽萍,夏振远,郭荣君,等.非硝酸盐还原细菌K18 降低TSNA机理的初步研究[J].中国烟草科学,2009,30(5):54-57.LEI Liping,XIA Zhenyuan,GUO Rongjun,et al.Mechanism of non-nitrate reduction endophytic bacteria K1 8 on TSNA reduction[J].Chinese Tobacco Science,2009,30(5):54-57.
[21]Atawodi SE; Richter E..Bacterial reduction of N-oxides of tobacco- speci fi c nitrosamines(TSNA)[J].Human & Experimental Toxicology,1996,15(4):329-334.
Isolation and screen of TSNAs-degrading bacillus 05-5402 and its degradation characteristics
LEI Liping1,WU Yuping1,MO Xiaohan1,ZHOU Jun2,XIA Zhenyuan1*
1 Yunnan Academy of Tobacco Agricultural Science,Kunming 630021,China;
2 Beijing Cigarette Factory,Shanghai Tobacco Group,Beijing 010000,China
The aim of current study was to isolate and screen TSNAs-degrading microorganism,and study its degradation characteristics.TSNAs-degrading Bacillus isolate 05-5402 was obtained by isolating bacillus using dilution-plate method with nicotine as alternative substrate,and was screened by selective medium containing NNK as sole carbon and nitrogen sources.Isolate 05-5402 was identi fi ed asBacillus pumilusby physio-biochemical characteristics and 16S rRNA gene sequence analysis.Isolate 05-5402 could degrade 22.2% of total TSNAs in the extracts of burley tobacco,and 47.4% of NNK and 55.7% of NAT.Isolate 05-5402 could reduce 17.3% of total TSNAs in tobacco during air-curing period,and 52.2% of NAB.Total TSNAs content of cut tobacco was reduced by 12.2% after fermentation with isolate 05-5402.Isolate 05-5402 can degrade TSNAs efficiently,which has application potential.
tobacco; TSNAs;Bacillus pumilus; degradation characteristics

雷丽萍,吴玉萍,莫笑晗,等.TSNAs降解菌05-5402的筛选及其降解特性研究[J].中国烟草学报,2017,23(5)
中国烟草总公司卷烟减害技术重大专项(110201101035(JH-10))
雷丽萍(1963—),硕士,副研究员,主要从事低危害烟草研究,Tel:0871-65183692,Email:lplei@yntsti.com
夏振远(1971—),Tel:0871-65106032,Email:zyxia@yntsti.com
2017-01-09;< class="emphasis_bold">网络出版日期:
日期:2017-07-18
:LEI Liping,WU Yuping,MO Xiaohan,et al.Isolation and screen of TSNAs-degrading bacillus 05-5402 and its degradation characteristics[J].Acta Tabacaria Sinica,2017,23(5)
*Corresponding author.Email:zyxia@yntsti.com
