氧化镁催化臭氧氧化偶氮染料废水
2017-11-15俞志敏
陈 俊,金 杰,吴 克,俞志敏,吴 鹏,亓 洁
(1. 合肥学院生物与环境工程系,合肥 230601;2. 污水净化与生态修复材料安徽省重点实验室,合肥 230088;3. 安徽省环境污染防治与生态修复协同创新中心,合肥 230601)
氧化镁催化臭氧氧化偶氮染料废水
陈 俊1,2,金 杰1,2,吴 克1,3,俞志敏1,3,吴 鹏1,亓 洁1
(1. 合肥学院生物与环境工程系,合肥 230601;2. 污水净化与生态修复材料安徽省重点实验室,合肥 230088;3. 安徽省环境污染防治与生态修复协同创新中心,合肥 230601)
实验采取氧化镁催化臭氧氧化法来降解偶氮染料酸性橙黄II废水,对反应过程中影响因素和机理进行了分析。结果表明:使用体积为300 mL的废水,污染物初始浓度为100 mg/L时,当向废水中通入的臭氧量为1000 mg/h,加入的氧化镁量为0.4 g,反应温度为30oC,控制废水的pH达8.0时,降解率达到84.9 %。氧化镁催化臭氧反应是发生在反应液中催化剂表面和溶液的非均相和均相反应,氧化镁催化臭氧分解成自由基,自由基对偶氮染料具有较好的氧化效果,通过氧化镁催化臭氧氧化链式反应过程最终达到降解偶氮染料废水的目的。
偶氮染料废水;氧化镁;催化臭氧氧化;降解率;反应机制
我国属于世界染料产量大国,随着染料的大量使用,排放的染料废水也随之增长。染料废水的色度较深,偶氮染料是一种偶氮基两端连接芳基的一类有机化合物的染料,其具有色度高、有机物浓度高、可生化性差、毒性强等特征。[1]如何处理好偶氮等染料废水成为了一个重要的环境问题。[2-3]
臭氧催化氧化是以反应产生自由基作为氧化剂,通过亲电加成反应、脱氢反应、电子转移反应等方式去除水中有机污染物的重要催化氧化技术。在反应过程中,臭氧通过氧化反应快速氧化分解水中的有机物,导致染料中的显色基团被破坏,从而达到了脱色和降解废水中有机物的目的。[4]催化剂是臭氧催化氧化反应体系的核心,催化剂的加入能够促进强氧化性羟基自由基的生成,可以氧化常规水处理工艺不能有效降解的偶氮染料污染物,并且减少有毒有害的副产物产生。[5]在非均相催化臭氧化中,催化剂是以固态形式存在的,金属氧化物是一类被广泛应用于催化臭氧氧化的催化剂,其中氧化镁是一种廉价、无毒的臭氧催化剂,[6-7]实验采取氧化镁催化臭氧氧化法来处置偶氮染料废水,偶氮染料采用酸性橙黄II (AOII)作为模拟废水,[8]并考察氧化镁投加量、温度、pH、臭氧投加量和染料废水初始浓度等因素对降解效果的影响,对氧化镁催化臭氧氧化降解偶氮染料废水反应机理和反应过程进行了分析。
1 实验材料与方法
1.1实验试剂实验所用的硝酸镁、氢氧化钠、盐酸、甲醇(国药集团化学试剂有限公司),AOII上海阿拉丁生化科技股份有限公司),均为分析纯。
1.2催化剂的制备取一定量的六水合硝酸镁于坩埚中研磨,然后将其置于箱式电阻炉中,通电并对其设置最终温度为500oC,升温速度为10oC/min,加热保持时间为2 h,加热等待。达到煅烧时间后自然冷却后取出,再对氧化镁粉末研磨,然后用100目筛过筛,将通过的氧化镁装袋后置于干燥器中待用。
1.3实验装置实验过程反应装置如图1所示。
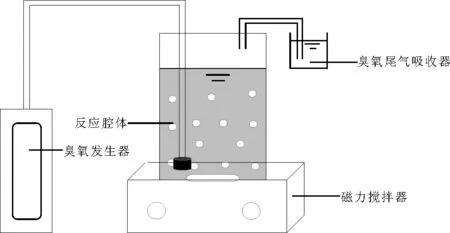
图1 反应装置示意图
实验过程中,将上述装置放在通风橱下进行,臭氧发生器产生的臭氧进入已加入氧化镁的含AOII染料废水中,通过臭氧发生器来调节臭氧流量,通过调节磁力加热搅拌器来调节温度和转速,在500 mL烧杯中,臭氧在氧化镁催化剂的催化作用下,对水中污染物进行降解,臭氧尾气采用碘化钾吸收。每隔一定的时间取一次水样,并将所得水样装瓶,最后测各水样的吸光度得出水样的浓度。
1.4分析方法AOⅡ浓度由紫外可见分光光度计在最大吸收波长484 nm出测定。实验中催化剂的晶型表征使用丹东通达TD-3500型 X射线衍射仪(XRD)测定。扫描电镜(SEM)分析采用日本Hitachi公司SU8010型扫描电镜进行分析观察。催化剂的比表面积采用美国Quantachrome Instruments自动气体吸附分析仪Autosorb-iQ-MP进行测定,催化剂先进行脱气处理,然后在液氮条件下N2吸附法进行测定。根据测得吸附等温线,计算出催化剂比表面积(SBET)等。
2 结果与讨论
2.1催化剂特征粉末催化剂的特征主要包括晶型、形貌、表面特性等。通过表征以获得催化剂的特征,解析催化剂的特征与其催化活性之间的关系。
2.1.1 物相组成分析 粉末的XRD图谱如图2所示。
分析结果显示制备的粉末在2θ为37.0o、43.0o、62.4o、74.8o和78.7o出现较强的衍射峰,其峰的位置与立方晶相的MgO的标准谱一致(PDF-#45-0946),没有其他杂峰的出现,说明热解得到的为纯的立方晶相的MgO。
2.1.2 形貌分析 采用SEM图对催化剂的形貌进行分析。结果如图3所示。
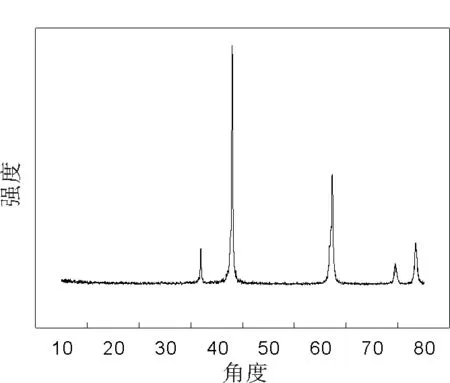
图2催化剂XRD图

图3催化剂的SEM图
由图3可以看出,SEM显示高温煅烧法的氧化镁为大小不均匀的圆球形。一般镁盐高温热解得到的择优暴露晶面是(100)晶面,(100)晶面是最稳定的晶面。氧化镁的(100)晶面是由镁离子和氧离子交替连接的平台棋盘结构,这种结构易于热解获得[9]。根据MgO的N2吸/脱附等温线,采用Brunauer-Emmett-Teller (BET)方法计算出MgO的SBET为13.4 m2/g。采用Barrett-Joyner-Halenda (BJH)方法计算出平均孔体积和孔径为0.023 cm3/g和 6.87 nm。
2.2MgO催化臭氧氧化降解AOⅡ染料废水性能研究氧化镁催化臭氧氧化偶氮染料废水过程中,臭氧投加量、催化剂投加量、废水初始pH、反应温度、污染物浓度等均会影响污染物的降解效率,因此,实验考察了这些因素对MgO催化臭氧氧化降解AOII的染料废水性能的影响。
2.2.1 臭氧投加量对AOII染料废水降解的影响 首先考察了臭氧投加量在催化臭氧氧化中的影响,实验条件在MgO为0.4 g,实验水样为300 mL,初始pH为5.5,AOII染料废水的浓度为100 mg/L,反应温度为25oC的条件下,探索不同臭氧投加量对MgO催化臭氧氧化降解AOII偶氮染料废水结果的影响,结果如图4所示。
由图4可知,臭氧投加量的改变对氧化镁催化臭氧氧化影响较大,在一定范围内,随着臭氧投加量的提高,MgO催化臭氧氧化降解AOII染料废水的降解率也不断增加,而当臭氧投加量为1500 mg/h时,MgO催化臭氧氧化降解AOII染料废水的降解率降低。当臭氧投加量为500 mg/h和1000 mg/h时,MgO催化臭氧氧化降解AOII染料废水在反应30 min时,AOII染料废水降解率分别为69.5 %和79.1 %。当臭氧量增加到1500 mg/h时,反应30 min时AOII染料废水降解率却在72.7 %,过量的臭氧投加量并没有提高降解效果。综合考虑处理的效果及成本,臭氧的投加量选用1000 mg/h。
2.2.2 催化剂投加量对AOII染料废水降解的影响 实验在臭氧投加量为1000 mg/h,实验水样为300 mL,废水初始pH为5.5,AOII染料废水初始浓度为100 mg/L,反应温度为25oC的条件下,考察了催化剂投加量对MgO催化臭氧氧化降解AOII染料废水性能的影响,结果如图5所示。

图4臭氧投加量对AOII偶氮染料废水降解性能的影响

图5MgO投加量对AOII偶氮染料废水降解率的影响
由图5可以看出,MgO催化剂提高了催化臭氧氧化降解AOII染料废水的效率。MgO量由0 g增加至0.4 g时,反应时间为30 min时AOII染料废水的降解率由61.6 %增至79.1 %,然而,当继续增加MgO量至0.6 g时,反应时间为30 min时AOII染料废水的降解率却只达到了76.8 %,降解率没有上升反而比投加0.4 g MgO时的AOII染料废水的降解率有所将低,这可能过多的臭氧催化剂量对一定浓度的臭氧催化是过量,过多的臭氧催化剂会对催化氧化过程中自由基产生淬灭,此外,过多的催化剂量在水中更容易发生团聚,影响了催化氧化反应,因此,投加催化剂的量一定要合适。综合考虑处理的效果,催化剂投加量为0.4 g。
根据氧化镁催化臭氧氧化性能,催化臭氧氧化机理实验等,对氧化镁催化臭氧氧化降解AOII的链式反应进行了推导。
臭氧通入水中可能发生如下反应:
O3+ H2O → 2·OH + O2k= 1.1 × 104M-1·s1
(1)
氧化镁催化剂催化臭氧氧化降解AOII反应过程中,反应与催化剂表面特性密切相关,这些特性主要为表面羟基基团(记为M-OH)和Lewis碱(记为M-j),催化剂在反应过程中其表面性质受到反应液pH影响,可发生如下式(2)或式(3)反应[10]。

(2)
M-OH + OH-↔ M-O-+ H2O pH >pHpzc
(3)
反应液初始pH为5.5,低于MgO的pHpzc(12.1),因而,氧化镁催化剂表面发生。
如式2反应,并发生如下式(4)等链式反应。
(4)
(5)
M-j + O3→ M-jO· + O2
(6)
O3+ OH-→ O2·-+ HO2·k= 70 M-1·s-1
(7)
O3+ HO2· → 2O2+ ·OHk= 1.6 × 109M-1·s-1
(8)
因而,在氧化镁催化臭氧氧化反应过程中,臭氧直接氧化反应和自由基氧化反应在氧化镁催化臭氧氧化降解AOII反应同时发生,AOII的降解可按下式发生反应而被降解。[11]
O3+ AOII → CO2+ H2O + intermediates
(9)
·OH + AOII → CO2+ H2O
(10)
MgO-jO· + AOII → CO2+ H2O + intermediates
(11)
MgO-O3+ AOII → CO2+ H2O + intermediates
(12)
MgO-AOII + O3→ CO2+ H2O + intermediates
(13)
由上分析同时可以看出,催化剂的表面性质对催化活性影响较大,氧化镁中的阴离子氧位置可能充当Lewis碱,起到催化臭氧氧化的作用,与臭氧分子相互作用,引发了链式反应。
2.2.3 反应液初始pH对AOII染料废水降解的影响 实验在臭氧投加量为1000 mg/h,实验水样为300 mL,初始AOII染料废水浓度为100 mg/L,MgO投加量为0.4 g,反应温度为25oC条件下,考察了反应液初始pH对MgO催化臭氧氧化降解含AOII染料废水性能的影响,结果如图6所示。
由图6可以看出,pH对氧化镁催化臭氧氧化降解含AOII染料废水的降解率影响较大,当反应pH为2.5时,30 min后,AOII的降解率只有75.1 %,当将反应液初始pH提升至5.5时,AOII的的降解率被提高,降解率达到了79.1 %,继续提高反应液初始pH至8.0时,降解率达到85.4 %。由此可以看出,碱性条件下,pH极大地促进了氧化镁催化臭氧氧化降解的效率。一般在碱性的条件下,臭氧分解产生具有强氧化性的自由基,而这些自由基与有机物反应的速率极高,在碱性环境有利于臭氧降解AOII染料的废水。
2.2.4 反应温度对AOII染料废水降解的影响 实验在臭氧投加量为1000 mg/h,实验水样为300 mL,MgO的投加量为0.4 g,初始AOII染料废水浓度为100 mg/L,废水的初始pH为5.5时,考察了反应温度对MgO催化臭氧氧化降解AOII偶氮染料废水效果的影响,结果如下图7所示。

图6不同pH对AOII偶氮染料废水降解率的影响

图7反应温度对AOII偶氮染料废水降解率的影响
由图7可知,在反应温度变化范围15oC至30oC条件下,反应温度的升高对氧化镁催化臭氧氧化降解AOII染料废水的性能起一定的促进作用,当控制反应温度为15℃时,在反应30 min后,AOII的降解率为73.1 %,当温度提升到25oC时,反应30 min后,AOII的降解率为79.1%,当温度提升至35oC时,30 min反应后,此时AOII的降解率为84.9%。由上述数据,可以得出在一定条件下,提高温度对氧化镁催化臭氧氧化降解AOII染料废水的性能起一定的促进作用。这可能是因为反应温度的升高促进了催化剂的活性,导致催化剂的催化效果加强,促进了反应过程中自由基的生成量,促使偶氮染料废水的降解率得以提升。
2.2.5 初始污染物浓度对AOII染料废水降解的影响 在实际应用过程中,污染物的浓度不会一成不变的,因此,实验考虑了50 mg/L至200 mg/L不同初始浓度染料污染物对MgO催化臭氧氧化降解AOII染料废水性能的影响实验。实验控制在臭氧投加量为1000 mg/h ,MgO为0.4 g,实验水样为300 mL,pH为5.5,反应温度为25oC的条件下,探索不同的初始污染物浓度对MgO催化臭氧氧化降解AOII偶氮染料废水结果的影响,结果如图8所示。
由上图8可知,伴随着染料废水浓度的增加,MgO催化臭氧氧化降解AOII而染料废水的降解率逐渐的降低。当废水的初始浓度为50 mg/L时,其降解率为84.4 %;当废水的初始浓度为100 mg/L时,它的降解率降至79.1 %;最后当废水的初始浓度为200 mg/L时,其降解率为75.9 %。结果表明:废水的初始浓度在一定范围内时,偶氮染料废水的降解率与废水初始浓度成反比。因此,染料废水的初始浓度应选100 mg/L。
2.3MgO催化臭氧氧化降解AOⅡ染料废水的机理研究催化臭氧氧化机理比较复杂,目前还没有定论,一般认为臭氧直接氧化污染物或者臭氧分解产生自由基而间接氧化污染物,两种反应可以发生在溶液中及催化剂表面。
实验结果表明MgO催化剂明显的提高了臭氧降解AOII效率,可能与催化剂催化臭氧氧化转化为自由基有关,因而有必要对反应体系中的羟基自由基进行调查。叔丁醇(TBA)是一种典型的羟基自由基淬灭剂,其与臭氧的反应速率常数为3×10-3M-1s-1而与羟基自由基的反应速率常数为6×108M-1s-1,与羟基自由基反应迅速而消耗羟基自由基,并且不重新生成链式反应产物,从而终止臭氧的链式分解,同时其与臭氧的反应速率非常低几乎不与臭氧分子反应,因而是常用的羟基自由基淬灭剂,[12]实验采用叔丁醇作为羟基自由基淬灭剂进行实验,结果如图9所示。

图8不同的初始废水浓度对AOII偶氮染料废水降解性能的影响

图9TBA对氧化镁催化臭氧氧化降解AOII和TOC影响
由图9可知,TBA降低了MgO催化臭氧氧化降解水中的AOII降解率,同样TBA降低了MgO催化臭氧氧化降解TOC降解率,且更加明显。AOII作为有机物含有双键(如C=C),这些双键容易和臭氧分子反应而被降解,因此,叔丁醇的加入未明显影响AOII的降解率,然而,TOC的降解率却受到TBA较大的影响,这可能是AOII在降解过程中,产生中间难降解产物如甲酸、草酸等,这些中间产物被臭氧氧化的速率非常低,其速率常数低于5.0 M-1·s-1和4.0 × 10-2M-1·s-1,而这些物质和羟基自由基反应速度各自达到了1.3 × 108M-1·s-1和1.4 × 106M-1·s-1,在TBA存在下,羟基自由基和TBA反应从而导致了整个反应系统TOC降解率降低。[13]通过AOII和TOC降解率的变化可以说明MgO催化臭氧氧化降解AOII过程中发生了自由基氧化反应。
在非均相催化臭氧氧化过程中,一阶降解方程发生在均相的溶液中和非均相的催化剂上,其速率平衡式可以描述为以下过程[14-15]:

(14)
khomo=k1[O3]+k2[·OH]
(15)
khete=k3+k4[O3]+k5[·OH]
(16)

(17)
式中:[C]和[dcata]代表有机物和催化剂浓度;k1,k2,k3,k4,k5,kO3和k·OH分别代表与水中臭氧分子,水中羟基自由基,催化剂表面吸附,催化剂吸附表面臭氧分子,催化剂表面羟基,反应体系中臭氧分子和反应体系中羟基的反应速率常数。
3 结 论
本文以配置的含AOII染料的偶氮染料废水为研究对象,开展了氧化镁催化臭氧氧化偶氮染料废水性能及机制的研究。在一定的条件下,MgO催化臭氧氧化降解AOII染料废水在反应30 min时降解率为84.9 %。氧化镁作为碱性金属氧化物催化臭氧分解成自由基,自由基对偶氮染料具有较好的氧化效果。氧化镁催化臭氧反应是发生在反应液中催化剂表面和溶液的非均相和均相反应,通过氧化镁催化臭氧氧化降解AOII的链式反应过程最终达到降解AOII的目的。氧化镁作为一种廉价易得且无毒无害的催化剂,可以被广泛使用于催化臭氧氧化处理偶氮染料等废水。
[1] 周琪,赵由才. 染料对人体健康和生态环境的危害[J]. 环境与健康杂志, 2005, 22(3):229-231.
[2] 任南琪,周显娇,郭婉茜,等. 染料废水处理技术研究进展[J].化工学报, 2013, 64(1):84-94.
[3] 张华春,熊国臣. 偶氮染料废水处理方法研究进展[J]. 染料与染色, 2016(3):45-51.
[4] 赵雪,何瑾馨,展义臻. 印染废水处理技术的研究进展[J]. 化学工业与工程技术, 2009, 30(2):38-43.
[5] Nawrocki J, Kasprzyk-Hordern B. The Efficiency and Mechanisms of Catalytic Ozonation[J]. Applied Catalysis B: Environmental, 2010, 99(1):27-42.
[6] Jin W, Ma L, Chen Y, et al. Catalytic Ozonation of Organic Pollutants from Bio-treated Dyeing and Finishing Wastewater Using Recycled Waste Iron Shavings as a Catalyst: Removal and Pathways[J]. Water Research, 2016, 92:140.
[7] Bing J, Hu C, Nie Y, et al. Mechanism of Catalytic Ozonation in Fe2O3/Al2O3@SBA-15 Aqueous Suspension for Destruction of Ibuprofen[J]. Environmental Science & Technology, 2015, 49(3):1690.
[8] Tian S H, Tu Y T, Chen D S, et al. Degradation of Acid Orange ii at Neutral pH Using Fe2(MoO4)3as a Heterogeneous Fenton-like catalyst[J]. Chemical Engineering Journal, 2011, 169(1-3):31-37.
[9] Barcaro G, Fortunelli A. The Interaction of Coinage Metal Clusters with the MgO(100) Surface[J]. Journal of Chemical Theory & Computation, 2005, 1(5):972.
[10] Zhao L, Sun Z, Ma J, et al. Enhancement Mechanism of Heterogeneous Catalytic Ozonation by Cordierite-supported Copper for the Degradation of Nitrobenzene in Aqueous Solution[J]. Environmental Science & Technology, 2009, 43(6):2047-2053.
[11] Moussavi G, Alizadeh R. The Integration of Ozonation Catalyzed with MgO Nanocrystals and the Biodegradation for the Removal of Phenol from Saline Wastewater[J]. Applied Catalysis B: Environmental, 2010, 97(1): 160-167.
[12] Huang R, Lan B, Chen Z, et al. Catalytic Ozonation of ρ-chlorobenzoic Acid over MCM-41 and Fe Loaded MCM-41[J]. Chemical Engineering Journal, 2012, 180:19-24.
[13] Ikhlaq A, Brown D R, Kasprzyk-Hordern B. Mechanisms of Catalytic Ozonation on Alumina and Zeolites in water: Formation of Hydroxyl Radicals[J]. Applied Catalysis B: Environmental, 2012, 123: 94-106.
[14] Li W, Qiang Z, Zhang T, et al. Kinetics and Mechanism of Pyruvic Acid Degradation by Ozone in the Presence of PdO/CeO2[J]. Applied Catalysis B: Environmental, 2012, 113:290-295.
[15] Valdés H, Zaror C A. Heterogeneous and Homogeneous Catalytic Ozonation of Benzothiazole Promoted by Activated Carbon: Kinetic Approach[J]. Chemosphere, 2006, 65(7):1131-1136.
DisposeofTheAzoDyeWastewaterbyMagnesiumOxideCatalyticOzonation
CHEN Jun1,2, JIN Jie1,2, WU Ke1,3, YU Zhi-min1,3, WU Peng1, QI Jie1
(1.Department of Biological and Environmental Engineering, Hefei University, Hefei 230601, 2.Anhui Key Laboratory of Sewage Purification and Eco-restoration Materials, Hefei 230088, 3.Collaborative Innovation Center for Environmental Pollution Control and Ecological Restoration of Anhui Province, Hefei 230601,China)
azo dye wastewater; MgO; catalytic ozonation; removal rate; reaction mechanism
2017-06-30
2017-09-15
本课题由安徽高校自然科学研究项目(KJ2016A877, KJ2016SD50),合肥学院科研发展基金自然科学重点项目(16ZR03ZDB),安徽省科技重大专项项目(16030801119),安徽省重点实验室开放课题(MJ-ZK201701)资助。
陈 俊(1986— ),男,安徽芜湖人,合肥学院生物与环境工程系讲师,博士。
TQ619
A
2096-2371(2017)05-0066-06
Abatract: Magnesium Oxide (MgO) was prepared and used as ozone catalyst in degradation of azo dye wastewater. Influencing factors and mechanism of the reaction process were analyzed. The concentration of pollutant, concentration of ozone, amount of MgO, temperature, and pH were 100 mg/L, 1000 mg/h, 0.4 g, 30oC, and 8.0, respectively, the pollutant of orange II (AOII) removal rate reached 84.9 %. MgO catalytic ozonation reactions happened in the catalyst surface and solution in the wastewater of heterogeneous and homogeneous reaction, ozone decomposed into free radical by MgO catalytic, the free radical had good oxidation effect on azo dyes, chain reaction reacted in the degradation of azo dyes process. Azo dyes wastewater can be achieved by the catalytic oxidation of MgO.
[责任编辑:张永军]
