泽兰乙醇提取物对大鼠离体心肌缺氧损伤的影响及机制
2017-11-14金玉张默函洪兰崔昊震
金玉,张默函,洪兰,崔昊震
(1延边大学附属医院,吉林延吉 133000;2延边大学医学院;3延边大学中医学院)
泽兰乙醇提取物对大鼠离体心肌缺氧损伤的影响及机制
金玉1,张默函2,洪兰2,崔昊震3
(1延边大学附属医院,吉林延吉 133000;2延边大学医学院;3延边大学中医学院)
目的观察泽兰乙醇提取物对大鼠离体心肌缺氧损伤的影响,并探讨其机制。方法将40只雄性SD大鼠随机分为正常对照组、HI模型组、泽兰组和LY294002组,各10只。取各组大鼠左心房建立心房灌流模型,正常对照组用氧饱和的HEPES缓冲液进行离体灌流,其他三组制备急性心肌缺氧损伤模型,泽兰组灌流时加入泽兰乙醇提取物(0.1 mg/mL),LY294002组加入PI3K/Akt信号通路阻断剂LY294002(1.0 mol/L)、泽兰乙醇提取物(0.1 mg/mL)。采用生理记录系统观察第1循环末、第7循环末、第13循环末时各组大鼠的心房搏动压,并采用Western blotting法检测各组大鼠心脏组织中磷酸化Akt(p-Akt)、缺氧诱导因子-1α(HIF-1α)、血红素氧合酶-1(HO-1)蛋白表达。结果心房搏动压在第7循环末时HI模型组、泽兰组、LY294002组均较正常对照组低(P均<0.05),在第13循环末时泽兰组、LY294002组较HI模型组高(P均<0.05)。HI模型组心肌组织中p-Akt蛋白表达较正常对照组低,泽兰组较HI模型组、LY294002组高(P均<0.05);HI模型组HIF-1α、HO-1蛋白表达均较正常对照组高,泽兰组均较HI模型组及LY294002组高(P均<0.05)。结论泽兰乙醇提取物对大鼠离体缺氧损伤心肌具有保护作用,其机制可能与上调PI3K/Akt/HIF-1α信号通路,从而增强其下游的HO-1蛋白表达有关。
泽兰;心肌缺氧损伤;缺氧诱导因子-1α;磷脂酰肌醇3激酶;血红素氧合酶-1
心肌缺氧是指各种原因引起冠状动脉血流量降低,致使心肌氧等物质供应不足和代谢产物清除减少为主的病理过程。缺氧诱导因子-1α(HIF-1α)作为细胞氧稳态调节的调控因子,在缺氧适应性反应中起核心作用[1]。近期研究[2]表明,磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)信号通路在心肌缺血再灌注损伤过程中发挥重要作用,激活PI3K/Akt信号通路可诱导HIF-1α蛋白的合成,并参与对HIF-1α的调节。此外,血红素氧合酶-1(HO-1)作为HIF-1α的下游基因,通过其降解产物在心肌缺血/缺氧病理过程中发挥重要的保护功能[3]。泽兰作为常见中草药,具有活血化瘀、行水消肿等功效,可发挥抗血管炎症、抗血小板凝聚、降低血糖和增强心肌收缩力等多种药理作用[4~6]。但有关泽兰抗心肌缺氧损伤方面的研究尚未见报道。2016年6~11月,本研究观察了泽兰乙醇提取物对大鼠离体心肌缺氧损伤的影响,并探讨其作用机制。
1 材料与方法
1.1 实验动物与试剂 成年雄性SD大鼠40只,体质量(250±30)g,由延边大学实验动物中心提供,合格证号:SCXK(吉)2011-0007。泽兰购自北京同仁堂药店。兔抗大鼠HIF-1α多克隆抗体(Abcam公司)、兔抗大鼠HO-1多克隆抗体(Abcam公司)、兔抗大鼠p-Akt多克隆抗体(p-Akt Ser473,Santa Cruz公司)、兔抗大鼠β-actin多克隆抗体(Santa Cruz公司)、PI3K/Akt信号通路阻断剂LY294002(Cell Signaling公司)。
1.2 泽兰乙醇提取物的制备[6]取泽兰全草500 g干燥后切碎,用8倍药物体积的95%乙醇浸泡24 h,6倍和4倍95%乙醇回流提取,回旋式减压浓缩机进行浓缩,经冷冻干燥机冻干后取得黑褐色粉末状药物(4.75 g),置于-20 ℃备用。
1.3 动物分组及处理 将40只雄性SD大鼠随机分为正常对照组、HI模型组、泽兰组和LY294002组,各10只。将所有大鼠用20%乌拉坦麻醉,迅速开胸取心,剥离左心房,固定在Choi等[7]研制的离体心脏灌流装置上。给药前,对离体心房灌注60 min以使心搏出量、心房搏动压趋于稳定。心房搏动频率固定在1.5 Hz,每2 min间隔记录左心房搏动压。在心房灌流模型建立后,正常对照组用氧饱和的HEPES缓冲液进行13个循环(156 min)的离体灌流实验;而HI模型组、泽兰组和LY294002组均经过1个对照循环(12 min)灌流,继以氮气(5% CO2+95% N2)取代氧气(5% CO2+95% O2)的方法制备急性缺氧损伤模型。以生理记录仪上显示心房搏动压水平下降≥80%作为急性心肌缺氧损伤模型制备成功标准。HI模型组进行12个循环(144 min)的缺氧灌流。泽兰组在进行6个循环(72 min)缺氧灌流后,在持续缺氧状态下再给予6个循环(72 min)的泽兰乙醇提取物(0.1 mg/mL)灌流。LY294002组在进行6个循环(72 min)缺氧状态下,经LY294002(1 mol/L)预处理后,持续在缺氧和LY294002共同存在的条件下给予6个循环(72 min)的泽兰乙醇提取物(0.1 mg/mL)灌流。
1.4 各组大鼠心房搏动压检测 心房灌流模型主体为透明聚乙烯套管(外径为4 mm),其下方固定被剥离的左心房。套管的两侧各埋藏1根细管和1条可用于电刺激的白金电极。左侧细管主要用于灌流缓冲液,右侧与压力感受器及BL-420S生物信号采集与分析系统相连,并测定每2 min内心房搏动压平均值的变化。比较各组大鼠第1循环末(10~12 min)、第7循环末(82~84 min)、第13循环末(154~156 min)时心房搏动压变化。心房灌流模型中心房搏动压改变与每回心房搏出量变化呈正比,能够间接反映心肌收缩力的变化[6,7]。
1.5 各组大鼠心肌组织p-Akt、HIF-1α和HO-1蛋白表达检测 采用Western blotting法。灌流实验结束后迅速将各组大鼠心房组织称重,按照组织蛋白提取试剂盒要求提取总蛋白,并用全波长分光光度计测定蛋白样品的浓度。取待测组织蛋白煮沸5 min。制备10% SDS-PAGE凝胶,电泳分离后用半干转移法将分离胶内的蛋白转移到PVDF膜上,用5%脱脂奶粉TBS-T缓冲液封闭PVDF膜上的非特异性位点,并分别加入兔抗大鼠p-Akt多克隆一抗(1∶400)、兔抗大鼠HIF-1α和HO-1多克隆一抗(1∶1 000),在4 ℃孵育过夜,洗涤后加入辣根过氧化物酶标记的山羊抗兔IgG(1∶1 000),室温下孵育1 h,洗膜。图像分析系统曝光成像并分析图像,以β-actin为内参,计算p-Akt、HIF-1α和HO-1蛋白的相对表达量。

2 结果
2.1 各组大鼠心房搏动压比较 见表1。

表1 各组大鼠心房搏动压比较
注:与正常对照组比较,#P<0.05;与HI模型组比较,△P<0.05;与同组第7循环末比较,*P<0.05。
2.2 各组大鼠心肌组织p-Akt、HIF-1α、HO-1蛋白表达比较 见表2、图1。
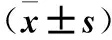
表2 各组大鼠心肌组织p-Akt、HIF-1α、HO-1蛋白表达比较
注:与正常对照组比较,#P<0.05;与HI模型组比较,△P<0.05;与LY294002组比较,*P<0.05。

图1 各组大鼠心肌组织p-Akt、HIF-1α、HO-1蛋白表达(Western blotting法)
3 讨论
心肌缺氧损伤是缺血性心脏病最常见的症状之一,传统中药中活血化瘀类、补气类及清热类药物已被用于干预心脏缺血再灌注损伤的研究中[8]。泽兰属于活血化瘀类药物,临床可用于治疗痛经、月经不调、跌打损伤、浮肿等。心肌收缩力是衡量心脏功能的重要指标之一,而缺氧能够造成心肌细胞内三磷酸腺苷的含量与活性降低,致使细胞内外离子分布异常引起心肌细胞功能下降,导致心肌收缩力明显减弱。本研究发现,HI模型组第7、13循环末的心房搏动压较正常对照组明显降低,泽兰组第13循环末的心房搏动压较HI模型组明显增高,表明泽兰乙醇提取物可增强离体心肌缺氧损伤大鼠的心肌收缩力,并发挥对心肌缺氧损伤的保护作用。
PI3K/Akt信号通路是膜受体信号向细胞内转导的重要途径,在细胞增殖、代谢、凋亡等过程中发挥关键性作用。HIF-1α是细胞氧稳态调节的调控因子,在缺氧的条件下可通过调节其下游的促红细胞生成素、诱导型NO合成酶、血管内皮生长因子、葡萄糖转运体的表达,促进红细胞生成、血管形成及糖代谢,从而增强细胞对缺氧的耐受性,参与心肌缺血/缺氧损伤的保护作用[9]。文献报道,在缺氧刺激下,心肌细胞可通过PI3K/Akt信号通路诱导HIF-1α蛋白的稳定及其转录,从而增加其表达水平。梁俊清等[10]研究证实,在缺氧条件下,通心络可以激活人脐静脉血管内皮细胞中的PI3K/Akt信号通路,从而上调HIF-1α蛋白表达,促进Bcl-2、Mcl-1等抗凋亡因子表达,抑制Bax等促凋亡因子表达,有效降低细胞凋亡率,提高缺氧细胞的增殖率。本研究结果显示, HI模型组心肌组织中p-Akt蛋白表达较正常对照组低,泽兰组较HI模型组高,LY294002组较泽兰组低,可见泽兰乙醇提取物可以使缺氧心肌中p-Akt蛋白表达水平显著提高,而此作用能被PI3K/Akt信号通路阻断剂LY294002所抑制。此外,心肌组织中的HIF-1α蛋白表达HI模型组较正常对照组高,泽兰组较HI模型组高,LY294002组较泽兰组低。上述研究结果提示,泽兰乙醇提取物对缺氧心肌的保护作用可能与激活PI3K/Akt信号通路,从而上调HIF-1α蛋白表达水平有关。
HO-1作为HIF-1α的下游基因,是血红蛋白分解代谢的起始与限速酶,在缺氧刺激下大量产生,增强机体抗缺氧能力。谢娟等[11]研究表明,激活HIF-1α可以使血管平滑肌细胞HO-1、诱导型NO合成酶及内皮素-1等基因表达增加,并催化产生CO,激活环磷酸鸟苷环化酶,提高环磷酸鸟苷水平,使血管平滑肌松弛,从而增加血管通透性和血流量,使缺氧组织得到充分的氧供。张国红等[12]研究表明,在冠心病的发生、发展过程中HIF-1α/HO-1通路被激活,其对心肌缺血/缺氧损伤发挥重要的保护功能。何祥虎等[13]研究证实,缺血预处理可以减少大鼠心肌缺血再灌注损伤,原因可能为HIF-1α诱导HO-1表达上调,并通过其抗炎、抗凋亡和抗氧化作用来对缺血性心肌发挥保护作用。本研究结果显示,HI模型组心肌组织中的HO-1蛋白表达较正常对照组高,这可能是缺氧刺激下诱导心肌细胞出现代偿性保护作用引起的[14]。且泽兰组心肌组织中的HO-1蛋白表达较HI模型组高,LY294002组较泽兰组低,提示泽兰乙醇提取物在大鼠心肌缺氧损伤过程中能够显著上调HO-1蛋白的表达,进而对心肌缺氧损伤发挥保护作用。
综上所述,泽兰乙醇提取物对大鼠离体缺氧损伤心肌具有保护作用,其机制可能与上调PI3K/Akt/HIF-1α信号通路,从而增强其下游的HO-1蛋白表达有关。此研究结果为今后临床治疗缺血性心脏疾病提供了可靠的用药依据,也为开发和研制创新药物提供了新思路。
[1] Ong SG, Hausenloy DJ. Hypoxia-inducible factor as a therapeutic target for cardioprotection [J]. Pharmacol Ther, 2012, 136(1):69-81.
[2] Liu SS, Ai QD, Feng K, et al. The cardioprotective effect of dihydromyricetin prevents inschemia-reperfusion-induced apoptosis in vivo and in vitro via the PI3K/Akt and HIF1 signaling pathways[J]. Apoptosis, 2016,21(12):1366-1385.
[3] 刘晨,程晓曙.血红素氧合酶/一氧化碳系统在心肌缺血再灌注损伤中的保护机制[J].心血管病学进展,2006,27(3):349-352.
[4] Lee, YJ, Kang DG, Kim JS, et al. Lycopus lucidus inhibits high glucose-induced vascular inflammation in human umbilical vein endothelial cells[J]. Vascul Pharmacol, 2008,48(1):38-46.
[5] 崔书源,崔昊震,张默函.泽兰乙醇提取物对糖尿病小鼠血糖及肝糖原含量的影响[J].山东医药,2016,56(14):36-38.
[6] Cui HZ, Oh HC, Li X, et al. Ethanol extract of Lycopus lucidus elicits positive inotropic effect via activation of Ca2+entry and Ca2+release in beating rabbit atria[J]. J Med Food, 2013,16(7):633-640.
[7] Choi DH, Kang DG, Cui X, et al. The positive inotropic effect on the aqueous extract of Convallaria keiskei in beating rabbit atria[J]. Life Sci, 2006,79(12):1178-1185.
[8] 王丽丽,李琳,李志强,等.清热类中药对心肌缺血/再灌注损伤的防治作用研究进展[J].中国药理学通报,2016,29(7):1026-1029.
[9] Ong SG, Hausenloy DJ. Hypoxia-inducible factor as a therapeutic target for cardioprotection [J]. Pharmac Ther, 2012,136(1):69-81.
[10] 梁俊清,徐海波,陈小娟,等.通心络通过PI-3K/Akt/HIF信号通路改善血管内皮细胞缺氧损伤[J].中国病理生理杂志,2012,28(5):846-851.
[11] 谢娟,张静,戎小平,等.缺氧诱导因子及其靶基因血红素加氧酶的研究现状[J].现代中西医结合杂志,2011,20(24):3109-3111.
[12] 张国红,陈宋明.冠心病患者缺氧诱导因子-1与血红素氧化酶-1的相关性研究[J].中国全科医学,2011,14(15):1662-1664.
[13] 何祥虎,王炎林,王成夭,等.缺血预处理对大鼠缺血再灌注心肌HIF-1α和HO-1的影响[J].中华麻醉学杂志,2010,30(2):194-197.
[14] Zhao MY, Zhu P, Fujino M, et al. 5-Aminolevulinic acid with sodium ferrous citrate induces autophagy and protects cardiomyocytes from hypoxia-induced cellular injury through MAPK-Nrf-2-HO-1 signaling cascade[J]. Biochem Biophys Res Commun, 2016,479(4):663-669.
EffectofethanolextractofLycopuslucidusTurczonmyocardialhypoxiainjuryofratsinvitro
JINYu1,ZHANGMohan,HONGLan,CUIHaozhen
(1AffiliatedHospitalofYanbianUniversity,Yanji133000,China)
ObjectiveTo observe the effect of ethanol extract of Lycopus lucidus Turcz (ELT) on myocardial hypoxia injury (HI) of rats in vitro and to investigate the mechanism.MethodsForty male SD rats were randomly divided into the normal control (NC) group , HI model group, ELT group, and ELT+ LY294002 group with 10 rats in each. The atrial perfusion models were established in the left atria of rats in each group.Rats in the NC group were perfused with oxygen-saturated HEPES buffer, while in the other three groups, we established the acute myocardial HI models. Rats in the ELT group were perfused with ethanol extract of ELT (0.1 mg mL), LY294002 group with LY294002 (1.0 mol/L) and ethanol extract of ELT (0.1 mg/mL). The atrial pulse pressure at the end of first cycle , 7th cycle, and 13th cycle of each group was measured by physiological system; the protein expression of phosphorylation of Akt (p-Akt), hypoxia-inducible factor-1α (HIF-1α and hemeoxygenase-1 (HO-1) was detected by Western blotting.ResultsThe atrial pulse pressure of the HI group, ELT group, and LY294002 group at the end of 7th cycle was significantly lower than that of the NC group (allP<0.05); the atrial pulse pressure of ELT group and LY294002 group at the end of 13th cycle was significantly higher than that of the HI group (allP<0.05). Furthermore, the protein level of p-Akt in the HI group was significantly lower than that of the NC group, while the protein level of the ELT group was higher than those of the HI group and LY294002 group (bothP<0.05); the protein levels of HIF-1α and HO-1 in the HI group were significantly higher than those of the NC group, and the ELT group was higher than the HI group and LY294002 group (allP<0.05).ConclusionThe ethanol extract of ELT has cardioprotective effect on myocardial HI of rats in vitro by up-regulating the PI3K/Akt/HIF-1α signaling pathway and thus promoting the HO-1 protein expression.
Lycopus lucidus Turcz; myocardial hypoxia injury; hypoxia-inducible factor-1α; phosphoinositide 3-kinase; hemeoxygenase-1
10.3969/j.issn.1002-266X.2017.38.004
R542.2
A
1002-266X(2017)38-0011-04
国家自然科学基金资助项目(81460643)。
金玉(1982-),女,硕士,主治医师,主要研究方向为心血管药理学。E-mail: yujin322@163.com
崔昊震(1978-),男,博士,副教授,硕士生导师,主要研究方向为中医药防治心血管系统疾病。E-mail: cuihaozhen@ybu.edu.cn
2017-02-10)
