二维超声结合多普勒超声在不同体积乳腺肿块患者行微创旋切术中的临床价值
2017-11-14史立晖
朱 毓,高 丹,史立晖
(北京通州区妇幼保健院超声科,北京 通州 101101)
·论著·
二维超声结合多普勒超声在不同体积乳腺肿块患者行微创旋切术中的临床价值
朱 毓,高 丹,史立晖
(北京通州区妇幼保健院超声科,北京 通州 101101)
目的探讨二维超声联合多普勒超声在乳腺微创旋切术术前筛查与预后判断中的临床价值。方法选择在二维超声联合多普勒超声介导下行乳腺微创旋切术的乳腺肿块患者80例,对患者乳腺进行超声扫查,记录病灶大小、位置、血供特点等。根据患者乳腺肿块大小进行分组:A组,肿块直径>1~3 cm;B组,肿块直径≤1 cm。所有患者在局麻下行乳腺微创旋切术,比较2组乳腺肿块切除率及出血率。结果本研究80例乳腺肿块患者共94个病灶,病理学检测结果显示乳腺囊肿36个病灶,乳腺瘤样增生19个病灶,乳腺纤维腺瘤39个病灶。2组乳腺肿块切除率及术中出血率差异均有统计学意义(P<0.05)。结论患者乳腺肿块越大,切除率越低,出血率越高。在乳腺微创旋切术前行二维超声联合多普勒超声扫查,对患者乳腺肿块的筛查及预后判断具有临床参考价值。
乳腺疾病;超声检查;乳腺微创旋切术
10.3969/j.issn.1007-3205.2017.11.023
乳腺肿块是常见的女性乳房疾病体征,准确筛选及评估患者的乳腺肿块情况,对于乳腺肿块治疗和预后具有重大的意义[1]。尤其是乳腺癌严重危害女性的身心健康。早发现、早治疗是乳腺肿块治疗的关键。二维超声可以显示乳腺肿块的位置、数目、大小、形态、边界、内部回声、后方回声及侧方声影等,但当有些乳腺良性肿瘤与恶性肿瘤部分重叠、分界不清晰时,恶性肿瘤的声像图有良性肿瘤表现,良性肿瘤的声像图有恶性肿瘤表现,故不能准确诊断乳腺良性肿瘤[2]。而多普勒超声不仅能够检测脏器内血供情况,还能够检查肿块血管丰富程度和病变组织,判断血管内有无血栓或狭窄[3-4]。传统手术方式虽然能够彻底切除乳腺肿块,但其创伤较大。随着社会的发展,现代女性开始注重生活质量,不仅要彻底切除乳腺肿块,还要不影响乳腺外观。采用乳腺微创旋切术切除乳腺良性肿瘤,具有操作方便、定位准确、切口小、并发症少等特点[5]。应用超声筛选适合乳腺微创旋切术的患者,对患者预后具有重要意义。本研究选择乳腺肿块患者80例,在二维超声联合多普勒超声介导下行乳腺微创旋切术,比较不同大小乳腺肿块患者的乳腺肿块切除率及出血率,旨在探讨二维超声联合多普勒超声在乳腺微创旋切术术前筛查与预后判断中的临床价值。
1 资 料 与 方 法
1.1 一般资料 选择2015 年1—12月收入我院妇科在二维超声联合多普勒超声介导下行乳腺微创旋切术的乳腺肿块患者80例,其中体检发现乳腺肿块59例,自检发现乳腺肿块21例。根据乳腺肿块大小进行分组:A组,肿块直径>1~3 cm 42例,年龄29~59岁,平均(43.9±5.6)岁;B组,肿块直径≤1 cm 38例,年龄28~58岁,平均(43.1±5.5)岁。纳入标准:①经乳腺钼靶X线摄影检查或多普勒超声等检查确诊乳腺肿块[6];②肿块≤3 cm;③临床资料完整;④术前经过二维超声及多普勒超声检查;⑤具有术后乳腺肿块病理检查结果;⑥完成术后随访;⑦患者自愿参与治疗并签署知情同意书。排除标准:①肿块>3 cm;②心脏病或高血压患者;③凝血功能障碍患者。
1.2 方法
1.2.1 检查方法 应用飞利浦iu22、GE E8二维彩多普勒超声诊断仪,7.5 MHz探头频率。乳腺肿块患者取仰卧位,应用二维超声检测乳腺肿块,记录肿块的位置、大小、形态、边界及内部回声等,并且采用多普勒超声检测乳腺肿块的血流阻力指数。
1.2.2 多普勒超声血流分级标准[7]根据Adler 半定量血流分级法,将肿块血供情况分为4级:未见血流信号为0级;少量血流为Ⅰ级,仅有1~2个细棒状或点状肿瘤血管;中量血流为Ⅱ级,具有2个较长血管或3~4个点状血管,较长血管的长度大于或接近肿块半径;多量血流为Ⅲ级,具有2个较长血管或≥5个点状血管。良性肿瘤一般血流信号少,恶性肿瘤内常有血流信号,但单凭血流信号判断乳腺肿瘤良恶性,不确切。
1.2.3 微创旋切术[8]应用美国强生公司麦默通微创旋切系统,包括真空吸附泵、8 G 槽式旋切刀、控制手柄及相应软件。患者取仰卧位,用碘伏对病灶所在位置进行消毒,随后行2%利多卡因局部麻醉,接着多普勒超声引导定位乳腺肿块,行0.3 cm隐蔽切口,根据多普勒超声的引导,将旋切刀插入乳腺肿块基底部,并且利用真空吸附泵辅助装置,将病灶组织吸附于微创旋切系统槽内,旋切病灶组织,至完全切除肿块,随后多普勒超声检测有无肿块残留,并将已切除的病灶组织送检,最后包扎伤口,手术完毕。
1.3 统计学方法 应用SPSS 20.0统计软件分析数据。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 乳腺肿块病理学结果 本研究乳腺肿块患者80 例,共检出94个病灶,病理学检测结果显示乳腺囊肿36个病灶,乳腺瘤样增生19个病灶,乳腺纤维腺瘤39个病灶。
2.2 乳腺肿块超声影像学结果 良性肿瘤超声影像学结果:椭圆形或圆形,形态规则,表面光滑,边界清晰,包膜完整,内部回声均匀,后方回声无衰减,腋窝淋巴结未肿大。乳腺囊肿超声影像学结果:椭圆形或圆形无回声区,边界清晰,包膜较薄,内部无回声。见图1。
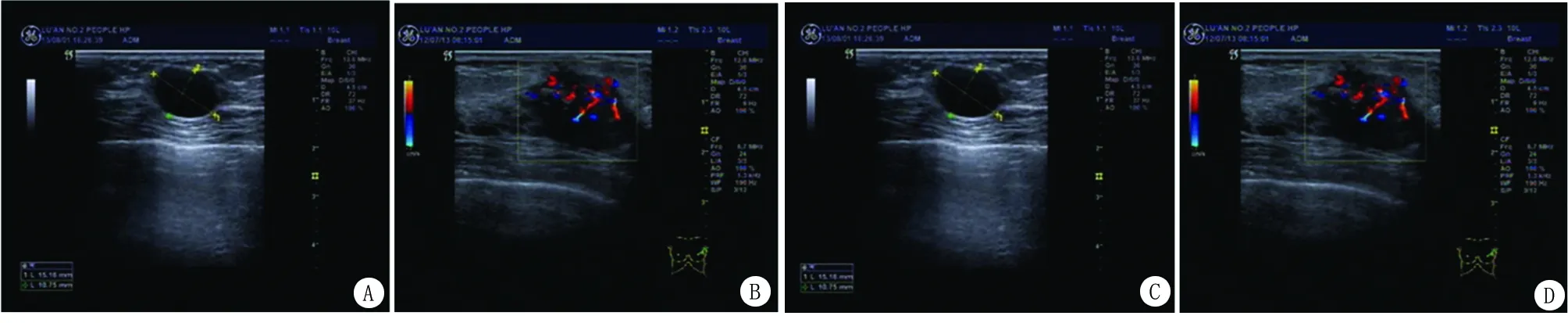
图1患者乳腺肿块的超声影像图
A.纤维腺瘤,边界清晰,包膜完整;B.乳腺增生性病变,回声分布不均;C.乳腺囊肿,边界清晰,无回声;D.乳腺浸润性癌,毛刺状,边界不清,回声分布不均
2.3 乳腺肿块切除率和出血率比较 A组病灶切除率低于B组,出血率高于B组,差异均有统计学意义(P<0.05),见表1。
2.4 乳腺肿块切除效果 本研究共80例乳腺肿块患者,术后无感染,术后6个月复查仅1例复发,病理学诊断为乳腺纤维腺瘤。

表1 不同大小乳腺肿块患者乳腺肿块切除率和出血率比较 (例数,%)
3 讨 论
乳腺微创旋切术是应用美国强生公司麦默通微创旋切系统,包括真空吸附泵、8G槽式旋切刀、控制手柄及相应软件,利用真空吸附泵辅助装置,将病灶组织吸附于槽内,然后进行切割[9]。因此,乳腺旋切系统既可用于乳腺肿块的治疗,又可用于乳腺病灶的病理诊断,从而降低假阴性率。乳腺微创旋切术为乳腺疾病的发现、诊断及治疗提供了更有效的方法,为良性肿瘤的微创切除提供了技术基础。乳腺微创旋切术是在超声等定位技术引导下的治疗技术,其优点有:①精确定位并切除病灶;②切口微小;③手术安全性好;④取样量大,诊断准确;④手术并发症少;⑤操作方便、快速。目前,乳腺微创旋切术治疗乳腺良性肿瘤已经有15年历史,治疗效果良好[10]。由于手术切口较小、不易留疤,年轻患者较为喜爱,故在临床应用较广泛。乳腺微创旋切术的病灶定位系统包括磁共振成像、钼靶定位及超声定位[11]。
超声技术在费用、操作时间及患者舒适度方面优于磁共振成像、钼靶定位。超声技术操作简便、定位准确,是诊断乳腺肿瘤的常用手段,尤其是小病灶、多病灶、病灶位置较深患者[12]。乳腺肿块的定位、定性及定量诊断基础是二维超声,其诊断主要是依据肿块的形态、边缘、包膜及内部回声等。而多普勒超声不仅能够显示患者肿块内部血管丰富程度,还可以通过检测病变组织的血供情况,进而判断血管内有无血栓或狭窄。介入性超声是指在超声的介入引导下完成疾病的诊断和治疗,如药物注入局部组织、组织穿刺活检等,其优点是操作简便、无辐射、价格较低,并且不受患者病情影响,在门诊等各种场合均可完成诊断治疗。随着医学技术的发展和健康体检的普及,乳腺肿块的检出率越来越高。在乳腺微创旋切术中,采用二维超声联合多普勒超声检查具有术前筛选病灶、术中定位治疗、术后随访的作用。因此,二维超声联合多普勒超声扫查行乳腺微创旋切术,对患者乳腺肿块的筛查及预后判断具有临床参考价值。
研究报道乳腺微创旋切术对乳腺肿瘤活检的灵敏度高、准确性好[13]。本研究80 例乳腺肿块患者共94个病灶,病理学检测结果显示乳腺囊肿36个病灶,乳腺瘤样增生19个病灶,乳腺纤维腺瘤39个病灶。说明二维超声联合多普勒超声扫查在术前筛选中准确度高,能够使患者避免开放手术活检[14]。
减少术后病灶残留及复发的关键是准确定位病灶并完全切除[15-16]。在超声介导下行乳腺微创旋切术,能够准确定位病灶,避开大血管,减少出血。本研究结果显示,2组乳腺肿块切除率及术中出血率差异均有统计学意义(P<0.05)。说明患者的乳腺肿块越大,其切除率越低,出血率越高。表明手术的病灶切除率和出血率与病灶大小及位置有关。超声引导下行乳腺微创旋切术的影响因素有肿块大小、血流丰富情况等。患者病灶越大,手术中穿刺次数增多,进而增大患者的创伤面积,出血率也随之升高。患者的乳腺腺体较厚或者病灶位置较深,术中不易压迫到出血点,导致出血率较高。在切除患者乳腺肿块过程中,需要避开粗大的血管,乳腺肿块血流较丰富,交叉越多,越易损伤血管,引起出血。
术后随访,当患者出现血肿或病灶残留时,超声检查显示不规则无回声[17]。造成患者病灶残留的可能原因是病灶位置较深、术中出血量较多、清除难度增加,造成病灶残留。针对这些情况,应当及时处理,避免病灶残留。本研究共80例乳腺肿块患者,术后无感染,术后6个月复查有1例复发。说明超声检查在微创旋切术后随访的重要性和必要性。
综上所述,患者的乳腺肿块越大,切除率越低,出血率越高。二维超声可以显示乳腺肿块的数目、位置、形态、大小、边界及回声等,多普勒超声能够显示患者的肿块内部血供情况,判断肿瘤的良性及恶性,在乳腺微创旋切术前行二维超声联合多普勒超声扫查,能够准确定位病灶,对患者乳腺肿块的筛查及预后判断具有临床参考价值。
[1] Ohsumi S,Taira N,Takabatake D,et al. Breast biopsy for mammographically detected nonpalpable lesions using a vacuum-assisted biopsy device (Mammotome) and upright-type stereotactic mammography unit without a digital imaging system:experience of 500 biopsies[J]. Breast Cancer,2014,21(2):123-127.
[2] 邓雄.B超引导下乳腺微创旋切术治疗乳腺良性肿瘤的临床分析[J].医学信息,2014,27(6):236-237.
[3] 巫朝君,杨伟雄,卢超政,等.超声引导下乳腺微创旋切术在乳腺可疑恶变组织中的应用[J].微创医学,2015,10(5):583-585.
[4] 张丽华,赵刚,郭卫东,等.彩色超声与弹性成像对乳腺肿块联合诊断的价值[J].河北医科大学学报,2012,33(8):958-961.
[5] 沈象吉.麦默通乳腺微创旋切术治疗乳腺良性肿块的疗效及安全性分析[J].中国基层医药,2014,21(19):2969-2970.
[6] 赵青,翟虹,赵献萍,等.超声弹性成像与常规超声诊断乳腺肿瘤良恶性的应用价值[J].重庆医学,2013,42(13):1468-1470.
[7] 霍彦平,吕晶,谢竟,等.超声引导下乳腺微创旋切术对早期乳腺癌的筛查作用[J].广东医学,2014,35(6):881-882.
[8] 韦力,姚志,周军,等.纵切面和横切面超声引导在真空辅助乳腺微创旋切术中的应用价值分析[J].中国全科医学,2014,17(9):1075-1078.
[9] Wang K,Ye Y,Sun G,et al. The Mammotome biopsy system is an effective treatment strategy for breast abscess[J]. Am J Surg,2013,205(1):35-38.
[10] 齐峰.麦默通乳腺微创旋切术与传统手术治疗乳腺良性肿瘤的对比研究[J/CD].实用妇科内分泌电子杂志,2015,2(12):25,27.
[11] 姚根新,王小伟.超声弹性成像在乳腺实性肿块良恶性诊断和鉴别中的应用[J].河北医科大学学报,2013,34(4):457-458.
[12] 曾宪良,温杏花.超声引导乳腺微创旋切术的临床应用[J].临床医学工程,2013,20(3):270-271.
[13] Yamaguchi R,Tanaka M,Tse GM,et al. Management of breast papillary lesions diagnosed in ultrasound-guided vacuum-assisted and core needle biopsies[J]. Histopathology,2015,66(4):565-576.
[14] 肖军,杨蓉.超声引导乳腺微创旋切术治疗乳腺良性肿瘤的临床观察[J].现代诊断与治疗,2015,26(17):3916-3917.
[15] 何杰,张超杰,范培芝,等.超声引导下乳腺微创旋切术与开放手术在治疗乳腺良性肿块中的对比研究[J].中国社区医师,2015,31(34):59-60.
[16] 夏爽.麦默通乳腺微创旋切术与传统手术的对比研究[J].江西医药,2014,49(11):1158-1160.
[17] Kikuchi M,Tanino H,Kosaka Y,et al. Usefulness of MRI of microcalcification lesions to determine the indication for stereotactic mammotome biopsy[J]. Anticancer Res,2014,34(11):6749-6753.
2016-11-01;
2017-02-16
朱毓(1978-),女,山东无棣人,北京通州区妇幼保健院主治医师,从事医学超声诊断研究。
R655.8
B
1007-3205(2017)11-1337-03
(本文编辑:刘斯静)
