烟台地区引起甜樱桃采后腐烂霉菌的分离鉴定
2017-11-13田亚晨贡汉生刘文丽南树港
田亚晨,贡汉生*,赵 珊,刘文丽,南树港,杨 婷
(鲁东大学食品工程学院,山东 烟台 264025)
烟台地区引起甜樱桃采后腐烂霉菌的分离鉴定
田亚晨,贡汉生*,赵 珊,刘文丽,南树港,杨 婷
(鲁东大学食品工程学院,山东 烟台 264025)
为明确引起烟台地区甜樱桃采后腐烂的主要霉菌,对烟台采后腐烂甜樱桃中的霉菌进行分离,应用内部转录间隔区序列分析方法和形态学观察将分离的霉菌进行鉴定。选出代表性霉菌菌株回接樱桃,进行致腐性检测。结果表明:从烟台不同区县收集的腐烂樱桃中分离出的60 株霉菌分属于6 个种:燕麦赤霉菌(Gibberella avenacea)、总状毛霉菌(Mucor racemosus)、三线镰刀菌(Fusarium tricinctum)、互生链格孢菌(Alternaria alternate)、奥桑青霉菌(Penicillium polonicum)和烟曲霉菌(Aspergillus fumigatus),其中互生链格孢菌和总状毛霉数量较多,分别为14 株和15 株。将这些霉菌中的代表菌株重新接回到甜樱桃,均能引起甜樱桃的腐烂。
甜樱桃;霉菌;分离鉴定
甜樱桃(Prunus avium L.)又名大樱桃,是蔷薇科、李属、樱桃亚属植物,19世纪70年代从欧洲传入中国[1-4]。甜樱桃是我国北方上市最早的高档鲜食水果之一,素有“春果第一枝”的美称[5]。甜樱桃色泽鲜艳,酸甜可口,富含人体所需的各种维生素、微量元素、多酚物质和花色苷[6-8]。甜樱桃本身具有较强的抗氧化能力,在预防疾病和维持人体健康方面起着非常重要的作用[9-10]。甜樱桃含有的各种有机成分如葡萄糖、蛋白质等和无机成分如铁、钙、磷、钾、钠等成为各种微生物的天然培养基,使其极易污染霉菌而腐烂[11]。樱桃采后损失可高至50%,其中因腐烂引起的损失在一半以上,2015年我国甜樱桃产量已超过60万 t,如腐烂损失率按25%计算,每年因腐烂损失的甜樱桃在10万 t以上,经济损失数十亿元[12-13]。
目前国内外已报道引起甜樱桃腐烂的主要有链格孢属(Alternaria)、曲霉属(Aspergillus)、葡萄孢属(Bo trytis)、镰刀菌属(Fusarium)、地丝菌属(Geotrichum)、盘长孢属(G loeosporium)、毛霉属(Mucor)、核盘菌属(M onilinia)、青霉属(Penicillium)和根霉属(Rhizopus)的霉菌[14]。不同地区引起甜樱桃腐烂的霉菌种类有所不同,这与不同地区的气候特征和邻近樱桃园的其他农作物污染的霉菌有关。传统的真菌鉴定方法主要是观察真菌在培养基上的颜色、形状、生长状态、生长速率及其在显微镜下的形态,进而确定真菌的种属地位。但由于同种真菌的菌丝和孢子形态差别较大,某些异种真菌却有相似的外观形态,形态学鉴定很难完全分清。目前常用于鉴定霉菌的分子生物学方法主要有18S rDNA和内转录间隔区(internal transcribed spacer,ITS)序列分析技术[15]。在rDNA基因中,5.8S rDNA和28S rDNA基因间隔序列称为ITS,ITS进化速度快,具有多态性,因不需要加入成熟的核糖体,所以在进化的过程中能承受更多的变异,其进化速率约为18S rDNA的10 倍,属于中度保守区域,利用它可以研究真菌的种及种以下的分类阶元[16-17]。
为明确引起烟台地区甜樱桃采后腐烂的霉菌种类,从而有针对性地抑制引起甜樱桃腐烂的霉菌,为有效防治和解决烟台地区甜樱桃采后腐烂提供依据,本研究从烟台市不同区县市场上收集采后腐烂的樱桃从中分离霉菌,并对这些霉菌ITS基因序列进行分析,从分子水平上确定其种属[18]。
1 材料与方法
1.1 材料与试剂
用于分离霉菌的60 份样品分别取自于烟台福山区、莱山区、芝罘区、牟平区、蓬莱市和栖霞市6 个市区樱桃市场上已腐烂的美早(Titon)甜樱桃,每个市场上取10 份腐烂樱桃样品。
培养基:查氏培养基,在0.10~0.15 MPa,120 ℃灭菌15 m in。
聚合酶链式反应(polymerase chain reaction,PCR)引物选用ITS通用引物ITS1和ITS4,由上海生工生物工程股份有限公司合成;真菌基因组DNA提取试剂盒 上海生工生物工程股份有限公司;PCR M aster m ix Thermo Scientific立陶宛分公司。
1.2 仪器与设备
SPX智能型生化培养箱 宁波江南仪器厂;IX73荧光倒置显微镜 日本奥林巴斯株式会社;高速冷冻离心机 上海安亭科技仪器厂;PCR扩增仪 杭州博日科技有限公司;DYY-10C型电泳仪 北京市六一仪器厂;SC850型凝胶成像系统 上海山富科学仪器有限公司。
1.3 方法
1.3.1 霉菌的培养与纯化
在无菌条件下,用接种针挑取腐烂樱桃表面的菌丝,接种于查氏培养基固体平皿中,于28 ℃培养箱中培养3~5 d,用接种针在长好的菌落边缘挑取少量菌丝植入另一查氏培养基上培养,重复上述步骤3 次,直至纯化得到单一的霉菌。将得到的霉菌转接到试管斜面培养基保存。1.3.2 ITS序列分析
1.3.2.1 基因组DNA的提取
用无菌刮刀刮取20 mg已纯化好的霉菌菌丝于1.5 m L离心管中,加入液氮研磨,按照真菌基因组DNA试剂盒说明书提取霉菌基因组DNA。
1.3.2.2 序列的扩增
应用I T S序列通用引物I T S 1:5’-TCCGTAGGTGA ACCTGCGG-3’和ITS4:5’-TCCTCCGCTTATTGATATGC-3’,以分离得到的霉菌基因组DNA为模板进行PCR扩增。PCR体系50 μL,扩增的循环参数为:94 ℃预变性5 m in;94 ℃变性1 m in、55 ℃复性1 m in、72 ℃延伸1 m in,40个循环;72 ℃保温10 m in。扩增产物经0.8%琼脂糖凝胶电泳,Genefounder染色,在凝胶成像系统上观察并记录结果。PCR产物送交上海生工生物工程股份有限公司纯化后测序。
1.3.2.3 系统发育树的构建
将测序得到菌株的ITS基因序列应用BLAST在GenBank中进行同源性比对,利用MEGA 6.0构建系统发育树。
1.3.3 霉菌的形态观察
用接种环取少量霉菌孢子,在查氏培养基固体平皿中接种成等边三角形的三点,于28 ℃培养箱中培养3~5 d,观察描述霉菌菌落的颜色、生长速度和孢子的颜色等特征。
将灭菌的盖玻片以45 ℃角插入查氏培养基平皿内,插入深度约1/2。用接种环将菌种接种在盖玻片与培养基相接的沿线,放置28 ℃培养3~7 d。培养后的菌丝体生长在培养基及盖玻片上,小心用镊子将盖玻片取出,擦去生长较差一面的菌丝体,将生长良好的菌丝体面向载玻片,压放于滴有1滴乳酸酚棉蓝液的载玻片上,用显微镜观察菌丝体和分生孢子着生情况。
1.3.4 霉菌的致腐性鉴定
把分离得到的霉菌重新接种到甜樱桃上,观察霉菌生长情况与原腐烂甜樱桃样品腐烂症状是否相符,如相符可认为是采后病原菌。
2 结果与分析
2.1 ITS序列分析结果
2.1.1 ITS基因序列扩增结果
从60 个腐烂甜樱桃样品中共分离纯化得到60 株霉菌,将菌株分别编号LD3.0001~LD3.0060。将60 株霉菌通过PCR技术进行ITS序列扩增并用琼脂糖凝胶电泳检测,获得了长度为500 bp左右的清晰条带,可用于后续鉴定工作,部分琼脂糖凝胶电泳图结果见图1。
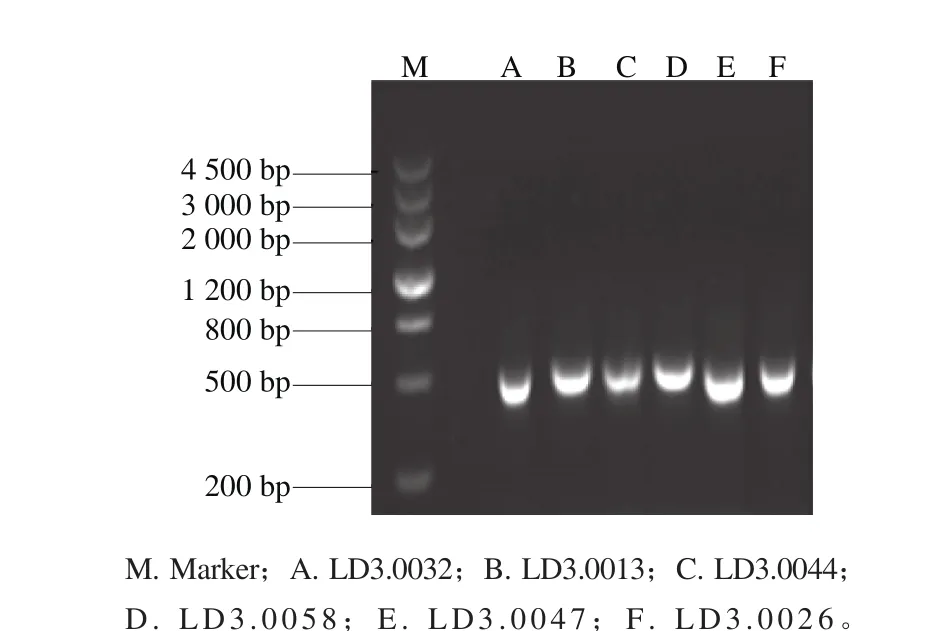
图1 PCR扩增ITS序列琼脂糖凝胶电泳结果Fig. 1 Electrophoresis analysis of PCR amplified products
2.1.2 同源性比较及系统发育关系
采用ITS序列分析方法对60 株霉菌进行鉴定,将PCR扩增后的产物进行测序。测序获得的ITS基因序列与GenBank中收录的基因序列进行同源性比较,并将典型菌株的ITS序列提交GenBank,用M EGA 6.0软件构建系统发育树。基于ITS序列分析结果和构建的系统发育树(图2),分离得到的60 株霉菌按照亲缘关系分属于6 个种:燕麦赤霉菌(Gibberella avenacea),8 株;总状毛霉菌(Mucor racemosus),14 株;三线镰刀菌(Fusarium tricinctum),8 株;互生链格孢菌(Alternaria a lternate),15 株;奥桑青霉菌(Penicillium polonicum),8 株;烟曲霉菌(Aspergillus fumigatus),7 株。其中赤霉菌为镰刀菌的有性阶段,都属于镰刀菌属,所以同源性极为接近(图2)。

图2 由MEGA 6.0构建霉菌菌株系统进化树Fig. 2 Phylogenetic tree of mou lds established by MEGA 6.0

表1 腐烂樱桃中所含霉菌种类及数量Tab le 1 Species and numbers of moulds isolated from decayed cherry fruits
每种霉菌中选出1株典型菌株进行后续实验,具体见表1。典型菌株LD3.0013、LD3.0026、LD3.0032、LD3.0047、LD3.0058和LD3.0044的ITS序列收录号分别为KY 056767、KY 056768、KY 056769、KY 056770、KY056771和KY056772。
2.2 霉菌的形态学分析
2.2.1 霉菌菌落形态观察结果

图3 霉菌菌落形态Fig. 3 M ould colonies
将6 株霉菌接种到查氏培养基中,经3~5 d培养进行形态观察,结果见图3。LD3.0013菌落为圆形,菌落中心有不规则状白色小突起,菌丝体呈白色,气生菌丝呈羊毛状,较疏松,边缘有缘毛,产生少量孢子。LD3.0026菌落为蓬松的绒毛状,菌丝初期白色,后顶端变为灰白色至黑色,说明孢子囊大量成熟。LD 3.0032菌落内部红褐色,表面白色,可肉眼观察到白色毡状菌丝,气生菌丝致密,菌丝较短。LD3.0047菌丝褐色至灰黑色,菌落表面呈绒毛状。LD 3.0058营养体为白色或淡黄色,菌丝较短,培养后期菌落中心及表面产生蓝绿色孢子。LD3.0044菌丝早期是无色的,后来渐变为浅褐色的毡状菌落,气生菌丝较致密,可观察到大量孢子。
2.2.2 霉菌菌体观察结果
将6 株典型霉菌接种到查氏培养基中插片培养,生长3~7 d,乳酸酚棉蓝染色液染色后用显微镜观察,6 株霉菌的显微镜照片如图4所示。

图4 霉菌分离、纯化后的显微形态特征Fig. 4 M icroscopic morphology of the moulds
根据图4显微镜观察到的霉菌显微形态可以发现,LD 3.0013菌丝体疏松,成网状,菌丝内有隔,表面光滑,顶端不形成膨大的顶囊;分支较多,部分分支呈镰刀形并聚集成束;分生孢子梗不明显,分生孢子较少,呈卵圆形或圆形。LD 3.0026的菌丝无隔、多核、分枝状,无假根或匍匐菌丝;菌丝体上直接生出单生、总状分枝的孢囊梗;各分枝顶端长着球形孢子囊,内有不同形状的囊轴,但无囊托,囊内产生大量球形、椭圆形的孢囊孢子。LD3.0032的菌丝有隔,分枝;分生孢子梗分枝或不分枝;分生孢子有两种形态,小型分生孢子呈卵圆形至柱形,有隔膜,大型分生孢子镰刀形或长柱形,有较多的横隔。LD 3.0047的菌丝有隔,表面光滑,多分枝,顶端形成膨大的孢子头;分生孢子梗较短,大多数不分枝,与营养菌丝几乎无区别,聚集成网状;分生孢子较少,少数为卵圆形。LD 3.0058菌丝有横隔,基部无足细胞,顶端不形成膨大的顶囊;孢梗茎表面较粗糙,分枝与梗茎有不同程度的叉开,不对称,顶端不膨大;分生孢子梗,多为单轮生,双轮生者少;分生孢子,多呈球形;分生孢子链疏松而不规则,散乱弯曲。LD3.0044的菌丝有横隔,无分枝;分生孢子梗直接生于气生菌丝,孢梗茎较长,壁光滑透明;分生孢梗茎顶端膨胀后生出产孢细胞;分生孢子为小球形或近球形。
2.3 分离霉菌的致腐性检测结果
将分离出的6 种典型霉菌(LD3.0013、LD3.0026、LD3.0032、LD3.0047、LD3.0058和LD3.0044)接种于刺破表皮的新鲜樱桃上进行致腐性检测。发现6 株霉菌均能引起樱桃的腐烂,腐烂症状与原始样品腐烂症状相同,见图5,它们在果实内部或表面发病,生成绒毛絮状菌丝,蔓延生长,最后导致全果腐烂。从接种霉菌而腐烂的甜樱桃上再次分离霉菌,分离得到的霉菌与所接霉菌菌体形态相同。说明这6 株霉菌是引起烟台市甜樱桃采后腐烂的霉菌。

图5 霉菌回接樱桃图Fig. 5 Sweet cherry fruits artifi cially inocu lated w ith the mou lds
3 讨 论
霉菌能够在温暖和潮湿环境中迅速繁殖,主要通过小型干性分生孢子附着在尘埃上,形成一定粒径的生物性粒子悬浮在空气中而传播[19]。甜樱桃一般在5—7月份上市,此时各地区降雨量大,平均温度为24~28 ℃,为各类致腐霉菌的孢子萌发提供了有利的温湿条件。另外,较高的空气湿度容易导致甜樱桃裂果的发生,如遇降水,会使裂果加剧,形成创口,更易感染病原菌[20]。
本实验从樱桃中分离出赤霉菌、镰刀菌、链格孢菌、毛霉菌、青霉菌和曲霉菌6 个菌属的霉菌,其中链格孢菌和毛霉菌占大多数。研究结果与以往报道的引起樱桃腐烂的病原真菌种类有所不同,究其原因可能是病原真菌对不同樱桃品种的侵染力不同,以及地理环境、管理水平和气候条件等方面的差异,而导致引起樱桃腐烂的病原真菌种类存在一定的差异;此外,不同地区因长期使用不同抑菌药物,也可能致使分离所得病原菌种类有所不同。目前国内对引起樱桃腐烂的镰刀菌和赤霉菌的报道很少,多数镰刀菌的生活史包含无性和有性阶段,其中赤霉菌为镰刀菌的有性阶段,所以赤霉菌也属于镰刀菌属霉菌。有研究表明,镰刀菌和赤霉菌主要存在于水稻、小麦等谷物中,不仅引起植物根、茎、叶的腐烂萎蔫造成粮食减产和损失,而且可产生多种真菌毒素如玉米赤霉烯酮和单端孢霉烯及其衍生物富集于谷粒或麦粒中,食用后引发人及家畜肝脏和肾脏衰竭和癌变[21-23]。由于烟台地区樱桃和小麦等粮食作物未能有效分隔种植,使樱桃在采收期间感染粮谷类致腐菌。本研究未发现赵远征等[24]报道的引起樱桃腐烂的链核盘菌,可能是因为链核盘菌主要产生褐腐病,患病樱桃腐烂后干瘪在枝头不易扩散,且采摘时容易避开所以在采后樱桃中较为少见。
近年来,霉菌及其毒素的污染对农业和畜牧业生产造成了巨大损失[25]。樱桃贮运过程中很容易发生霉烂并产生霉菌毒素。链格孢菌是导致水果、蔬菜及冷藏食品腐败变质的主要微生物,可以产生多种次生代谢物。目前,从链格孢菌中已经分离了超过30 种明显有毒性的毒素,统称为链格孢菌毒素。有研究表明链格孢菌毒素具有细胞毒性、基因毒性和致突变、致癌、致畸作用[26-27]。曲霉、青霉和镰刀菌是产生赭曲霉毒素、展青霉毒素、伏马菌素等真菌毒素的主要类群,以往研究已经证明上述霉菌毒素具有致畸、致癌、致突变等作用[28-31]。现阶段对于产毒霉菌主要通过除湿、控温、过滤、除氧、紫外线照射、喷洒化学制剂等进行控制[32-33]。
霉菌在粮食、蔬菜和水果等农产品上大量存在,由此引起的腐烂以及使人和动、植物中毒的风险,其危害极大。本研究从烟台地区采后霉烂的甜樱桃上共分离鉴定得到赤霉菌、链格孢菌、毛霉菌、镰刀菌、青霉菌和曲霉菌6 个菌属的霉菌,为今后抑制甜樱桃的腐烂霉菌提供了理论支持,为新鲜樱桃运输、贮藏过程中微生物病害防治提供了参考依据。
[1] IPPOUSHI K, SASANUMA M, OIKE H, et al. Absolute quantification o f Pru av 2 in sw eet cherry fruit by liquid chromatography/tandem mass spectrometry w ith the use of a stable isotope-labelled peptide[J]. Food Chem istry, 2016, 204: 129-134. DOI:10.1016/j.foodchem.2016.02.115.
[2] 于国合. 大樱桃发展前景广阔[J]. 农技服务, 2004(2): 4-6.
[3] 董维. UV-C对甜樱桃采后腐烂的控制[D]. 北京: 中国农业大学,2003.
[4] 凌丹燕, 李永强, 路梅, 等. 短柄樱桃干腐病病原菌的鉴定及其生物学特性[J]. 浙江师范大学学报(自然科学版), 2016, 39(2): 200-206. DOI:10.16218/j.issn.1001-5051.2016.02.013.
[5] 潘凤荣. 甜樱桃栽培技术[J]. 北方果树, 2009(2): 36-40.DOI:10.16376/j.cnki.bfgs.2009.02.032.
[6] LONGOBARDI F, VENTRELLA A, BIANCO A, et al. Nontargeted1H NMR fingerprinting and multivariate statistical analyses for the characterisation of the geographical origin of Italian sweet cherries[J]. Food Chem istry, 2013, 141(3): 3028-3033. DOI:10.1016/j.foodchem.2013.05.135.
[7] 郭海军. 甜樱桃设施高效栽培技术(一)[J]. 果树实用技术与信息,2016(5): 19-21.
[8] 洪玮, 王静, 王瑞英, 等. 甜樱桃设施栽培探讨[J]. 现代农业科技,2015(18): 118-119.
[9] YOO K M, MOHAMAD A F, LEE H J, et al. Antiproliferative effects o f cherry juice and w ine in Chinese ham ster lung fibroblast cells and their phenolic constituents and antioxidants activities[J]. Food Chem istry, 2010, 123(3): 734-740. DOI:10.1016/j.foodchem.2010.05.043.
[10] Y ILM AZ K, ERC ILSI S, ZENG IN Y, et al. Prelim inary characterisation of Cornelian cherry (Cornus mas L.) genotypes for their physico-chem ical propertie[J]. Food Chem istry, 2009, 114(2):408-412. DOI:10.1016/j.foodchem.2008.09.055.
[11] 施俊凤, 薛梦林, 王春生, 等. 甜樱桃采后生理特性与保鲜技术的研究现状与进展[J]. 保鲜与加工, 2009, 9(6): 7-10.
[12] IPPOLITO A, SCHENA L, PENTIMONE I, et al. Control of postharvest rots of sweet cherries by pre- and postharvest applications of Aureobasidium pullulans in combination w ith calcium chloride or sodium bicarbonate[J]. Postharvest Biology and Technology, 2005,36(3): 245-252. DOI:10.1016/j.postharvbio.2005.02.007.
[13] 黄贞光, 刘聪利, 李明, 等. 近20年国内外甜樱桃产业发展动态及对未来的预测[J]. 果树学报, 2014(增刊1): 1-6.
[14] 付全娟, 魏国芹, 孙杨, 等. 樱桃次生成分及生物活性研究进展[J].北方园艺, 2016(7): 198-201.
[15] IWEN P, HINRICHS S, RUPP M. U tilization of the internal transcribed spacer regions as molecular targets to detect and identify human fungal pathogens[J]. Medical M ycology, 2002, 40(1): 87-109.
[16] 张志华, 洪葵. 核酸序列直接分析在真菌鉴定方面的应用[J]. 热带生物学报, 2006, 12(2): 39-43.
[17] 唐建辉, 王伟. 西瓜炭疽菌核糖体基因ITS区段的克隆及序列分析[J]. 安徽农业科学, 2007, 35(9): 2566-2568. DOI:10.13989/j.cnki.0517-6611.2007.09.023.
[18] 齐修云. 大樱桃防冻害的综合管理技术研究[J]. 福建农业, 2015(7): 133.
[19] 刘海涛. 霉菌污染及其防治措施[J]. 中国实用医药, 2007, 2(4): 98-99.
[20] 丁锡强, 孙衍晓, 高峰, 等. 烟台市大樱桃生产的气象条件利弊分析及对策研究[J]. 河北农业科学, 2009, 13(11): 19-22.DOI:10.16318/j.cnki.hbnykx.2009.11.030.
[21] MARI M, MARTIM I C, GU IDARELLI M, et al. Postharvest biocontrol of Monilinia laxa, Monilinia fructico la and Monilinia fructigena on stone fruit by tw o Aureobasid ium pu llu lans strains[J]. Biological Control, 2012, 60: 132-140. DOI:10.1016/j.biocontrol.2011.10.013.
[22] 武爱波, 李和平, 张静柏, 等. 小麦和玉米籽粒赤霉菌产毒类型的PCR检测[J]. 麦类作物学报, 2005, 25(5): 1-4.
[23] 全国小麦赤霉病研究协作组. 我国小麦赤霉病穗部镰刀菌种类、分布和致病性[J]. 上海师范大学学报(自然科学版), 1984(3): 69-82.
[24] 赵远征, 刘志恒, 李俞涛, 等. 大樱桃黑斑病病原鉴定及其致病性研究[J]. 园艺学报, 2013, 40(8): 1560-1566. DOI:10.16420/j.issn.0513-353x.2013.08.001.
[25] 苏永腾, 刘强. 谷物霉菌毒素的危害及其控制措施的研究[J]. 中国食物与营养, 2010(4): 9-12.
[26] 朱建兰, 常永义. 樱桃黑色轮斑病的病原菌鉴定及其生物学研究[J]. 中国果树, 2004(3): 9-12. DOI:10.16626/j.cnki.issn1000-8047.2004.03.004.
[27] MOSS M, THRANE U. Fusarium taxonom y w ith relation to trichothecene formation[J]. Toxicology Letters, 2004, 153(1): 23-28.DOI:10.1016/j.toxlet.2004.04.021.
[28] KOCH P. State of the art of trichothecenes analysis[J]. Toxicology Letters, 2004, 153(1): 109-112. DOI:10.1016/j.toxlet.2004.04.027.
[29] 宋蕤, 韩舜愈, 李敏, 等. 甘肃河西走廊产区酿酒葡萄产毒霉菌的分离与鉴定[J]. 食品科学, 2014, 35(19): 189-193. DOI:10.7506/spkx1002-6630-201419039.
[30] 于新, 庞杰. 柑橘采后青霉毒素的研究[J]. 食品科学, 1998, 19(11):11-13.
[31] 李加友, 褚云峰, 陆筑凤, 等. 饲料发酵耦合黄曲霉毒素B1的生物脱除方法研究[J]. 中国畜牧杂志, 2016, 52(4): 59-62.
[32] 黄广明, 阳艳林. 霉菌毒素污染的危害[J]. 农业知识, 2016(18): 56-57.
[33] 任皓, 王金荣, 娄鹏, 等. 饲料中青霉菌类毒素的污染及其检测技术研究[J]. 饲料博览, 2009(6): 29-32.
Screening and Identification of Spoilage Moulds from Postharvest Sweet Cherry in Yantai
TIAN Yachen, GONG Hansheng*, ZHAO Shan, LIU Wenli, NAN Shugang, YANG Ting
(School of Food Engineering, Ludong University, Yantai 264025, China)
In order to clarify the dom inant mould species causing postharvest decay of sweet cherry in Yantai, spoilage moulds from decayed sweet cherry fruits were screened and identified by internal transcribed spacer (ITS) sequence analysis.Typical strains were exam ined for colonial morphology and then re-inoculated into sweet cherry to test their pathogenicity.A total of 60 moulds were isolated from decayed sweet cherry from different regions of Yantai, and they were assigned to 6 species based on both ITS sequence analysis and morphological identification, Mucor racemosu, Fusarium tricinctum,Alternaria alternate, Penicillium polonicum and Aspergillus fumigatus. The predom inant species were Alternaria alternate(14 strains) and Mucor racemosu (15 strains). Compared w ith naturally decayed sweet cherry, sweet cherries inoculated w ith moulds were decayed and displayed the same colonial morphology.
sweet cherries; moulds; screening and identification
10.7506/spkx1002-6630-201722005
TS201.3
A
1002-6630(2017)22-0028-06
田亚晨, 贡汉生, 赵珊, 等. 烟台地区引起甜樱桃采后腐烂霉菌的分离鉴定[J]. 食品科学, 2017, 38(22): 28-33.
DOI:10.7506/spkx1002-6630-201722005. http://www.spkx.net.cn
TIAN Yachen, GONG Hansheng, ZHAO Shan, et al. Screening and identification of spoilage moulds from postharvest sweet cherry in Yantai[J]. Food Science, 2017, 38(22): 28-33. (in Chinese w ith English abstract) DOI:10.7506/spkx1002-6630-201722005. http://www.spkx.net.cn
2016-11-29
国家自然科学基金青年科学基金项目(31301565);山东省自然科学基金青年基金项目(ZR2012CQ009);烟台市科技计划项目(2012125);山东省高等学校科技计划项目(J12LD03)
田亚晨(1995—),女,本科生,研究方向为农产品贮藏及加工。E-mail:1446144220@qq.com
*通信作者:贡汉生(1981—),男,副教授,博士,研究方向为农产品贮藏及加工。E-mail:hsgong_221@163.com
