鸡蛋黄蛋白质水解产物制备及其对MC3T3-E1细胞增殖分化的影响
2017-11-13陈宏杰金永国马美湖
陈宏杰,金永国,马美湖*
(华中农业大学食品科技学院,湖北 武汉 430070)
鸡蛋黄蛋白质水解产物制备及其对MC3T3-E1细胞增殖分化的影响
陈宏杰,金永国,马美湖*
(华中农业大学食品科技学院,湖北 武汉 430070)
鸡蛋黄经脱脂得到蛋黄蛋白质,直接以MC3T3-E1细胞增殖活力为指标,对水解条件进行优化,从而制备蛋黄蛋白质水解产物(egg yolk proteins hydrolysate,EYPH)并对其促MC3T3-E1细胞增殖分化的活性进行研究。结果表明:在对比胰蛋白酶与风味蛋白酶水解过程中,发现单一胰蛋白酶反应得到产物活性最好,胰蛋白酶反应的最佳水解条件为水解时间6 h、水解温度37 ℃、酶与底物质量比1∶50、pH 8.0。EYPH使MC3T3-E1细胞增殖活力得到提高,为129.89%,细胞周期分析得到S期细胞增加了4.69%,这2 个方面证实EYPH对MC3T3-E1细胞的增殖活力有显著的提高。EYPH对MC3T3-E1细胞分化矿化有显著影响,碱性磷酸酶活力提高了9.1%;刺激骨钙素分泌,其含量上升2 mg/m L;形成更多的矿化结节。此外,EYPH还能刺激RUNX2特异性转录因子的基因表达,表达量提高了6.12倍。结果说明EYPH对成骨细胞MC3T3-E1增殖分化有显著的促进作用,因此,EYPH对于抗骨质疏松方面有较好的应用潜力,为开发其功能性食品提供一定的数据参考。
蛋黄蛋白质水解产物;水解条件;MC3T3-E1细胞;增殖;分化
骨质疏松症是一种常见的疾病,主要特征为骨质量和微体系结构受到系统性的损伤[1]。正常成年人的骨质量稳态是通过骨形成与骨吸收的平衡来维持。预防治疗骨质疏松症是通过抑制骨吸收和促进骨形成来阻止骨质的流失[2-4]。骨吸收是通过破骨细胞活化分解骨基质所产生的,骨形成是通过成骨细胞增殖、胞外基质成熟、胞外基质矿化及凋亡所调控的[5]。成骨细胞的增殖及分化是骨形成的关键,提高成骨细胞分化活力可以有效的促进骨形成[6]。诱导成骨细胞分化对于预防治疗骨质疏松症具有重要意义。目前市面上销售的治疗骨质疏松症的骨合成药剂特立帕肽是一种甲状腺激素类似物,它不适用于骨质疏松症的所有患者[7]。因此,开发促进骨形成的药剂及功能产品具有重要研究意义。
目前,有研究[8-12]报道食源性功能产品对MC3T3-E1细胞增殖分化有促进作用,说明可以在食品中寻找促进骨形成的功能产品。蛋黄蛋白质是蛋黄提取卵磷脂的副产物,在鸡胚发育过程中这些蛋白质是必需的生物活性物质。有关提取卵磷脂后副产物的加工利用研究的报道[13-15]也逐渐增加,主要是通过蛋白酶对其进行水解得到具有功能活性物质,活性功能主要表现在抗氧化、抗高血压、抗糖尿病等作用。据报道[16-17]由于蛋黄蛋白质在胚胎骨骼发育过程起关键作用,所以蛋黄来源肽对于骨代谢有着保护作用,对预防骨质疏松症具有潜在效果。但是对于这一功能物质的水解条件的研究目前鲜有报道,该蛋黄来源肽促进骨形成的机理研究也不是很清楚。
因此,在本研究中以蛋黄蛋白质为底物,以成骨细胞MC3T3-E1的增殖活力为评价指标,采用正交法确定水解反应的最优条件,水解得到蛋黄蛋白质水解产物(egg yolk proteins hydrolysate,EYPH)。研究其对成骨细胞MC3T3-E1增殖活力、碱性磷酸酶(alkaline phosphatase,ALP)活性、骨钙素(osteocalcin,OC)含量和成骨细胞特异性转录因子RUNX 2的基因表达的影响,为开发预防治疗骨质疏松的功能性产品提供理论依据。
1 材料与方法
1.1 材料与试剂
新鲜鸡蛋 武汉九峰山养殖场;MC3T3-E1细胞中国科学院上海细胞库。
胰蛋白酶、风味蛋白酶 上海源叶生物科技有限公司;α-M EM培养基、胎牛血清、双抗(青霉素、链霉素) 美国Gibco公司;茜素红染料 美国Sigm a公司;CCK-8细胞计数盒 北京庄盟国际生物基因科技有限公司;碱性磷酸酶检测试剂盒 南京建成生物工程研究所;小鼠骨钙素ELISA检测试剂盒 上海酶联生物科技有限公司;BCA蛋白检测试剂盒、碘化丙啶PI试剂 武汉谷歌生物科技有限公司;RNaseA核糖核酸酶 北京So larbio公司;Trizo l RNA提取试剂盒美国Invitrogen公司;cDNA合成试剂盒 美国Thermo Fisher公司;SYBR Green染料 瑞士Roche公司;其他试剂均为分析纯。
1.2 仪器与设备
Sigma3-30K高速冷冻离心机 美国Sigma公司;ALPHA 1-4冷冻干燥机 德国Christ公司;HERAcell 150I型二氧化碳培养箱 德国Thermo公司;IX 71荧光倒置显微镜 日本Olympus公司;iMark酶标仪 联想生物科技有限公司;FACSCalibur流式细胞仪 美国BD公司;StepOnePlus实时荧光定量聚合酶链式反应(real time fluorescence quantitative-polymerase chain reaction,RTFQ-PCR)仪 美国ABI公司。
1.3 方法
1.3.1 蛋黄蛋白质的水解
将新鲜鸡蛋进行蛋黄分离,混匀后经冷冻干燥机干燥,后将蛋黄粉经乙醇和正己烷(体积比1∶2)溶液除去蛋黄中脂质成分,得到蛋黄蛋白质(egg yolk protein,EYP)。蛋白酶水解反应是根据Zambrow icz等[18]的方法,作一定改动:称取一定量EYP溶于一定去离子水中(质量浓度为5.0 mg/m L),充分混匀。将溶液放置恒温搅拌反应器中将温度调节至蛋白酶最适温度,将pH值调至蛋白酶最适值,最后加入一定量的蛋白酶反应。制备得到的EYPH放置于95 ℃水浴中灭酶10 m in,冷却后放置于冷冻离心机中离心(8 000×g,15m in),收集上清液冻干。
1.3.2 水解度的测定
根据蓝泽林[19]的甲醛滴定法测定水解EYP的水解度(degree of hydrolysis,DH)。DH计算由公式(1)和公式(2)表示。

式中:h(NH2)为水解后的氨基态氮浓度/(mmol/g);h0为水解前的氨基态氮浓度/(mmol/g);htot为底物中的肽键浓度/(mmol/g),卵黄蛋白的htot为7.841 mmol/g。

式中:V1为样品组所消耗的NaOH溶液的体积/m L;V2为对照组所消耗的NaOH溶液的体积/m L;C为NaOH的物质的量浓度/(mol/m L);V为待测液的体积/m L;V0为取水解产物的体积/m L;m为蛋黄蛋白质质量/g。
1.3.3 单因素试验及正交试验设计
在蛋白酶水解过程中,酶与底物比、反应pH值、水解温度、水解时间都影响着水解度(DH)[20]。水解过程中仅用DH来衡量水解条件的优化是不够的,对于制备活性水解产物,其不同的水解条件可以对其活性功能产生很大的影响。因此在对比DH的程度上使用其活性功能作为指标去优化其水解条件,首先采用单因素试验确定胰蛋白酶和风味蛋白酶各自适宜的水解条件。
每种蛋白酶的作用位点不同,水解得到的产物活性也有所不同[21]。2 种酶复合后可能有协同的作用,对于蛋白质中活性位点的释放起到更好的作用。对胰蛋白酶和风味蛋白酶的单一作用及复合作用进行四因素三水平的正交试验,试验因素与水平见表1所示。
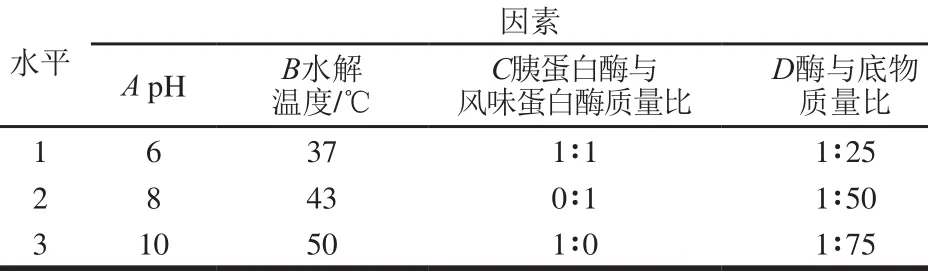
表1 正交试验因素与水平Table 1 Factors and their coded and actual levels used for orthogonal array design
1.3.4 MC3T3-E1细胞增殖活力测定
将Li Jia等[22]使用CCK-8试剂盒测定细胞增殖率的方法适当改进。将细胞按8×103个/孔接种于96孔板中,使其贴壁4 h,更换不同浓度的含有水解产物的培养液100 μL,每个浓度设5个复孔。将96孔板放置于恒湿恒温培养箱中培养24 h。取出培养板更换正常培养液,再向每孔加入10 μL CCK-8试剂,置于培养箱中反应2 h后,置于酶标仪450 nm波长下测定OD值。细胞增殖率按公式(3)计算:

1.3.5 MC3T3-E1细胞周期分析
根据Liu Junli等[23]的方法通过碘化丙啶(propidium iodide,PI)染色检测DNA的分布从而分析细胞周期。将细胞按2×105个/孔接种于6孔板中,使贴壁4 h,加入质量浓度为0、1、2 mg/m L的含水解产物的培养液2.5 m L,每个质量浓度设置3个孔。孵育24 h后,用胰蛋白酶将细胞消化下培养板,加入体积分数90%冰浴乙醇,保持-20 ℃的温度12 h。用0.01mol/L的磷酸盐缓冲液清洗细胞,用RNaseA消化40 m in,加入PI避光染色20 m in,利用流式细胞仪在激发波长488 nm下进行检测,分析细胞周期。
1.3.6 MC3T3-E1细胞ALP活力测定
取细胞浓度为9×104个/m L接种于12 孔板中,每孔接种1 m L,待48 h后,更换质量浓度为0、1、2 mg/m L的含水解产物的分化诱导培养液培养诱导分化5 d(每个质量浓度3个复孔),去除培养液,用含质量分数1%TritonX-100的细胞裂解液裂解细胞,取上清液,根据碱性磷酸酶检测试剂盒的说明操作测定该上清液的ALP活力。
1.3.7 MC3T3-E1细胞OC含量的测定
将细胞按9×104个/孔的浓度接种于12 孔板中,培养48 h后,换质量浓度为0、1、2 mg/m L的含水解产物的分化诱导培养液培养诱导分化5 d(每个质量浓度3个复孔),收集培养液,根据小鼠骨钙素ELISA试剂盒的说明操作检测培养液中OC的含量。
1.3.8 RTFQ-PCR测定成骨细胞特异性转录因子RUNX2的基因表达
根据A lessand ro等[24]的方法进行适当修改,使用RTFQ-PCR仪对成骨细胞特异性转录因子RUNX2的基因表达进行分析。将细胞按2×105个/孔接种于6孔板中,培养48 h后,换质量浓度为0、1、2 mg/m L的含水解产物的分化诱导培养液培养诱导分化5 d,每个质量浓度设置3 个孔。根据Trizol试剂说明提取细胞中总RNA,取2 μg RNA通过cDNA合成试剂盒反转录用FQ-PCR进行分析(95 ℃,15 s→65 ℃,60 s循环40 次),mRNAs是通过SYBR Green染色引物作为参照基因所测定,反应引物序列见表2。

表2 RTFQ-PCR反应引物Table 2 Primer sequences used for RTFQ-PCR analysis
1.3.9 MC3T3-E1细胞茜素红染色分析
将细胞按2×105个/孔的密度接种于6 孔板中,培养48 h后,换质量浓度为0、1、2 mg/m L的含水解产物的分化诱导培养液培养诱导分化26 d。去除培养液,用预冷的PBS清洗2 次,用预冷的体积分数75%乙醇溶液固定1 h,吸出固定液,用磷酸盐缓冲液清洗2 次,向每孔中加入40 mmol/L的茜素红染色液(由氨水溶解pH值调节至4.2),室温放置15 m in。去除染色液,用去离子水洗涤染色后的细胞5 次,置于37 ℃烘箱烘干5 h,拍照观察。
1.4 数据分析
运用SPSS 17.0软件进行数据分析,所有数据进行方差分析,P值小于0.05为显著性差异,数据用标准偏差表示。
2 结果与分析
2.1 单因素试验对胰蛋白酶水解制备EYPH的影响
从图1A可以看出,随着水解时间的延长,胰蛋白酶对蛋黄蛋白质的水解度也随之增大,在4~7 h范围内水解速率较快,7 h后水解速率降缓,10 h后DH几乎无变化。这可能是由于底物中胰蛋白酶的目标位点被逐渐酶解,后不再酶解其余肽键,所以DH变化逐渐稳定。DH不同,得到的产物结构也是有差异的。在水解6 h后所得到的产物对MC3T3-E1细胞增殖活力的影响最高,细胞增殖率为115.77%。在水解6 h时,DH为18.6%,6 h后随水解时间延长DH增大,但产物活性均低于水解6 h的产物。产物活性并不随DH的增加而增大,这可能是因为胰酶将产物中的活性物质进一步水解,而导致活性降低。所以后期水解条件优化中,都使用MC3T3-E1细胞增殖活力为衡量指标。由图1B可知,在pH值为8的水解条件下,得到的产物对MC3T3-E1细胞增殖活力的影响是最佳的。由图1C可知,水解温度在37 ℃时,水解产物对MC3T3-E1细胞增殖活力的影响是最大的。由图1D可知,酶与底物质量比为1∶50,水解产物活性最强。
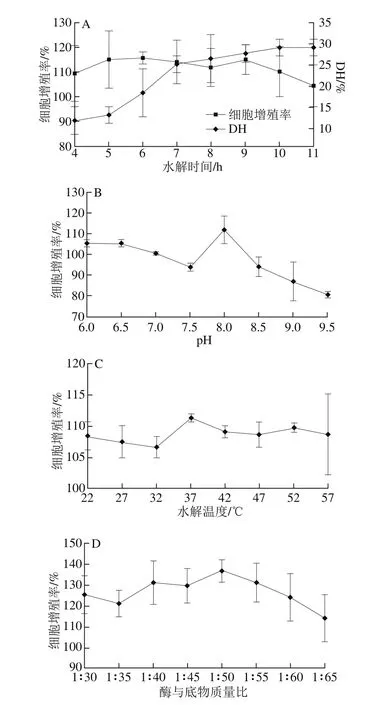
图1 4 种单因素条件对胰蛋白酶制备EYPH的影响Fig. 1 Effects of hydrolysis conditions for trypsin alone on cell proliferation promoting activity of EYPH
2.2 单因素试验对风味蛋白酶水解制备EYPH的影响
由图2A可知,随着水解时间的延长,其产物对MC3T3-E1增殖的影响是先增加后减弱的,在6~8 h时水解产物的活性基本一致,在8 h后活性减弱,推测为过长时间的水解使活性物质进一步的被酶切,导致活性降低。如图2B所示,在pH值为7.5时所得到产物活性最强,在该酶水解时调节pH值为7.5。从图2C可得,产物随水解温度活性先升高后降低,在50 ℃条件下活性最高,推测是由于温度过高后使酶的活性受抑制。由图2D可知,在酶与底物质量比为1∶20时产物活性最高,可能由于风味蛋白酶的分子质量大,底物量过大时,少量的酶分子与底物接触不完全,因此酶与底物质量比过大时,产物活性降低。

图2 4 种单因素条件对风味蛋白酶制备EYPH的影响Fig. 2 Effect of hydrolysis conditions for fl avourzyme alone on cell proliferation promoting activity of EYPH
2.3 胰蛋白酶与风味蛋白酶复合的正交试验结果
由于每种蛋白酶酶切的位点不同,为考察复合后是否有协同作用,进行复合酶与单一酶的正交试验,结果如表3所示,其中水解时间为6 h。由表3可得,水解的最佳pH值为8,最佳温度为37 ℃,最适用酶为单一胰蛋白酶,最佳酶与底物混合比为1∶75。各因素对细胞增殖率的影响顺序为pH值>酶与底物质量比>胰蛋白酶与风味蛋白酶质量比>水解温度,且由表4方差分析可知pH值影响显著。最优条件为A2B1C3D3,水解得到的产物加入培养基中,MC3T3-E1细胞增殖率为118.75%,进而验证了正交试验结果,从这一结果可以得出单一胰蛋白酶水解要优于复合酶水解。

表3 正交试验设计及结果Table 3 Orthogonal array design with experimental results

表4 方差分析Table 4 Analysis of variance
2.4 EYPH对MC3T3-E1细胞增殖率的影响
细胞增殖是细胞新生的过程,它能使细胞数目迅速增多,细胞增殖是组织与器官发育的基础[25]。在骨骼发育过程中,成骨细胞的增殖是这一过程的先决条件。如图3A所示,EYPH显著提高MC3T3-E1的增殖活力,在质量浓度偏低的情况下,随质量浓度增加其增殖率也增加,在质量浓度偏高时,质量浓度增加反而使其增殖率降低。如图3B可知,在1 mg/m L时,MC3T3-E1增殖率达到129.87%,2 mg/m L时,增殖率为110.11%。从结果可知,1 mg/m L的EYPH可以显著的提高MC3T3-E1细胞增殖率(P<0.05),2 mg/m L的促进效果不明显,且2 个剂量组之间存在显著差异(P<0.05)。
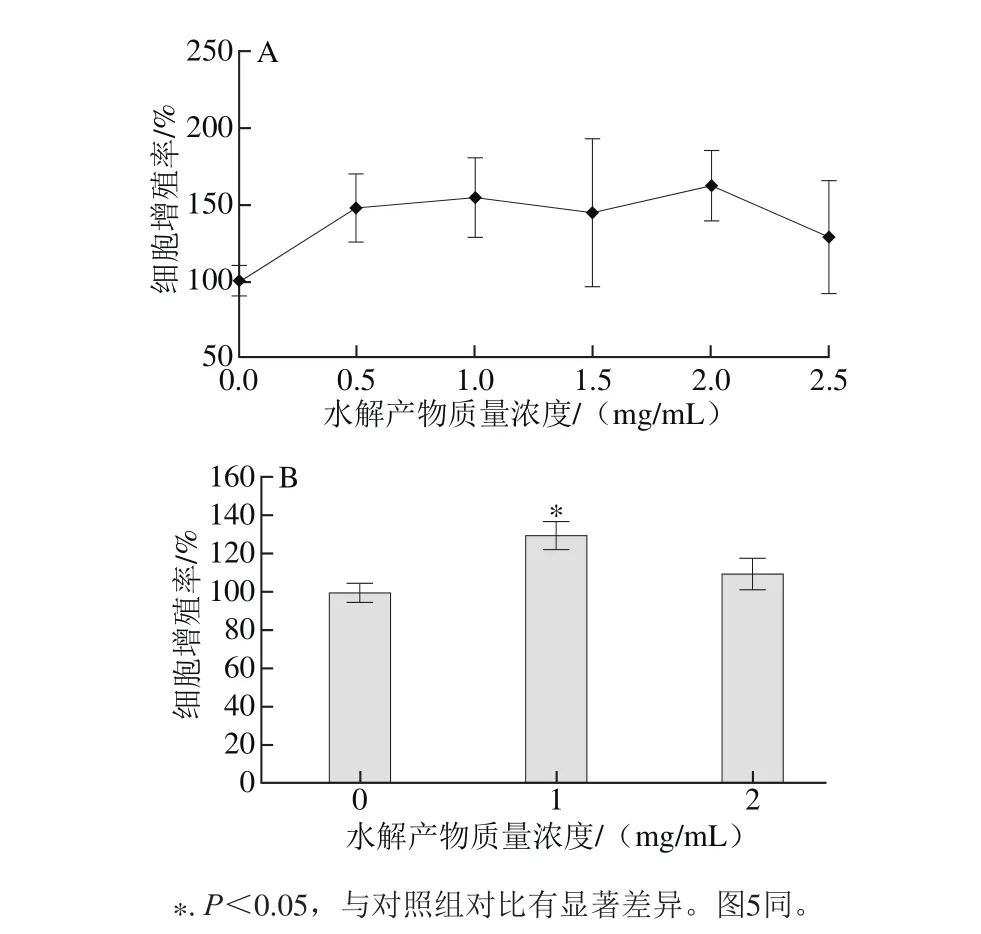
图3 EYPH对MC3T3-E1细胞增殖的影响Fig. 3 Effect of EYPH on proliferation of MC3T3-E1 cells
2.5 EYPH对MC3T3-E1细胞周期的影响
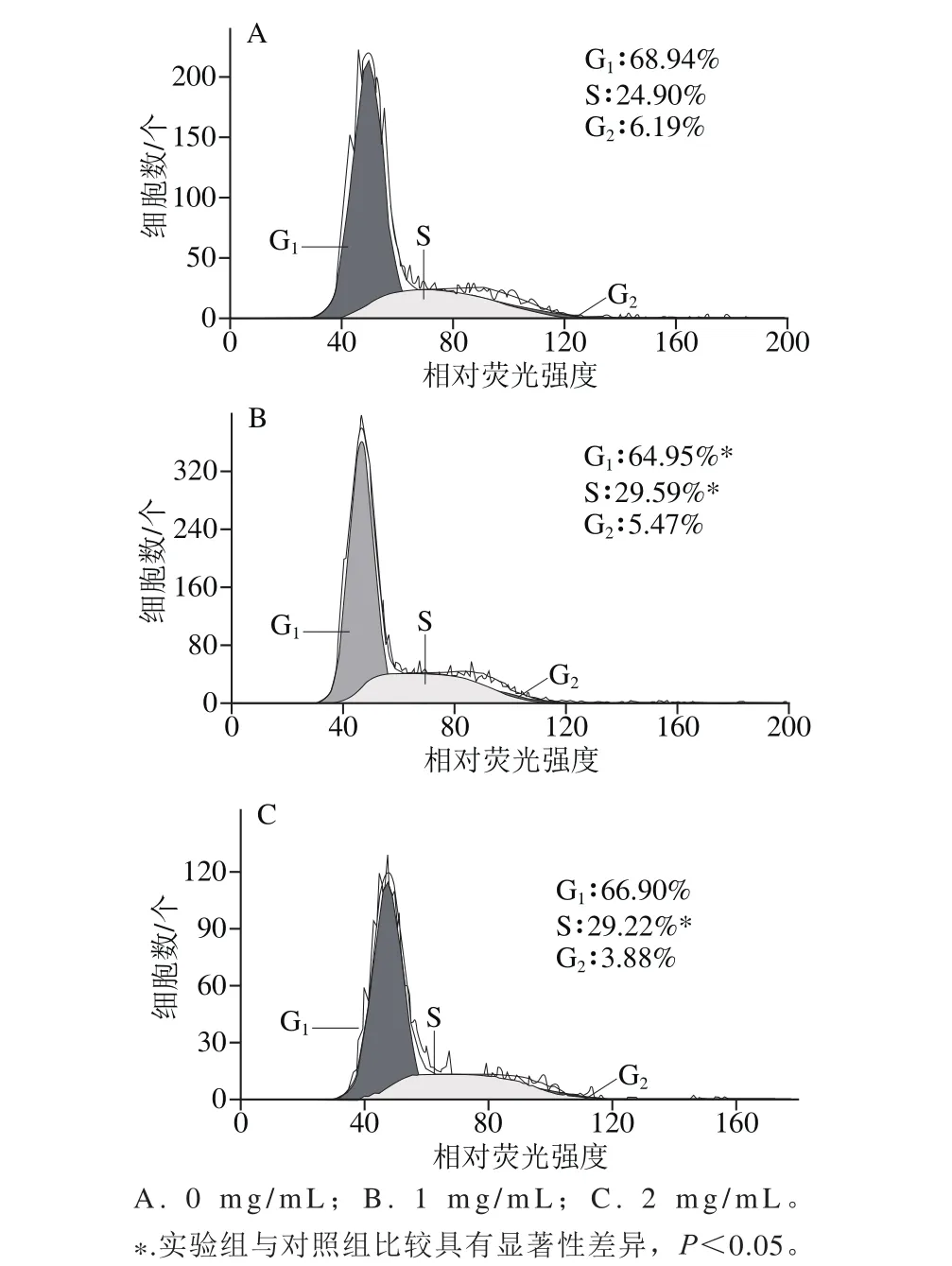
图4 EYPH处理后MC3T3-E1细胞周期分布的改变Fig. 4 Effect of EYPH the cell cycle distribution of MC3T3-E1 cells
细胞周期是指细胞从一次分裂完成开始到下一次分裂结束所经历的全过程,分为间期(G1、S、G2)与分裂期(M)。S期是细胞中从DNA合成开始到DNA合成结束的全过程,是细胞增殖周期的关键阶段。通过流式细胞仪测定EYPH处理后细胞周期的分布,并在细胞周期分布水平上讨论EYPH对MC3T3-E1细胞增殖率的影响。由图4可知,经EYPH处理后的MC3T3-E1细胞,处于S期细胞数都显著高于对照组,1 mg/m L处理的S期细胞数占29.59%,2 mg/m L处理的S期细胞数占29.22%。从结果表明EYPH对MC3T3-E1细胞增殖有促进作用,且1 mg/m L处理时效果优于2 mg/m L处理时效果,进而从细胞周期水平验证了CCK-8法测定的结果。
2.6 EYPH对MC3T3-E1细胞中ALP活力的影响
ALP是成骨细胞分化和细胞外基质成熟的标志[26-27],在测定成骨细胞活性中是一个重要的指标,ALP活力的增加表示成骨细胞分化阶段的促进。由图5可知,EYPH质量浓度为1 mg/m L时,ALP活力高于对照组,ALP活力增加了9.1%,显著高于对照组与2 mg/m L质量浓度组(P<0.05),质量浓度为2 mg/m L时ALP活力与对照组无显著差异(P>0.05)。说明EYPH可以提高MC3T3-E1细胞ALP活力。

图5 EYPH对MC3T3-E1细胞中ALP的影响Fig. 5 Effect of EYPH on ALP activity of MC3T3-E1 cells
2.7 EYPH对MC3T3-E1细胞OC含量的影响
OC是成骨细胞特异性合成并分泌的一种蛋白,是成骨细胞分化成熟的标志物[28]。OC分泌量的增加也表明成骨细胞分化得到促进。由图6可知,在1 mg/m L处理下,OC分泌量要高于对照组与2 mg/m L组,但提高量不显著(P>0.05)。这可能是因为在培养时间7 d时,细胞中OC的mRNA刚开始合成且还没有转录成OC蛋白,则OC含量可能是成骨细胞分化后期的标志物。

图6 EYPH对MC3T3-E1细胞OC含量的影响Fig. 6 Effect of EYPH on osteocalcin secretion in MC3T3-E1 cells
2.8 EYPH对成骨细胞中特异性转录因子RUNX2的基因表达的影响
RUNX 2是成骨细胞中特异性转录因子,在成骨细胞分化中起着关键性的调控作用,能刺激分化过程中蛋白的基因转录[29-30]。RUNX 2的基因表达水平是成骨细胞增殖、分化阶段的重要指标。如图7所示,EYPH刺激MC3T3-E1细胞中RUNX 2的基因表达量并显著上升,在1 mg/m L的EYPH刺激下RUNX2基因表达水平相对于对照组提高了6.12 倍(P<0.01),质量浓度为2 mg/m L时提升了2.96倍。结果表明EYPH显著刺激成骨细胞中RUNX2的表达,且低剂量刺激后效果更好。
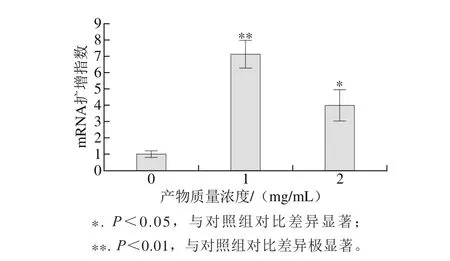
图7 EYPH处理后MC3T3-E1细胞中RUNX2的表达扩增指数Fig. 7 Effect of EYPH on the expressions level of RUNX2 in MC3T3-E1 cells
2.9 EYPH对MC3T3-E1细胞形成矿化结节的影响
矿化结节是成骨细胞经历细胞分化阶段,胞外基质成熟,通过与钙离子的结合,形成的钙离子螯合物。茜素红染色液可以与其特异性结合,形成红色的复合物,从而可以直观的表征矿化结节的形成量。如图8可知,在1 mg/m L的EYPH处理下,矿化结节形成的最多,其染色程度最深,应该是结合的特异性产物比较多。结果表明EYPH可以有效刺激MC3T3-E1细胞的矿化,具有促进骨形成的作用。

图8 EYPH对MC3T3-E1细胞矿化的影响Fig. 8 Effect of EYPH on m ineralization in MC3T3-E1 cells
3 结 论
本实验将鸡蛋黄经有机溶剂脱脂后得到蛋黄蛋白质,采用2 种蛋白酶进行单因素及正交试验优化,并直接以水解产物对MC3T3-E1影响为指标,得到了制备EYPH的最优水解条件为单一胰蛋白酶水解、水解时间6 h、pH 8、水解温度37℃、酶与底物质量比1∶50。在此条件下制备得到的EYPH可以显著促进MC3T3-E1细胞增殖,增殖率为129.89%,MC3T3-E1中ALP活力提高了9.1%,该细胞中OC的分泌量增加了2 mg/m L,刺激MC3T3-E1中RUNX2的基因表达量极显著的提高了6.12倍,促进成骨细胞矿化结节的产生。综上所述,EYPH具有显著促进MC3T3-E1细胞增殖、分化和矿化的作用,具有潜在的促进骨形成的作用,为开发预防骨质疏松的功能产品提供理论依据。
[1] RACHNER T D, KHOSLA S, HOFBAUER L C. Osteoporosis: now and the future[J]. Lancet, 2011, 377: 1276. DOI:10.1016/S0140-6736(10)62349-5.
[2] MONTAGNANI A, GONNELLI S. Antidiabetic therapy effects on bone metabolism and fracture risk[J]. Diabetes Obesity & Metabolism,2013, 15(9): 784-791. DOI:10.1111/dom.12077.
[3] WU Q, LI R S, ZHAO Y, et al. Vaccination w ith DKK1-derived peptides promotes bone formation and bone mass in an aged mouse osteoporosis model[J]. Calcified Tissue International, 2014, 95(2): 153-165.DOI:10.1007/s00223-014-9875-2.
[4] GE C, CAWTHORN W P, LI Y, et al. Reciprocal control of osteogenic and adipogenic differentiation by ERK/MAP kinase phosphorylation of RUNX2 and PPARγ transcription factors[J]. Journal of Cellular Physiology, 2016, 231(3): 587-596. DOI:10.1002/jcp.25102.
[5] 童安莉, 陈璐璐, 丁桂芝. 成骨细胞骨形成机制研究进展[J]. 中国骨质疏松杂志, 1999, 5(3): 60-64. DOI:10.3969/j.issn.1006-7108.1999.03.020.
[6] ORRISS I R, ARNETT T R, GEORGE J, et al. A llopurinol and oxypurinol promote osteoblast differentiation and increase bone formation[J]. Experimental Cell Research, 2016, 342(2): 166-174.DOI:10.1016/j.yexcr.2016.03.004.
[7] BERNABEI R, MARTONE A M, ORTOLANI E, et al. Screening,diagnosis and treatment of osteoporosis: a brief review[J]. Clinical Cases in M ineral & Bone M etabolism, 2014, 11(3): 201-207.DOI:10.11138/ccmbm/2014.11.3.201
[8] QIN L, FAN Y S, GAO Z Q, et al. Effect of Fructus Ligustri Lucidi, on osteoblastic like cell-line MC3T3-E1[J]. Journal of Ethnopharmacology,2015, 170: 88-95. DOI:10.1016/j.jep.2015.05.013.
[9] K IM IRA Y, OGURA K, TANIUCHI Y, et al. Collagen-derived dipeptide proly l-hydroxyproline promotes differentiation of MC3T3-E1 osteoblastic cells[J]. Biochem ical & Biophysical Research Communications, 2014, 453(3): 498-501. DOI:10.1016/j.bbrc.2014.09.121.
[10] 唐琪, 王维倩, 王仁飞, 等. 柚皮苷对小鼠成骨细胞MC3T3-E1增殖功能的影响[J]. 浙江中医药大学学报, 2010, 34(2): 171-172.DOI:10.3969/j.issn.1005-5509.2010.02.018.
[11] 夏光华, 贺敏, 詹麒平, 等. 鲫鱼卵唾液酸糖蛋白化学结构分析及对前成骨细胞MC3T3-E1增殖分化的影响[J]. 食品科学, 2014, 35(13):203-207. DOI:10.7506/spkx1002-6630-201413039.
[12] M IYAKE M, ARA I N, USH IO S, et al. Prom oting effect o f kaempferol on the differentiation and mineralization of murine preosteoblastic cell line MC3T3-E1[J]. Bioscience, Biotechnology, and Biochem istry, 2003, 67(6): 1199-205. DOI:10.1271/bbb.67.1199.
[13] BP C P T, M INE Y, JUNEJA L R, et al. Comparative composition and antioxidant activity of peptide fractions obtained by ultrafi ltration of egg yolk protein enzymatic hydrolysates[J]. Membranes, 2011, 1(3):149-161. DOI:10.3390/membranes1030149.
[14] 廖丹葵. 鸡蛋蛋黄蛋白质制备降血压肽的研究[D]. 南宁: 广西大学,2006: 132-133.
[15] ZAMBROWICZ A, POKORA M, SETNER B, et al. Multifunctional peptides derived from an egg yolk protein hydrolysate: isolation and characterization[J]. Am ino Acids, 2015, 47(2): 369-380. DOI:10.1007/s00726-014-1869-x.
[16] JI M, LEEM K H, KIM M, et al. Egg yolk soluble protein stimulates the proliferation and differentiation of osteoblastic MC3T3-E1 cells[J].Bioscience, Biotechnology, and Biochem istry, 2007, 71(5): 1327-1329. DOI:10.1271/bbb.60217.
[17] KIM H K, LEE S, LEEM K H. Protective effect of egg yolk peptide on bone metabolism[J]. M enopause-the Journal o f the North American Menopause Society, 2011, 18(3): 307-313. DOI:10.1097/gme.0b013e3181f31b1f.
[18] ZAMBROW ICZ A, POKORA M, ECKERT E, et al. Antioxidant and antim icrobial activity of lecithin free egg yolk protein preparation hydrolysates obtained w ith digestive enzymes[J]. Functional Foods in Health & Disease, 2012, 2(12): 487-500.
[19] 蓝泽林. 蛋黄油脂提取副产物: 蛋黄蛋白质综合利用的研究[D].无锡: 江南大学, 2008: 12-13.
[20] 王志兵, 邱芳萍, 解耸林. 鹿角盘蛋白多肽的制备与活性研究[J]. 中国食品学报, 2008, 8(3): 28-32. DO I:10.3969/j.issn.1009-7848.2008.03.005.
[21] 宋茹, 谢超, 崔晓旭. 酶解法制备鱿鱼蛋白抗氧化肽工艺优化[J].浙江海洋学院学报(自然科学版), 2009, 28(3): 311-314.
[22] LI J, HAO L, WU J, et al. Linarin promotes osteogenic differentiation by activating the BMP-2/RUNX 2 pathw ay via protein kinase A signaling[J]. International Journal of Molecular Medicine, 2016, 37(4):901-910. DOI:10.3892/ijmm.2016.2490.
[23] LIU J L, ZHANG B, SONG S J, et al. Bovine collagen peptides compounds promote the proliferation and differentiation of MC3T3-E1 pre-osteoblasts[J]. PLoS ONE, 2014, 9(6): 99920. DOI:10.1371/journal.pone.0099920.
[24] CUTARELLI A, MARINI M, TANCREDI V, et al. Adenosine triphosphate stimulates differentiation and m ineralization in human osteoblast-like Saos-2 cells[J]. Development Grow th & Regeneration,2016, 58(4): 400-408. DOI:10.1111/dgd.12288.
[25] 李晓明. 肾脏发生发育中的细胞增殖与凋亡[J]. 辽宁医学院学报,2004, 25(3): 57-59. DOI:10.3969/j.issn.1674-0424.2004.03.019.
[26] SONG L, ZHAO J, ZHANG X, et al. Icariin induces osteoblast proliferation, differentiation and m ineralization through estrogen receptor-mediated ERK and JNK signal activation[J]. European Journal of Pharmacology, 2013, 714(1/2/3): 15-22. DOI:10.1016/j.ejphar.2013.05.039.
[27] KONO R, OKUNO Y, INADA K, et al. A Prunus mume extract stimu lated the proliferation and differentiation o f osteoblastic MC3T3-E1 cells[J]. Bioscience, Biotechnology & Biochemistry, 2011,75(10): 1907-1911. DOI:10.1271/bbb.110264.
[28] BARTELL S M, RAYALAM S, AMBATI S, et al. Central (ICV) leptin injection increases bone formation, bone mineral density, muscle mass,serum IGF-1, and the expression of osteogenic genes in leptin-deficient ob/ob m ice[J]. Journal of Bone & M ineral Research, 2011, 26(8):1710-1720. DOI:10.1002/jbm r.406.
[29] KOMORI T. Regulation of bone development and extracellular matrix protein genes by RUNX2[J]. Cell and Tissue Research, 2010, 339:189-195. DOI:10.1007/s00441-009-0832-8.
[30] LO Y C, CHANG Y H, WEI B L, et al. Betulinic acid stimulates the differentiation and m ineralization of osteoblastic MC3T3-E1 cells: involvement of BMP/RUNX 2 and beta-catenin signals[J].Journal of Agricultural & Food Chem istry, 2010, 58(11): 6643-6649.DOI:10.1021/jf904158k.
Preparation of Egg Yolk Protein Hydrolysate and Its Effect on Proliferation and Differentiation of MC3T3-E1 Cells
CHEN Hongjie, JIN Yongguo, MA Meihu*
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
In this study, the hydrolysis conditions for preparing egg yolk protein hydrolysate (EYPH) from defatted egg yolk were optim ized based on the viability of MC3T3-E1 cells when cultured in the presence of EYPH. Additionally, we also evaluated the promoting effect of EYPH on proliferation and differentiation of MC3T3-E1 cells. The results showed that the hydrolysis w ith trypsin alone yielded a product w ith stronger cell proliferation promoting activity than when it was used in combination w ith flavourzyme. The optimum hydrolysis conditions for trypsin were as follows: hydrolysis time, 6 h;temperature, 37 ℃; enzyme-to-substrate ratio, 1:50; and pH, 8.0. EYPH prepared under the optimized conditions increased the viability of MC3T3-E1 cells by 9.1% and the proportion of S-phase cells by 4.69% indicating that EYPH significantly increased the proliferation of MC3T3-E1 cells. EYPH significantly affected differentiation and mineralization of MC3T3-E1 cells as indicated by a 9.1% increase in alkaline phosphatase activity, an increase in osteocalcin secretion of 2 mg/m L, and the formation of more mineralized nodules of MC3T3-E1. Furthermore, EYPH also could stimulate the expression level of RUNX2 gene by 6.12 times. These finding showed that EYPH could significantly promote proliferation and differentiation in osteoblastic MC3T3-E1 cells. Therefore, EYPH has the potential to be used as a functional food ingredient for its antiosteoporosis activity.
egg yolk protein hydrolysate; hydrolysis conditions; MC3T3-E1 cells; proliferation; differentiation
10.7506/spkx1002-6630-201722015
TS253.9
A
1002-6630(2017)22-0095-07
陈宏杰, 金永国, 马美湖. 鸡蛋黄蛋白质水解产物制备及其对MC3T3-E1细胞增殖分化的影响[J]. 食品科学, 2017,38(22): 95-101. DOI:10.7506/spkx1002-6630-201722015. http://www.spkx.net.cn
CHEN Hongjie, JIN Yongguo, MA Meihu. Preparation of egg yolk protein hydrolysate and its effect on proliferation and differentiation of MC3T3-E1 cells[J]. Food Science, 2017, 38(22): 95-101. (in Chinese w ith English abstract)
10.7506/spkx1002-6630-201722015. http://www.spkx.net.cn
2016-10-10
公益性行业(农业)科研专项(201303084)
陈宏杰(1990—),男,硕士研究生,研究方向为蛋品科学。E-mail:598734780@qq.com
*通信作者:马美湖(1957—),男,教授,博士,研究方向为畜产品科学与技术。E-mail:mameihuhn@163.com
