不同管径钛纳米管对成纤维细胞增殖、伸展和胶原分泌功能的影响
2017-11-13李红彩马壮
李红彩 马壮
不同管径钛纳米管对成纤维细胞增殖、伸展和胶原分泌功能的影响
李红彩 马壮
目的研究不同管径Ti-TiO2纳米管对成纤维细胞增殖、伸展和胶原分泌功能的影响。方法以1、5、10、20 V电压阳极氧化制备不同管径Ti-TiO2纳米管试件,试件表面培养成纤维细胞,MTT法检测细胞增殖,扫描电镜观察形态,天狼星红苦味酸染色检测细胞胶原分泌功能。结果1、5、10、20 V制备的纳米管径依次为15、30、50和100 nm。细胞在抛光表面的增殖均高于纳米管表面;第5天时,100 nm纳米管表面细胞的增殖显著高于其他(P<0.01)。第3天时,抛光表面细胞呈典型长梭型,纳米管表面细胞伪足明显。100 nm纳米管表面细胞的试件胶原分泌功能最大(P<0.05)。结论100 nm纳米管对细胞增殖的抑制作用较小并能促进细胞的胶原纤维分泌功能。
纳米管; 成纤维细胞; 细胞增殖; 细胞伸展; 胶原纤维
种植体与牙龈软组织的结合直接影响到种植体的临床成败,而成纤维细胞是牙龈组织中的重要组织细胞类型,其在种植体表面良好的生长和功能分化直接影响种植体-软组织界面的形成。众所周知,相对于微米级粗糙表面,成纤维细胞更倾向于光滑的表面,而成骨细胞则更喜欢粗糙一点儿的表面[1]。因而临床常用种植体的颈部也通常采用与根部粗化处理不同的光滑表面设计。
阳极氧化技术可在纯钛及钛合金等表面生成垂直排布、均匀一致的TiO2纳米管阵列[2];与抛光纯钛相比,该纳米级管状阵列结构拥有更大的比表面积和生物活性,可影响细胞在其表面的黏附、增殖、分化、基因表达以及信号转导等功能[3-5]。机械抛光纯钛表面常有微米级抛光划痕,但由于阳极氧化过程中的化学腐蚀作用,阳极氧化纳米管表面粗糙度显著降低;随着阳极氧化电压的增大,纳米管管径的增大,其表面粗糙度变化不明显[3,6]。本研究用阳极氧化方法控制电压在1~20 V之间、室温下氧化1 h,形成直径在15~100 nm范围的不同尺寸的TiO2纳米管结构,观察成纤维细胞在各种不同管径TiO2纳米管表面的伸展、增殖和胶原纤维分泌功能,评价不同管径纳米管对成纤维细胞的影响,为种植体颈部的设计提供理论依据。
1 材料与方法
1.1 主要材料、试剂和仪器
医用纯钛板材(TA2,西北有色金属研究院);小鼠成纤维细胞L929(第四军医大学组织工程研发中心提供);PBS;DMEM、胎牛血清(Gibco BRL,美国);胰蛋白酶(Sigma,美国); Hoechst33342荧光染料(碧云天生物技术研究所);二甲基亚砜(DMSO)、MTT试剂(北京索来宝科技有限公司)、1%天狼星红/苦味酸液(第四军医大学基础部病理教研室提供);酶联免疫仪(BIO-TEK,美国);S-4800场发射扫描电子显微镜(JSM-6700F,日本);体视显微镜(Leica,德国);医用离心机(北京京立离心机有限公司)。
1.2 Ti-TiO2纳米管的制备
10 mm×10 mm×1 mm纯钛试件经碳化硅砂纸打磨至1 500 目,丙酮、95%乙醇及双蒸水超声清洗,自然干燥后备用。以钛试件为阳极、铂片为阴极,在1 mol/L磷酸和质量百分比为0.3%的氢氟酸电解液中,控制电压分别为1、5、10和20 V,常温反应1 h,制备1、5、10和20 V纳米管钛试件,分别用NT1、NT5、NT10和NT20表示;以未行电解处理的抛光纯钛为对照组,用PT表示。
1.3 试件表面形貌分析
每组试件中任取1 个试件,超声清洗后,真空干燥,场发射扫描电子显微镜分析试件表面形貌。
1.4 细胞培养
L-929成纤维细胞培养于10%胎牛血清、1%抗生素(青霉素和链霉素)的DMEM培养基中,置于37 ℃、5%的CO2细胞培养箱中,隔天换液1 次,细胞层生长至70%~80%时传代。
1.5 细胞增殖
试件经60Co辐照消毒后置入24 孔培养板内(每组23 个试件,每孔1 个试件),将L-929以2×104个/L、1 ml/孔接种于24 孔板,置于37 ℃、5%的CO2细胞培养箱中培养。细胞培养1、3和5 d后,每组各取5 孔终止细胞培养,PBS清洗3 次,每孔加入MTT(5 mg/ml)200 μl和无血清无酚红DMEM 800 μl,37 ℃孵育4 h后吸弃上清,加入DMSO 1 ml/孔溶解生成的结晶物,每孔分别取3 份200 μl溶解液转移至96 孔培养板,空白孔调零,测490 nm处测其吸光度A值。
1.6 扫描电镜观察细胞形态
试件放置和细胞接种同细胞增殖。细胞培养3 d后,每组任选2 个试件,PBS清洗3 遍, 2.5%戊二醛4 ℃ 24 h,之后梯度乙醇(50%、70%、80%、90%和100%)脱水,临界点干燥法干燥后喷金,扫描电镜观察细胞形态。
1.7 胶原分泌功能
试样放置和细胞接种同细胞增殖。细胞培养3 d后,每组6 个试件, PBS漂洗3 次,4%多聚甲醛固定过夜,PBS漂洗3 次,室温下1%天狼星红/苦味酸液染色2 h,0.1 mol/L醋酸轻轻漂洗,室内自然干燥后备用。每组任选1 个试件体式显微镜下拍照。量化分析,每孔1 个试样,加入500 μl/孔去染液(0.2 mol/L NaOH溶液和99%甲醇按体积比1∶1混合配制),室温静置30 min,每孔取3 份150 μl染液分别转移到96 孔培养板,空白孔加入150 μl去染液,空白孔调零,540 nm处测量其A值。结果用3 d时细胞增殖的吸光度A值进行标准化。
1.8 统计学分析
采用SPSS 17.0统计软件进行数据处理,用单因素方差分析和Student-Newman-Keuls(SNK)检验比较组间差别,检验水准为0.05。
2 结 果
2.1 各组试件表面形貌的扫描电镜观察
不同阳极氧化电压可制备出不同管径的纳米管(图 1)。1、5、10和20 V阳极氧化电压所形成的纳米管管径依次为约15、30、50和100 nm。1 V电压可形成网格状的纳米孔结构,管孔之间无明显界限。5 V电压可形成典型的管状纳米管结构,有独立的管壁;随着电压增大,纳米管管径也相应增大。对照组抛光试件在较低放大倍数时可见抛光划痕。
2.2 各组试件表面成纤维细胞的增殖
抛光表面成纤维细胞的增殖均高于所有阳极氧化组试样表面,其中这种差异在第1天和第5天具有统计学意义(P<0.01);第3天和5天时,5 V纳米管表面成纤维细胞的增殖均显著小于同时间点其余各组(P<0.01);第5天时,20 V纳米管表面成纤维细胞的增殖显著高于其余纳米管组(P<0.01)(图 2)。
2.3 各组试件表面3 d时成纤维细胞形态
抛光表面的细胞多数呈现出典型的长梭型形态,沿抛光划痕伸展;各纳米管表面细胞伸展宽度增加,充满大量细胞质,板状伪足明显,其中1 V和5 V纳米管表面的细胞呈现大量的板状伪足和丝状伪足(图 3)。
2.4 各组试样表面3 d时纤维细胞的胶原分泌
成纤维细胞3 d时的胶原分泌A540 nm值用细胞3 d时增殖结果A490 nm标准化(图 4),结果如图 5所示。成纤维细胞在各组试样表面培养3 d后的相对胶原分泌功能组间差异显著(P<0. 05),除1 V纳米管组外,其余纳米管组表面成纤维细胞的相对胶原分泌功能均显著高于抛光表面(P<0.05),且随着阳极氧化电压增大,细胞相对胶原分泌功能也越大,20 V纳米管表面成纤维细胞的相对胶原分泌功能最大,且与其余各组相比差异有统计学意义(P<0.05)。

图 1 各组试件表面形貌(SEM, ×100 000)
Fig 1 Surface morphology of the samples(SEM, ×100 000)
3 讨 论
理想情况下,种植体-软组织界面应形成紧密的“袖口”,阻挡细菌及其他致炎因子侵入,成为功能性的生物封闭屏障,保持种植体在体内的长期稳定作用。影响种植体-软组织界面的因素很多,如种植体表面特征、种植体形状、手术操作及患者自身因素等。种植体表面的纳米管形貌可提高种植体-骨组织结合,同时纳米管的管状形貌可作为生长因子和抗炎药物等的载体,这为种植体周围炎的防治提供了新思路,成为近年来的研究热点。
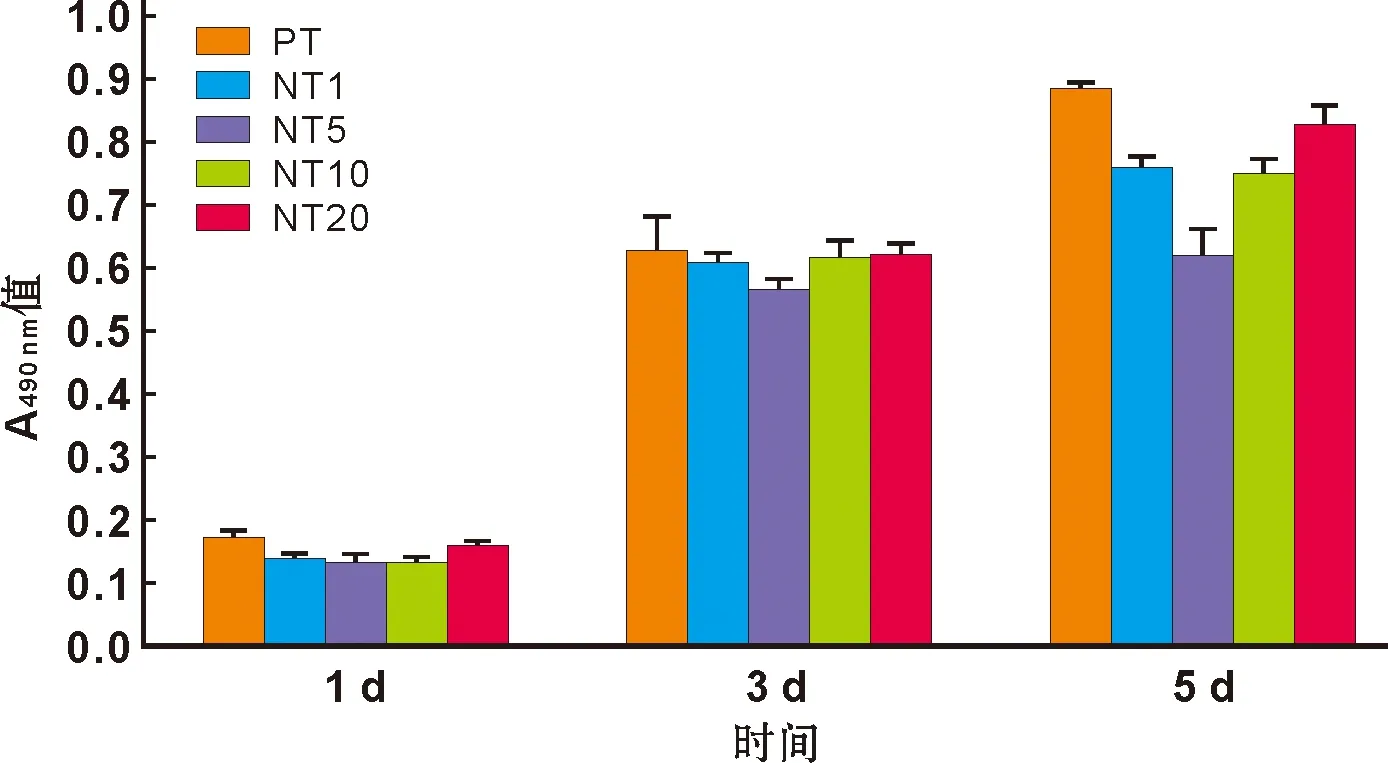
图 2 成纤维细胞在各组试样表面增殖(MTT实验)
Fig 2 Proliferation of fibroblasts(MTT assay)
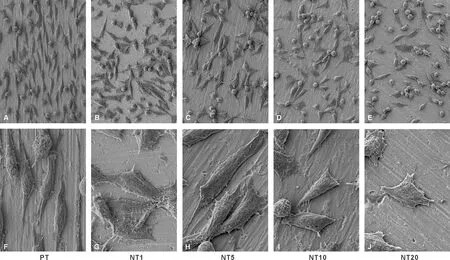
图 3 各组试件表面3 d后的成纤维细胞形态(SEM, A~E: ×500, F~J: ×2 000)
Fig 3 Fibroblasts on the sample surfaces after 3 days of culture(SEM, A~E: ×500, F~J: ×2 000)

图 4 成纤维细胞3 d时分泌的胶原纤维(天狼星红染色)
Fig 4 Collagen production of fibroblasts after 3 days of culture on the sample surfaces(Alizarin red staining)

图 5 成纤维细胞在各组试样表面3 d时胶原分泌功能检测
Fig 5 Relative collagen production of fibroblasts after 3 days of culture on the sample surfaces
研究表明成纤维细胞的在生物材料表面的黏附、伸展、增殖、分化等受材料表面纳米级形貌的影响。研究发现PMMA表面直径为120 nm的纳米坑阵列降低了成纤维细胞的黏附、伸展等和广泛的基因下调[7]。钛合金表面10~180 nm的纳米孔也阻碍了成纤维细胞的增殖。也有报道认为成纤维细胞在细胞排列上对直径30 nm的纳米坑的反应比直径为160 nm时更敏感[8]。有研究表明:管径约120 nm的TiO2纳米管结构可以促进人牙龈成纤维细胞的黏附、增殖等功能,而且在人工唾液中表现出良好的电化学稳定性,可以促进口腔种植体与周围牙龈组织结合[9]。本研究结果提示纳米管表面不同程度的抑制了成纤维细胞的增殖和两极伸展,同时促进了细胞的胶原分泌功能。纳米形貌对细胞的影响受到纳米尺寸、形貌结构的空间方向、结构的排列有序或者无序、结构的混杂或者均一以及结构间距等众多因素的制约,这可能是造成纳米级形貌对成纤维细胞的影响研究结果不一致的重要原因。本研究中成纤维细胞在各纳米管表面增殖明显少于抛光纯钛表面,细胞的两极伸展也不同程度受到抑制,表明纳米管形貌跟其他纳米级结构一样抑制成纤维细胞的生长。不同管径纳米管对成纤维细胞增殖抑制作用也不同,1 V电压下形成的管径约15 nm的纳米管对成纤维细胞增殖的影响较小;5 V电压下形成的约30 nm管径的纳米管对成纤维细胞增殖的抑制作用最大;之后随着阳极氧化电压的增大,纳米管管径增大,纳米管对成纤维细胞增殖的抑制作用也逐渐减弱;在各纳米管组中,20 V电压下阳极氧化形成的约100 nm管径的纳米管对成纤维细胞增殖的抑制作用最小。
材料表面形貌可影响其表面黏附的成纤维细胞的形态[10]。研究显示120 nm管径的TiO2纳米管表面细胞形态伸长且有较多的长短不一的丝状伪足[9],这与我们前期细胞黏附的实验结果一致[11]。材料表面形貌通过影响黏附相关整合素受体的表达,改变其聚集、组装,进而决定细胞的形态和伸展方面的多样性[12]。本研究观察了成纤维细胞在各组试样表面培养3 d后呈现的细胞形态。与抛光纯钛相比,纳米管形貌抑制了细胞的两极伸展,同时呈现较多的板状伪足和丝状伪足,而这种细胞形态改变同时受纳米管管径大小的影响。
试样表面形貌显著影响成纤维细胞功能分化和相关基因的表达。本研究发现,5、10、20 V纳米管表面成纤维细胞的胶原分泌功能显著增强,且随着阳极氧化电压的增大,纳米管管径增大,成纤维细胞的胶原分泌功能也越强。有研究表明100 nm的TiO2纳米管与自然状态下的TiO2相比,周围形成的纤维囊层较薄,软组织的炎症反应更小,提示在种植体软组织接触部位的应用价值[13]。而张程程等[14]的研究结果提示管径为130 nm的纳米管比较小管径的种植体表面形貌有利于软组织的早期修复和改建。本实验结果显示,与抛光纯钛表面相比,纳米管表面成纤维细胞的增殖较差且受纳米管管径的影响,但细胞的胶原分泌明显增强,提示纳米管表面可能会形成薄而韧的软组织,有利于软组织的早期修复。材料表面形貌对细胞功能的影响除了通过形貌直接给细胞传递的空间信号来调控细胞的基因表达及相关功能分化外,还通过对细胞形态的改变来传递信号调节细胞的相关功能。最近的研究也证实钛纳米管形貌对细胞生物学行为的影响有多种信号通路参与调节[5]。
由于细胞增殖和分化之间不可逃避的生物学负性关系,因而最重要的问题是在细胞增殖和分化之间的寻找合适的平衡点,并同时促进细胞的增殖和分化。本研究的结果提示在不同管径的纳米管中,20 V阳极氧化纳米管表面成纤维细胞的增殖和胶原分泌功能最大,因而20V阳极氧化纳米管最适合成纤维细胞的生长,然而最适宜种植体颈部软组织愈合的纳米管管径仍需进一步的体内试验研究。
4 结 论
与抛光表面相比,纳米管表面成纤维细胞的增殖受到抑制;各纳米管组中,5 V纳米管对成纤维细胞增殖的抑制作用最大,20 V纳米管对成纤维细胞增殖的抑制作用最小。成纤维细胞在抛光和阳极氧化纳米管表面形态差异明显;抛光试样表面成纤维细胞呈典型的长梭型,而纳米管表面细胞的两极伸展受到抑制。纳米管表面成纤维细胞的相对胶原分泌功能增强,20 V纳米管表面成纤维细胞的相对胶原分泌功能最大。
[1] Brunette DM. Titanium in Medicine: Material Science, Surface Science, Biological Responses and Medical Applications[M]. Heidelberg: Springer, 2001: 485-512.
[2] 梁砚琴, 杨贤金, 崔振铎, 等.钛和钛合金表面TiO2纳米管研究进展[J]. 科技导报, 2009, 27(14): 94-101.
[3] Brammer KS, Oh S, Cobb CJ, et al. Improved bone-forming functionality on diameter-controlled TiO2nanotube surface[J]. Acta Biomater, 2009, 5(8): 3215-3223.
[4] 梅盛林, 张玉梅, 赵领洲, 等. 近β钛合金TLM表面阳极氧化对成骨细胞早期附着的影响[J].实用口腔医学杂志, 2010, 26(5): 597-601.
[5] Wang W, Zhao L, Ma Q, et al. The role of the Wnt/β-catenin pathway in the effect of implant topography on MG63 differentiation[J]. Biomaterials, 2012, 33(32): 7993-8002.
[6] Ma Q, Mei S, Ji K, et al. Immobilization of Ag nanoparticles/FGF-2 on a modified titanium implant surface and improved human gingival fibroblasts behavior[J]. J Biomed Mater Res A, 2011, 98(2): 274-286.
[7] Dalby MJ, Gadegaard N, Wilkinson CD. The response of fibroblasts to hexagonal nanotopography fabricated by electron beam lithography[J]. J Biomed Mater Res A, 2008, 84(4): 973-979.
[8] Seunarine K, Curtis A, Meredith D, et al. A hierarchical response of cells to perpendicular micro-and nanometric textural cues[J]. IEEE Trans Nanobioscience, 2009, 8(3): 219-225.
[9] Demetrescu I, Pirvu C, Mitran V. Effect of nano-topographical features of Ti/TiO2electrode surface on cell response and electrochemical stability in artificial saliva[J]. Bioelectrochemistry, 2010, 79(1): 122-129.
[10]Eisenbarth E, Meyle J, Nachtigall W. Influence of the surface structure of titanium materials on the adhesion of fibroblasts[J]. Biomaterials, 1996, 17(14): 1399-1403.
[11]李红彩, 张玉梅, 孙海平. 不同管径Ti-TiO2纳米管对成纤维细胞和成骨细胞黏附的影响[J].中华口腔医学杂志, 2012, 47(2): 122-126.
[12]He J, Zhou W, Zhou X, et al. The anatase phase of nanotopography titania plays an important role on osteoblast cell morphology and proliferation[J]. J Mater Sci Mater Med, 2008, 19(11): 3465-3472.
[13]Kim D, Choi B, Song J, et al. TiO2nanotube stimulate chondrogenic differentiation of limb mesenchymal cells by modulating focal activity[J]. Exp Mol Med, 2011, 43(8): 455-461.
[14]张程程, 巴亚玛, 张玉梅. 钛种植体表面不同管径TiO2纳米管涂层与软组织结合的体内研究[J]. 牙体牙髓牙周病学杂志, 2014, 24(2): 95-100.
Theeffectsofdiameter-controlledtitaniumnanotubesontheproliferation,strechingandcollagensecretionoffibroblasts
LIHongcai,MAZhuang.
412000,ZhuzhouCentralHospital,DepartmentofStomatology,China
Objective: To study the effects of Ti-TiO2nanotubes with different diameters on the proliferation, stretching and collagen secretion of fibroblasts.MethodsTiO2nanotubes formed at 1,5,10 and 20 V potentials served as the experimental samples and polished pure titanium served as the control. Fibroblasts was cultivated on the surface of the various samples. MTT assay was used to examine the cell proliferation. The surface morphology of the cells was observed with SEM. Collagen secrection was tested by sirius red/bitter acid staining.ResultsThe nanotubes prepared by 1,5,10 and 20 V were with the diameter of 15,30,50 and 100 nm respectively. At day 1,3 and 5,the cell proliferation on polished pure titanium surface was more than that on the nanotubes surfaces at the same time;at day 5,cell proliferation on 100 nm nanotubes was significantly more than that on the other nanotube surfaces(P<0.01). At day 3, fibroblasts at polished pure titanium surface stretched as typical long spindle form, while with obvious pseudopodium at nanotube surfaces. The collagen secretion of fibroblasts was highest at 100 nm nanotubes(P<0.01).Conclusion100 nm nanotubes may have minimal negative effect on fibroblast proliferation and the greatest positive effect on the collagen secretion.
Nanotubes;Fibroblasts;Cellproliferation;Cellspreading;Collagenfiber
湖南省2013年度医药卫生科研计划课题(编号: C2013-051)
412000, 株洲市中心医院口腔科
李红彩 E-mail: 495401889@qq.com
R783.1
A
10.3969/j.issn.1001-3733.2017.05.009
(收稿: 2017-03-30 修回: 2017-05-22)
