胰岛素和小檗碱对Ⅱ型糖尿病大鼠钛种植体骨整合的影响
2017-11-13朱文忠张春宝越野宋鑫磊
朱文忠 张春宝 越野 宋鑫磊
胰岛素和小檗碱对Ⅱ型糖尿病大鼠钛种植体骨整合的影响
朱文忠 张春宝 越野 宋鑫磊
目的研究胰岛素和小檗碱对Ⅱ型糖尿病大鼠种植体骨整合的影响。方法53 只SD大鼠,随机抽取10 只,分入H组(健康组)。剩余大鼠利用高糖饮食+小剂量链脲佐菌素(STZ)诱导,获得Ⅱ型糖尿病模型大鼠共40 只,随机等分为B组(小檗碱组)、I组(胰岛素组)、IB组(胰岛素+小檗碱组)和N组(未治疗组)。将100 枚纯钛种植体植入大鼠双侧股骨干骺端。第7、32、38、66和101天测量大鼠的体重(BW)和空腹血糖值(GLU)。术后10 周,取大鼠股骨行Micro-CT扫描、VG染色及种植体拔出实验。观察硬组织切片;测量骨体积分数(BV/TV)、骨小梁厚度(Tb.Th)、骨小梁数目(Tb.N)、骨小梁间隙(Tb.Sp)、骨小梁容积率(TBV)、骨接触率(BIC)及最大拔出力(MPF)。结果BW和GLU:IB组和H组间无显著的统计学差异(P>0.05);但IB组显著优于I组和B组;I组和B组优于N组(P<0.05)。骨质(BV/TV、Tb.Th、Tb.N、Tb.Sp)和骨整合(TBV、BIC、MPF):IB组和H组间无显著的统计学差异(P>0.05);但IB组优于I组和B组;I组和B组优于N组(P<0.05)。结论胰岛素和小檗碱联用可有效降低Ⅱ型糖尿病大鼠血糖,并促进种植体的骨整合。
糖尿病; 胰岛素; 小檗碱; 骨整合; 种植体
糖尿病是以高血糖为主要特征的慢性代谢性疾病,累及全身脏器,伴发多种并发症[1]。其中,Ⅱ型糖尿病最为常见,常并发牙周炎症,造成牙列缺损或缺失[2],亟需种植修复。大量实践表明,糖尿病患者相较于非糖尿病患者,种植体骨整合更差,种植体成功率也更低[3]。随着种植技术的发展和胰岛素的广泛使用,种植体的骨整合得到了改善,但糖尿病仍是种植修复最为重要的危险因素之一。如何进一步提高其骨整合能力和种植成功率,成为临床医生亟需解决的问题。
小檗碱是从毛茛科植物黄连根茎中提取的异喹啉生物碱,主要用于治疗细菌性腹泻。研究表明,小檗碱还具有缓解胰岛素抵抗、降血糖以及预防骨质疏松的作用[4]。因此,本实验拟通过构建Ⅱ型糖尿病大鼠模型,研究胰岛素和小檗碱对于种植体骨整合的影响。
1 材料与方法
1.1 Ⅱ型糖尿病SD大鼠模型的建立
第四军医大学实验动物中心提供健康SD大鼠53 只,6 月龄,体重约为200~225 g。常规饲料驯养1 周后,随机抽取10 只编入H组(健康组)。剩余大鼠,采用高糖饲料(瑞林,郑州)连续喂养3 周。使用2%STZ(30 mg/kg,Sigma公司,美国)一次性腹腔注射。3 d后,血糖仪(家康,BGM506,日本)测定空腹血糖(GLU)。将GLU≥16.7 mmol/L定义为Ⅱ型糖尿病模型大鼠。本实验共成功获得模型大鼠40 只,3 只失败(死亡1 只,血糖不合格2 只)。同时,H组腹腔注射相同剂量的柠檬酸-柠檬酸钠缓冲液(pH=4.4)。
1.2 动物分组、种植体植入及药物治疗
随机数字表法将模型大鼠等分为4 组:N组(糖尿病+未治疗)、I组(糖尿病+胰岛素)、B组(糖尿病+小檗碱)和IB组(糖尿病+胰岛素+小檗碱)。
2%戊巴比妥钠(2.5 ml/kg)腹腔注射麻醉,备皮消毒。在大鼠双侧下肢股骨头处向股骨方向做长约1 cm切口,钝性分离肌肉、骨膜。按照标准种植程序将自制纯钛种植体(1.75 mm×5 mm,图 1)垂直于骨面植入股骨干骺端(图 1)。术后连续注射庆大霉素(6 mg/kg,2 次/d)3 d。

图 1 纯钛种植体及种植体植入
根据文献报道,I组和IB组给以1-2 U NPH胰岛素[5](中效优泌林 礼来,法国);B组和IB组给以300 mg/kg,1次/d的黄连素[6](中国药品生物制品检定所)灌胃;H组和N组则给以等剂量生理盐水灌胃。连续给药10 周,处死所有大鼠,取样检测。
1.3 检测BW和GLU
分别于(驯养后)第7天、(造模+种植手术后1 d)第32天、(术后1 周)第38天、(术后5 周)第66天和(术后10 周)第101天测量所有大鼠体重(BW);通过尾静脉采血,测定GLU。
1.4 Micro-CT扫描分析
仔细想想,这种歇斯底里应该还是主导的。那个暑假我翻滚沉思,表情如同被人欠了二十万未索回。以至于最后我妈看不下去我吃饭时都端着碗皱着眉毛的样子了,强行把我丢出去给初中孩子做家教。
取处死大鼠的双侧股骨,剥离清理软组织。左侧股骨标本,截取种植体周围1 cm范围的骨块,甲醛固定2 d。使用Micro-CT(SIEMENS,德国)扫描。利用Inveon Acquisition Workplace 2.2软件,重建距种植体表面和底端分别为0.5 mm和1 mm的区域,测定骨形态学参数BV/TV、Tb.N、Tb.Th和Tb.Sp(图 2)。

图 2 Micro-CT三维重建与分析
1.5 骨标本的VG染色
CT扫描后,骨标本经脱水干燥、塑化包埋,使用硬组织切片机(Leica SP 1600,Leica,德国)切片、打磨、抛光。使用Weigert氏铁苏木素和Van Gieson氏染液染色并脱水,密封固定。在光学显微镜(Olympus BH2日本)下,观察植体骨整合情况及植体周围骨小梁结构。通过数字化图像分析系统(Leica Imaging System,Cambridge, 英国),获得形态学指标TBV和BIC。
1.6 测定MPF
取右侧股骨标本,修整成块,自凝塑料包埋,使用电子万能试验机(Instron 5848,英斯特朗,美国)沿种植体长轴方向以2 mm/min的速度将种植体拔出,测定最大拔出力(MPF)值。
1.7 统计学分析
2 结 果
2.1 体重及血糖水平
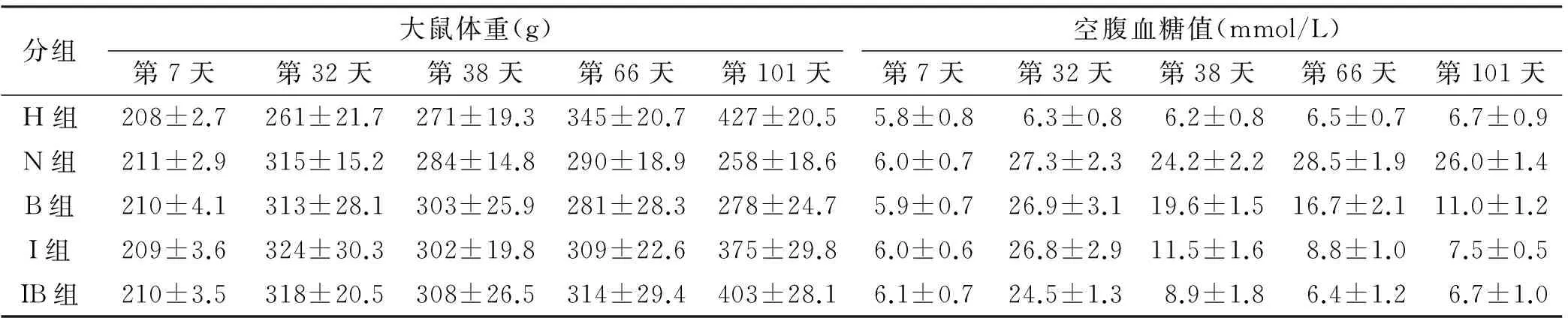
表 1 5 组不同时间点大鼠体重和空腹血糖值
2.2 Micro-CT扫描结果
术后10 周,H组和给药组各组骨形态参数均优于N组(P<0.05);IB组相较于H组,各组参数无显著的统计学差异(P>0.05);在BV/TV、Tb.Th和Tb.N三方面,IB组>I组>B组(P<0.05)。在Tb.Sp方面,则是B组>I组>IB组(P<0.05)(表 2)。
2.3 VG染色结果
术后10 周,H组和IB组植体螺纹间充满骨组织,骨与植体间紧密结合,无纤维组织,骨整合良好。N组植体与骨组织间主要发生纤维结合,骨整合较少。I组和B组介于两者之间,骨组织和植体间发生部分骨整合,仍有部分纤维结缔组织和红细胞充填其中(图 3)。BIC和TBV方面,H组和IB组间无显著的统计学差异(P>0.05);I组>B组>N组,且有显著的统计学差异(P<0.05)(表 3)。
2.4 比较MPF

表 2 种植术后10周各组植体周围骨形态计量学参数

图 3 种植术后10 周各组VG染色切片观察
术后10 周,H组和IB组间MPF无显著的统计学差异(P>0.05);I组>B组>N组,且有显著的统计学差异(P<0.05)(表 3)。
表 3 种植术后10 周各组BIC、TBV和MPF比较
Tab 3 Comparison of BIC, TBV and MPF in the 5 groups 10 weeks after implantation

分组BIC(%)TBV(%)MPF(N)H组63.13±9.2757.31±4.59103.45±15.64N组34.68±10.6531.36±6.4554.39±19.26B组45.71±13.2942.61±5.1773.01±14.32I组50.72±9.8649.72±4.6183.42±18.56IB组64.30±10.1156.84±5.3499.89±16.79
3 讨 论
常用于种植研究的动物模型有大鼠股骨模型、兔股[7]/胫[8]骨模型,以及犬颌骨模型。本实验选取大鼠股骨干垢端作为植入位点。主要原因是:①其骨组织结构与牙槽骨组织类似,有完整丰富的松质骨骨小梁结构,是常用的植入位点;②在糖尿病的作用下,大鼠股骨也能像颌骨一样呈现出类似的骨质疏松的症状。
胰岛素是治疗糖尿病的特效药,但本实验结果显示,胰岛素(I组)并未使得GLU及骨整合恢复至正常水平,提示单纯使用胰岛素并不能完全改善糖尿病的这些症状,这与前人的研究结果一致[9]。这可能与Ⅱ型糖尿病导致的高胰岛素血症及胰岛素抵抗有关,体细胞因缺乏胰岛素相关的信号转导而导致对胰岛素的利用效能降低。另一方面,单纯使用小檗碱虽也可以降低GLU,改善骨质及骨整合状况,但也并不能完全改善这些症状。究其原因,可能是因为小檗碱只能改善胰岛素抵抗,但并不能改变因胰岛B细胞受损而导致的胰岛素分泌量的绝对不足。
IB组(胰岛素+小檗碱)无论是GLU、BW、MPF及骨整合等多项指标均接近H组(P<0.05),且显著高于I组及B组。说明小檗碱和胰岛素的联用,对血糖的控制和骨整合状况的改善有叠加效果。原因可能有以下几点:①胰岛素的使用,可以弥补因胰岛受损引起的胰岛素含量的不足,从而有效控制血糖,降低高血糖毒性;②小檗碱可有效缓解胰岛素抵抗,增强胰岛素的敏感性,从而控制血糖,降低钙磷等矿物质的流失[10];③小檗碱可以通过促进成骨细胞的分化,改善骨整合[11]。
4 结 论
胰岛素和小檗碱两者拥有不同的药理作用,胰岛素补充了糖尿病大鼠体内胰岛素的绝对缺乏,小檗碱则改善了其胰岛素抵抗,两者联用,药效互补,对Ⅱ型糖尿病血糖的控制及骨整合的改善有相互叠加的作用。但小檗碱影响骨整合的分子机制尚未完全明了,还需在今后的实验中进行深入研究。
[1] 陆再英, 钟南山. 内科学.第7版[M]. 北京: 人民卫生出版社, 2008: 770-793.
[2] Bascones-Martínez A, Muoz-Corcuera M, Bascones-Ilundain J. Diabetes and periodontitis: A bidirectional relationship[J]. Med Clin(Barc), 2014, 145(1): 31-35.
[3] 郭观生. 糖尿病对种植体骨结合的影响研究观察[J]. 中国医学工程, 2013, 21(1): 70-71.
[4] 汪群红, 何贤君, 胡敏, 等. 小檗碱对Ⅱ型糖尿病大鼠降血糖作用的药效学研究[J]. 中华中医药学刊, 2016, 34(10): 2531-2533.
[5] Siqueira JT, Cavalhermachado SC, Aranachavez VE, et al. Bone formation around titanium implants in the rat tibia: Role of insulin[J]. Implant Dent, 2003, 12(3): 242-251.
[6] Lu T, Liang Y, Song J, et al. Simultaneous determination of berberine and palmatine in rat plasma by HPLC-ESI-MS after oral administration of traditional Chinese medicinal preparation Huang-Lian-Jie-Du decoction and the pharmacokinetic application of the method[J]. J Pharm Biomed Anal, 2006, 40(5): 1218-1224.
[7] Guillot R, Pignot-Paintrand I, Lavaud J, et al. Assessment of a polyelectrolyte multilayer film coating loaded with BMP-2 on titanium and PEEK implants in the rabbit femoral condyle[J]. Acta Biomater, 2016, 36: 310-322.
[8] Gehrke SA, Marin GW. Biomechanical evaluation of dental implants with three different designs: Removal torque and resonance frequency analysis in rabbits[J]. Ann Anat, 2014, 199: 30-35.
[9] Wang B, Song Y, Wang F, et al. Effects of local infiltration of insulin around titanium implants in diabetic rats[J]. Br J Oral Maxillofac Surg, 2011, 49(3): 225-229.
[10]朱文卓, 宋滇平. 糖尿病性骨质疏松的研究进展[J]. 医学综述, 2007, 13(3): 97-101.
[11]Inzerillo AM, Epstein S. Osteoporosis and diabetes mellitus[J]. Rev Endocr Metab Disord, 2004, 5(3): 261-268.
TheeffectsofinsulinandberberineontheosseointegrationoftitaniumimplantintypeIIdiabeticrats
ZHUWenzhong1,ZHANGChunbao2,YUEYe2,SONGXinlei3.
1. 710005Xi'an,DepartmentofStomatology,theSecondPeople'sHospitalofShaanxiProvince,China; 2.StateKeyLaboratoryofMilitaryStomatology&NationalClinicalResearchCenterforOralDiseases&ShaanxiKeyLaboratoryofStomatology,DentalLaboratory,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,Xi'an; 3.NavyOverseasSnailHospitalDepartmentofStomatology,Zhoushan
Objective: To study the effects of insulin and berberine on osseointegration of titanium implant in type II diabetic rats.Methods10 out of 53 SD rats were randomly selected and selected into H group(healthy group)(n=10). The remaining rats were treated with high glucose diet plus low dose of streptozotocin(STZ) and 40 rats were induced into the models of type II diabeties. The 40 dibetic rats were randomly divided into group B(berberine), group I(insulin), group IB(insulin+berberine) and group N(without treatment). 2 pure titanium implants were implanted into the bilateral femoral metaphysis of each rat. After 7, 32, 38, 66 and 101 d, the body weight(BW) and fasting blood glucose(GLU) were measured. After 10 week, the rats were sacrifice, femoral metaphysis samples were subjected to Micro-CT scan, VG staining and implant pull-out test. Hard tissue slices were observed; bone volume fraction(BV/TV), Liang Houdu(Tb.Th), trabecular bone trabecular number(Tb.N), Liang Jianxi(Tb.Sp), trabecular bone trabecular bone volume(TBV), bone contact ratio(BIC) and the maximum pull-out strength(MPF) were measured.ResultsThere was no significant difference of BW and GLU between IB group and H group(P>0.05), but the BW and GLU of IB group was better than those of I group and B group, I group and B group were better than those of group N(P<0.05).BV/TV, Tb.Th, Tb.N, Tb.Sp, TBV, BIC and MPF of IB group were not statistically different from those of H group(P>0.05); but the indexes of IB group were higher than those of I group and B group, those of I group and B group were higher than those of N group(P<0.05).ConclusionThe combination of insulin and berberine can effectively reduce blood glucose and can promote osseointegration of titanium implants in type II diabetic rats.
Diabetes;Insulin;Berberine;Osseointegration;Implant
710005 西安, 陕西省第二人民医院口腔科(朱文忠); 军事口腔医学国家重点实验室, 口腔疾病国家临床医学研究中心, 陕西省口腔医学重点实验室, 第四军医大学口腔医院修复工艺中心(张春宝 越野); 海军外洋螺医院口腔科(宋鑫磊)
张春宝 029-84776455
R783.3
A
10.3969/j.issn.1001-3733.2017.05.007
(收稿: 2017-02-27 修回: 2017-05-23)
