CAR-T细胞治疗用于实体瘤的研究进展
2017-11-13葛玉凤韩东晖吴介恒秦卫军杨安钢温伟红
葛玉凤,韩东晖,吴介恒,杨 发,谢 品,秦卫军,杨安钢,温伟红
(第四军医大学:1西京医院泌尿外科,2基础部免疫学教研室,陕西西安710032)
CAR-T细胞治疗用于实体瘤的研究进展
葛玉凤1,韩东晖1,吴介恒2,杨 发1,谢 品1,秦卫军1,杨安钢2,温伟红2
(第四军医大学:1西京医院泌尿外科,2基础部免疫学教研室,陕西西安710032)
嵌合抗原受体(CAR)修饰的T细胞,即CAR⁃T细胞治疗策略是一种非常热门的免疫治疗策略,它可特异性识别肿瘤抗原,进而发挥特异性的杀伤作用.因此靶向性好,杀伤力强,并且T细胞的有效活化和增殖不依赖于MHC分子,是一种高效的免疫杀伤策略.目前,CAR⁃T细胞治疗正在从实验室逐渐走向临床.其在淋巴瘤治疗中效果良好,为血液肿瘤提供了治愈的希望.在实体瘤中,由于肿瘤微环境的复杂性,CAR⁃T细胞的治疗效果尚不理想,但是近年来在实体瘤方面也取得了不错的进展.本文就CAR⁃T治疗策略在实体瘤方面的研究进展进行综述.
嵌合抗原受体;CAR⁃T;免疫治疗;实体瘤
0 引言
1 CAR-T技术简介
通常我们所说的CAR分子主要由三个部分组成:胞外的单链抗体、跨膜区和胞内的信号传导结构.自1989年Gross[4]提出CAR的概念至今已发展至第四代CAR.一代CAR只有单一的胞内信号分子,没有共刺激分子,因此,它虽然能识别肿瘤细胞,但是由于T细胞无法增殖,临床效果有限.二代CAR加入了共刺激分子,如CD28,4⁃1BB,OX40等[5],由于共刺激信号的存在,T细胞可以持续增殖,CAR⁃T细胞的抗肿瘤活性得到了明显的提高[6].为了进一步增强T细胞的杀伤能力,研究人员又在二代CAR的基础上增加了一个共刺激分子的信号传导结构域,也就是说三代CAR有两个共刺激分子,研究显示三代CAR⁃T细胞的增殖能力和杀伤活性都得到了进一步的提高.目前,研究人员正在进行四代CAR技术的研究,四代CAR将通过联合细胞因子或共刺激分子的配体改善免疫微环境,从而进一步增强CAR⁃T细胞的活性[7].第一代至第四代CAR结构见图1.
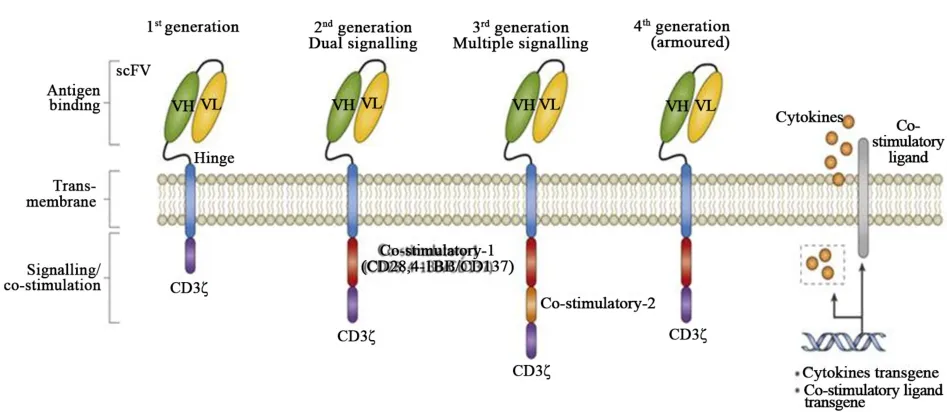
图1 四代CAR分子的结构示意图[7]
2 CAR-T细胞用于实体瘤治疗的现状
鉴于CAR⁃T技术在血液肿瘤中的良好效果,研究人员也逐渐在尝试将CAR⁃T技术应用于实体瘤的治疗中.目前研究较多的实体瘤类型主要有神经母细胞瘤、胶质瘤、胰腺癌、前列腺癌等.
2.1 CAR-T细胞用于神经母细胞瘤治疗的研究神经母细胞瘤(neuroblastoma)是一种多发于儿童的恶性肿瘤,其恶性程度高,预后差,生存率低[8].双唾液酸神经节苷脂(disialoganglioside,GD2)是一种糖脂类抗原,其在包括神经母细胞瘤、胶质瘤、视神经母细胞瘤等多种肿瘤中呈特异性高表达,是理想的治疗靶点[9].目前以GD2为靶点的CAR⁃T细胞治疗研究比较多.Louis等[10]用针对GD2的CAR⁃T细胞进行了临床试验,共纳入了19例神经母细胞瘤患者,给患者注射GD2⁃CAR修饰的EBV特异性的细胞毒性T细胞(EBV⁃specific cytotoxic T lymphocytes,EBV⁃CTLs)或者活化的T细胞(activated T cells,ATCs),发现输注后6周仍能检测到这些细胞的患者预后较好,其中3例患者甚至实现了完全缓解.这些研究证实了CAR⁃T细胞用于治疗神经母细胞瘤的有效性.
此外,Esser等[11]用NK细胞作为效应细胞,通过慢病毒感染使NK⁃92细胞表达针对GD2的CAR分子,发现这种修饰后的CAR⁃NK⁃92细胞可有效增强NK⁃92细胞对GD2阳性细胞的特异性杀伤作用.
2.2 CAR-T细胞用于胶质瘤治疗的研究在胶质瘤的研究中,EGFR是一种有效的治疗靶点.Caruso等[12]用两种亲和力不同的EGFR抗体制备了两种不同的CAR⁃T细胞,发现亲和力高的CAR⁃T细胞对EGFR高表达和低表达的肿瘤细胞均有杀伤作用,而亲和力较低的CAR⁃T细胞只对EGFR高表达的肿瘤细胞有杀伤作用.这些结果提示,选择适当亲和力的CAR⁃T细胞有望实现对肿瘤细胞的特异性杀伤,而对正常组织没有毒性,从而减少副作用.组成性激活的EGFRvIII是一种天然存在的EGFR突变体,它只在肿瘤细胞表达,而正常细胞不表达,是一种更为理想的治疗靶点.Sampson等[13]构建了针对EGFRvIII的三代小鼠CAR⁃T细胞(EGFRvIII mCAR T),利用具有完全免疫能力的荷瘤小鼠模型,结果发现给小鼠输注高剂量的这种CAR⁃T细胞可以治愈所有的荷瘤小鼠.同时发现这些CAR⁃T细胞的抗肿瘤作用依赖于小鼠的免疫系统,这些小鼠还可以抵抗EGFRvIII阴性肿瘤细胞的再次荷瘤,这一研究证实了CAR⁃T细胞用于胶质瘤治疗的有效性,并指出患者体内免疫协同作用的重要性.
在胶质瘤的治疗研究中,EGFR并不是单一的治疗靶点.Brown等[14]制备了一种针对白细胞介素13受体α2(interleukin⁃13 receptor alpha 2,IL13Rα2)的CAR⁃T细胞,他们将这种细胞在220 d内先后在肿瘤切除部位和脑室系统输注给1例胶质瘤复发的患者,发现治疗后患者的颅内和脊髓肿瘤得到了有效缓解,脑脊液中的细胞因子和免疫细胞水平都明显增加,这种临床反应持续了7.5个月,并且治疗过程中没有发现3级以上的毒性作用.这一研究进一步证实了CAR⁃T细胞用于胶质瘤治疗的有效性.
2.3 CAR-T细胞用于胰腺癌治疗的研究胰腺癌会在肿瘤周围形成一个坚固的屏障,使免疫细胞无法识别,并且在血供不足的情况下,胰腺癌组织也能生存,并且非常容易转移,因此治疗比较棘手.间皮素(mesothelin)是一种与肿瘤浸润有关的细胞膜抗原,研究发现很多肿瘤都有间皮素的高表达,以间皮素为靶点的CAR⁃T细胞在胰腺癌的治疗中显示出良好的效果[15].Beatty等[16]设计了针对间皮素的带有CD3ζ和4⁃1BB共刺激结构域的二代CAR,他们用体外转录的mRNA使T细胞瞬时表达CAR分子,并用这种T细胞治疗2例不同的实体瘤患者,分别是恶性胸膜间皮瘤和转移性胰腺癌.结果显示,这种CAR⁃T细胞在外周血中短暂存在,并且可有效到达原发灶和转移灶,同时诱导体液免疫应答,显示出明显的抗肿瘤活性,而对正常组织没有明显的毒性,因此这种CAR⁃T细胞用于实体瘤的治疗是安全可行的.
在CAR⁃T的治疗中,异常的自身抗原也可作为治疗的靶点.Posey等[17]设计了一种CAR,这种CAR分子特异性识别Tn糖基化的粘蛋白1(Tn⁃MUC1),这种Tn⁃MUC1是一种新生抗原,且在多种肿瘤中呈高表达.发现这种CAR修饰的T细胞可在小鼠体内有效抑制胰腺癌移植瘤的生长,具有良好的特异性杀伤活性.这一研究证实异常糖基化的抗原也是一种理想的治疗靶点.
人体自主神经通过复杂的、多层次的神经体系来实现对心脏功能的精密调节[11] ,传统观念认为,心率的增快是交感神经活性增强造成的。人体和动物无论在安静或运动状态下都以迷走神经的调节作用占优势,运动时心率增快主要是由于迷走神经活性减弱,而不是由交感神经活性增强造成的。迷走神经通过释放乙酰胆碱并与胆碱能受体结合,抑制靶器官作用,迷走神经为心脏的减速神经,主要表现为心脏的负性频率、传导、肌力的作用[12]。
2.4 CAR-T细胞用于前列腺癌治疗的研究随着CAR⁃T技术的发展,研究者也尝试将这一技术应用于前列腺癌的治疗.前列腺特异性膜抗原(prostate specific membrane antigen,PSMA)特异性表达于前列腺癌组织,是一种理想的治疗靶点.Zuccolotto等[18]设计了针对人PSMA的CAR,特异性识别PSMA的CAR⁃T细胞可在体外有效杀伤PSMA阳性的前列腺癌细胞,并可在绝大多数的荷瘤裸鼠体内完全抑制肿瘤的生长,并有效延长小鼠的生存期.Ma等[19]比较了针对PSMA的一代CAR和二代CAR修饰的T细胞对前列腺癌细胞的特异性杀伤作用,研究证明这些CAR⁃T细胞均能特异性杀伤PSMA阳性的前列腺癌细胞,但二代CAR⁃T细胞在体内外的杀伤效果均优于一代CAR.
2.5 CAR-T细胞用于其它实体瘤治疗的研究除了上述肿瘤,CAR⁃T技术也被尝试用于其他实体瘤的治疗,在这些研究中,也有很多有趣的发现.比如,在黑色素瘤的研究中,Zhang等[20]利用一种特异性识别gp100/HLA⁃A2复合物的抗体制备了二代CAR,这种CAR修饰的T细胞可在体外HLA⁃A2存在的情况下特异性杀伤黑色素瘤细胞,也可在荷瘤小鼠体内抑制黑色素瘤的生长.Kandalaft等[21]利用针对叶酸受体α(folate receptor⁃α)的CAR⁃T细胞进行了卵巢癌的Ⅰ期临床试验,在给患者输注CAR⁃T细胞后的第48 h输注大量未感染的自身外周血淋巴细胞(periph⁃eral blood lymphocytes,PBL),研究发现可有效抑制CAR⁃T细胞的过量扩增,从而有效地抑制副作用.Geldres等[22]发现硫酸软骨素蛋白聚醣4(chondroitin sulfate proteoglycan⁃4,CSPG4)在多种肿瘤如黑色素瘤、乳腺癌、头颈部肿瘤等中均呈特异性高表达,制备了针对CSPG4的二代CAR⁃T细胞,并在荷瘤小鼠体内证实了这种CAR⁃T细胞的抗肿瘤作用,因此CSPG4也是一种CAR⁃T细胞治疗的理想靶点,有望用于多种肿瘤的治疗.
除了利用特异性的单链抗体进行肿瘤抗原的识别,也有研究人员试图利用配受体的特异性结合来识别肿瘤细胞.如Song等[23]设计利用NKG2D受体的胞外区去识别NKG2D配体(NKG2D ligands,NKG2DLs)制备成利用配受体的结合特异性识别肿瘤细胞的CAR⁃T细胞,研究发现这种包含NKG2D受体胞外区的CAR⁃T细胞也可有效识别并特异性杀伤NKG2DL阳性的卵巢癌细胞.在此基础上,发现使用组蛋白去乙酰化酶的抑制剂VPA(sodium valproate)可促进NKG2DL的表达,从而增强CAR⁃T细胞的杀伤作用.
CAR⁃T治疗策略在实体瘤的治疗研究中取得了一些进展,但相对于CAR⁃T细胞在血液肿瘤中的显著效果,CAR⁃T治疗策略应用于实体瘤还不够成熟.要想将CAR⁃T技术成功应用于实体瘤的治疗还需要进一步改进方法,提高疗效.
3 CAR-T细胞在实体瘤治疗中存在的问题及改进方法
相比于在血液肿瘤的显著疗效,CAR⁃T技术在实体肿瘤的治疗方面还存在一定的困难,面临的主要问题有:缺乏特异性的靶点、CAR⁃T细胞不能有效浸润入肿瘤组织及肿瘤微环境对CAR⁃T细胞的抑制性作用等[24-26].为了使CAR⁃T细胞技术更好地应用于实体瘤的治疗,学者们进行了多方面的探索,也找到了一些改进的方法.
3.1 细胞因子风暴CAR⁃T免疫治疗技术要想在临床进行应用,首先要考虑的就是CAR⁃T免疫疗法的安全性,而细胞因子风暴(cytokine release syndrome,CRS)无疑成为CAR⁃T技术在临床应用中比较难避免的风险.CAR⁃T技术的关键是T细胞利用具有识别靶细胞表面抗原能力的CAR受体,结合到靶细胞表面的分子,这个过程中使T细胞内部信号产生,来激活T细胞,进而快速摧毁靶细胞,同时,CAR⁃T细胞大量扩增,释放大量的细胞因子[27].之前JUNO公司JCAR015导致患者死亡,后来研究发现是治疗时癌细胞进入神经中枢系统,在炎症条件下,CAR⁃T细胞通过血脑屏障后与癌细胞发生了反应,局部的CRS使患者脑水肿死亡.最近,Cellectis公司研发的通用型CAR⁃T产品——UCART123宣布上市后,在治疗时出现了1例患者死亡的事件.据推测患者死亡也是由严重CRS导致的,但CRS爆发的原因尚不明确.
现在看来,在CAR⁃T免疫治疗的过程中,CRS释放暂时是无法避免的.目前急需要找到CRS的主要病因减少细胞因子的释放,从而缓解或者克服CAR⁃T应用安全性.目前,临床上的解决方案不多,在各种免疫疗法中,寻找肿瘤杀伤效果更突出、作用更持久的免疫细胞有可能会减弱细胞因子风暴的强度,缓解患者免疫细胞回输后发热、发烧的症状.
3.2 缺乏特异性的靶点CAR⁃T细胞治疗策略在血液肿瘤中能取得理想的效果,很重要的一个原因是血液肿瘤存在特异性的靶点,而实体瘤中很难找到像血液肿瘤那样的特异性抗原,大部分抗原在肿瘤细胞上都是相对高表达,正常细胞也会有少量的表达,因此很难避免对正常细胞的非特异性杀伤,从而产生“On⁃target but off⁃tumor”的副作用.为了解决这个问题,Fedorov等[28]设计了一种抗原特异性的抑制性CAR分子(inhibitory CAR,iCAR),这种CAR分子胞外区识别特定正常细胞上的抗原,而胞内区使用抑制性受体PD⁃1或CTLA⁃4的胞内区.他们通过病毒感染使T细胞同时表达这种iCAR分子和识别肿瘤抗原的CAR分子,研究发现当靶细胞只表达肿瘤抗原时,这种CAR⁃T细胞可有效杀伤肿瘤细胞,而当细胞同时表达特定正常抗原和肿瘤抗原时,iCAR则会发挥抑制性的作用,这时T细胞不杀伤这种正常细胞.通过这种设计有望实现对CAR⁃T细胞的动态安全调控.
除此之外,为了避免单一治疗靶点可能引起的“On⁃target but off⁃tumor”副作用,研究人员设计了针对双靶点的CAR⁃T细胞.比如,Wilkie等[29]将CD3ζ提供的第一信号和共刺激分子提供的第二信号分开,分别由ErbB2和MUC1特异性的CAR分子来提供,他们发现这种双靶点的CAR⁃T细胞可有效杀伤ErbB2阳性细胞,但是T细胞的增殖需要ErbB2和MUC1两种抗原的同时存在.Kloss等[30]也设计了与之类似的双靶点CAR⁃T细胞,两个信号分别由针对PSMA和PSCA的CAR分子提供,研究证实这种双靶点的CAR只杀伤表达双靶点的肿瘤细胞,而对表达单一抗原的细胞没有杀伤作用.因此针对双靶点的CAR⁃T细胞不仅增强了治疗效果,还提高了治疗的安全性.
3.3 CAR-T细胞不能有效浸润入肿瘤组织CAR⁃T细胞只有浸润入肿瘤组织才能更好地发挥抗肿瘤作用,为了实现CAR⁃T细胞的有效浸润,Chinnasamy等[31]设计了一种CAR⁃T细胞,这种细胞表达针对VEGFR⁃2的CAR分子,同时表达单链的IL⁃12分子.结果显示,这种CAR⁃T细胞可有效抑制多种荷瘤模型中肿瘤的生长,而只表达其中一种分子的T细胞均没有抑制作用.他们发现这种CAR⁃T细胞可有效浸润入肿瘤组织,有效扩增并可持续较长的时间,其抗肿瘤作用可能是通过抑制VEGFR⁃2阳性的CD11b+Gr1+髓系抑制性细胞改变了免疫抑制性肿瘤微环境,从而实现了对肿瘤的有效抑制.
为了实现CAR⁃T细胞的有效浸润,Di等[32]给靶向CD30的CAR⁃T细胞共表达趋化因子受体CCR4,他们利用皮下淋巴瘤模型证实表达趋化因子CCL17或CCL22的淋巴瘤细胞可有效募集表达CCR4的CAR⁃T细胞,从而实现对肿瘤的有效杀伤.此外,Ca⁃ruana等在研究中发现,体外扩增的CAR⁃T细胞缺乏乙酰肝素酶(heparanase,HPSE)的表达,他们给CAR⁃T细胞同时过表达HPSE,使其有效降解细胞外基质(extracellular matrix,ECM),从而有效浸润入肿瘤组织,增强对实体瘤的杀伤活性,这种CAR⁃T细胞有望应用于富含基质的实体瘤的治疗.
免疫抑制性介质如前列腺素E2(prostaglandin E2,PGE2)和腺苷酸的存在限制了CAR⁃T细胞治疗在实体瘤中的应用,这是因为它们可通过激活蛋白激酶A(protein kinase A,PKA)而抑制T细胞的活化.由于PKA对T细胞的抑制性作用依赖于其与膜分子ezrin的结合,因此,Newick[33]等设计了一种小分子多肽RIAD(regulatory subunit I anchoring disruptor)这种多肽可有效抑制PKA与ezrin的结合,从而解除PKA对T细胞的抑制性作用.研究发现这种多肽可促进CAR⁃T细胞的迁移和浸润,从而促进其对实体瘤细胞的有效杀伤.
3.4 肿瘤微环境对CAR-T细胞治疗的影响肿瘤微环境中的免疫抑制性细胞可通过对CAR⁃T细胞的功能抑制消弱其对肿瘤细胞的有效杀伤.抑制这些免疫抑制性细胞的功能有望提高CAR⁃T细胞在实体瘤中的治疗效果.John等[34]在利用针对HER2的CAR⁃T细胞治疗乳腺癌的过程中,联合使用针对PD⁃1的阻断抗体,发现这种联合治疗可增强CAR⁃T细胞的抗肿瘤作用,同时研究发现,这种联合治疗可显著下调肿瘤微环境中Gr1+CD11b+骨髓源性抑制性细胞(myeloid⁃derivedsuppressor cells,MDSC)的比例.因此,这种联合治疗有望大大提高CAR⁃T细胞的治疗效果.Burga等[35]在利用针对癌胚抗原(carcinoem⁃bryonic antigen,CEA)的CAR⁃T细胞进行肝转移治疗的研究中,发现肝MDSC(liver MDSC,L⁃MDSC)可通过PD⁃L1抑制CAR⁃T细胞的杀伤功能,而去除MDSC或中和MDSC赖以生存的GM⁃CSF或联合使用PD⁃L1的阻断抗体可增强CAR⁃T细胞的杀伤效果.
肿瘤细胞在受到免疫攻击后会上调免疫抑制性配体如PD⁃L1的表达,这些配体与CAR⁃T细胞的相应受体如PD⁃1的结合可明显抑制T细胞的杀伤活性,从而减弱其抗肿瘤效果.Cherkassky等[36]在利用针对间皮素的CAR⁃T细胞治疗小鼠胸膜间皮瘤模型时发现,肿瘤微环境中PD⁃1的表达大大抑制了CAR⁃T细胞的杀伤活性,研究发现使用PD⁃1阻断抗体,用shRNA抑制细胞内PD⁃1的表达或表达PD⁃1的显性负突变体蛋白均可有效增强CAR⁃T细胞的抗肿瘤效果.因此研究认为联合使用PD⁃1/PD⁃L1的阻断抗体有望提高CAR⁃T细胞的抗肿瘤效果.
为了消除PD⁃1介导的免疫抑制,Liu等[37]设计了一种转换受体,这种受体由PD⁃1的胞外区和CD28的跨膜和胞内区组成,他们给CAR⁃T细胞感染这种转换受体,发现可有效增强CAR⁃T细胞向肿瘤组织的浸润,并减弱免疫微环境对CAR⁃T细胞的免疫抑制,展示出明显增强的抗肿瘤活性.Suarez等[38]设计了一种CAR⁃T细胞,这种细胞表达针对碳酸酐酶IX(carbonic anhydrase IX,CAIX)的CAR分子,同时分泌可介导ADCC作用的PD⁃L1抗体,他们用这种CAR⁃T细胞治疗转移性肾透明细胞癌荷瘤小鼠,发现其抗肿瘤活性比对照CAR⁃T细胞高5倍,肿瘤重量减少50%~80%.因此这种策略有望进一步提高CAR⁃T细胞在实体瘤中的治疗效果.
4 展望
目前,随着CAR⁃T技术在血液肿瘤中的成功应用,CAR⁃T细胞技术进入了一个崭新的时代,也为肿瘤患者带来了新的希望.然而,尽管CAR⁃T细胞在血液肿瘤中显示了良好的治疗效果,但在实体瘤的应用中还面临诸多困难,如缺乏特异性的靶点、CAR⁃T细胞不能有效浸润入肿瘤组织和免疫抑制性微环境对CAR⁃T细胞的抑制性作用等.CAR⁃T细胞治疗的最终目标是治愈肿瘤,目前研究人员正在进行多方面的尝试,试图通过提高靶点的特异性或选择多个靶点进行治疗,促进CAR⁃T细胞向肿瘤组织的迁移浸润,解除肿瘤微环境的免疫抑制性,提高CAR⁃T细胞在实体瘤中的抗肿瘤效果.相信通过研究人员的不断探索,CAR⁃T细胞策略最终将成功应用于实体瘤的治疗,使治愈实体瘤成为可能.
[1] Maude SL,Frey N,Shaw PA,et al.Chimeric antigen receptor T cells for sustained remissions in leukemia[J].N Engl J Med,2014,371(16):1507-1517.
[2] Brudno JN,Kochenderfer JN.Chimeric antigen receptor T⁃cell therapies for lymphoma[J].Nat Rev Clin Oncol,2017.
[3] Batlevi CL,Matsuki E,Brentjens RJ,et al.Novel immunotherapies in lymphoid malignancies[J].Nat Rev Clin oncol,2016,13(1):25-40.
[4] Gross G,Waks T,Eshhar Z.Expression of immunoglobulin⁃T⁃cell receptor chimeric molecules as functional receptors with antibody⁃type specificity[J].Proc Natl Acad Sci U S A,1989,86(24):10024-10028.
[5] Savoldo B,Ramos CA,Liu E,et al.CD28 costimulation improves expansion and persistence of chimeric antigen receptor⁃modified T cells in lymphoma patients[J].J Clin invest,2011,121(5):1822-1826.
[6] Frigault MJ,Lee J,Basil MC,et al.Identification of chimeric antigen receptors that mediate constitutive or inducible proliferation of T cells[J].Cancer Immunol Res,2015,3(4):356-367.
[7] Terakura S,Yamamoto TN,Gardner RA,et al.Generation of CD19⁃chimeric antigen receptor modified CD8+T cells derived from virus⁃specific central memory T cells[J].Blood,2011,119(1):72-82.
[8] Sait S,Modak S,Anti⁃GD2 immunotherapy for neuroblastoma[J].Expert Rev Anticancer Ther,2017,17(10):889-904.
[9] Suzuki M,Cheung NK.Disialoganglioside GD2 as a therapeutic target for human diseases[J].Expert Opin Ther Targets,2015,19(3):349-362.
[10] Louis CU,Savoldo B,Dotti G,et al.Antitumor activity and long⁃term fate of chimeric antigen receptor⁃positive T cells in patients with neuroblastoma[J].Blood,2011,118(23):6050-6056.
[11] Esser R,Müller T,Stefes D,et al.NK cells engineered to express a GD2⁃specific antigen receptor display built⁃in ADCC⁃like activity against tumour cells of neuroectodermal origin[J].J Cell Mol Med,2012,16(3):569-581.
[12] Caruso HG,Hurton LV,Najjar A,et al.Tuning Sensitivity of CAR to EGFR density limits recognition of normal tissue while Maintaining Potent AntitumorActivity[J].CancerRes,2015,75(17):3505-3518.
[13] Sampson JH,Choi BD,Sanchez⁃Perez L,et al.EGFRvIII mCAR⁃modified T⁃cell therapy cures mice with established intracerebral glioma and generates host immunity against tumor⁃antigen loss[J].Clin Cancer Res,2014,20(4):972-984.
[14] Brown CE,Alizadeh D,Starr R,et al.Regression of glioblastoma after chimeric antigen receptor T⁃cell therapy[J].N Engl J Med,2016,375(26):2561-2569.
[15] Morello A,Sadelain M,Adusumilli PS.Mesothelin⁃targeted CARs:driving T cells to solid tumors[J].Cancer Discov,2016,6(2):133-146.
[16] Beatty GL,Haas AR,Maus MV,et al.Mesothelin⁃specific chimeric antigen receptor mRNA⁃engineered T cells induce anti⁃tumor activity in solid malignancies[J].Cancer immunol Res,2014,2(2):112-120.
[17] Posey AD Jr,Schwab RD,Boesteanu AC,et al.Engineered CAR T cells targeting the cancer⁃associated Tn⁃glycoform of the membrane mucin MUC1 control adenocarcinoma[J].Immunity,2016,44(6):1444-1454.
[18] Zuccolotto G,Fracasso G,Merlo A,et al.PSMA⁃specific CAR⁃engineered T cells eradicate disseminated prostate cancer in preclini⁃cal models[J].PloS One,2014,9(10):e109427.
[19] Ma Q,Gomes EM,Lo AS,et al.Advanced generation anti⁃prostate specific membrane antigen designer T Cells for prostate cancer immu⁃notherapy[J].Prostate,2014,74(3):286-296.
[20] Zhang G,Wang L,Cui H,et al.Anti⁃melanoma activity of T cells redirected with a TCR⁃like chimeric antigen receptor[J].Sci Rep,2014,4:3571.
[21] Kandalaft LE,Powell DJ Jr,Coukos G.A phase I clinical trial of adoptive transfer of folate receptor⁃alpha redirected autologous T cells for recurrent ovarian cancer[J].J Transl Med,2012,10:157.
[22] Geldres C,Savoldo B,Hoyos V,et al.T lymphocytes redirected against the chondroitin sulfate proteoglycan⁃4 control the growth of multiple solid tumors both in vitro and in vivo[J].Clin Cancer Res,2014,20(4):962-971.
[23] Song DG,Ye Q,Santoro S,et al.Chimeric NKG2D CAR⁃expressing T cell⁃mediated attack of human ovarian cancer is enhanced by histone deacetylase inhibition[J].Human gene therapy,2013,24(3):295-305.
[24] ScarfòI,Maus MV.Current approaches to increase CAR T cell potency in solid tumors:targeting the tumor microenvironment[J].J Immunotherapy Cancer,2017,5:28.
[25] Johnson LA,June CH.Driving gene⁃engineered T cell immunotherapy of cancer[J].Cell Res,2017,27(1):38-58.
[26] Newick K,O'Brien S,Moon E,et al.CAR T cell therapy for solid tumors[J].Annu rev Med,2017,68:139-152.
[27] Barrett DM,Grupp SA,June CH.Chimeric antigen receptor⁃and TCR⁃modified T cells enter main street and wall street[J].J Immunol,2015,195(3):755-761.
[28] Fedorov VD,Themeli M,Sadelain M.PD⁃1⁃and CTLA⁃4⁃based inhibitory chimeric antigen receptors(iCARs)divert off⁃target immunotherapy responses[J].Sci Transl Med,2013,5(215):215ra172.
[29] Wilkie S,van Schalkwyk MC,Hobbs S,et al.Dual targeting of ErbB2 and MUC1 in breast cancer using chimeric antigen receptors engineered to provide complementary signaling[J].J Clin Immunol,2012,32(5):1059-1070.
[30] Kloss CC,Condomines M,Cartellieri M,et al.Combinatorial antigen recognition with balanced signaling promotes selective tumor eradication by engineered T cells[J].Nat Biotechnol,2013,31(1):71-75.
[31] Chinnasamy D,Yu Z,Kerkar SP,et al.Local delivery of interleukin⁃12 using T cells targeting VEGF receptor⁃2 eradicates multiple vascularized tumors in mice[J].Clin Cancer Res,2012,18(6):1672-1683.
[32] Di Stasi A,De Angelis B,Rooney CM,et al.T lymphocytes coexpressing CCR4 and a chimeric antigen receptor targeting CD30 have improved homing and antitumor activity in a Hodgkin tumor model[J].Blood,2009,113(25):6392-6402.
[33] Newick K,O'Brien S,Sun J,et al.Augmentation of CAR T⁃cell trafficking and antitumor efficacy by blocking protein kinase A localization[J].Cancer immunol Res,2016,4(6):541-551.
[34] John LB,Devaud C,Duong CP,et al.Anti⁃PD⁃1 antibody therapy potently enhances the eradication of established tumors by gene⁃modified T cells[J].Clin Cancer Res,2013,19(20):5636-5646.
[35] Burga RA,Thorn M,Point GR,et al.Liver myeloid⁃derived suppressor cells expand in response to liver metastases in mice and inhibit the anti⁃tumor efficacy of anti⁃CEA CAR⁃T[J].Cancer immunol,immunother,2015,64(7):817-829.
[36] Cherkassky L,Morello A,Villena⁃Vargas J,et al.Human CAR T cells with cell⁃intrinsic PD⁃1 checkpoint blockade resist tumor⁃mediated inhibition[J].J Clin invest,2016,126(8):3130-3144.
[37] Liu X,Ranganathan R,Jiang S,et al.A chimeric switch⁃receptor targeting PD1 augments the efficacy of second⁃generation CAR T cells in advanced solid tumors[J].Cancer Res,2016,76(6):1578-1590.
[38] Suarez ER,Chang de K,Sun J,et al.Chimeric antigen receptor T cells secreting anti⁃PD⁃L1 antibodies more effectively regress renal cell carcinoma in a humanized mouse model[J].Oncotarget,2016,7(23):34341-34355.
Research progress of CAR-T cell therapy in solid tumors
GE Yu-Feng1,HAN Dong-Hui1,WU Jie-Heng2,YANG Fa1,XIE Pin1,QIN Wei-Jun1,YANG An-Gang2,WEN Wei-Hong21Department of Urology,Xijing Hospital,2Department of Immu⁃nology,Fourth Military Medical University,Xi'an 710032,China
T cells modified by chimeric antigen receptor(CAR)therapy strategy,the CAR⁃T cell therapy,is a popular immune therapy strategy,which could specifically identify tumor antigens and then play a specific killing effect.It is a highly effective immune killer strategy with accurate targeting,strong lethality,and effective activation and proliferation of T cells is not depend⁃ent on MHC molecules.At present,CAR⁃T cell therapy is gradu⁃ally used from laboratory to clinic,which provides a cure hope for patients with blood tumor owing to a good treatment in lymphoma.The effect of CAR⁃T cells is not ideal in solid tumors due to the complexity of the tumor microenvironment,while there has been some good progress in solid tumors in recent years.In this paper,CAR⁃T treatment strategy in solid tumor research progress will be reviewed.
chimeric antigen receptor;CAR⁃T;immunothera⁃py;solid tumor
R730.51
A
2017-08-28;接受日期:2017-09-16
国家重点基础研究发展计划(973)(2013CB530500);国家自然科学基金(81372225)
葛玉凤.硕士.研究方向:免疫.E⁃mail:gyfeng_yzx@163.com
温伟红.博士,副教授.研究方向:免疫.E⁃mail:wenweih@fmmu.edu.cn杨安钢(共同通讯作者).博士,教授,博导.研究方向:免疫.E⁃mail:agyang@fmmu.edu.cn
2095⁃6894(2017)10⁃50⁃04
