TRPM7离子通道在口腔鳞癌细胞增殖和迁移中的作用
2017-11-11韩晟陈衍
韩晟 陈衍
TRPM7离子通道在口腔鳞癌细胞增殖和迁移中的作用
韩晟 陈衍
目的探讨TRPM7离子通道在口腔鳞癌细胞增殖和迁移中的作用。方法Western blotting,RT-PCR和间接免疫荧光法检测口腔鳞癌细胞OC2中TRPM7的表达和细胞内定位。MTT法和Transwell试验分别检测抑制TRPM7通道(2-APB、siRNA TRPM7)对OC2细胞增殖和迁移的影响。Western blotting检测2-APB或siRNA TRPM7阻断PI3K/AKT通路对OC2细胞中TRPM7的表达影响。采用膜片钳技术初步探索干预TRPM7通道对OC2细胞阳离子通透的影响。结果OC2细胞中TRPM7过表达,主要表达在细胞质中。阻断TRPM7通道后,OC2细胞增殖和迁移能力受抑制,且呈浓度依赖性和时间依赖性。阻断TRPM7通道后,抑制OC2细胞TRPM7可下调磷酸化AKT以及磷酸化ERK的表达,而对组成性AKT以及ERK的表达无明显影响。膜片钳技术显示在TRPM7过表达的OC2细胞中TRPM7样电流激活,2-APB 阻断TRPM7通道后电流明显减弱,而采用TRPM7通道活化剂Bradykinin后,电流明显增强。结论TRPM7在口腔鳞癌细胞OC2中过表达,可能通过影响PI3K/AKT和MAPK-ERK信号转导途径以及阳离子内流发挥对细胞增殖、迁移的调节作用。
口腔鳞癌; 瞬时受体电位家族成员7; 细胞增殖; 迁移
口腔鳞癌是头颈部最常见的恶性肿瘤,晚期口腔鳞癌患者预后差,传统治疗方法有效率低,因此需要寻找新的治疗靶点。近年来研究发现某些离子通道与肿瘤的发生发展密切相关。很多离子通道在非兴奋性组织起源的肿瘤中高表达,而在相同起源的正常组织中低表达或不表达。因此离子通道成为肿瘤研究领域新的热点。瞬时受体电位家族成员TRPM7(transient receptor potential melastatin 7)组成性表达于兴奋性和非兴奋性细胞的质膜上,参与细胞内离子平衡的调节、神经递质的释放、细胞的黏附和迁移等重要生理过程[1]。TRPM7在多种肿瘤中过表达,与肿瘤细胞的生长、增殖和转移密切相关[2-5]。目前有关口腔癌相关离子通道的研究还很缺乏,本研究初步探讨TRPM7离子通道在口腔鳞癌细胞增殖和迁移中的作用,不仅有助于进一步阐明口腔癌发生、发展及转移的机制,并为基于该离子通道的口腔鳞癌靶向治疗提供理论依据。
1 材料与方法
1.1 细胞培养
人类口腔鳞癌细胞株OC2由第四军医大学口腔医学院实验中心保留。培养基采用以1∶1混合的Dulbecco培养基和Ham F12培养基,辅以10 胎牛血清和抗生素(50 U/L青霉素和50 U/L链霉素)溶液,以及2.5 mmol/L谷氨酰胺和400 g/L氢化可的松溶液。37 ℃含5% CO2的孵箱培养。免疫组化实验时,将细胞接种于预先用多聚左旋鸟氨酸包被的盖玻片上,生长3 d后用于实验。
1.2 间接免疫荧光法观察口腔鳞癌细胞OC2中TRPM7的表达和细胞内定位
将OC2细胞按2×105/孔的密度分别接种于预先放置盖玻片的6 孔板中,次日PBS洗涤后用4%多聚甲醛室温固定15 min,PBS漂洗后将细胞置于乙醇和乙酸(2∶1)混合液中快速冷却5 min(-20 ℃),室温下加入预先用PBS稀释的3 TritonX-100,作用20 min后加入由2%正常山羊血清和1%牛血清白蛋白组成的封闭缓冲液,孵育30 min后直接加入1∶100稀释比例的TRPM7一抗(Abgent), 4 ℃孵育过夜。 二抗选用稀释比例1∶750的Cy3偶联的羊抗兔抗体(Jackson Immunoresearch,Inc,USA),室温下孵育2 h, 避光。 DAPI封片,激光共聚焦显微镜下观察。
1.3 Western blotting法
提取细胞的总蛋白,配置电泳样品。配置分离胶(TRPM7 75 g/L,其余120 g/L)和50 g/L的浓缩胶。等量样品经SDS-PAGE电泳后,稳流将蛋白电转至甲醇预处理的PVDF膜上(TRPM7电转5 h,其余电转2 h)。转膜、封闭后按流程分别加入一抗和二抗。暗室中发光、显影和定影。抗AKT抗体、抗phospho-AKT(Ser473)、抗ERK 抗体、抗phospho-ERK(1/2)(Thr202/Tyr204)抗体购自Cell Signaling Technology,Inc,USA。
1.4 RT-PCR法检测OC2中TRPM7的表达
Trizol法提取OC2细胞的RNA,RT-PCR扩增TRPM7 mRMA,引物设计:正义5'-AAACATGTTGGTGATGCCCTC-3'。 反义5'-CACACACAACAACTGGAA CGG-3'(NCBI accession no. NC_005102)。 RT-PCR扩增条件: 94 ℃ 30 s,57 ℃ 15 s,72 ℃ 30 s,共30 个循环(Clontech, CA)。
1.5 TRPM7-siRNA转染
特异性TRPM7-siRNA合成序列设计为:5'-AAGCAGAGTGACCTGGTAGA T-3'。将细胞数预先稀释至10 个细胞/ml;转染试剂si PORTNeoFX(Ambion)和TRPM7 siRNA分别用Opti-MEMI低血清培养基(Invitrogen)按照1∶20进行稀释,再将稀释后的NeoFX和TRPM7-siRNA混合,形成转染复合物;将含有转染复合物的培养基先等分至24 孔板内,再将稀释后的细胞加入24 孔板,使每孔分别含有30 nmol/L终浓度的TRPM7-siRNA和10 个细胞。经过TRPM7-siRNA转染的细胞72 h后用于细胞毒评估。
1.6 MTT细胞增殖试验
将细胞按3×103/孔的密度分别接种于96 孔板,给予上述细胞TRPM7通道抑制剂2-APB(0、10、100 mol/L)作用48 h后终止反应,MTT法测定细胞存活率和增殖曲线。均设复孔和对照孔。
1.7 Transwell 细胞迁移实验
将Transwell小室(Corning)放入24 孔细胞培养板中,常规培养肿瘤细胞,胰酶消化后接种小室, 24 h后冰甲醛固定滤膜后进行HE染色。用棉签轻轻拭去滤膜上表面未穿透的细胞,各选择5个高倍镜(×200)视野,分别计数滤膜下面和24孔板中的细胞数(穿膜细胞数),以穿膜细胞数表示其运动能力。
1.8 膜片钳技术记录细胞TRPM7通道全细胞电流
采用膜片钳技术记录细胞TRPM7通道全细胞电流,分析浓度梯度与电流关系。在无钙离子的细胞外液(添加细胞外钙离子螯合剂)中,膜片钳技术记录细胞TRPM7通道电流在TRPM7通道抑制剂(2-APB 100 mol/L)和激活剂(Bradykinin 10 μmol/L)作用下的电流变化情况。配置细胞外溶液:K-gluconate 5 mmol/L,Na-gluconate 140 mmol/L,CaCl21 mmol/L, MgCl21 mmol/L, glucose 5 mmol/L及HEPES 10 mmol/L, pH 7.4。细胞内溶液:Na-gluconate 140 mmol/L,NaCl 4 mmol/L,EGTA 1 mmol/L,EDTA 1 mmol/L及HEPES 10 mmol/L,pH 7.2。葡萄糖酸盐适量减少以维持合适的渗透压。室温下膜片钳记录全细胞离子,采用Axopatch 200B放大器(Axon Instruments, Foster City)及pClamp 9.2软件分析。
2 结 果
2.1 口腔鳞癌细胞OC2中TRPM7的表达
采用间接免疫荧光法检测OC2细胞中TRPM7的细胞内定位,结果示TRPM7主要定位于胞质中(图 1)。采用Western blotting 和RT-PCR法检测OC2中TRPM7的表达情况,结果显示在OC2细胞中TRPM7过表达,siRNA TRPM7后TRPM7 的蛋白(图 2A)和mRNA(图 2B)表达水平均下调。

A: 荧光染色; B: DAPI染色
图 1 OC2细胞中TRPM7蛋白的表达
(× 40)
A: Indirect immunofluorescence assay; B: DAPI staining
Fig 1 TRPM expression in OC2 cells
(× 40)

A: TRPM7蛋白表达; B: TRPM7 mRNA表达
2.2 抑制TRPM7对口腔鳞癌细胞系OC2生物学性状的影响
为探讨阻断TRPM7通道对OC2细胞增殖的影响,给予TRPM7抑制剂2-APB(0、 10、 100 μmol/L)、siRNA TRPM7后,观察对细胞生物学性状的影响。MTT结果显示,2-APB 阻断TRPM7通道后OC2细胞生长和增殖受抑,且呈浓度依赖性和时间依赖性(图 3),100 μmol/L作用48 h时其抑制能力达到78.56%。同样,给予siRNA TRPM7后,OC2细胞生长和增殖受抑,且呈时间依赖性,在作用48 h后,其细胞增殖能力下降约84.27%(图 4)。此外,siRNA TRPM7后, OC2细胞的迁移能力受到明显抑制,与对照组相比作用24 h其迁移能力下降71.09%(图 5)。

图 3 2-APB对OC2细胞增殖的影响
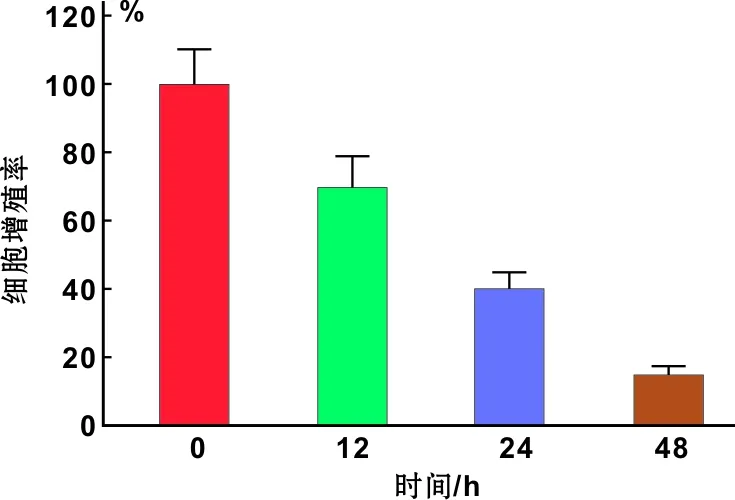
图 4 siRNA TRPM7对OC2细胞增殖的影响
Fig 4 The effects of siRNA TRPM7 on the proliferation of OC2 cells
2.3 TRPM7通道可通过PI3K/AKT途径对口腔鳞癌细胞系OC2的生长进行调控
为探讨TRPM7通道对OC2细胞系PI3K/AKT和MAPK-ERK信号转导通路的影响,对OC2细胞siRNA TRPM7后,采用Western blotting检测AKT、磷酸化AKT、ERK以及磷酸化ERK的表达情况。结果显示,抑制OC2细胞TRPM7可下调磷酸化AKT以及磷酸化ERK的表达,而对组成性AKT以及ERK的表达无明显影响(图 6)。
2.4 TRPM7通道对口腔鳞癌细胞系OC2阳离子通透的影响
采用膜片钳技术探索TRPM7通道对OC2阳离子通透的影响。给予OC2细胞TRPM7通道抑制剂2-APB(100 μmol/L)或活化剂Bradykinin(10 μmol/L),膜片钳实验检测了OC2全细胞电流,结果显示,在TRPM7过表达的OC2细胞中TRPM7样电流激活,采用TRPM7通道抑制剂2-APB 阻断TRPM7通道后电流明显减弱,而采用TRPM7通道活化剂Bradykinin后,电流明显增强(图 7)。
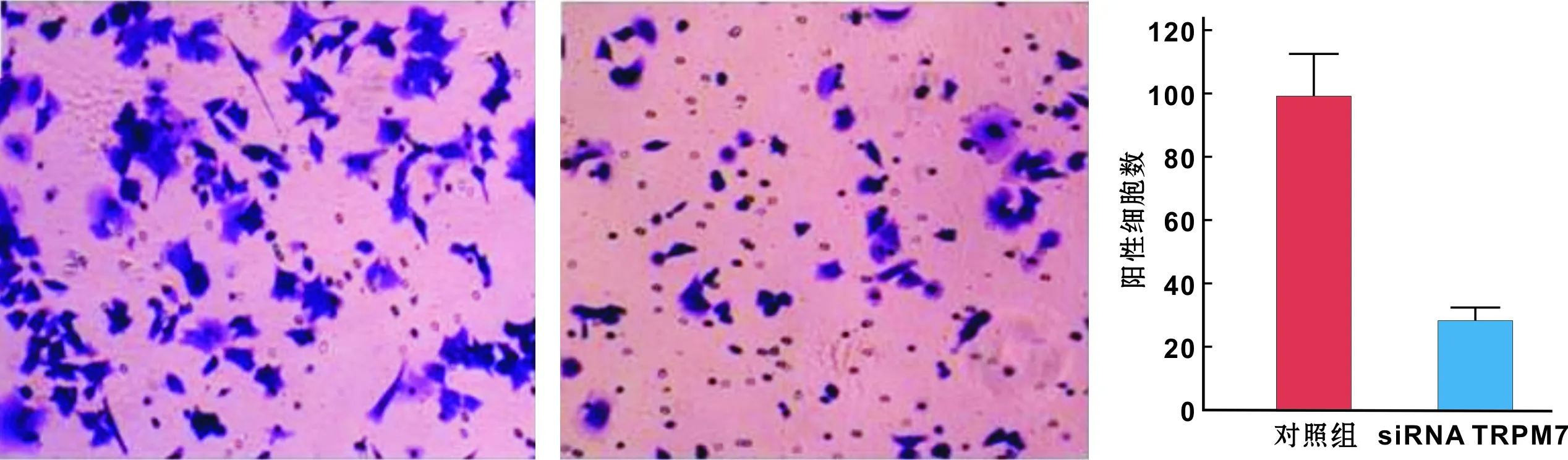
图 5 siRNA TRPM7对OC2细胞迁移能力的影响

图 6 TRPM7对OC2细胞磷酸化AKT以及磷酸化ERK表达的影响
Fig 6 The effects of TRPM7 on the expression of phosphorylated AKT and phosphorylated ERK

图 7 TRPM7对OC2细胞阳离子通透的影响
Fig 7 The effects of TRPM7 on the positive ion permeability of OC2 cells
3 讨 论
TRPM7为TRPM亚家族成员,是第一个被发现的具有离子通道和蛋白激酶双重结构的“双功能蛋白”,其对阳离子具有通透性,调控细胞内Mg2+和Ca2+内稳定[1,6]。此外,TRPM7还作为一种丝/苏胺酸蛋白激酶可使自身或底物磷酸化,是细胞生长和增殖的关键调控者,不仅是早期胚胎发育所必须的,还在多种肿瘤细胞中过表达,参与调控肿瘤细胞的生长和迁移[2-5]。TRPM7 在头颈部肿瘤中的研究较少。TRPM7在鼻咽鳞癌中过表达,是鼻咽鳞癌细胞增殖、抗凋亡所必需,并与较差的临床预后密切相关,是独立的临床预后因素,敲除TRPM7可以增强鼻咽鳞癌细胞对放疗的敏感性[3,8]。我们的研究发现,口腔鳞癌OC2细胞中TRPM7过表达,特异性抑制TRPM7后OC2细胞生长、增殖和迁移能力明显受抑。因此说明TRPM7离子通道在口腔鳞癌的发生、发展和转移中起到重要作用,而抑制该通道可能成为口腔鳞癌新的治疗途径。
那么TRPM7到底通过什么途径调控口腔鳞癌细胞的生长、增殖和迁移能力?研究表明TRPM7可通过STAT3、AKT、JAK2/STAT3及Notch等多种信号通路调控不同肿瘤细胞的增殖和迁移[3,9-10]。本研究显示,抑制TRPM7可下调磷酸化AKT以及磷酸化ERK的表达水平,因此推测TRPM7通道可能通过PI3K/AKT和MAPK-ERK途径对口腔鳞癌细胞系OC2的生长进行调控,但是还需要进一步验证。此外,我们还推测TRPM7通道至少通过影响阳离子参与口腔癌的发生发展。TRPM7是调控非兴奋性细胞(肿瘤细胞属非兴奋细胞)Ca2+内流的关键通道[11]。TRPM7和m-钙激活蛋白酶共存于细胞黏附复合体中,Ca2+可通过TRPM7通道激活m-钙激活蛋白酶,使细胞黏附复合物解离从而抑制细胞黏附[12]。TRPM7 Ca2+通道参与人鼻咽癌细胞的侵袭转移。细胞外Ca2+螯合剂、TRPM7抑制剂均可抑制鼻咽癌细胞的迁移,而运用TRPM7 活化剂则促进细胞增殖[13]。在头颈部肿瘤细胞FaDu和FCC25内检测到Ca2+传感电流和TRPM7 通道,这种电流至少部分通过 TRPM7通道[14]。我们的膜片钳技术检测结果显示在TRPM7过表达的OC2细胞中TRPM7样电流激活,采用TRPM7通道抑制剂2-APB 阻断TRPM7通道后电流明显减弱,而采用TRPM7通道活化剂Bradykinin后,电流明显增强。
综上所述,TRPM7在口腔鳞癌细胞OC2中过表达,抑制TRPM7离子通道可抑制肿瘤细胞增殖和迁移,可能通过影响PI3K/AKT和MAPK/ERK信号转导途径以及阳离子内流发挥作用,靶向TRPM7离子通道可能为口腔鳞癌新的治疗途径。
[1] Yee NS, Kazi AA, Yee RK. Cellular and developmental biology of TRPM7 channel-kinase: Implicated roles in cancer[J]. Cells, 2014, 3(3): 751-777.
[2] Gautier M, Perrière M, Monet M, et al. Recent advances in oncogenic roles of the TRPM7 chanzyme[J]. Curr Med Chem, 2016, 23(36): 4092-4107.
[3] Qin Y, Liao ZW, Luo JY, et al.Functional characterization of TRPM7 in nasopharyngeal carcinoma and its knockdown effects on tumorigenesis[J]. Tumour Biol, 2016, 37(7): 9273-9283.
[4] Yee NS, Kazi AA, Li Q, et al. Aberrant over-expression of TRPM7 ion channels in pancreatic cancer: Required for cancer cell invasion and implicated in tumor growth and metastasis[J]. Biol Open, 2015, 4(4): 507-514
[5] Wang J, Liao QJ, Zhang Y, et al. TRPM7 is required for ovarian cancer cell growth, migration and invasion[J]. Biochem Biophys Res Commun, 2014, 454(4): 547-553
[6] Santoni G, Farfariello V, Amantini C. TRPV channels in tumor growth and progression[J]. Adv Exp Med Biol, 2011, 704: 947-967.
[7] Jin J, Wu LJ, Jun J, et al. The channel kinase, TRPM7, is required for early embryonic development[J]. Proc Natl Acad Sci USA, 2012, 109(5): E225-233.
[8] Chen JP, Wang J, Luan Y, et al.TRPM7 promotes the metastatic process in human nasopharyngeal carcinoma[J]. Cancer Lett, 2015, 356(2 Pt B): 483-490.
[9] Wang J, Liao QJ, Zhang Y, et al.TRPM7 is required for ovarian cancer cell growth, migration and invasion[J]. Biochem Biophys Res Commun, 2014, 454(4): 547-553.
[10]Liu M, Inoue K, Leng T, et al. TRPM7 channels regulate glioma stem cell through STAT3 and Notch signaling pathways[J]. Cell Signal, 2014, 26(12): 2773-2781.
[11]Prevarskaya N, Skryma R, Shuba Y. Calcium in tumour metastasis: New roles for known actors[J]. Nat Rev Cancer, 2011, 11(8): 609-618.
[12]Su LT, Agapito MA, Li M, et al. TRPM7 regulates cell adhesion by controlling the calcium-dependent protease calpain[J]. J Biol Chem, 2006, 281(16): 11260-11270.
[13]Chen JP, Luan Y, You CX, et al.TRPM7 regulates the migration of human nasopharyngeal carcinoma cell by mediating Ca(2+) influx[J]. Cell Calcium, 2010, 47(5): 425-432.
[14]Jiang J, Li MH, Inoue K, et al. TRPM7-like current in human head and neck carcinoma cells: Role in cell proliferation[J]. Cancer Res, 2007, 67(22): 10929-10938.
TheroleofTRPM7ionchannelintheproliferationandmigrationoforalsquamouscancercells
HANSheng1,CHENYan2.
1. 710032Xi'an,StateKeyLaboratoryofMilitaryStomatology&NationalClinicalResearchCenterforOralDiseases,DepartmentofInformationCenter,SchoolofStomatology,TheFourthMilitaryMedicalUniversity,China; 2.DepartmentofOncology,Xi'jingHospital,TheFourthMilitaryMedicalUniversity,Xi'an
Objective: To investigate the role of the transient receptor potential melastatin subfamily member 7(TRPM7) ion channel in the proliferation and migration of oral squamous cancer cells OC2.MethodsThe expression of TRPM7 in OC2 cells was examined by western blotting, RT-PCR and indirect immunofluorescence assay. The influence of TRPM7 on cell proliferation and migration under the inhibition of TRPM7 ion channel with 2-APB or siRNA TRPM7 in OC2 cells was examined by MTT and Transwell respectively. The influence of PI3K/AKT signal pathway on the expression of TRPM7 in OC2 cells was tested by Western blotting. The change of positive ion current when the OC2 cells were treated with TRPM7 inhibitor and activator was explored with patch clamp technique.ResultsTRPM7 overexpression in OC2 cells mainly in the cytoplasm was observed, siRNA TRPM7 downregulated the expression of TRPM7. Inhibition of TRPM7(2-APB or siRNA TRPM7) inhibited the growth and proliferation of OC2 cells in a time- and dose-dependent manner. Blockage of TRPM7 ion channel inhibited the migration capacity of OC2 cells. Inhibition of TRPM7 downregulated the expression of phosphorylated AKT and phosphorylated ERK. Patch clamp assay showed the activation of TRPM7-like current in OC2 cells. 2-APB could weaken this current while Bradykinin could enhance the current.ConclusionTRPM7 may regulate the proliferation and migration of oral cancer cells by the regulation of PI3K/AKT and MAPK/ERK signal pathways and cell positive current.
Oralsquamouscellcarcinoma;TRPM7;Cellproliferation;Migration
陕西省攻关项目资助(编号: 2013K12-03-01); 中华医学会吴阶平医学基金(编号: 320.6750.12235)
710032 西安, 军事口腔医学国家重点实验室, 口腔疾病国家临床医学研究中心, 第四军医大学口腔医院信息科(韩晟); 第四军医大学西京医院肿瘤科(陈衍)
陈衍 E-mail: chenyan@fmmu.edu.cn
R739.8
A
10.3969/j.issn.1001-3733.2017.04.022
(收稿: 2016-12-07 修回: 2017-01-04)
