书虱代谢抗性研究进展
2017-11-11景田兴魏丹丹王进军
景田兴 郎 宁 豆 威 魏丹丹 王进军
(西南大学植物保护学院;昆虫学与害虫控制工程重庆市重点实验室,重庆 400715)
书虱代谢抗性研究进展
景田兴 郎 宁 豆 威 魏丹丹 王进军
(西南大学植物保护学院;昆虫学与害虫控制工程重庆市重点实验室,重庆 400715)
书虱是一类在全球范围内均有分布的仓储害虫,对原粮特别是种子粮造成极大威胁,可造成严重经济损失。近年来,书虱抗药性问题日益突出,在其抗药性机制方面的研究也越来越深入。在诸多抗性机制中,代谢抗性占据了重要的地位。其中,三大代谢解毒酶细胞色素P450单加氧酶(P450)、酯酶(ESTs)和谷胱甘肽-S-转移酶(GSTs)在书虱代谢抗性中扮演重要角色。本文从生理生化、转录组学与分子生物学等方面,对书虱代谢抗性的研究进行阐述,为书虱的抗性防控提供借鉴。
书虱 代谢抗性 转录组 P450 酯酶 谷胱甘肽-S-转移酶
书虱隶属于啮虫目Psocoptera,书虱科Liposcelididae,书虱属Liposcelis,是一类广泛存在于多种储粮物中的微小害虫,在全球范围内均有分布。此类害虫喜温暖潮湿,喜食粮食胚部和破碎粒,由于其种群极易扩张而暴发成灾,对原粮特别是种子粮造成极大威胁,大量发生时可造成严重经济损失。近年来,书虱对包括有机磷类、烟碱类、菊酯类、生长调节剂类在内的多种类型的储粮保护剂产生了极强的忍耐力,并且多种复配药剂在书虱的长期防控中效果并不理想。昆虫抗药性机制大致分为代谢抗性、靶标抗性和行为抗性。大量研究表明与杀虫剂代谢相关的解毒酶的解毒能力增强是昆虫对杀虫剂产生抗性的的主要原因之一。目前对书虱的研究同样表明三大代谢解毒酶(P450s、 ESTs、 GSTs)在书虱代谢抗性中扮演重要角色。综述了书虱代谢抗性的研究进展,以期为书虱的抗性防控提供参考。
1 书虱药剂敏感性与增效作用测定
利用药膜法测定9种常用杀虫剂对嗜卷书虱的触杀毒力发现,有机磷杀虫剂类普遍对书虱有较好的防治效果,溴氰菊酯具有良好的击倒作用。5种有机磷类杀虫剂的触杀毒力由高到低依次为甲基对氧磷>毒死蜱>马拉硫磷>乙基对氧磷>氧乐果。在供试的2种氨基甲酸酯类杀虫剂中,涕灭威的触杀毒力显著高于残杀威,而拟除虫菊酯类杀虫剂的触杀毒力均显著低于其他供试杀虫剂,但具有较好的击倒作用。采用毒死蜱、对氧磷和丁硫克百威对嗜卷书虱和嗜虫书虱敏感品系毒力敏感性比较发现,嗜卷书虱对3种杀虫剂的LC50均显著高于嗜虫书虱,表明嗜虫书虱对有机磷和氨基甲酸酯类杀虫剂比嗜卷书虱更敏感[1-3]。在探究3种增效剂(DEF、TPP和DEM)在嗜卷书虱中的增效作用时发现,增效倍数较高的分别是DEF对毒死蜱和马拉硫磷(SR为7.50和5.90)以及TPP对涕灭威SR为6.75)的增效作用,而DEM的增效作用相对最小,仅对乙基对氧磷有相对较高的增效倍数(SR为2.97)。该结果暗示嗜卷书虱中羧酸酯酶(CarE)极有可能对涕灭威的代谢起着重要作用,而GSTs参与乙基对氧磷的代谢,但对其他杀虫剂的代谢贡献不大[4]。
对嗜虫书虱不同地理种群进行药剂(溴氰菊酯、马拉硫磷和残杀威)敏感性测定发现,随州种群对供试药剂相对敏感,而铜梁种群抗性水平相对较高(铜梁种群对马拉硫磷和残杀威的LC50分别是随州种群的7.30和7.59倍,但2个地理种群对溴氰菊酯的敏感性无显著性差异)。这表明,书虱不同地理种群由于用药背景存在差异,其对同种药剂的耐受性有很大的不同。在此基础上,添加增效剂PBO后,结果显示溴氰菊酯和马拉硫磷对敏感种群(随州种群)的毒杀作用增强,增效比分别为2.2、2.45,但PBO对残杀威无增效作用。添加PBO后,溴氰菊酯、马拉硫磷和残杀威对抗性种群(铜梁种群)均出现毒杀作用增强,其增效比分别为2.35、2.60、2.39。这均表明P450能够对3种药剂的代谢起重要作用,但P450在敏感种群中对残杀威的代谢作用较小[5]。
2 书虱细胞色素P450研究进展
昆虫对杀虫剂的抗性与P450活性的升高有关。如棉铃虫(Helicoverpaarmigera)抗辛硫磷品系P450的活性是敏感品系的2.3倍[6]。嗜虫书虱敏感种群和抗性种群的P450活性测定结果显示,抗性种群P450的比活力是敏感种群的1.93倍。经溴氰菊酯和马拉硫磷胁迫后,P450活性均呈现不同程度增高。马拉硫磷处理后,P450的活性是对照的2.97倍,且差异显著;溴氰菊酯处理后的P450活性是对照的2.35倍。药剂诱导后P450酶活的升高可能是虫体受到药剂刺激而出现的应激反应,从蛋白质水平说明药剂的刺激与P450活性之间存在一定联系。
在对酶学的特异性研究中,蛋白的异源表达技术应用广泛。利用原核表达系统,采用pDest表达载体对嗜卷书虱CYP6CE1进行异源表达,经SDS-PAGE电泳和免疫印迹验证后确定成功获得CYP6CE1重组蛋白。采用3种不同的表达载体(pDest17、pET43和pCW载体)对另外3个P450基因(CYP4CB1、CYP4CC1和CYP4CD1)都成功进行了表达载体的构建,这为将来P450基因的原核表达奠定了基础[7]。对嗜虫书虱P450的异源表达尝试以昆虫sf9细胞为宿主的Bac-to-Bac真核表达系统,成功构建了CYP4FD2基因的表达载体,为嗜虫书虱P450真核表达做好了前期准备工作。
P450基因作为生物体内的一种重要的初级代谢酶,其mRNA水平上的过量表达是大多数昆虫对杀虫剂产生抗药性的主要机制之一。目前,在嗜卷书虱中克隆出5个P450全长基因(表1)。通过低剂量(LC10)长时间和较高剂量(LC50)短时间2种诱导体系对嗜卷书虱进行药剂处理,利用qPCR技术分析发现,溴氰菊酯及甲基对氧磷可显著诱导CYP6CE1、CYP6CE2、CYP4CB1及CYP4CC1的上调表达,而涕灭威仅能显著诱导CYP4CD1的上调表达。分析5个P450对3种不同药剂诱导反应的时间效应发现,甲基对氧磷的诱导作用较溴氰菊酯及涕灭威更加迅速,而溴氰菊酯诱导后P450基因表达量回落则更快。表明P450基因对有机磷杀虫剂的诱导反应更迅速,但在体内的代谢速率可能较慢,对拟除虫菊酯类杀虫剂的诱导反应略显迟缓,但代谢速率更高[8]。另外,在解析5个P450基因在嗜卷书虱DDVP和PH3抗性、敏感品系种的表达模式发现,除了CYP4CC1外,其他4个P450基因在抗性品系存在不同程度的过量表达,这也暗示这4个P450基因极有可能共同参与嗜卷书虱抗性的形成[7]。
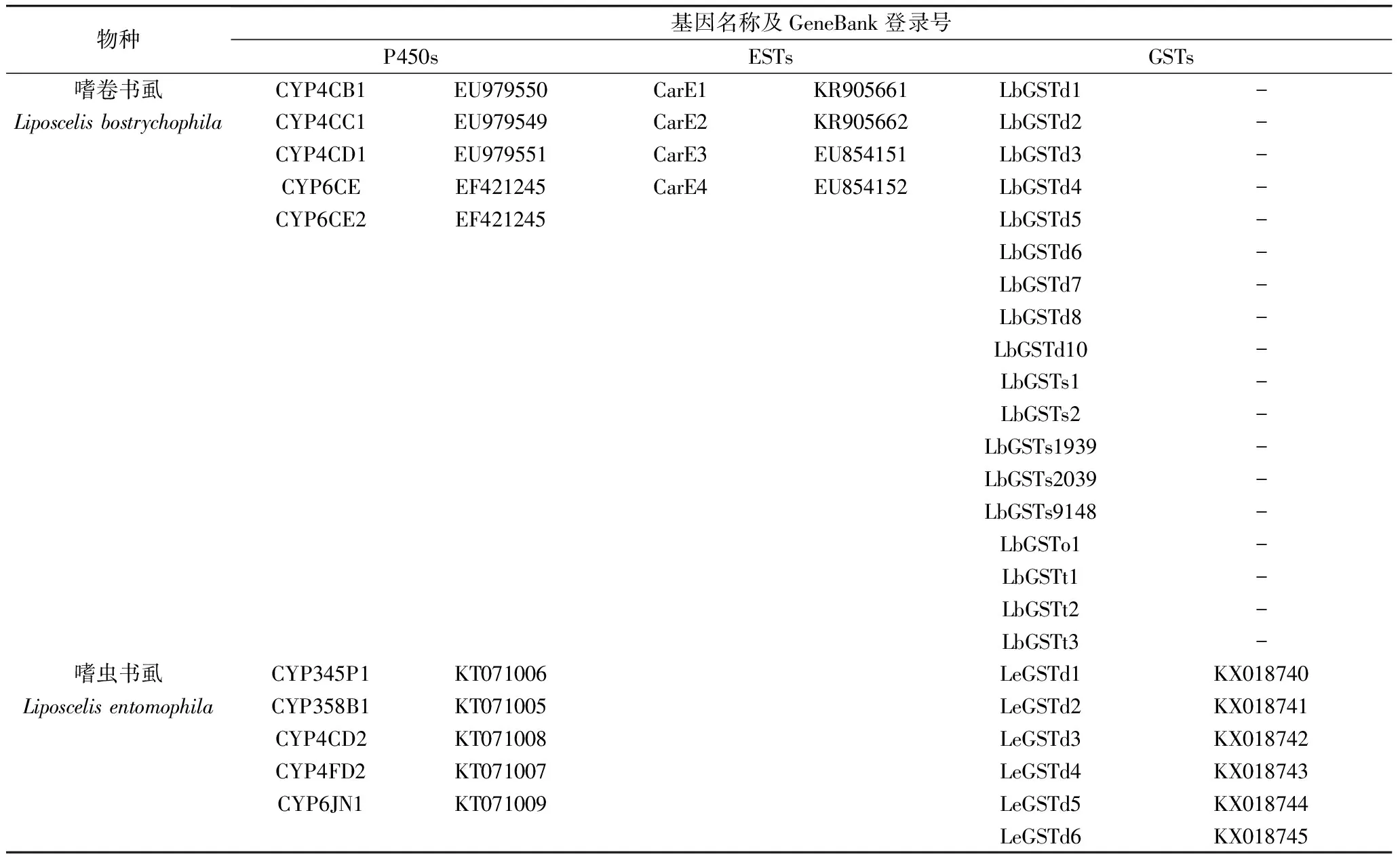
表1 书虱中已获得完整开放阅读框的三大代谢酶基因名称与登录号
注:“-”表示暂未获得GenBank登录号。
基于嗜虫书虱转录组数据库,通过对cDNA全长序列的克隆和测序验证,获得5个嗜虫书虱P450基因(CYP358B1、CYP345P1、CYP4FD2、CYP4CD2和CYP6JN1)(表1)。利用qPCR技术检测5个P450在敏感和抗性种群中的表达量发现,5个基因在抗性种群的表达量均显著高于其在敏感种群的表达量。其中,CYP4CD2与CYP6JN1在抗性种群的表达量分别是其在敏感种群中的8倍和10倍以上,这表明P450在嗜虫书虱的抗性形成中具有重要作用,且CYP4CD2与CYP6JN1是其中发挥重要作用的基因。此外,5个P450基因对药剂胁迫的响应模式表明,嗜虫书虱P450基因对马拉硫磷胁迫响应最为明显,经药剂诱导后,5个P450基因在12 h达到表达高峰,其中CYP4CD2和CYP6JN1诱导表达上调幅度较大,分别为对照的9.77和9.47倍。该结果也暗示了P450基因对有机磷类杀虫剂反应迅速且剧烈。嗜虫书虱多数P450基因可被溴氰菊酯诱导上调,其表现出的诱导效应相对滞后,表达高峰多出现在药剂处理24 h后。而在残杀威诱导后,仅CYP4CD2出现显著性上调,大多数基因无显著性变化[5]。这说明P450在嗜虫书虱的抗性形成中扮演重要角色,能够参与有机磷与菊酯类药剂的代谢,且2个P450(CYP4CD2与CYP6JN1)基因起到重要作用,但P450对氨基甲酸酯类药剂的代谢作用较小。
3 书虱酯酶研究进展
羧酸酯酶是昆虫体内的重要解毒酶,其活力增强是昆虫对有机磷和氨基甲酸酯类杀虫剂产生抗性的重要机制[9-10]。对嗜卷书虱和嗜虫书虱羧酸酯酶活性及其动力学特性的比较研究发现,嗜虫书虱羧酸酯酶活性显著高于嗜卷书虱,暗示嗜虫书虱的酯酶对外源化合物的降解作用大于嗜卷书虱。通过对酯酶同工酶电泳,从嗜卷书虱和嗜虫书虱体内分别检测出8条和7条同工酶谱带,同时前者的酶谱分布比后者广。PAGE分析显示,4种杀虫剂离体条件下对2种书虱酯酶同工酶的抑制能力存在显著差异,其中敌敌畏的抑制力最强[1]。该结果说明2种书虱酯酶的代谢能力存在差异,很可能是由于这种差异造成了2种书虱对药剂敏感性的不同。
基于嗜卷书虱转录组数据,共筛选出4个羧酸酯酶基因(CarE1、CarE2、CarE3、CarE4)(表1),与其他昆虫的10个酯酶基因进行多重序列比对发现,不同昆虫CarEs之间存在保守性相对较高的区域。4条CarE基因编码的氨基酸序列均含有CarE的保守基序。除CarE3外,其他3个CarEs存在内质网信号肽。对嗜卷书虱进行药剂(涕灭威、高效氯氰菊酯、马拉硫磷)诱导后发现,涕灭威能够诱导CarE2与CarE3 2个基因的上调表达,且达到对照的2倍以上,但CarE1与CarE4均出现显著性下调。马拉硫磷诱导后,4个酯酶基因均出现下调,这与有机磷类对书虱触杀毒力最强的结果相一致,可能是酯酶基因的表达量下降导致了书虱对有机磷杀虫剂的较高敏感性。经高效氯氰菊酯诱导后,4个酯酶基因则全部出现上调,暗示菊酯类农药毒杀作用较低,可能是由于酯酶基因的迅速上调表达而导致,说明酯酶在书虱代谢菊酯类农药具有一定的作用。
4 书虱谷胱甘肽-S-转移酶研究进展
采用Glutathione Sepharose 4B亲和层析法纯化了嗜卷书虱3个品系(SS,敏感品系;DDVP-R,敌敌畏抗性品系;PH3-R,磷化氢抗性品系)的GSTs,3个品系GSTs的纯化倍数在62~91倍之间。利用微量滴度酶标板法分析纯化后的GSTs的生化特性发现,与SS品系相比,DDVP-R和PH3-R品系的GSTs活性显著提高。动力学比较发现,以GSH为底物时,两抗性品系Km值较低,说明DDVP和PH3的胁迫造成GSTs对内源性化合物GSH获得了较高的亲和能力;就Vmax而言,两抗性品系的Vmax的值均高于敏感品系,证实其催化能力较强[11]。此外,杀虫剂对嗜卷书虱3个品系GSTs的离体作用研究表明,丁硫克百威的抑制作用明显,其中PH3-R品系对丁硫克百威的抑制作用敏感度低,抑制中浓度I50分别为SS和DDVP-R品系的3.9和4.7倍[12]。此外,利尿酸、姜黄素和四溴磺酚钠对嗜卷书虱纯化后的GSTs均有显著的离体抑制作用。
基于嗜卷书虱转录组数据库,共克隆获得了18条嗜卷书虱GSTs cDNA全长序列(表1),其中有10个GSTs基因属于Delta家族,3个属于Theta家族,2个属于Sigma家族,1个属于Omega家族,2个属于microsomal家族,其碱基序列长度在459~774 bp之间,氨基酸序列长度在153~248 aa之间。解析14个GST基因在嗜卷书虱各发育阶段的表达模式,可以明确各GSTs基因成员参与的生理功能。定量分析结果表明,大多数GSTs基因在1龄若虫和成虫阶段mRNA表达水平最高,可能同嗜卷书虱此时大量取食以及接触外源化合物的机会相对较多有关。
GSTs是一种重要的次级代谢酶,其中Delta和Epsilon是昆虫特有的2个家族,并在昆虫抗药性的形成中起到重要作用。根据嗜虫书虱转录组数据,我们鉴定到嗜虫书虱15个GST Delta家族基因,其数目远远大于人类体虱(Pediculushumanus)Delta家族的数目(4条),Delta家族GSTs数量的差异很可能是导致书虱与人类体虱在抵抗外界胁迫能力上的重要原因之一。在嗜虫书虱15个Delta GSTs中,共获得6条Delta家族GST ORF的cDNA序列(表1)。核苷酸序列长度范围为639~654 bp,编码氨基酸序列长度范围为213~218 aa。对嗜虫书虱进行马拉硫磷、残杀威与高效溴氰菊酯3种杀虫剂亚致死剂量诱导后发现,15个Delta GSTs对药剂的响应有所不同。马拉硫磷与残杀威诱导后均有6个基因出现显著性上调;高效溴氰菊酯诱导后仅4个基因出现显著性上调。在药剂诱导后,也可发现某些Delta GSTs出现显著性下调,其中高效溴氰菊酯诱导后,有6个基因均出现下调,且这6个GSTs中有5个基因在药剂刺激后连续36 h出现显著性下调现象。基因的表达在一定程度上遵循能量守恒,通过降低一些次要基因的表达来满足关键基因表达所需要的物质和能量。另外,在对嗜虫书虱不同地理种群的Delta GST表达量进行检测时发现,对马拉硫磷和残杀威敏感性低的抗性种群中有9个GSTs基因表达量显著高于其他种群,但抗性种群对菊酯类杀虫剂的敏感性(LC50)与其他种群并不存在差异,这说明过量表达的Delta GST并未使得书虱对菊酯类杀虫剂敏感性降低。这表明Delta家族GSTs可能参与了有机磷和氨基甲酸酯类杀虫剂的代谢,但在菊酯类农药的代谢中作用较小[13]。
5 书虱转录组学研究
昆虫转录组学研究已经成为昆虫基因组研究领域中最活跃的领域之一。基于第二代高通量测序技术,目前已建立了嗜卷书虱、嗜虫书虱以及三色书虱转录组总库,将Unigene提交至Nr、Swiss-Prot、KEGG、COG、GO数据库进行BLASTX比对,并针对3种书虱抗药性相关的三大解毒代谢酶基因分别进行鉴定。经人工校正剔除不能正确翻译、与非昆虫高度同源以及序列长度较短的序列(< 800 bp)后,在嗜卷书虱、嗜虫书虱和三色书虱中分别获得49、68和94个P450s基因;剔除短序列(< 300 bp)后,在嗜卷书虱、嗜虫书虱和三色书虱中分别获得31、37和35个GSTs基因;剔除短序列(< 1 000 bp)后,在嗜卷书虱、嗜虫书虱和三色书虱中分别获得55、19和34个ESTs基因[14-15]。在昆虫中,三大代谢酶基因的数目能够在一定程度上反应昆虫抗逆性与适应性的强弱。目前,发现P450s数目最少的为寄生性昆虫人类体虱(Pediculushumanus,37条),最多的为淡色库蚊(Culexpipiens,180条);发现GSTs数目最少的为西方蜜蜂(Apismellifera,10条),最多的为黑腹果蝇(Drosophilamelanogaster,38条);报道中ESTs数目最少的为西方蜜蜂(24条),最多的为冈比亚按蚊(Anophelesgambiae, 51条)[16-18]。可见,3种书虱代谢酶基因的数目在已报道昆虫代谢酶数目的范围内,而嗜卷书虱的酯酶家族基因的数目远超过其他昆虫。同时,可以发现代谢酶基因数目较少的体虱和蜜蜂均为对杀虫剂等异源刺激较为敏感的昆虫,而代谢酶基因数目较多的多为生存环境较恶劣,对环境适应性强的昆虫。该发现可能意味着在嗜卷书虱中较多的酯酶基因在其抵抗外界胁迫,甚至抗性的发生发展中起到较为重要的作用。对抗药性相关基因的挖掘和鉴定不仅为后续其功能的研究提供了基础数据,也为书虱杀虫剂新靶标的开发以及药剂代谢分子机理的研究提供参考。
6 小结与展望
从生理生化、转录组学和分子生物学3个角度综述了三大解毒代谢酶在书虱中的研究进展。三大代谢解毒酶在书虱的药剂代谢甚至抗药性的形成和发展中起到重要的作用。代谢解毒酶在抗性种群中具有较高的酶活性,且在转录水平具有更高的表达量。经不同药剂进行诱导后,书虱体内大部分代谢酶基因出现上调表达,其中有机磷和氨基甲酸酯类杀虫剂对P450s、ESTs和GSTs基因的诱导作用较为明显。菊酯类杀虫剂诱导后,大部分P450和酯酶基因出现上调,但在嗜虫书虱中,溴氰菊酯诱导后超过半数的GST Delta家族基因出现了显著性下调。此外,增效剂试验也发现PBO和TPP对有机磷和氨基甲酸酯类杀虫剂增效作用明显,而DEM在书虱中对菊酯类杀虫剂的增效作用不明显。总之,P450s与酯酶参与了有机磷和氨基甲酸酯类杀虫剂的代谢,但GSTs较少的参与菊酯类杀虫剂的代谢。
书虱随着虫体发育,代谢解毒酶基因在高龄若虫和成虫期出现显著性高表达,且该类基因在雌虫中的表达量远远高于雄虫。三大代谢解毒酶基因在书虱卵期和低龄若虫期的表达远低于高龄若虫和成虫,且低龄若虫对药剂具有更高的敏感性,这意味着对书虱的防控可以重点着手于卵期和低龄若虫期。目前书虱解毒代谢酶的研究仍比较落后,且已有的基因功能研究多停留在mRNA水平,后续研究应利用异源表达和RNAi技术,进一步明确不同代谢酶基因在书虱抗性形成中的贡献大小、作用及功能。
[1]程伟霞, 王进军, 王梓英, 等. 嗜卷书虱和嗜虫书虱酯酶性质的比较研究[J]. 农药学学报, 2002, 4: 61-66
Cheng W X, Wang J J, Wang Z Y, et al. Comparison of the activity of Carboxylesterase and Acetylcholinesterase inLiposcelisbostrychophilaandL.entomophila[J]. Chinese Journal of Pesticide Science, 2002, 4: 61-66
[2]Ahmedani M S, Shagufta N, Aslam M, et al. Psocid: A new risk for global food security and safety [J]. Applied Entomology and Zoology, 2010, 45: 89-100
[3]Nayak M K, Collins P J, Throne J E, et al. Biology and management of psocids infesting stored products [J]. Annual Review of Entomology, 2014, 59: 279-297
[4]周安韦. 嗜卷书虱羧酸酯酶生化毒理学特性及其mRNA表达水平研究[D]. 重庆: 西南大学, 2010
Zhou A W. biochemical and toxicological characteristics and mRNA expression of carboxylesterase fromLiposcelisbostrychophilaBadonnel [D]. Chongqing: Southwest University, 2010
[5]Li T, Liu Y, Wei D D, et al. Characterization and expression profiles of five possible cytochrome p450 genes fromLiposcelisentomophila(Enderlein) (psocoptera:Liposcelididae) [J]. Archives of Insect Biochemistry and Physiology, 2016, 92: 259-273
[6]Feng T, Yue Y, Hua R. The relationships among MFO, Glutathione S-Transferases, and Phoxim resistance inHelicoverpaarmigera[J]. Pesticide Biochemistry and Physiology, 2000, 68: 96-101
[7]蒋红波. 嗜卷书虱P450基因的分子生物学特性及其异源表达研究[D]. 重庆: 西南大学, 2010
Jiang H B. Molecular characterizations and heterogous expression of P450 genes in the psocid,LiposcelisbostrychophilaBadonnel (psocoptera: Liposcelididae) [D]. Chongqing: Southwest University, 2010
[8]Jiang H B, Tang P A, Xu Y Q, et al. Molecular characterization of two novel deltamethrin-inducible P450 genes fromLiposcelisbostrychophilaBadonnel (Psocoptera:Liposcelididae) [J]. Archives of Insect Biochemistry and Physiology, 2010, 74: 17-37
[9]张文吉, 张友军, 韩熹莱. 棉铃虫不同龄期幼虫羧酸酯酶,谷胱甘肽转移酶,乙酰胆碱酯酶研究[J]. 植物保护学报, 1996, 23: 157-162
Zhang W J, Zhang Y J, Han X L. studies on the carboxylesterase glutathione-s-transferase and Acetylcholinesterase in different ages ofHelicoverpaarmigeralarva [J]. ACYA Phytophycica Sinica, 1996, 23: 157-162
[10]韩启发, 庄佩君, 唐振华. 抗杀螟硫磷二化螟的抗性遗传力研究[J]. 昆虫学报, 1995, 38: 402-406
Han Q F, Zhuang P J, Tang Z H. Estimation of realized heritability of resistance to fenitrothion in the rice stem borerchilosuppessalis[J]. ACTA Entomologica Sinica, 1995, 38: 402-406
[11]Dou W, Wang J J, Zhao Z M. Toxicological and biochemical characterizations of GSTs inLiposcelisbostrychophilaBadonnel (Psocop., Liposcelididae) [J]. Journal of Applied Entomology, 2006, 130: 251-256
[12]Dou W, Wu S, Hassan M W, et al. Purification and biochemical characterization of glutathione S-transferases from three strains ofLiposcelisbostrychophilaBadonnel (Psocoptera: Liposcelididae): implication of insecticide resistance [J]. Pesticide Biochemistry and Physiology, 2009, 94:10-14
[13]Jing T X, Wu Y X, Li T, et al. Identification and expression profiles of fifteen delta-class glutathione S-transferase genes from a stored-product pest,Liposcelisentomophila(Enderlein) (Psocoptera: Liposcelididae) [J]. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2017, 206: 35-41
[14]Dou W, Shen G M, Niu J Z, et al. Mining genes involved in insecticide resistance ofLiposcelisbostrychophilaBadonnel by transcriptome and expression profile analysis[J]. PLoS ONE, 2013, 8: e79878
[15]Wei D D, Chen E H, Ding T B, et al. De novo assembly, gene annotation, and marker discovery in stored-product pestLiposcelisentomophila(Enderlein) using transcriptome sequences [J]. PLoS ONE, 2013, 8: e80046
[16]Claudianos C, Ranson H, Johnson R M, et al. A deficit of detoxification enzymes: pesticide sensitivity and environmental response in the honeybee[J]. Insect Molecular Biology,2006, 15: 615-636
[17]Low W Y, Ng H L, Morton C J, et al. Molecular evolution of Glutathione S-Transferases in the genusDrosophila[J]. Genetics, 2007, 177: 1363-1375
[18]Feyereisen R, Arthropod C Y. Pomes illustrate the tempo and mode in P450 evolution [J]. Biochimica Et Biophysica Acta, 2011, 1814: 19-28.
Advances in Metabolic Resistance to Insecticides in Psocids (Psocoptera: Liposcelididae)
Jing Tianxing Lang Ning Dou Wei Wei Dandan Wang Jinjun
(Key Laboratory of Entomology and Pest Control Engineering; College of Plant Protection, Southwest University, Chongqing 400715)
The psocids, of the genusLiposcelisare kinds of worldwide stored-product insects. Outbreaks can lead to significant economic losses, especially to the unprocessed food grains and seeds. Recently, apparent insecticides resistances have been observed in psocids and numerous studies focusing on this resistance problem have been done and a series of papers about the mechanisms of resistance in psocids have been published. Resistant mechanisms mainly involve in metabolic resistance induced by increases in the metabolic capabilities of detoxificative enzymes, and target site resistance by decreases in target site sensitivity. This review mainly focused on mechanisms of metabolic resistance associated with the three major enzymes, Cytochrome P450 monooxygenases (P450s), Estrases (ESTs), and Gluthione-S-transferases (GSTs) in psocids. Based on the researches on biochemical and toxicological characterizations, transcriptomics, and molecular biology of P450s, ESTs and GSTs genes inLiposcelisspecies, this study could provide a foundation for developing psocids management strategies.
psocids, metabolic resistance, transcriptome, P450, ESTs, gluthione-S-transferases
S379.5
A
1003-0174(2017)10-0191-06
国家自然科学基金(31301667),重庆市基础与前沿研究计划(cstc2015jcyjA80009)
2017-04-30
景田兴,男,1992年出生,博士,农业昆虫与害虫防治
王进军,男,1970年出生,教授,昆虫分子生态与分子毒理学
