芒果核多酚纯化物成分分析及其抗氧化研究
2017-11-10康超李燕段振华罗杨合帅良伍淑婕
康超,李燕,段振华,罗杨合,帅良,伍淑婕,*
(1.贺州学院食品科学与工程技术研究院,广西贺州542899;2.贺州学院食品与生物工程学院,广西贺州542899)
芒果核多酚纯化物成分分析及其抗氧化研究
康超1,2,李燕1,2,段振华1,2,罗杨合1,2,帅良1,2,伍淑婕1,2,*
(1.贺州学院食品科学与工程技术研究院,广西贺州542899;2.贺州学院食品与生物工程学院,广西贺州542899)
采用30%、50%、70%、90%的乙醇回流提取芒果核多酚物质,把提取液浓缩浸膏,依次采用硅胶柱层析法、薄层色谱跟踪检测、红外光谱、核磁共振等方法进行检测分析。结果表明,30%和50%乙醇纯化物中主要成分是鞣酸,70%乙醇纯化物是鞣花酸,90%乙醇纯化物是蓖麻油酸,进一步的纯化单体分别为芥酸以及油酸甘油酯;抗氧化活性试验表明,芒果核多酚及其纯化物对羟基自由基(·OH)、DPPH自由基(DPPH·)清除作用明显,说明芒果核多酚具有很好的抗氧化活性,为芒果核的综合开发利用提供重要依据。
芒果核;多酚纯化物;成分分析;抗氧化活性
芒果中化学成分种类繁多[1-2],主要以多酚物质为主,没食子酸、香豆素、芒果苷、香草醛、单宁等,并且90%的多酚存在于占芒果总重20%~60%的芒果核中,国外针对果核活性成分做了较多研究,发现芒果核中的酚类物质具有很高的研究价值[3-9]。由于芒果核多酚粗提物中含多种成分,要弄清其化学组成和主要功效成分,必须对粗提物进行分离纯化。目前,分离纯化多酚类化合物的方法主要有大孔树脂吸附法、柱层析法等。大孔吸附树脂具有吸附容量大,吸附速度快、选择性好、再生处理方便等优点,被广泛用于天然产物的初步分离纯化。柱层析法工艺简单,常用于从多组分中分离出单组分。特别是采用硅胶等柱层析被证明是能有效的分离简单酚类及某些多酚低聚体等。因此,本研究对大孔树脂分离纯化芒果核多酚的工艺进行了前期探讨,在此基础上采用硅胶柱层析对所得纯化物进一步分离,并利用高效液相色谱法、红外光谱和核磁共振等技术进行分析,为了解芒果核多酚物质的结构和构效关系奠定基础。
1 材料与方法
1.1 材料
芒果果核:由广西合浦果香园食品有限公司提供,于60℃恒温烘干并粉碎后,贮于干燥避光处备用。
1.2 试剂和仪器
无水碳酸钠、甲醇、乙醇、正丁醇、丙酮、乙酸乙酯、福林酚试剂、二氯甲烷、三氯甲烷、石油醚、环己烷、甲酸、冰醋酸、硫酸、碘、AB-8大孔吸附树脂、硅胶(100目~200目)、硅胶(200目~300目)、没食子酸标准品等:柳州苏利有限责任公司。万能粉碎机、电热恒温干燥箱(DHG-9145A):上海齐欣科学仪器有限公司;电子天平(BSA124S):赛多利斯科学仪器(北京)有限公司;分光光度计(UV1901PC):上海奥析科学仪器有限公司;旋转蒸发仪(RE311A-W,Yamato)、低温冷却液循环泵(DLSB-5L/20):郑州长城科工贸有限公司;暗箱三用紫外分析仪(ZF-7):上海嘉鹏科技有限公司;玻璃仪器气流烘干器(C型):河南省予华仪器有限公司;高效液相色谱仪(Flexar LC-chromera):Perkin Elmer,Inc.;冷冻干燥机(FD-3):北京博医康实验仪器有限公司等。
1.3 方法
1.3.1 芒果核多酚分离纯化工艺路线
大孔树脂预处理→多酚粗提物浓缩液过滤后上大孔树脂柱→水洗脱糖、蛋白质等大分子化合物→30%、50%、70%、90%乙醇溶液洗脱→收集洗脱液→真空浓缩→冷冻干燥,得多酚初步纯化物→少量乙醇溶解→上硅胶柱→分别用氯仿∶丙酮∶甲酸=95∶4∶1、氯仿∶丙酮∶甲酸=94∶5 ∶1、氯仿 ∶丙酮 ∶甲酸=93 ∶6∶1、氯仿 ∶丙酮 ∶甲酸=92 ∶7 ∶1、氯仿 ∶丙酮 ∶甲酸=90∶9 ∶1(体积比)洗脱,收集洗脱液→真空浓缩→冷冻干燥
1.3.2 大孔树脂的处理、再生、上样、洗脱
方法参考文献[10]。
1.3.3 芒果核多酚初步纯化物的薄层层析及硅胶分离
1.3.4 芒果核多酚的红外光谱及核磁共振分析分析
红外光谱分析:将待测样品及KBr烘至绝干,取1 mg待测样品,加入100 mg KBr混匀,在红外灯照射下研磨、压片。傅里叶红外光谱先对纯KBr薄片进行背景扫描,再对含有样品的KBr薄片进行扫描,得到红外光谱图。
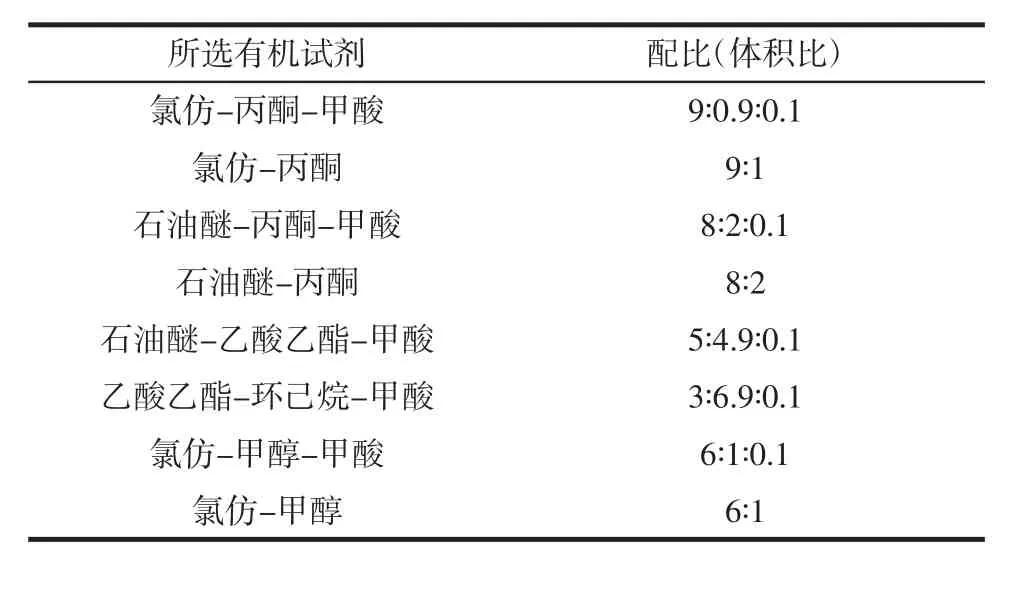
表1 不同的TLC展开体系Table 1 Different expansion system
芒果核多酚的MS分析:电喷雾(ESI)离子化源,质量扫描范围:50~650,干燥气流:8 L/min,干燥器温度:350℃,喷雾器压力:30 Pa氢核磁共振(1H-NMR)分析:以D2O作为溶剂溶解样品,浓度约为10 mg/mL,记录化合物的1H-NMR谱图。
1.3.5 抗氧化活性的测定
清除羟基自由基能力测定、清除超氧阴离子自由基能力测定、清除DPPH自由基能力测定等参考文献[12]。
2 结果与分析
2.1 不同组分芒果核多酚的红外图谱分析
30%乙醇纯化物的傅立叶变换红外光谱如图1所示,50%乙醇纯化物的傅立叶变换红外光谱如图2所示。
两者主要吸收峰[IR(KBr)]/cm-1:1 711~1713,1 612~1 615,1 525~1 533,1 447,1 316~1 318,1 198~1 202,872,760~780,703,685~690。其中 1 711~1 733 和1 447 cm-1是鞣酸的特征峰,1 713 cm-1这是由于分子中C=O伸缩振动引起的,1 447 cm-1附近的吸收峰是由于C-H弯曲振动引起。1 612 cm-1、1 615 cm-1附近的吸收峰是由于C=C伸缩引起,1 525 cm-1、1 533 cm-1附近的吸收峰是由于C=C骨架振动引起,1 316 cm-1、1 318 cm-1附近的吸收峰归因于C-O伸缩引起。1 000 cm-1~650 cm-1之间出现的吸收峰是因为C-H面外弯曲振动,在谱图中703 cm-1、780 cm-1出现吸收峰可以判断是苯环邻二取代,769 cm-1~659 cm-1出现的吸收峰是O-H面外弯曲引起的。50%乙醇纯化物的红外光谱峰重合性较好,主要吸收峰与鞣酸基本符合。30%、50%乙醇纯化物的红外光谱峰重合性较好,主要吸收峰与鞣酸基本符合。
70%乙醇纯化物的傅立叶变换红外光谱如图3所示。
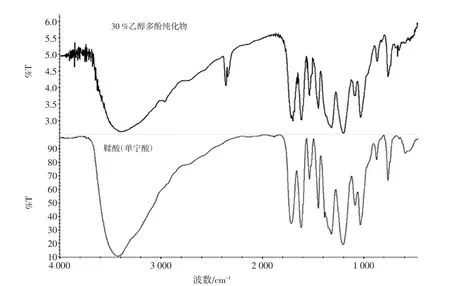
图1 30%乙醇多酚纯化物的红外测试图Fig.1 Infrared measurement of 30%ethanol purification
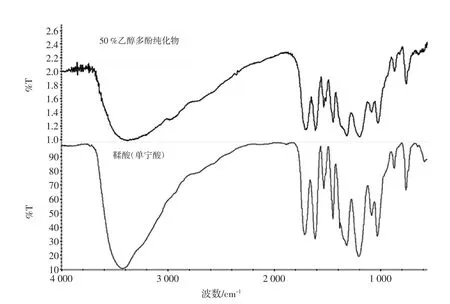
图2 50%乙醇多酚纯化物的红外测试图Fig.2 Infrared measurement of 50%ethanol purification
主要吸收峰[IR(KBr)]/cm-1:2 955,2 925,1 699,1618,1583,1512,1451,1397,1340,1259,1196,1112,1 056,924,883,756。其中 2 955 cm-1和 2 925 cm-1是由于C-H伸缩振动引起,1 699 cm-1附近的吸收峰是为C=O 的伸缩振动引起的;1 618、1 583、1 512、1 451 cm-1是苯环上的C=C伸缩振动峰,924 cm-1、883 cm-1及756 cm-1出现的吸收峰是C-H面外弯曲振动引起的,且756 cm-1是判断为苯环邻二取代的重要峰值。70%乙醇纯化物与鞣花酸的红外图谱峰重合性较好,各个峰波数大致相同。
90%乙醇纯化物的傅立叶变换红外光谱如图4所示。
与癌组织NF-κB阴性表达患者比较,癌组织NF-κB阳性表达患者中T2、T3、N2和N3患者比例均升高,差异有统计学意义(P<0.05),见表2。与癌组织HMGB1阴性表达患者比较,癌组织HMGB1阳性表达患者中T2、T3、N2和N3患者比例亦均升高,差异有统计学意义(P<0.05),见表3。
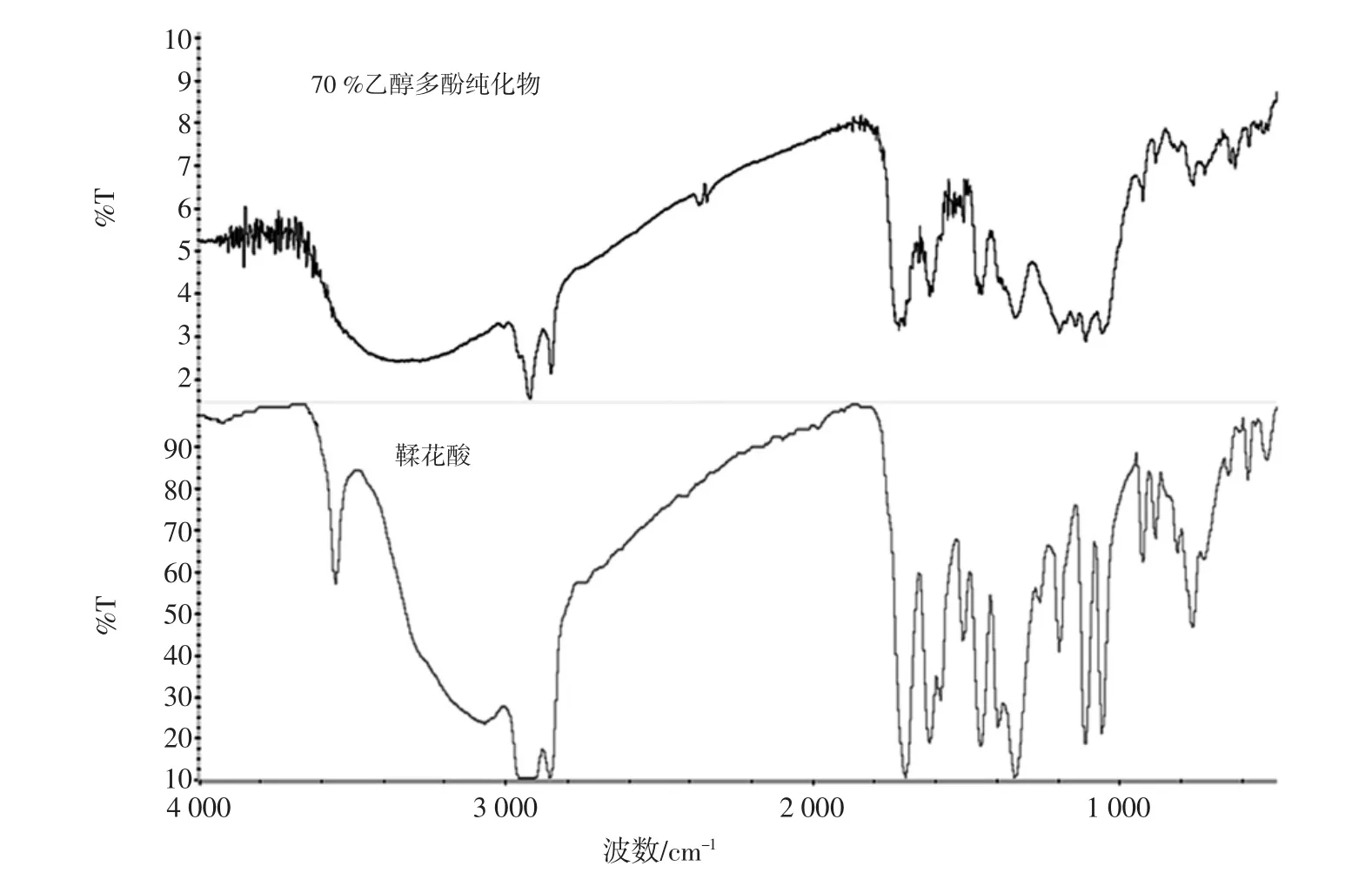
图3 70%乙醇多酚纯化物的红外测试图Fig.3 Infrared measurement of 70%ethanol purification
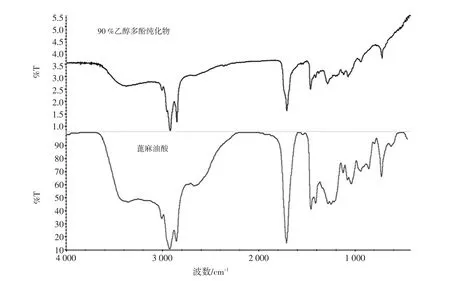
图4 90%乙醇多酚纯化物的红外测试图Fig.4 Infrared measurement of 90%ethanol purification
主要吸收峰[IR(KBr)]/cm-1:3 406,3 011,2 928,2 856,1 711,1 448,1 378,1 281,1 247,1 123,1 082,1 037,946,726。其中3 406 cm-1出现吸收峰是由于OH伸缩振动引起的;3 011 cm-1处出现吸收峰是由于烯烃中C-H伸缩振动引起的;2 928 cm-1和2 856 cm-1处出现吸收峰是由于C-H伸缩振动,且为-CH2-基团;1 711 cm-1处的吸收峰是因为C=O伸缩引起;1 448 cm-1和1 378 cm-1两处的吸收峰是C-H弯曲振动引起;1 281 cm-1、1 247 cm-1及 1 123 cm-1三处峰值受到C-H面内弯曲振动影响,1 082 cm-1和1 037 cm-1的峰是因为C-O伸缩振动引起;946 cm-1和726 cm-1处出现吸收峰是由于C-H面外弯曲振动引起,共同形成双键。90%乙醇纯化物与蓖麻油酸的红外图谱峰重合性较好,主要特征峰波数大致相同。
2.2 层析纯化合物的红外图谱分析
层析纯化合物1(K1,90%醇纯化物分离出的化合物1)的傅立叶变换红外光谱如图5所示。
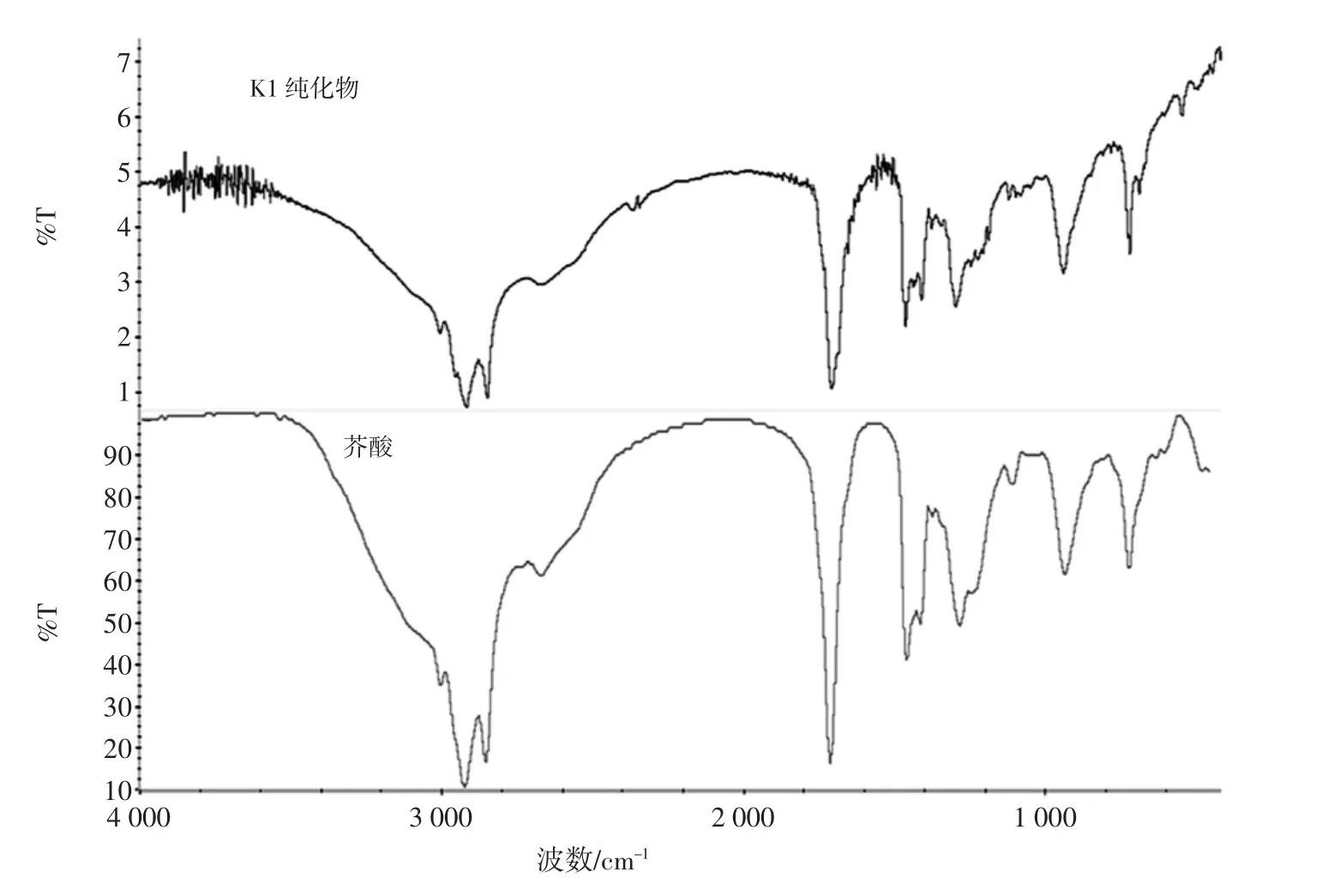
图5 K1的红外测试图Fig.5 Infrared measurement of K1
出现主要吸收峰[IR(KBr)]cm-1:3 007,2 953,2 920,2 852,1 713,1 468,1 409,1 386,1 376,1 296,941,720。其中3 007 cm-1处出现吸收峰是由于烯烃中C-H伸缩振动引起的;2 953 cm-1、2 852 cm-1及 2 920 cm-1处出现吸收峰是由于饱和碳上的C-H伸缩振动引起的,且为-C=C-H;1 713 cm-1处的吸收峰是因为C=O伸缩引起;1 468 cm-1和1 409 cm-1处出现吸收峰是由于CH弯曲振动引起,且为-CH3;1 386 cm-1和1 376 cm-1两处出现吸收峰的话即为-C(CH2)2;941cm-1和720cm-1处出现吸收峰是由于C-H面外弯曲振动引起,共同形成双键。K1与芥酸的红外图谱峰重合性较好,主要特征峰波数大致相同。
层析纯化合物2(K2,90%醇纯化物分离出的化合物2)的傅立叶变换红外光谱如图6所示。
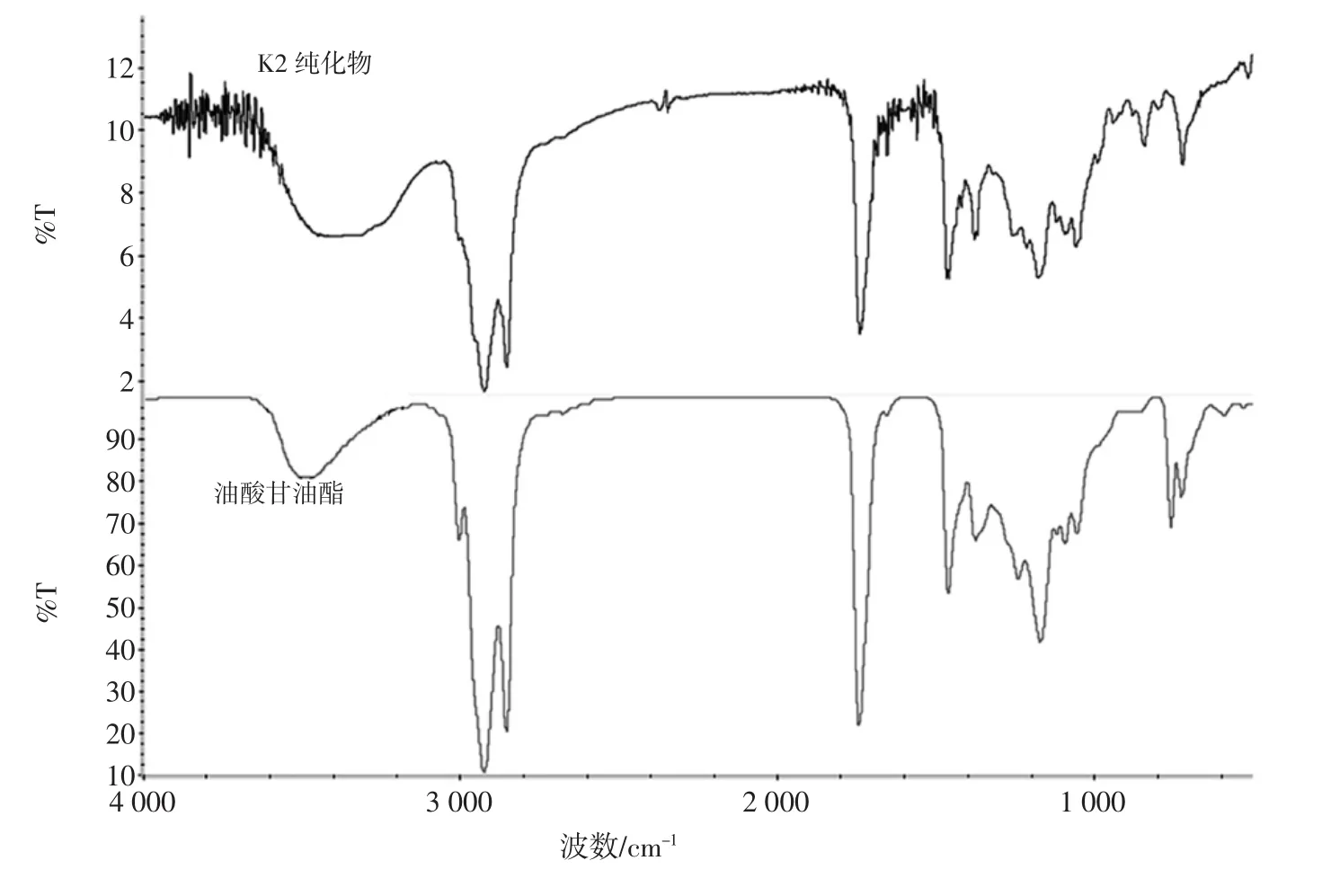
图6 K2的红外测试图Fig.6 Infrared measurement of K2
主要吸收峰[IR(KBr)]/cm-1:3 392,2 926,2 855,1 737,1 465,1 376,1 243,1 178,1 069,990,847,722。其中3 392 cm-1处为宽的吸收峰,这是因为分子间氢键O-H伸缩振动引起;2 926 cm-1及2 855 cm-1出现吸收峰是因为C-H伸缩振动,且可判断为-CH2-;1 737 cm-1出现吸收峰是因为形成酯基C-C(=O)-O;1 737和1 465 cm-1形成吸收峰是由于C-H弯曲振动,且分别形成甲基与亚甲基;1 243 cm-1、1 178 cm-1和1 069 cm-1出现吸收峰是因为C-H面内弯曲振动;847 cm-1和722 cm-1出现吸收峰因为C-H面外弯曲振动引起,共同形成双键。K2与油酸甘油酯的红外图谱峰重合性较好,主要特征峰波数大致相同。
2.3 层析纯化合物核磁共振图谱分析
层析纯化合物1(K1,90%醇纯化物分离出的化合物1)的氢谱图如图7所示。
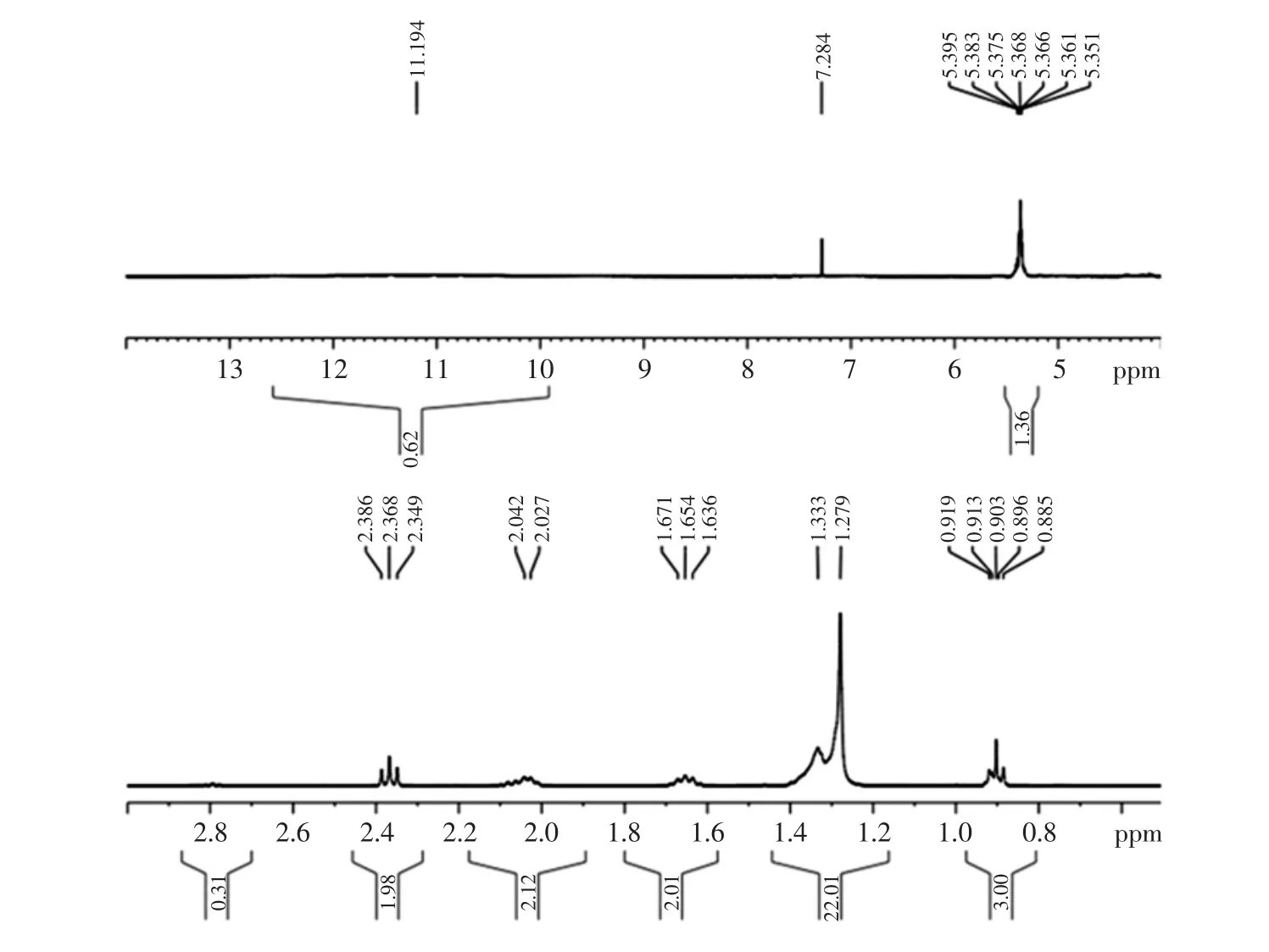
图7 K1的氢谱图Fig.7 The hydrogen spectrum of K1
化合物1(K1)在常温下为微黄色晶形蜡状固体,溶于氯仿和乙酸乙酯中,不易溶于水,熔点(℃):28~34;洗脱剂(体积比)为氯仿∶丙酮∶甲酸=95∶4∶1,Rf=0.738 1;碘缸中取出为棕黄色圆点,10%硫酸-乙醇显色淡紫色。1H-NMR(500 MHz,CDCl3)谱中(见图 7):dH11.194(1H,q)为羧基-COOH的氢信号;dH5.351(1H,m)说明该化合物存在一个C=C;化学位移(ppm)dH2.349(1H,t)为与-COOH 相连的亚甲基-CH2-的氢信号;化学位移(ppm)dH2.027(1H,d)为与双键相连的亚甲基的氢信号;化学位移(ppm)dH1.636(1H,d)为亚甲基的氢信号;化学位移(ppm)dH1.279(1H,s)和化学位移(ppm)dH1.333(1H,s)显示该化合物中间存在长的碳链,且为脂肪酸长碳链;化学位移(ppm)dH0.896(1H,m)为-CH3的氢信号。该物质为亚麻酸的几率1%~2%,亚油酸的几率为9%~10%,油酸41%~43%,饱和脂肪酸40%~43%,综合上述分析并结合红外图谱,故该物质鉴定为芥酸。
层析纯化合物2(K2,90%醇纯化物分离出的化合物2)的氢谱图如图8所示。
化合物2(K2)在常温下为微黄色晶形蜡状固体,溶于氯仿和乙酸乙酯中,不易溶于水,熔点(℃):35-37;洗脱剂(体积比)为氯仿∶丙酮∶甲酸=93∶6∶1,Rf=0.285 7;碘缸中取出为棕黄色圆点,10%硫酸-乙醇显色淡紫色。1H-NMR(500 MHz,CDCl3)谱中(见图 8):化学位移(ppm)dH5.35(1H,s)为说明该化合物存在一个 C=C;化学位移(ppm)dH3.94(1H,m)为与一个氧原子相连的亚甲基(-CH2)的氢信号;化学位移(ppm)dH2.77(1H,s)为与双键相连的亚甲基的氢信号;化学位移(ppm)dH2.34(1H,t)与-COO-相连的亚甲基-CH2-的氢信号;化学位移(ppm)dH2.02(1H,t)为与双键相连的亚甲基的氢信号;化学位移(ppm)dH1.63(1H,t)为亚甲基的氢信号;化学位移(ppm)dH1.25(1H,m)显示该化合物中间存在长的亚甲基,且为脂肪酸长碳链;化学位移(ppm)dH0.88(1H,m)为-CH3的氢信号。该物质为亚麻酸的几率1%~2%,亚油酸的几率为13%~14%,油酸36%~38%,饱和脂肪酸27%~30%,甘油20%~21%。综合上述分析并结合红外图谱,故该物质鉴定为油酸甘油酯。
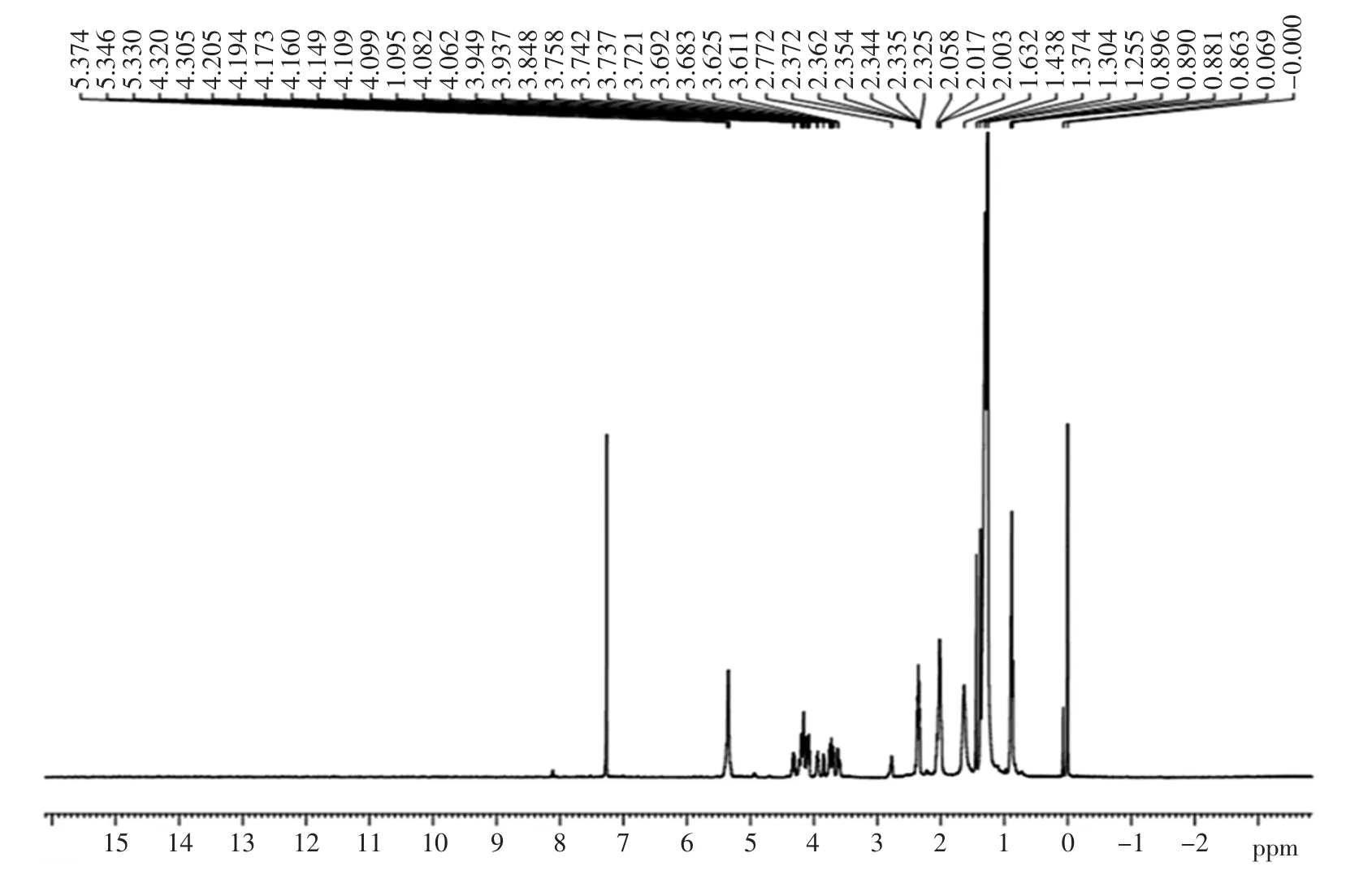
图8 K2的氢谱图Fig.8 The hydrogen spectrum of K2
2.4 抗氧化性能研究
2.4.1 不同组分芒果核多酚对DPPH自由基的清除能力的测定
不同组分芒果核多酚对DPPH自由基的清除能力的测定见图9。
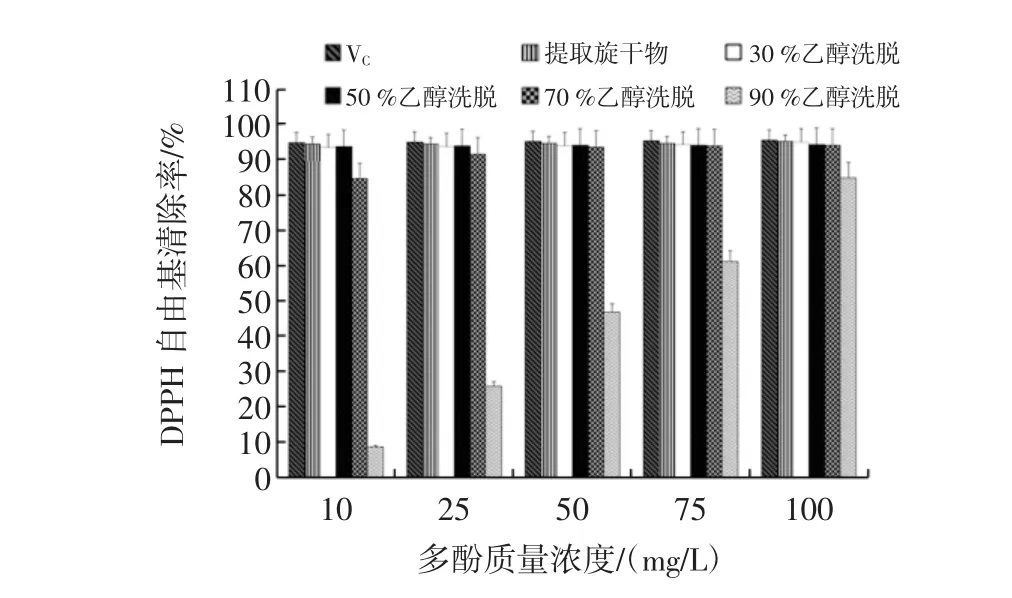
图9 不同组分芒果核多酚对DPPH自由基的清除能力Fig.9 Different components of mango nuclear polyphenols DPPH free radical scavenging ability
如图9,表示芒果核提取物、不同浓度乙醇洗脱物对DPPH自由基均有一定的清除能力,且随质量浓度的增大,清除作用也逐渐增强呈现上升的趋势。VC、芒果核粗提物及不同浓度乙醇洗脱组分对DPPH·清除效果显著,除90%乙醇洗脱组分外的其余样品的清除率在浓度为10 mg/L~100 mg/L内都可达到85%以上。相比较而言,各样品对DPPH自由基清除作用的大小为:VC>芒果核粗提物>30%乙醇洗脱组分>50%乙醇洗脱组分>70%乙醇洗脱组分>90%乙醇洗脱组分,但是芒果核粗提物、30%乙醇洗脱组分和50%乙醇洗脱组分的清除能力相差不大,可能原因是三者的主要成分为鞣酸。
2.4.2 不同组分芒果核对·OH的清除作用
不同组分芒果核多酚对·OH的清除能力的测定见图10。
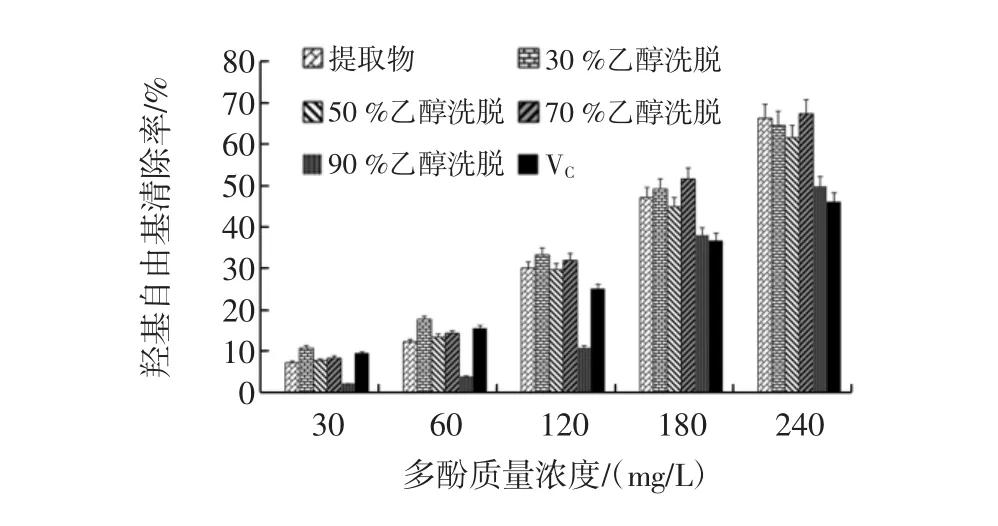
图10 不同组分芒果核多酚在水杨酸体系中对·OH的清除作用Fig.10 Different components of mango nuclear in salicylic acid system of·OH scavenging effect
如图10,表示芒果核提取物、不同浓度乙醇洗脱物对·OH均有一定的清除能力,且随质量浓度的增大,清除作用也逐渐增强呈现上升的趋势。研究者常会选择清除率为50%时抗氧化剂的质量浓度即IC50作为评价抗氧化剂对自由基的清除能力和抗氧化作用,IC50越小,证明抗氧化剂的清除自由基的能力越强。根据各样品清除率与其质量浓度的线性关系:芒果核粗提物为y=0.285 8x-3.346 5,IC50=186.66 mg/L,R2=0.996 3;30%乙醇洗脱组分为y=0.258 9x+2.568 2,IC50=183.21 mg/L,R2=0.999 8;50%乙醇洗脱组分为y=0.258 9x-1.061 5,IC50=197.22 mg/L,R2=0.998 5;70%乙醇洗脱组分为y=0.289 5x-1.659,IC50=178.44 mg/L,R2=0.997 2;90%乙醇洗脱组分为y=0.244 6x-9.888 9,IC50=244.84 mg/L,R2=0.939 3;VC为 y=0.175 1x+4.469 3,IC50=260.03 mg/L,R2=0.998 7。通过线性方程得出各样品的IC50,根据IC50值显示各样品对·OH的清除能力的大小为:70%乙醇洗脱组分>30%乙醇洗脱组分>芒果核粗提物>50%乙醇洗脱组分>90%乙醇洗脱组分>VC。其原因可能和不同组分成分有关,由前面检测结果可知30%和50%乙醇洗脱组分主要是鞣酸,因此,两者对·OH清除能力相差不大,类似的,对DPPH·清除能力差异也不大(图9)。芒果核粗提物及不同浓度乙醇洗脱组分的清除作用均比VC的清除作用强。
K1、K2为90%乙醇洗脱组分进行进一步硅胶层析分离所得物质,在水杨酸体系对·OH的清除效果,以VC作为阳性对照,结果如图11所示。
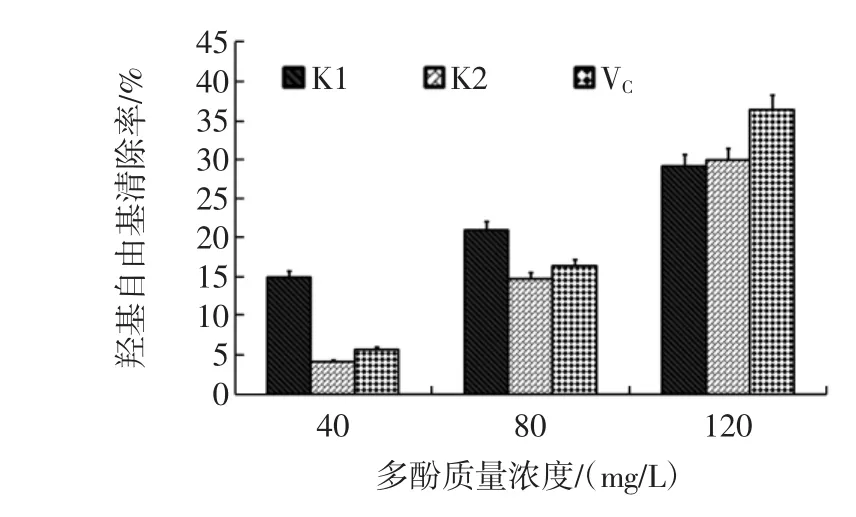
图11 K1、K2在水杨酸体系中对·OH的清除作用Fig.11 K1 and K2 in salicylic acid system of·OH scavenging effect
如图11,随着K1、K2及VC的质量浓度的增高,对·OH的清除作用也越强,即使在低浓度情况下也表现出一定程度的清除效果。相比较VC而言,在低浓度(40、80 mg/L)的时候K1清除效果较好,但在120 mg/L时,VC表现出的清除效果较强且增长幅度也较大。
3 结论
芒果核中化学成分较复杂且分离难度大,特别是含有酚羟基的酚类物质,极性大又极易被氧化,这会给分离纯化带来很大的困难。本实验经过AB-8大孔树脂纯化后,发现芒果核的酚类成分分离相当困难,在分离过程中还存在拖尾现象,薄层层析展开剂的选择中,通过采用了加酸可以防止拖尾现象,发现氯仿-丙酮-甲酸展开效果较好,因此在层析洗脱时采用了3种洗脱剂的洗脱系统,以保证得到更好的分离效果。本论文通过红外光谱和核磁分析,确定了30%和50%乙醇纯化物中最主要的成分是鞣酸,70%乙醇纯化物中最主要的成分是鞣花酸,90%乙醇纯化物中最主要的成分是蓖麻油酸,化合物K1为芥酸,化合物K2为油酸甘油酯,均为已知化合物。抗氧化活性试验表明,芒果核多酚及其纯化物对羟基自由基、超氧阴离子自由基及DPPH自由基清除作用明显,说明芒果核多酚具有很好的抗氧化活性。
[1] 周新远,刘帅.“希望之果”-芒果[J].中老年保健,2010(2):36-37
[2] 鞠志杰.芒果[J].当代人,2006(8):17-18
[3]Yean-Yean Soong,Philip J Barlow.Antioxidant activity and phenolic content of selected fruit seeds[J].Food Chemistry,2004,88(3):411-417
[4] Yean-Yean Soong,Philip J Barlow.Quantification of gallic acid and ellagic acid from longan(Dimocarpus longan Lour.)seed and mango(Mangifera indicaL.)kernel and their effects on antioxidant activity[J].Food Chemistry,2006,97(3):524-530
[5] Barreto J C,Trevisan M T,Hull W E.Characterization and quantitation of polyphenolic compounds in bark,kernel,leaves,and peel of mango(Mangifera indicaL.)[J].J Agric Food Chem,2008,56(14):5599-5610
[6] Nithitanakool S,Pithayanukul P,Bavovada R.Antioxidant and hepatoprotective activities of thai mango seed kernel extract[J].Planta Med,2009,75(10):1118-1123
[7] Maisuthisakul P,Gordon M H.Influence of polysaccharides and storage during processing on the properties of mango seed kernel extract(microencapsulation)[J].Food Chem,2012,134(3):1453-1460
[8] Maisuthisakul P.Characterization and storage stability of the extract of Thai mango(Mangifera indica Linn.Cultivar Chok-Anan)seed kernels[J].J Food Sci Technol,2014,51(8):1453-1462
[9] Abdullah A S,Mohammed A S,Rasedee A.Induction of apoptosis and oxidative stress in estrogen receptor-negative breast cancer,MDA-MB231 cells,by ethanolic mango seed extract[J].BMC Complement Altern Med,2015,15(3):45
[10]康超,罗杨合,李燕,等.一种芒果核多酚提取物及其制备方法:201610471546.4.[P].2016-06-24
[11]王峥涛,梁光义.中药化学[M].上海:上海科学技术出版社,2009:151-153
[12]康超,李燕,段振华,等.芒果核酚类物质提取工艺优化及其抗氧化活性研究[J].食品研究与开发,2017,38(5):47-51
Component Analysis of Polyphenol from Mango Kernel Seeds and Its Evaluation of Antioxidative Activity
KANG Chao1,2,LI Yan1,2,DUAN Zhen-hua1,2,LUO Yang-he1,2,SHUAI Liang1,2,WU Shu-jie1,2,*
(1.Research Institute of Food Science&Engineering Technology,Hezhou University,Hezhou 542899,Guangxi,China;2.Food and Bioengineering College,Hezhou University,Hezhou 542899,Guangxi,China)
Polyphenols of mango kernel seeds were extracted by different concentration of ethanol(30%,50%,70%and 90%),and then separated by silica gel column chromatography,thin layer chromatography.The structure of the purified compound products were analyzed by infrared spectrum and nuclear magnetic resonance.The main component purified by 30%or 50%ethanol was gallic acid,while 70%ethanol and 90%ethanol were ellagic acid and castor oil acid,respectively.The further purifying and identifying the component purified by 90%were determined to be erucic acid and 1,2-Dioleoy1-rac-glycerol.The results of antioxidation experiments showed that the purified polyphenols from mango kernel seeds had stronger antioxidant activity against hydroxyl radicals(·OH)and DPPH radicals(DPPH·),which would provide an important basis for comprehensive utilization of mango kernel.
mango kernel seeds;purified polyphenol;component analysis;antioxidative activity
10.3969/j.issn.1005-6521.2017.22.002
国家自然科学基金(21365011);贺州学院博士启动基金(HZUBS201515);广西高校中青年教师基础能力提升项目(2017KY06556);广西特色果蔬深加工与保鲜技术研究(YS201601);‘广西特聘专家’专项(厅发[2016]21号)
康超(1985—),女(汉),讲师,博士,研究方向:食品工程和天然产物研究与开发。
*通信作者:伍淑婕(1973—),女,副教授,研究方向:生物活性物质开发与利用。
2017-04-07
