低氧微环境下siRNA靶向沉默HIF-2α基因对前列腺癌PC-3细胞增殖和凋亡的影响
2017-11-10陈剑晖李晓帆穆细院李永生蔡伟忠
陈剑晖, 李晓帆, 穆细院, 李永生, 蔡伟忠
低氧微环境下siRNA靶向沉默HIF-2α基因对前列腺癌PC-3细胞增殖和凋亡的影响
陈剑晖1, 李晓帆2, 穆细院1, 李永生1, 蔡伟忠1
目的观察体外低氧条件下缺氧诱导因子-2α(HIF-2α)在人前列腺癌细胞PC-3中的表达情况,并研究siRNA沉默HIF-2α基因对前列腺癌PC-3细胞生长及凋亡的影响。方法在体外培养的PC-3细胞中加入化学诱导剂CoCl2建立低氧模型,采用逆转录PCR(RT-PCR)和Western印迹法检测CoCl2诱导HIF-2α mRNA和蛋白表达的时-效和量-效关系。合成HIF-2α siRNA片段并转染前列腺癌PC-3细胞,采用RT-PCR及Western印迹法检测HIF-2α siRNA对HIF-2α基因表达的影响,采用MTT法检测转染HIF-2α siRNA后对PC-3细胞生长的抑制情况,采用流式细胞仪检测RNA干扰对PC-3细胞凋亡的影响。结果(1)低氧可诱导PC-3细胞的HIF-2α mRNA表达,与常氧组比较,低氧12,24及48 h组的HIF-2α mRNA和蛋白表达量逐渐升高(P<0.05)。100 μmol/L的CoCl2作用48 h可作为最佳前列腺癌细胞PC-3低氧模型。(2)低氧+HIF-2α siRNA干扰组的HIF-2α mRNA和蛋白表达水平明显低于低氧+阴性对照组和低氧组(P<0.05),而低氧+阴性对照组与低氧组的HIF-2α mRNA和蛋白表达水平无显著性差异(P>0.05)。低氧+HIF-2α siRNA干扰组细胞增殖受抑制、细胞凋亡增加(P<0.05),而常氧组、低氧组、低氧+阴性对照组细胞增殖活力和凋亡差别均无统计学意义(P>0.05)。结论低氧可促进前列腺癌PC-3细胞表达HIF-2α逐渐上调,siRNA干扰HIF-2α可以抑制低氧状态下前列腺癌PC-3细胞HIF-2α基因的表达,达到抑制细胞增殖、促进细胞凋亡的目的。阻断HIF-2α信号通路可作为激素非依赖前列腺癌治疗的新策略。
前列腺肿瘤; RNA干扰; 基因; 细胞增殖; 细胞凋亡
缺氧是实体肿瘤普遍存在的一个客观现象[1]。研究表明,大多数实体肿瘤体积增大时,瘤体内部出现缺氧微环境,对缺氧的适应是肿瘤生长及耐药过程中一个关键的步骤。缺氧诱导因子-α(hypoxia inducible factor-α, HIF-α)是这个过程中最重要的调节因子[2]。HIF-α主要分为HIF-1α和HIF-2α。研究表明,HIF-1α的表达程度与前列腺癌的发生、发展及预后密切相关[3],但HIF-2α在前列腺癌中的作用和意义仍有争议。本研究在体外低氧微环境下观察前列腺癌PC-3细胞HIF-2α的表达情况,并利用RNA干扰的方法观察抑制HIF-2α表达对前列腺癌细胞PC-3生长及细胞凋亡的影响,报道如下。
1 材料与方法
1.1材料
1.1.1细胞 人前列腺癌PC-3细胞株(批号:20091005,上海中国科学院细胞库),加入含10%胎牛血清的Ham’s F-12培养基,以0.25%胰蛋白酶消化传代,取对数生长期的细胞用于实验。
1.1.2试剂 10%胎牛血清(南美血源,批号:202145K,美国Gibco公司);Ham’s F-12培养液(批号:NWJ0373,美国Hyclone公司);CoCl2(批号:0806013,美国Sigma公司);TrizolTM试剂(批号:R0016,美国Invitrogen公司);RT-PCR试剂盒(批号:DDR021A,日本Takara公司);LipofectamineTM2000试剂盒(批号:11668-019,美国Invitrogen公司);SP-9001检测试剂盒(批号:20120409,北京中杉金桥生物技术有限公司);兔抗人HIF-2α单克隆抗体(批号:2608)及兔抗人β-actin抗体(批号:3807)(美国CST公司);山羊抗兔二抗(批号:C40109-04,美国LI-COR公司);Annexin V-FITC试剂盒(批号:20121108,南京凯基生物科技发展有限公司);HIF-2α siRNA由江苏Biomics生物技术有限公司合成、纯化。PCR引物及内参由上海生物工程有限公司合成。
1.1.3仪器 Forma CO2培养箱及超低温冰箱(美国Thermo公司);倒置显微镜(CKX31型,日本Olympus公司);自动多功能酶标仪(2600型,美国Awareness公司);PCR仪(CFX96型)及稳压垂直电泳仪(美国Bio-Rad公司);分光光度计(德国Eppendorff公司);流式细胞仪(FACS Calibur型,美国BD公司)。
1.2方法
1.2.1细胞培养及低氧模型的建立 (1)常氧培养:PC-3细胞培养于含10%胎牛血清的Ham’s F-12培养液中,并置于37 ℃、体积分数为0.05的CO2和体积分数为0.2的O2、饱和湿度的自控CO2细胞培养箱内,以常规方法培养细胞。(2)低氧培养:向培养基中加入CoCl2,按终浓度为50,100,150,200 μmol/L分组,并持续培养3~5代,使细胞稳定生长传代。检测低氧处理后12,24,48 h各组细胞的HIF-2α表达水平,为细胞的低氧模型拟定最佳的CoCl2作用浓度和作用时间。
1.2.2siRNA的合成、转染
1.2.2.1siRNA的合成 siRNA在-20 ℃的环境下冻干存储,因荧光标记RNA的Oligo对光敏感,须避光保存。实验时使用125 μL的焦碳酸二乙酯水去重悬3.0 nmol的siRNA,溶解成20 μmol/L的样品使用。
HIF-2α siRNA:
正义链:5′-CAACCTGCAGCCTCAGTGTATC-3′
反义链:5′-CACCACGTCGTTCTTCTCGATG-3′
阴性对照Scrambled siRNA序列:
正义链:5′-UUCUCCGAACGUGUCACGUTT-3′
反义链:5′-ACGUGACACGUUCGGAGAATT-3′
1.2.2.2细胞转染 250 μL的无血清培养基内加入1 mg/mL的LipofectamineTM2000 5 μL,250 μL的无血清培养基内加入20 μmol/L的siRNA 5 μL,2种稀释液相加混匀,室温孵育20 min。无血清培养基稀释至1 000 μL,制备成siRNA的终浓度为100 nmol/L、LipofectamineTM2000的终浓度为5 μg/mL的混合液。在细胞转染前24 h,将对数生长的细胞以4×108L-1的密度接种于6孔培养板,当细胞融合度为60%~70%时,按照LipofectamineTM2000试剂盒说明书将siRNA-脂质体混合液逐滴加入细胞孔中,转染4~6 h后更换低氧环境(10%胎牛血清的Ham’s F-12培养液中加入终浓度为100 μmol/L的 CoCl2)。24 h后在荧光显微镜下观察转染羧基荧光素(FAM)siRNA的细胞并计算转染率。转染48 h后,提取各组细胞的RNA和蛋白质,检测各项相关指标。
1.2.3分组 根据转染的情况分为4组,分别为低氧+HIF-2α siRNA组、低氧+阴性对照组、低氧组及常氧组。此外,另设一FAM siRNA组,为FAM标记的siRNA转染组(与低氧+HIF-2α siRNA组具有相同浓度和培养条件的siRNA和LipofectamineTM2000),用于计算转染率。
1.2.4检测HIF-2α mRNA的表达 采用RT-PCR方法进行检测。TrizolTM试剂一步法提取未转染前及转染后48 h的PC-3细胞总RNA。目的基因为HIF-2α,内参为β-actin,各引物序列和探针见表1。目的基因及内参的PCR反应参数:预变性94 ℃ 3 min;之后变性94 ℃ 30 s→退火58 ℃ 45 s→延伸72 ℃ 45 s,共进行32个循环;72 ℃再延伸10 min;电泳并通过凝胶成像分析系统成像。重复3次。
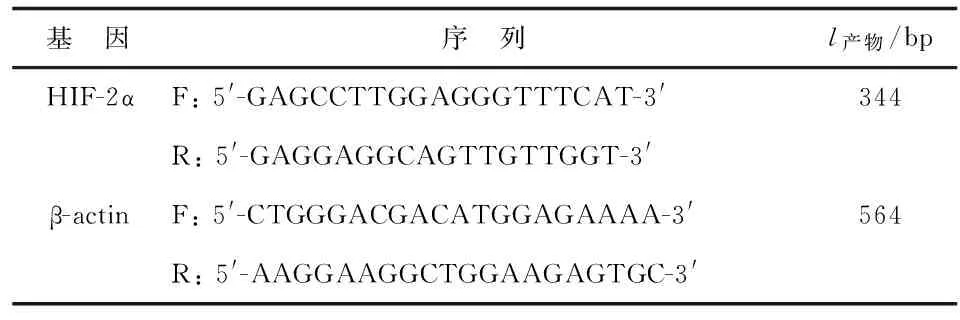
表1 逆转录PCR引物和探针
1.2.5检测HIF-2α蛋白的表达 采用Western-blot方法进行检测。取转染48 h后的PC-3细胞,加4 ℃预冷的磷酸盐缓冲液洗涤,吸尽洗液。用细胞刮刀刮到一侧,然后转移到1.5 mL的EP管中,加150 μL含PMSF的裂解液,于冰上裂解30 min,4 ℃下12 000 r/min离心5 min,将离心后的上清分装转移到1.5 mL的离心管中,置于-20 ℃的冰箱保存。用考马斯亮蓝法蛋白定量后,取出80 μg蛋白,以β-actin作为对照,经10%的SDS-PAGE电泳分离、转膜和封闭后,加入兔抗人HIF-2α单克隆一抗(1∶500)及兔抗人β-actin一抗(1∶1 000),4 ℃过夜孵育后,用TBST洗膜3次,每次10 min。加入1∶1 000稀释的HRP标记的山羊抗兔二抗,室温下孵育2 h,进行ECL化学发光显影、定影后,用凝胶图像处理系统进行分析。
1.2.6测定细胞生长 采用MTT法测定,将处于对数生长期的细胞以胰酶消化,制备成单细胞悬液,以每孔1×l04个细胞接种于96孔培养板,每个处理组设5个复孔。置于37 ℃,体积分数为0.05的CO2培养箱中培养24 h后,进行细胞转染,转染后继续培养48 h,加入20 μL的MTT溶液,继续培养4 h后终止培养,小心吸弃孔内上清液,每孔加入DMSO 200 μL,低速振荡15 min,使结晶物充分溶解,以只加培养基不加细胞的空白对照孔调零,酶标仪在490 nm波长处检测每孔的光密度值(OD)。计算细胞存活率,其中转染后的HIF-2α siRNA组、阴性对照组、未转染的低氧组为公式中的实验组,常氧组为对照组。
细胞存活率=(OD实验组-OD空白组)/(OD对照组-OD空白组)×100%
1.2.7测定细胞凋亡 采用Annexin V与PI双染法流式细胞术检测,取对数生长期的PC-3细胞,胰酶消化制备成单细胞悬液,台盼蓝染色法计算活细胞数>98%,稀释成5×105mL-1的细胞悬液,接种到6孔板中,置于37 ℃、体积分数为0.05的CO2培养箱中培养24 h,此后分组并进行细胞转染,48 h后用0.25%胰酶消化细胞,再用磷酸盐缓冲液洗涤细胞2次,收集5×105个细胞,加入500 μL的Binding Buffer悬浮细胞,依次加入5 μL Annexin V-FITC及5 μL碘化丙啶,混匀,室温避光反应10 min,应用流式细胞仪检测细胞的凋亡情况(激发波长Ex=488 nm;发射波长Em=530 nm)。

2 结 果
2.1前列腺癌PC-3细胞最优低氧模型的建立
2.1.1低氧条件下PC-3细胞在不同时相表达HIF-2α mRNA的情况 取CoCl2浓度为100 μmol/L,设时-效关系组,结果显示,低氧48 h组PC-3细胞表达HIF-2α mRNA的水平最高,常氧对照组及低氧12,24,48 h组的HIF-2α mRNA相对表达量分别为(0.205±0.023),(0.403±0.021),(0.501±0.024)及(0.674±0.022),各组间差别均有统计学意义(P<0.05,图1)。
2.1.2低氧条件下PC-3细胞在不同时相表达HIF-2α蛋白的情况 低氧48 h组PC-3细胞表达HIF-2α蛋白的水平最高,常氧对照组及低氧12,24,48 h组的HIF-2α蛋白相对表达量分别为(0.223±0.017),(0.304±0.012),(0.386±0.016)及(0.47±0.03),各组间差别均有统计学意义(P<0.05,图2)。
2.1.3不同浓度CoCl2诱导PC-3细胞表达HIF-2α mRNA的情况 取不同浓度的CoCl2作用48 h,结果显示,CoCl2浓度100 μmol/L组的PC-3细胞表达HIF-2α mRNA水平最高,常氧对照组及50,100,150,200 μmol/L组的HIF-2α mRNA相对表达量分别为(0.501±0.014),(1.249±0.024),(1.512±0.012),(0.572±0.023)及(0.291±0.021),各组间比较差别均有统计学意义(P<0.05,图3)。由于CoCl2100 μmol/L缺氧48 h组的PC-3细胞HIF-2α mRNA表达水平最高,故采用CoCl2100 μmol/L缺氧48 h作为后续实验的缺氧模型。

n=10. A:PC-3细胞HIF-2α mRNA的相对表达量; B:RT-PCR检测HIF-2α mRNA的电泳图谱. 1~4组分别为常氧对照组及低氧12,24,48 h组; M:DNA marker.图1 RT-PCR检测不同时相PC-3细胞HIF-2α mRNA的表达水平(CoCl2浓度为100 μmol/L)Fig 1 Expression of HIF-2α mRNA in PC-3 cells at different time point of hypoxia detected by RT-PCR (treat with 100 μmol/L of CoCl2)

n=10. A:PC-3细胞HIF-2α蛋白的相对表达量; B:Western-blot检测HIF-2α蛋白的电泳图谱. 1~4组分别为常氧对照组及低氧12,24,48 h组.图2 Western-blot法检测不同时相PC-3细胞HIF-2α蛋白的表达情况(CoCl2浓度为100 μmol/L)Fig 2 Expression of HIF-2α protein at different time point of hypoxia detected by Western-blot (treat with 100 μmol/L of CoCl2)
2.2LipofectamineTM2000的转染效率测定 在PC-3细胞转染FAM siRNA后,用荧光显微镜检测结果显示,FAM siRNA胞内分布,siRNA的终浓度为100 nmol/L时,转染效率>80%,继续培养48~72 h荧光未明显减弱,符合本实验要求(图4)。

n=10. A:PC-3细胞HIF-2α mRNA的相对表达量; B:RT-PCR检测HIF-2α mRNA的电泳图谱. 1:常氧对照组;2~5:50,100,150及200 μmol/L CoCl2组;M:DNA marker.图3 RT-PCR检测不同浓度CoCl2作用下PC-3细胞的HIF-2α mRNA的表达水平Fig 3 Expression of HIF-2α mRNA in PC-3 cells after treat with different concentrations of CoCl2 detected by RT-PCR

A:普通光学显微镜成像;B:荧光显微镜成像.图4 转染FAM-siRNA 24 h后的显微镜成像( ×100)Fig 4 Ordinary microscopic imaging and fluorescent microscopic imaging at 24 h after transfecting( ×100)
2.3转染HIF-2α siRNA对前列腺癌PC-3细胞HIF-2α mRNA表达水平的影响 转染HIF-2α siRNA 48 h后低氧+HIF-2α siRNA组的HIF-2α mRNA表达水平明显下调[灰度比值为(0.424±0.023)],与常氧组、低氧组、低氧+阴性对照组比较[灰度比值分别为(0.504±0.013),(1.494±0.027),(1.503±0.023)],差别均有统计学意义(F=267.62,P<0.05),表明转染HIF-2α siRNA能够有效抑制PC-3细胞的HIF-2α mRNA的表达(图5)。

n=10. A:PC-3细胞HIF-2α mRNA的相对表达量; B:RT-PCR检测HIF-2α mRNA的电泳图谱. 1~4组分别为常氧组、低氧组、低氧+阴性对照组及低氧+HIF-2α siRNA组;M:DNA marker.图5 RT-PCR检测各组PC-3细胞HIF-2α mRNA的表达水平Fig 5 Expression of HIF-2α mRNA in different groups of PC-3 cells detected by RT-PCR
2.4转染HIF-2α siRNA对前列腺癌PC-3细胞HIF-2α蛋白表达水平的影响 Western-blot分析显示,低氧+HIF-2α siRNA组、常氧组、低氧组及低氧+阴性对照组的HIF-2α蛋白相对表达量分别为(0.167±0.029),(0.274±0.029),(0.45±0.08)及(0.44±0.14)(图6)。低氧组、低氧+脂质体组的HIF-2α蛋白表达量较常氧组显著增加(P<0.05),而低氧+HIF-2α siRNA组较其他3组显著降低(P<0.05),说明转染HIF-2α siRNA能够有效抑制PC-3细胞的HIF-2α蛋白表达。
2.5转染HIF-2α siRNA 对前列腺癌PC-3细胞生长影响 MTT法检测结果提示,低氧+HIF-2α siRNA组、低氧组、低氧+阴性对照组的存活率分别为(55.3±1.3)%,(76.3±1.3)%及(75.5±1.8)%。低氧+HIF-2α siRNA组PC-3细胞的存活率较低氧组、低氧+阴性对照组显著性降低(F=203.54,P<0.05),而低氧组的细胞存活率与低氧+阴性对照组比较,差别无统计学意义(t=-2.20,P>0.05)。结果表明,在低氧微环境下,沉默HIF-2α基因能使PC-3细胞生长明显受抑制。
2.6转染HIF-2α siRNA 对前列腺癌PC-3细胞凋亡的影响 常氧组、低氧组及低氧+阴性对照组的细胞凋亡率分别为(3.9±0.3)%,(5.5±0.4)%及(5.3±0.5)%;而低氧+HIF-2α siRNA组的凋亡率为(45.6±0.7)%,与前3组比较,差别有统计学意义(F=5 092.28,P<0.01)。表明在低氧微环境下,抑制HIF-2α基因的表达能使PC-3细胞凋亡率明显增加(图7)。

n=10. A:PC-3细胞HIF-2α蛋白的相对表达量; B:Western-blot检测HIF-2α蛋白的电泳图谱. 1~4组分别为低氧+HIF-2α siRNA组、常氧组、低氧+阴性对照组及低氧组.图6 Western-blot法检测各组PC-3细胞HIF-2α蛋白表达情况Fig 6 Expression of HIF-2α protein in different groups of PC-3 cells detected by Western-blot

活细胞位于流式细胞图的左下象限(Annexin V-/PI-),凋亡早期细胞位于右下象限(Annexin V+/PI-),凋亡晚期细胞位于右上象限(Annexin V+/PI+),死亡细胞位于左上象限(Annexin V-/PI+);Q4为早期凋亡率,Q2为晚期凋亡率,Q2+Q4为总凋亡率.图7 Annexin V-FITC与PI双染法流式细胞术分析各组细胞的凋亡率Fig 7 Apoptosis rate of different groups by FCM and using Annexin V-FITC/PI double staining kit
3 讨 论
缺氧是实体瘤微环境的基本特征之一,是肿瘤生长发展的关键调控因素。恶性肿瘤在生长过程中,由于肿瘤细胞异常增殖过快,瘤体内远离血管的局部组织会出现缺氧和营养物质的相对不足,故体积较大的肿瘤内部出现慢性缺氧是普遍现象。
针对缺氧的转录适应性调节是由HIF-α亚单位与芳香烃受体核转录因子形成的异二聚体介导的,其翻译后水平表达的调控机制涉及羟基化、蛋白与蛋白的相互作用、泛素化降解的动态平衡[4-5]。在常氧(氧的体积分数为21%)的条件下,羟基化的HIF-1α/2α与E3泛素连接酶vHL相结合,通过泛素-蛋白酶体途径降解,HIF-α处于表达和降解的动态平衡中。在低氧(氧的体积分数为0.5%~3%)条件下,HIF-α因无法羟基化而与vHL分离,得以稳定存在[6-7],其与从胞质转移到核内的HIF-β结合形成二聚体,启动靶基因表达产生多种生物学效应。
研究表明,HIF信号通路在肿瘤的发生发展、肿瘤血管生长和能量代谢中起重要作用[8]。研究多涉及HIF-1α,肿瘤内低氧诱导上百种靶基因以HIF-1依赖的方式编码蛋白,这些蛋白在肿瘤的血管生成、细胞存活、永生化、基因突变、增殖代谢、侵袭转移、免疫逃逸和放/化疗耐受等各个方面发挥重要作用[9]。在前列腺癌领域,既往研究证实,HIF-1α与前列腺癌的恶变密切相关[3];而对于HIF-2α在激素非依赖前列腺癌进展中的作用仍存在很大争议。然而相关研究表明,肿瘤局部低氧环境可诱导肿瘤细胞高表达HIF-2α,进而上调多种基因的表达和转录,使其适应低氧的微环境[10-11]。在较长时相的缺氧过程中,细胞中的HIF-1α表达随缺氧时间的延长而进行性下降,HIF-2α表达却进行性升高,提示HIF-2α可能在慢性缺氧过程中发挥主要作用[12]。Ji等的研究提示,HIF-2α mRNA与肿瘤的高侵袭性密切相关[13]。近年来的研究提示,HIF-2α与泌尿系肿瘤,如肾癌、膀胱癌的发展、抗凋亡及侵袭性密切相关[14-15];在肿瘤干细胞群的诱导方面,HIF-2α较HIF-1α发挥着更为重要的作用[16-17]。基于上述研究,笔者推测,HIF-2α在激素非依赖前列腺癌的发生发展中可能起重要作用,可阻断HIF-2通路,抑制HIF-2α表达,或抑制肿瘤细胞增殖的效果。
RNA干扰技术为转录后的基因沉默,是由双链RNA抑制同源基因的表达而诱发的,能有效、特异地阻断或降低靶基因的表达,具有快速、高效、特异性强的优势。目前在基因功能探索和恶性肿瘤基因治疗方面应用广泛[18-19]。癌基因通常作为RNA干扰的靶基因[20],利用siRNA抑制肿瘤癌基因的表达这一技术已相当成熟,能够在体外实验中取得较好的基因沉默效果。
PC-3细胞是一种恶性程度较高的高转移和雄激素抵抗的人前列腺癌细胞。本研究表明,以CoCl2化学低氧法模拟肿瘤低氧微环境,能成功诱导前列腺癌PC-3细胞中的HIF-2α表达,且随着低氧时间的延长,HIF-2α mRNA的表达量呈逐渐增加趋势,提示HIF-2α的表达与低氧具有一定的时间依赖性,提示HIF-2α在前列腺癌PC-3细胞适应慢性缺氧的过程中发挥着重要的作用。本实验通过siRNA沉默低氧环境下前列腺癌PC-3细胞的HIF-2α基因的表达,结果显示,转染HIF-2α siRNA 48 h后,PC-3细胞的HIF-2α mRNA表达水平明显下调,低于常氧组、低氧对照组及低氧+阴性对照组,说明siRNA沉默HIF-2α基因效果良好。MTT和流式细胞技术检测的结果显示,在低氧环境下,抑制HIF-2α基因的表达能使PC-3细胞生长明显受抑制,并使PC-3细胞的凋亡率明显增加。这些结果提示,HIF-2α很可能是前列腺癌PC-3细胞适应低氧微环境,并出现生物学行为进一步恶化的关键因子之一。有研究报道,HIF-2α促进细胞生长与HIF-2α的促血管生成作用密切相关,且较于HIF-1α,HIF-2α更易与血管内皮生长因子增强相结合,在不同组织内血管内皮生长因子和HIF-2α mRNA二者的表达趋势更为相符[21]。Ben-Shoshan等的研究亦显示,HIF-2α可作用于c-Myc下游靶基因,促进肿瘤低氧状态下的细胞增殖[22]。而Luo等的研究提示,HIF-2α可促进前列腺癌干细胞增殖和转移,其原因可能是由于HIF-2α改变了前列腺癌细胞内雄激素受体介导的信号通路[23]。由此可以推测,在慢性缺氧状态下,去势抵抗型前列腺癌细胞中,与放/化疗耐受以及与肿瘤侵袭和转移密切相关的基因表达活跃,可能与HIF-2α这一上游基因的表达上调密切相关。而HIF-2α与肿瘤生物学行为相关的基因,如葡萄糖代谢、细胞存活、血管生成和肿瘤侵袭的关系和作用机制值得后续研究进一步探索。
综上所述,HIF-2α可能是前列腺癌PC-3细胞在低氧环境下增殖的关键因子之一,对肿瘤生物学行为的发展起着重要作用。在当今国际上对于控制激素非依赖前列腺癌难以获得满意疗效的情况下,HIF-2α有望成为新的、高效的分子靶点。
[1] Poon E, Harris A L, Ashcroft M. Targeting the hypoxia-inducicble factor(HIF) pathway in cancer[J].ExpertRevMolMed, 2009,11(1):e26.
[2] Gassmann M, Chilov D, Wenger R H. Regulation of the hypoxia-inducible factor-1 alpha in the nucleus[J].AdvExpMedBiol, 2000,475(1):87-99.
[3] Amankwah E K, Sellers T A, Park J Y. Gene variants in the angiogenesis pathway and prostate cancer[J].Carcinogenesis, 2012,33(7):1259-1269.
[4] Gonzalez-Flores A, Aguilar-Quesada R, Siles E,etal. Intercaction between PARP-1 and HIF-2 alpha in the hypoxie response[J].Oncogene, 2014,33(7):891-898.
[5] Li L, Madu C O, Lu A,etal. HIF-1 alpha promotes a hypoxia-independent cell migration[J].OpenBiolJ, 2010,3(1):8-14.
[6] Com P G, Ricci M S, Scata K A,etal. Mxi1 is induced by hypoxia in a HIF-1-dependent manner and protects cells from c-Myc-induced apoptosis[J].CancerBiolTher, 2005,4(11):1285-1294.
[7] Loboda A, Jozkowicz A, Dulak J. HIF-1 and HIF-2 transcription factors-similar but not identical[J].MolCells, 2010,29(5):435-442.
[8] Salminen A, Kai K, Kauppinen A. AMPK and HIF signaling pathways regulate both longevity and cancer growth: the good news and the bad news about survival mechanisms[J].Biogerontology, 2016,17(4):655-680.
[9] Semenza G L. Oxyen homeostasis[J].WileyInterdiscipRevSystBiolMed, 2010,22(2):177-180.
[10] Chen L, Endler A, Shibasaki F. Hypoxia and angiogenesis:regulation of hypoxia-inducible factors via novel binding lactors[J].ExpMolMed, 2009,41(12):42-49.
[11] Zhdanov A V, Dmitriev R I, Golubeva A V,etal. Chronic hypoxia leads to a glycolytic phenotype and suppressed HIF-2 signaling in PC12 cells[J].BiochimBiophysActa, 2013,1830(6):3553-3569.
[12] Uchida T, Rossignol F, Matthay M A,etal. Prolonged hypoxia differentially regulates hypoxia-inducible factor (HIF)-2α and HIF-2α expression in lung epithelial cells[J].JBiolChem, 2004,279(15):14871-14878.
[13] Ji P, Xuan J W, Onita T,etal. Correlation study showing no concordance between EPAS-1/HIF-2alpha mRNA and protein expression in transitional cell cancer of the bladder[J].Urology, 2003,61(4):851-857.
[15] Foreman K E, Patel D, Davidson V,etal. MP45-09 emetine dihydrochloride preferentially inhibits HIF-1α and HIF-2α expression in bladder cancer cells[J].JournalofUrology, 2015,193(4):e538-e539.
[16] Mei Y K, Lemos R, Liu X,etal. The hypoxiaassociated factor switches cells from HIF-1alpha to HIF-2alpha-dependent signaling promoting stem cell characteristics,aggressive tumor growth and invasion[J].CancerRes, 2011,71(11):4015-4027.
[17] Mimeault M, Batra S K. Hypoxia-inducing factors as master regulators of stemness properties and altered metabolism of cancer-and metastasis-initiating cells[J].JCellMolMed, 2013,17(1):30-54.
[18] Pecot C V, Calin G A, Coleman R L,etal. RNA interference in the clinic:challenges and future directions[J].NatRevCancer, 2011,11(1):59-67.
[19] Chitkara D, Singh S, Mittal A. Nanocarrier-based co-delivery of small molecules and siRNA/miRNA for treatment of cancer[J].TherapeuticDelivery, 2016,7(4):245.
[20] Maduri S. Applicability of RNA interference in cancer therapy: Current status.[J].IndianJCancer, 2015,52(1):11.
[21] 王 健. 缺氧诱导因子2α对肝癌细胞生物学行为的影响[D].武汉:华中科技大学,2006.
[22] Ben-Shoshan J, Schwartz S, Luboshits G,etal. Constitutive expression of HIF-1α and HIF-2α in bone marrow stromal cells differentially promotes their proangiogenic properties[J].StemCells, 2008,26(10):2634-2643.
[23] Luo J, Lee S O, Cui Y,etal. Infiltrating bone marrow mesenchymal stem cells(BM-MSCs) increase prostate cancer cell invasion via altering the CCL5/HIF2α/androgen receptor signals[J].Oncotarget, 2015,6(29):27555-27565.
EffectsofSilencingHIF-2αGenebysiRNAonHumanProstateCancerPC-3CellApoptosisAndProliferationUnderHypoxicConditions
CHENJianhui1,LIXiaofan2,MUXiyuan1,LIYongsheng1,CAIWeizhong1
1.DepartmentofUrology,FujianMedicalUniversityUnionHospital,Fuzhou350001,China;2.DepartmentofHematology,FujianInstituteofHematology,FujianProvincialKeyLaboratoryonHematology,FujianMedicalUniversityUnionHospital,Fuzhou350001,China
Objective To observe the expression of hypoxia-inducible factor-2alpha (HIF-2α) in human prostate cancer PC-3 cell under hypoxia, and investigate the effects of silencing HIF-2α gene by siRNA on PC-3 cell apoptosis and proliferation under hypoxia.MethodsTumor hypoxia was induced by CoCl2chemical hypoxia method. RT-PCR and Western-blot was performed to detect the expression of HIF-2α mRNA and protein in human prostate cancer PC-3 cells, and the relations of the quantity-efficiency and the time-efficiency were analyzed. siRNA was chemically synthesized and transfected into PC-3 cells. The expressions of HIF-2α in hypoxia micro-environment were respectively detected by RT-PCR and Western-blot. The effects of apoptosis and proliferation were detected by FCM and MTT assay.Results(1)Hypoxia improved HIF-2α expression in PC-3 cells in a time-dependent manner. Compared with the normal oxygen group, the HIF-2α mRNA and protein expression level was significantly higher in 12 h-, 24 h-, and 48 h- group(P<0.05). The best model of hypoxia was 48 h- group induced by 100 μmol/L CoCl2. (2)The levels of mRNA and protein of HIF-2α were suppressed significantly after being treated with HIF-2α siRNA in PC-3 cells(P<0.05), but there was no significant difference in cell proliferation and apoptosis between CoCl2negative control group and CoCl2group(P>0.05). The proliferation potential and apoptosis in PC-3 cells were changed significantly after transfecting HIF-2α siRNA(P>0.05), but there was no significant difference among normal oxygen group, CoCl2groups, and CoCl2negative control group(P>0.05).ConclusionHIF-2α is over-expressed in human prostate cancer cell PC-3 after CoCl2treatment. HIF-2α siRNA effectively reduces the HIF-2α mRNA expressions in PC-3 cells. Tansfecting HIF-2α siRNA inhibits PC-3 cells proliferation and increases PC-3 cells apoptosis. Blocking HIF-2α signal pathway can be a potential strategy in the treatment of androgen independent prostate cancer.
prostatic neoplasms; RNA interference; genes; cell proliferation; apoptosis
R341.31; R737.25; R977.6
A
1672-4194(2017)05-0275-07
2017-04-20
福建省卫生厅青年基金(2010-2-17);福建省青年拔尖创新人才及福建省杰出青年科研人才培育计划(JA14130)
福建医科大学 附属协和医院,福州 350001 1. 泌尿外科;2. 血液科,福建省血液病研究所
陈剑晖,男,主治医师,医学硕士
蔡伟忠. Email: 59506952@qq.com
(编辑:何佳凤)
