长尖对齿藓原丝体快速培育的关键影响因子研究
2017-11-09李晓明李茹雪卜崇峰1
赵 洋 李晓明 李茹雪 王 春 卜崇峰1,*
(1.中国科学院水利部水土保持研究所,杨凌 712100; 2.中国科学院大学,北京 100049; 3.西北农林科技大学水土保持研究所,杨凌 712100; 4.西北农林科技大学资源与环境学院,杨凌 712100)
长尖对齿藓原丝体快速培育的关键影响因子研究
赵 洋1,2李晓明4李茹雪3王 春3卜崇峰1,3*
(1.中国科学院水利部水土保持研究所,杨凌 712100; 2.中国科学院大学,北京 100049; 3.西北农林科技大学水土保持研究所,杨凌 712100; 4.西北农林科技大学资源与环境学院,杨凌 712100)
为了给苔藓结皮野外恢复的大规模接种提供丰富种源,本文利用0.1% NaClO(10、15、20、30、45、60、120 s)和0.1% HgCl2(10、15、20、30、45、60、120 s)两种消毒液,采用Knop、MS和Hoagland 3种培养基,设置5.5、6、6.5、7、7.5、8、8.5七个水平的pH值,通过单因素试验设计方法,测定长尖对齿藓[Didymodonditrichoides(Broth.)]茎叶体的成活率、原丝体长度和分枝数等指标,探讨影响长尖对齿藓原丝体扩繁的关键因子。结果表明:(1)消毒方式、培养基及pH均对长尖对齿藓茎叶体的成活率、原丝体长度和分枝数有显著影响(P<0.05),影响大小依次均为消毒方式>培养基>pH;(2)最适合的消毒方式为:0.1%NaClO消毒15~20 s;(3)最适合长尖对齿藓原丝体生长的培养基是Knop和Hoagland培养基;(4)最适合长尖对齿藓原丝体生长的pH是7.5。从而得出快速培育长尖对齿藓原丝体的最佳组合为:0.1% NaClO消毒15~20 s+Hoagland/Knop+pH=7.5。本文的研究结果可以缩短长尖对齿藓生长周期以进行快速繁殖,为苔藓结皮的快速培育以及工程化应用提供一定的借鉴。
长尖对齿藓;原丝体;消毒方式;培养基;pH
苔藓植物作为一种过渡植物,具有耐旱、耐寒和养分需求低等特点[1],不仅能改善其生存地的生态环境,使土壤从贫瘠转为肥沃,而且在改善土壤的理化性质、增加土壤肥力以及防风固沙等方面有着不可忽视的作用[2~4]。
自然条件下,苔藓结皮的发育会受到一些资源、环境等的限制,且生长缓慢,有时需要几十年甚至上百年才可以形成稳定的苔藓结皮层[5]。同时,苔藓结皮的抗干扰能力比较脆弱,一旦受到破坏,便需要漫长的时间才可以恢复[6]。因此,可以通过苔藓结皮的人工培育,缩短其生长周期,实现苔藓结皮的快速培育与恢复,使其迅速发挥水土保持等生态功能。但苔藓植物一般个体矮小,且多种间杂生,不易于鉴别和分离,难以实现单一种源的大量采集[7];同时,苔藓结皮的大量采集势必会对野外地表扰动破坏严重,造成不必要的水土流失。而通过室内扩繁原丝体技术仅需少量的结皮种源就可以获得大量可供移植的苔藓结皮,在室内将种源制备好,然后直接接种到野外,可以在一定程度上解决种源问题。因此,通过组织培养技术来获得大量、单一且无菌的实验材料可能会成为苔藓结皮领域的重要研究内容之一。
原丝体阶段是苔藓植物区别于其他高等植物的一个特殊阶段,可以通过苔藓的孢子、茎叶体、叶部位长出,而且一条原丝体又可以分化成无数个配子体,从而为苔藓植物的快速繁殖提供条件[8~9]。目前,国内外学者关于苔藓的研究报道较多,但大都集中在苔藓植物的孢子消毒[10~14]、不同培养条件对苔藓植物孢子成活率和原丝体发育的影响[15~19]以及添加植物生长调节剂对原丝体分化的影响等方面的研究[20~23],而以苔藓植物茎叶体为外植体进行原丝体培育的鲜有报道。为此,本研究以长尖对齿藓茎叶体为研究对象,从茎叶体的成活率、原丝体长度和分枝数等方面来评价不同的消毒方式、培养基以及pH对长尖对齿藓原丝体生长和分化的影响,筛选出扩繁长尖对齿藓原丝体关键因子,从而为苔藓结皮野外恢复工程化应用提供种源。
1 材料与方法
1.1 材料
本实验所用苔藓结皮采自陕西省延安市安塞县纸坊沟(36°46′99″~36°52′44″N,109°17′2″~109°18′50″E)。选择发育良好且较为完整的苔藓结皮,利用小铲铲取苔藓结皮层(1 cm厚),装入塑料袋运回实验室自然阴干备用。经鉴定供试藓种的优势种为长尖对齿藓(Didymodonditrichoides)。
1.2 试验设计
1.2.1 苔藓结皮茎叶体的制备
人工挑出肉眼可见的植物残渣、土块、石子等,用自来水冲洗,使苔藓植株与土壤分离,并用蒸馏水冲洗数次,再将洗净的结皮阴干,用小刀切成1~2 mm的茎叶体备用。
1.2.2 培养基的制备
基本培养基为Knop+12%琼脂;MS+12%琼脂;Hoagland+12%琼脂;将pH调至7.0~7.2。
1.2.3 试验设计方法
采用单因素试验设计方法,考虑消毒剂与消毒时间、培养基以及pH这3个因素,每个因素水平详见表1~3,且每个处理设置3个重复。
1.2.4 培育过程
将长尖对齿藓的茎叶体分别在0.1% NaClO和0.1% HgCl2两种消毒液下进行7个时间梯度(10、15、20、30、45、60和120 s)的消毒。待消毒液消毒完成后,用无菌水冲洗8~10次,尽可能的洗掉残留的消毒液,以减少对茎叶体的伤害。根据相关文献报道[24~26],将消完毒的茎叶体分别接种在上述的培养基(90 mm)上,在智能光照培养箱中进行培养(培养条件为温度25℃、光强2 500~3 500 Lux、光照时间12 h/12 h),每个培养基上接种10个外植体,每个处理设3个重复。接种完成后,每天观察其生长状况,10 d后测定其成活率。
在消毒试验结束后,试验中选取了Knop、MS和Hoagland 3种培养基作为培养长尖对齿藓茎叶体的基质,培养条件同上,随后设置了7个pH梯度(5.5、6、6.5、7、7.5、8和8.5),定期测量其成活率、原丝体长度和分枝数,在长尖对齿藓原丝体长度和分枝数趋于稳定变化时试验结束。其中成活率的判别标准是植株是否还存在绿色以及返绿现象,成活率=成活的外植体数/接种的外植体数×100%[27],用肉眼辨别植株的存活情况;原丝体长度是选用长尖对齿藓茎叶体分散形成的原丝体测量,取最长的主轴原丝体用尺子测量其长度[8],用毫米表示;原丝体分枝数是将茎叶体分散形成的原丝体群的数目用肉眼数出来,然后选取最多的分枝数作为长尖对齿藓原丝体的分枝数。
表1消毒剂与消毒时间单因素试验设计表
Table1Singlefactorexperimentdesigntableofdisinfectantanddisinfectiontime

消毒剂Disinfectant消毒时间Disinfectiontime(s)0.1%NaClO0.1%HgCl210、15、20、30、45、60、120

表2 培养基配方表

表3 pH单因素试验设计表
1.3 数据处理与分析
试验数据运用Excel 2010软件进行处理与分析,数据表达为平均值±标准误(Means±SE)。利用统计分析软件SPSS 19.0对不同处理的各个指标进行方差分析和多重比较,分析不同因素对各个指标的影响程度。
2 结果与分析
2.1 消毒方式对长尖对齿藓茎叶体的影响
试验考虑在Hoagland培养基下不同消毒方式对长尖对齿藓茎叶体的成活率的影响(表4~5)。将HgCl2和NaClO处理过的茎叶体接种到3种培养基上都会造成茎叶体死亡,且HgCl2消毒和NaClO消毒在不同的消毒时间下均有显著性差异(P<0.05),但HgCl2消毒液处理下的最高成活率21.00%都显著低于NaClO处理下的最低成活率47.78%(P<0.05),说明HgCl2消毒液不适合作为长尖对齿藓茎叶体的消毒剂。
而NaClO作为苔藓组织培养中常用的消毒剂,具有一定的挥发性,对外植体的毒害作用相对较小。从本试验的结果可以看出(表5),NaClO消毒液在不同的时间处理下有显著差异(P<0.05),且15和20 s处理下的茎叶体的成活率显著高于10、30、45、60、120 s这5个处理(P<0.05),而用0.1% NaClO处理下的15、20 s的茎叶体存活率无显著差异(P>0.05)。说明,用0.1%的NaClO处理15~20 s是最适合长尖对齿藓茎叶体的消毒方式。
表4HgCl2消毒液对长尖对齿藓茎叶体的消毒效果(培养10d)
Table4HgCl2disinfectantonthecormusofD.ditrichoidedisinfectioneffect(cultured10d)

HgCl2浓度ConcentrationofHgCl2(%)消毒时间Disinfectiontime(s)成活率Survivalrate(%)0.110152030456012021.00±0.14b3.82±0.05c0.00±0.00d0.00±0.00d0.00±0.00d0.00±0.00d0.00±0.00d
表5NaClO消毒液对长尖对齿藓茎叶体的消毒效果(培养10d)
Table5NaClOdisinfectantonthecormusofD.ditrichoidedisinfectioneffect(cultured10d)

NaClO浓度ConcentrationofNaClO(%)消毒时间Disinfectiontime(s)成活率Survivalrate(%)0.110152030456012047.78±0.20c86.73±0.11a83.74±0.06a62.50±0.17b51.14±0.08c55.00±0.13bc52.50±0.06c
注:同列相同字母表示处理间差异不显著(P>0.05);不同字母表示处理间差异显著(P<0.05)
Note:The same column with the same letters between treatments were not significant(P>0.05);Different letters indicate significant differences between treatments(P<0.05)
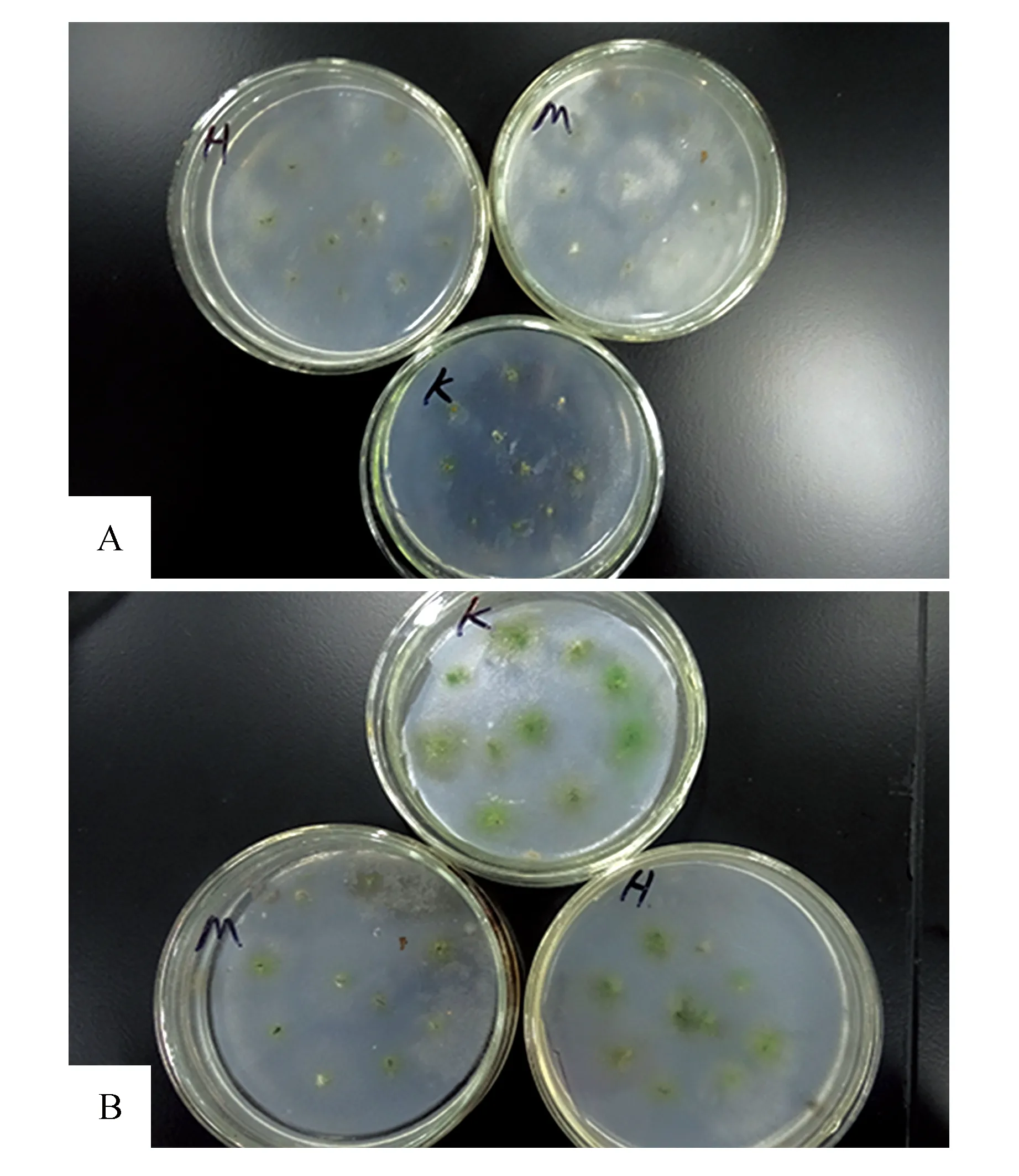
图1 不同培养基下原丝体生长状况 A. MS、Hoagland和Knop培养基在0.1% NaClO消毒15 s基础上培养10 d时原丝体生长状况图;B. MS、Hoagland和Knop培养基在0.1% NaClO消毒15 s基础上培养30 d原丝体生长状况图Fig.1 The growth condition of protonema under different culture medium A. MS,Hoagland and Knop culture medium on the basis of 0.1% NaClO disinfection 15 s culture 10 days’s protonema growth condition; B. MS,Hoagland and Knop culture medium on the basis of 0.1% NaClO disinfection 15 s culture 10 days’s protonema growth condition
2.2 培养基对长尖对齿藓原丝体生长的影响
试验考虑在0.1%NaClO消毒15 s的基础上,选取了Knop、Hoagland和MS 3种培养基,从图2A可以看出随着培养时间的延长,3种培养基上茎叶体的成活率均呈先上升后下降的趋势。这是因为在培养初期,茎叶体先失去了活性,然后随着培养时间的延长,茎叶体出现返绿迹象,并分化原丝体和配子体且原丝体和配子体并存,使得成活率上升(图2);而培养到30 d时,培养基中有藻类的产生,和茎叶体竞争养分,导致一部分的茎叶体死亡,从而使成活率降低。
从图2B和图1可以看出在培养10 d时,MS培养基中茎叶体的存活率显著低于Knop和Hoagland培养基,而随着培养时间的增长,茎叶体开始返绿(图1),并不断的分化出配子体,使得在培养30 d时,三者之间没有存在显著性差异(P>0.05)。而Knop和Hoagland培养基在培养10和30 d时都没有出现显著性差异(P>0.05)。
试验结果表明,Knop和Hoagland培养基上的茎叶体在7 d左右开始萌发原丝体(图3E),而MS培养基上的茎叶体在15 d左右才开始萌发原丝体,而且茎叶体返绿速度很慢。从图2C~D和图1也可以直观看出,在培养30 d时,接种在MS培养基上的茎叶体的原丝体长度和分枝数明显的低于Knop和Hoagland培养基,而Knop和Hoagland培养基上茎叶体分化的原丝体长度和分枝数并无明显差异,但Knop培养基稍微要比Hoagland培养基的值高一些。说明Knop和Hoagland培养基最适合长尖对齿藓茎叶体的生长,而MS培养基不适合。
2.3 pH对长尖对齿藓原丝体生长的影响
试验在0.1%NaClO消毒15 s,在Knop和Hoagland培养基下设置了5.5、6、6.5、7、7.5、8、8.5这7个pH梯度。从图4A~B可以看出无论是Knop还是Hoagland培养基,在pH=5.5的情况下,长尖对齿藓茎叶体已经全部死亡且没有分化原丝体和配子体,与其他几个pH处理差异显著(P<0.01),说明长尖对齿藓茎叶体不适合在过酸的环境中生长。从图4B可以看出在Hoagland培养基的pH=8和pH=8.5的情况下,长尖对齿藓茎叶体已经全部死亡且没有分化原丝体和配子体,说明长尖对齿藓茎叶体在Hoagland培养基下不适合在偏碱的环境中生长。同时可以看出其他几个pH处理随着培养时间的延长,Knop和Hoagland培养基上的原丝体长度均呈上升趋势,在25~30 d时趋于平缓增长,而在30~35 d时又快速增长,但在30和35 d的pH处理所表现出的趋势一致,所以选择30 d进行后续分析。
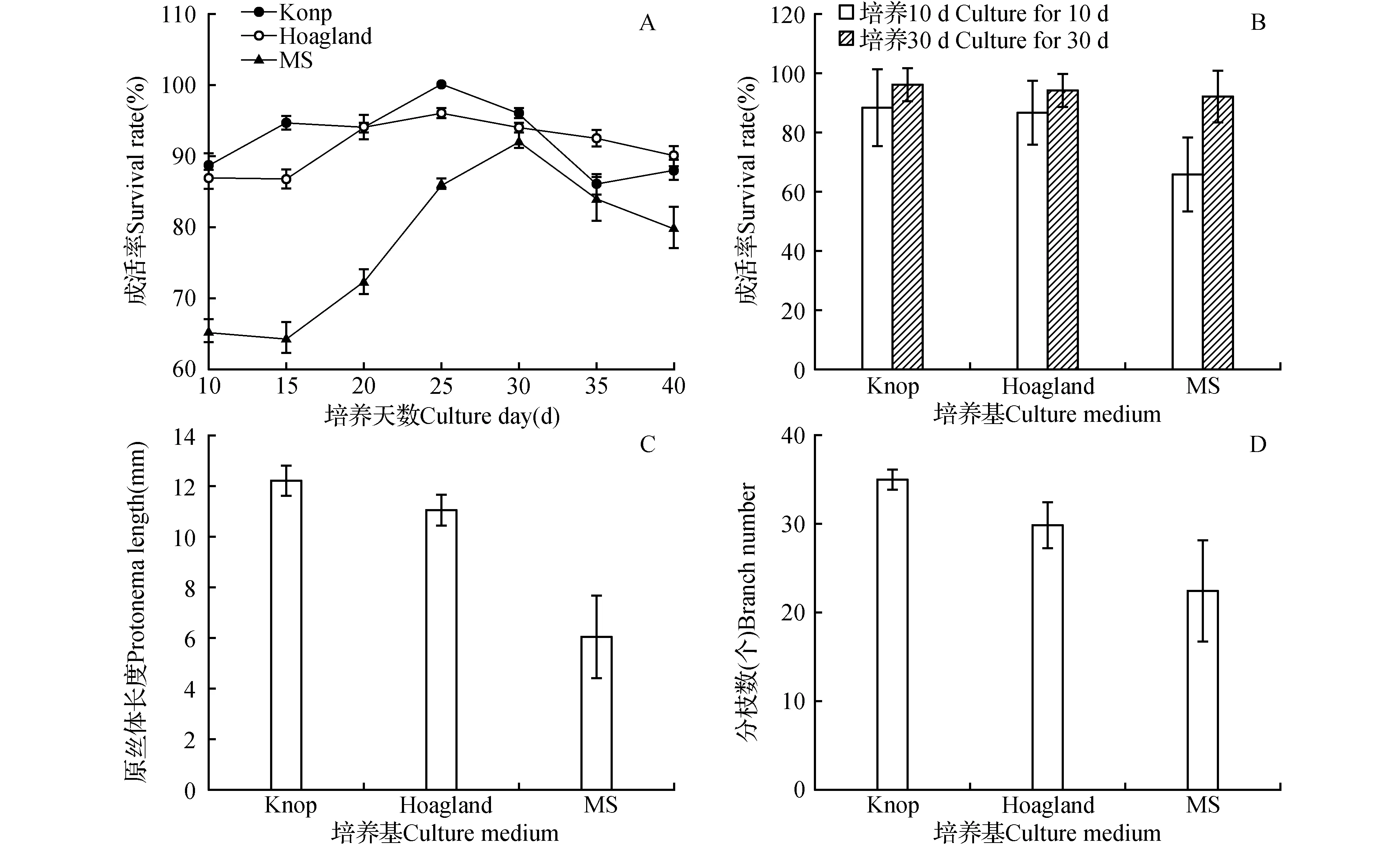
图2 培养基对长尖对齿藓茎叶体的成活率、原丝体长度和分枝数影响 A.在3种培养基中的长尖对齿藓茎叶体成活率随培养时间的变化图;B.在3种培养基中长尖对齿藓茎叶体分别在10和30 d的成活率对比图;C.在3种培养基中长尖对齿藓在30 d的原丝体长度图;D.在3种培养基中长尖对齿藓在30 d的原丝体分枝数图 相同字母代表无显著差异(P>0.05),不同字母代表差异显著(P<0.05) 下同。Fig.2 The influence of culture medium to the survival rate of the cormus of D.ditrichoides,length of protonema and number of branches A. Survival rate of the cormus of D.ditrichoides in three kinds of culture medium with the variation of culture time figure; B. Survival rate of the cormus of D.ditrichoides in three kinds of culture medium respectively in the 10 and 30 day comparison figure;C. D.ditrichoides in three kinds of culture medium in a 30-day protonema length figure; D. D.ditrichoides in three kinds of culture medium in a 30-day protonema branch number figure The same letters represent no significant differences(P>0.05);Different letters represent significant differences(P<0.05) The same as below.

图3 不同培养阶段长尖对齿藓原丝体生长图 a. Knop培养基下培养10 d左右的茎叶体;b. Knop培养基下培养30 d分化的原丝体;c. Knop培养基下培养40 d生长的原丝体;d. Knop培养基下培养50 d分化的原丝体和配子体;e.显微镜下观察的7 d分化出来的原丝体;f. 显微镜下观察的30 d分化的原丝体Fig.3 Different culture stages of the protonema growth of D.ditrichoides a. Cormus cultivated about 10 days under Knop culture medium; b. Differentiation of protonema in 30days under Knop culture medium; c. Differentiation of protonema in 40 days under Knop culture medium; d. Differentiation of protonema and gametophytes in 50 days under Knop culture medium; e. 7 days of differentiation of protonema observed under microscope; f. 30 days of differentiation of protonema observed under microscope
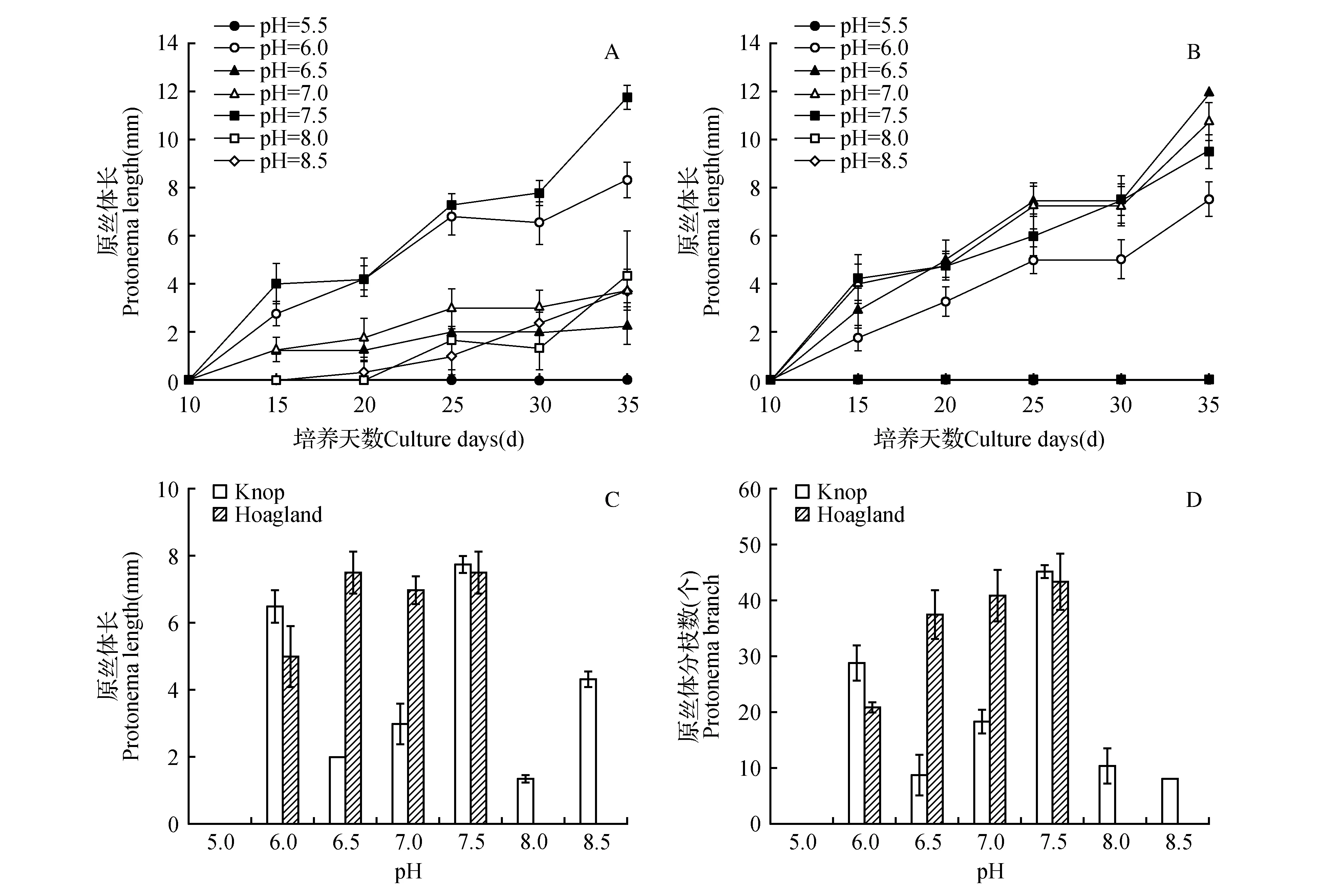
图4 不同pH对长尖对齿藓原丝体长度以及分枝数的影响 A.在Knop培养基不同pH梯度下长尖对齿藓原丝体长度随着培养时间变化图;B.在Hoagland培养基不同pH梯度下长尖对齿藓原丝体随着培养时间变化图;C.在Knop和Hoaland培养基不同pH梯度下30 d的原丝体长度图;D.在Knop和Hoaland培养基不同pH梯度下30 d的原丝体分枝图Fig.4 Effect of different pH on the D.ditrichoides protonema length and branches A. Protonema length of D.ditrichoides as the culture time variation under different pH gradient of Knop culture medium; B. Protonema length of D.ditrichoides as the culture time variation under different pH gradient of Hoagland culture medium; C. Protonema length in Knop and Hoagland medium cultured 30 days at different pH gradient; D. Protonema branches in Knop and Hoagland medium cultured 30 days at different pH gradient
从图4C~D可以看出在培养到30 d时,Knop培养基在pH为7.5时的原丝体长度和分枝数最大,且原丝体长度和分枝数与其他6个pH处理存在着显著性差异(P<0.05),所以在Knop培养基下最适合长尖对齿藓茎叶体原丝体生长的pH是7.5。而在Hoagland培养基下pH在7.5、7和6.5下的原丝体长度和分枝数三者之间没有显著性差异(P>0.05),而与pH为6和5.5这两个处理存在着显著差异(P<0.05),因而在综合对比pH为7.5、7和6.5情况下的原丝体长度和分枝数,可知pH为7.5为长尖对齿藓原丝体在Hoagland培养基下生长的最适pH。
3 讨论
3.1 消毒方式对长尖对齿藓茎叶体的影响
外植体的消毒在苔藓植物的组织培养中是至关重要的一步,但由于藓种的不同以及同一藓种的不同部位对于消毒的承受程度大不相同,所以选择合适的消毒液及其浓度、消毒时间是很关键的一步[24]。本试验中采用了0.1% NaClO和0.1% HgCl2作为消毒液,并设置了不同消毒时间,发现经HgCl2消毒处理的长尖对齿藓茎叶体的成活率显著低于NaClO处理,但在NaClO处理下并不是消毒时间越长,其成活率越高,而是存在一个最适值。
本试验确定的最佳消毒方式是:0.1% NaClO处理15~20 s。李晓毓确定最适合尖叶匍灯藓(Plagiomniumacutum(Lindb.) T.Kop.)外植体的消毒方式是0.05%的HgCl2消毒60 s[28]、郎玉卓发现的最适合大羽藓(Thuidiumcymbifolium(Doz. Et Molk.) Doz.Et Molk)配子体的消毒方式是0.5% NaClO+0.05% HgCl2消毒60 s[11]、Gonzadle研究的大羽藓孢子用5% NaClO消毒5 min才可以得到很好的效果[13]。这和本研究关于不同藓种的消毒方式存在一个最适值是一致的,但是所得到的最佳消毒方式却不一致。这是因为不同藓种对消毒剂以及消毒时间的要求不同,同时本试验选取长尖对齿藓茎叶体作为外植体,相对于苔藓孢子比较脆弱,以及长尖对齿藓藓种的结构特点和生长的环境都会在一定程度上影响消毒效果,从而和前人的研究结果产生差异。
3.2 培养基对长尖对齿藓原丝体的影响
培养基质会对苔藓植物原丝体的生长和分化产生影响,而苔藓植物在培养基上的生长还会受到自身分泌物的反馈抑制作用[29]。崔巍[10]等采用Benecke、MS和Knop 3种培养基培养毛尖紫萼藓(GrimmiapiliferaP.Beauv)的配子体时发现Benecke培养基最适合毛尖紫萼藓的返绿生长。杭璐璐[30]等采用MS、Benecke、1/2MS、改良Knop和Knop培养基培养细叶小羽藓(Haplocladiummicrophyllum(Hedw.) Broth)的孢子时发现MS培养基下孢子萌发率最高。本试验选取了Knop、MS和Hoagland 3种培养基作为长尖对齿藓茎叶体的培养基质。将消毒后的茎叶体接种到培养基上时发现MS的染菌率最高,同时原丝体萌发时间最久且生长缓慢,而Knop和Hoagland两种培养基上染菌率比较低,且在7 d左右就开始萌发原丝体并且迅速生长。
本试验得出MS培养基最不适合长尖对齿藓原丝体的生长,而Knop和Hoagland培养基两者之间没有显著差异(P>0.05)。在MS培养基下长尖对齿藓的原丝体不仅萌发晚而且生长缓慢,这是由于培养基成分不同。MS作为一种无机培养基在很多苔藓种的组织培养中表现出绝对的优势,但在本试验中发现其不适合长尖对齿藓原丝体的生长,此结果和李晓毓[28]等的研究结果一致,这表明苔藓植物组织培养的培养基无机盐成分并不是越全越好。同时由于不同的苔藓种对培养基质的要求是不同的,原丝体在生长的过程中,也会分泌一些化合物到培养基上[29],这些化合物会在某种程度上与培养基相互作用,从而影响原丝体的生长,在MS培养基上生长的原丝体会分泌很多的植物激素,从而影响原丝体生长,促进配子体的分化[31~32]。
3.3 pH对长尖对齿藓原丝体的影响
不同苔藓植物对pH有不同的适应范围,且不同原始生境的苔藓植物之间对环境的pH要求差异也很大。王振杰[33]等在研究不同培养基和pH对金灰藓(Pylaisiellapolyantha(Hedw.)Grout)孢子萌发的影响时发现,在Knop、SH、N63种培养基下设置不同的pH梯度后,金灰藓孢子在3种培养基中萌发最好的pH分别为7、8、7,说明金灰藓孢子适合在碱性环境中生存。本试验选取了5.5~8.5中的7个pH梯度进行长尖对齿藓原丝体的培养,在培养过程中发现pH为5.5时,长尖对齿藓茎叶体未分化原丝体和配子体且已经全部死亡。
本试验得出最适合长尖对齿藓原丝体生长的pH为7.5,和他人的研究结果不一致。这是因为不同苔藓种对pH的要求差异很大,一般认为苔藓植物最适的pH范围是5~9。而在苔藓植物组织培养过程中培养条件的最适pH不仅取决于苔藓植物的种类,同时和该种苔藓植物生长的原始生境有一定的关系,而在特殊生境中生长的苔藓植物对培养基的pH要求更严格。本试验采集的长尖对齿藓采自陕北安塞纸坊沟,其生境处的pH为7.8,试验得出的结果也验证了这一说法,此外苔藓植物在生长过程中会分泌一些物质从而在一定程度上也会影响培养基的pH[31]。长尖对齿藓的生境是在黄土区,而黄土区的土质偏碱性,这样就使得在组织培养条件下,长尖对齿藓的原丝体更适合在中性偏碱的环境中生存。
4 结论
采用单因素试验设计方法,在智能光照培养箱(温度25℃、光强2 500~3 500 Lux、光照时间12 h/12 h)的条件下进行长尖对齿藓茎叶体的组织培养,研究了不同的消毒方式、培养基及pH对长尖对齿藓原丝体生长和分化的影响,主要结论有:(1)消毒方式、培养基和pH对长尖对齿藓茎叶体的成活率、原丝体长度和分枝数均有显著影响(P<0.05),对于长尖对齿藓茎叶体成活率、原丝体长度和的影响顺序为消毒方式>培养基>pH;(2)快速培育长尖对齿藓原丝体的最佳组合为:0.1% NaClO消毒15~20 s+Hoagland/Knop+pH为7.5。本试验的实验结果可以为黄土区苔藓结皮野外恢复工程化应用提供一些借鉴。
1.娄红祥.苔藓化学与生物学[M].北京:科学出版社,2012.
Lou H X.Chemistry and biology of bryophytes[M].Beijing:Science Press,2012.
2.杨永胜,冯伟,袁方,等.快速培育黄土高原苔藓结皮的关键影响因子[J].水土保持学报,2015,29(4):289-294.
Yang Y S,Feng W,Yuan F,et al.Key influential factors of rapid cultivation of moss crusts on Loess Plateau[J].Journal of Soil and Water Conservation,2015,29(4):289-294.
3.牛玉璐,曹永胜.生物结皮及其在荒漠治理中的作用[J].生物学教学,2005,30(10):5-6.
Niu Y L,Cao Y S.Bio-cluster and its role in desert harnessing[J].Biology Teaching,2005,30(10):5-6.
4.高丽倩,赵允格,秦宁强,等.黄土丘陵区生物结皮对土壤物理属性的影响[J].自然资源学报,2012,27(8):1316-1326.
Gao L Q,Zhao Y G,Qin N Q,et al.Impact of biological soil crust on soil physical properties in the Hilly Loess Plateau Region,China[J].Journal of Natural Resources,2012,27(8):1316-1326.
5.李金峰,孟杰,叶菁,等.陕北水蚀风蚀交错区生物结皮的形成过程与发育特征[J].自然资源学报,2014,29(1):67-79.
Li J F,Meng J,Ye J,et al.The development characteristics and formation process of biological soil crusts in Wind-Water erosion crisscross region,Northern Shaanxi Province,China[J].Journal of Natural Resources,2014,29(1):67-79.
6.Bu C F,Wu S F,Xie Y S,et al.The study of biological soil crusts:hotspots and prospects[J].Clean-Soil,Air,Water,2013,41(9):899-906.
7.吴鹏程.苔藓植物生物学[M].北京:科学出版社,1998.
Wu P C.Bryological biology,introduction and diverse branches[M].Beijing:Science Press,1998.
8.黄士良.侧蒴藓类植物孢子萌发与原丝体发育研究[D].石家庄:河北师范大学,2009.
Huang S L.Study on the spore germination and protonema development ofPleurocarpousMosses[D].Shijiazhuang:Hebei Normal University,2009.
9.田桂泉,张萍.干旱区固定沙丘结皮层藓类植物繁殖生物学特性研究[J].河套大学学报,2004,1(1):20-25.
Tian G Q,Zhang P.Study on the characteristic of reproductive biology of mosses in the soil crust of fixed dunes in desert regions[J].Journal of Hetao University,2004,1(1):20-25.
10.崔巍,张海娟,沙伟.毛尖紫萼藓外植体消毒方法及接种培养基的筛选[J].北方园艺,2012(10):138-140.
Cui W,Zhang H J,Sha W.Screen of sterilized methods and inoculation culture medium filter for explants ofGrimmiapilifera[J].Northern Horticulture,2012(10):138-140.
11.郎玉卓,阚世超,刘伟才,等.大羽藓组培初代培养适宜消毒方法的筛选[J].安徽农业科学,2008,36(34):14892-14893.
Lang Y Z,Kan S C,Liu W C,et al.Screening of appropriate disinfection method of early culturedThuidiumcymbifoliumtissue culture[J].Journal of Anhui Agricultural Sciences,2008,36(34):14892-14893.
12.Kute,Elzbieta.Callus induction and gametophyte regeneration in moss cultures[M].New Yourk:McGraw-Hill,1971.
13.Gonzalez M L,Mallon R,Reinoso J,et al.In vitro micropropagation and long-term conservation of the endangered mossSplachnumampullaceum[J].Biologia Plantarum,2006,50(3):339-345.
14.张楠,杜宝明,季梦成.细叶小羽藓(Haplocladiummicrophyllum)配子体组织培养的消毒方法及蔗糖浓度筛选[J].浙江大学学报:农业与生命科学版,2012,38(3):288-292.
Zhang N,Du B M,Ji M C.Sterilization method and sucrose concentration selection for initial culture ofHaplocladiummicrophyllumgametophyte[J],Journal of Zhejiang University:Agriculture & Life Sciences,2012,38(3):288-292.
15.李敏,赵建成,黄士良,等.中华缩叶藓孢子萌发与原丝体发育特征研究[J].西北植物学报,2006,26(8):1521-1525.
Li M,Zhao J C,Huang S L,et al.Characteristics of spore germination and protonemal development inPtychomitriumsinense[J].Acta Botanica Boreali-Occidentalia Sinica,2006,26(8):1521-1525.
16.刘保东,丛迎芝.波叶仙鹤藓的孢子培养及发育生物学研究[J].植物研究,2003,23(2):159-163.
Liu B D,Cong Y Z.Studies on spores culture and development al biology ofAtrichumundulatum[J].Bulletin of Botanical Research,2003,23(2):159-163.
17.范庆书,赵建成,黄士良.金灰藓(Pylaisiellapolyantha)配子体发生的实验观察[J].植物科学学报,2004,22(2):140-144.
Fan Q S,Zhao J C,Huang S L.Experimental observations on the gametophyte development ofPylaisiellapolyantha[J].Journal of Wuhan Botanical Research,2004,22(2):140-144.
18.于淑玲,商艳艳,赵建成.3种藓类植物的原丝体发育特征[J].河北师范大学学报:自然科学版,2010,34(3):343-347.
Yu S L,Shang Y Y,Zhao J C.Study on characteristics of protonema development in three species of mosses[J].Journal of Hebei Normal University:Natural Science Edition,2010,34(3):343-347.
19.Duckett J G,Burch J,Fletcher P W,et al.In vitro cultivation of bryophytes:a review of practicalities,problems,progress and promise[J].Journal of Bryology,2004,26(1):3-20.
20.Christianson M L.ABA prevents the second cytokinin-mediated event during the induction of shoot buds in the mossFunariahygrometrica[J].American Journal of Botany,2000,87(10):1540-1545.
21.Bopp M.50 years of the moss story[M].//Esser K,Kadereit J W,Lüttge U,et al.Progress in Botany.Berlin Heidelberg:Springer,2000:3-34.
22.Cvetic T,Sabovljevic A,Sabovljevic M,et al.Development of the mossPogonatumurnigerum(Hedw.) P.Beauv.under in vitro culture conditions[J].Archives of Biological Sciences,2007,59(1):57-61.
23.刘丽,胡光珍,王幼芳,等.萘乙酸(NAA)对葫芦藓(Funariahygrometrica)孢子萌发及原丝体生长的影响[J].华东师范大学学报:自然科学版,2004(4):138-141.
Liu L,Hu G Z,Wang Y F,et al.Effect of NAA on spore germination and protonema growth ofFunariahygrometrica[J].Journal of east China normal university:Natural Science,2004(4):138-141.
24.于淑玲.观赏苔藓植物的组织培养[J].生物学通报,2009,44(4):56-57.
Yu S L.Tissue culture of watching bryophyte[J].Bulletin of Biology,2009,44(4):56-57.
25.刘世彪,陈军,李菁,等.光照和温度对尖叶拟船叶藓孢子萌发及原丝体发育的影响[J].西北植物学报,2003,23(1):101-106.
Liu S B,Chen J,Li J,et al.Effects of light and temperatures on spore germination and protonema development ofDolichomitriopsisdiversiformis[J].Acta Botanica Boreali-Occidentalia Sinica,2003,23(1):101-106.
26.李敏,赵建成,黄士良,等.垂蒴真藓原丝体发育特征的研究[J].西北植物学报,2005,25(2):363-367.
Li M,Zhao J C,Huang S L,et al.Study on the characteristics of protonema development ofBryumuliginosum[J].Acta Botanica Boreali-Occidentalia Sinica,2005,25(2):363-367.
27.张梅娟,沙伟.东亚砂藓组织培养技术方法研究[J].植物科学学报,2013,31(6):616-622.
Zhang M J,Sha W.Research on tissue culture technology ofRacomitriumjaponicum[J].Plant Science Journal,2013,31(6):616-622.
28.李晓毓,吴翠珍,熊源新,等.尖叶匍灯藓的组织培养及显微观察[J].山地农业生物学报,2006,25(3):217-222.
Li X Y,Wu C Z,Xiong Y X,et al.The tissue culture and microscopic observations ofPlagiomniumcuspidatum[J].Journal of Mountain Agriculture and Biology,2006,25(3):217-222.
29.Schween G,Hohe A,Koprivova A,et al.Effects of nutrients,cell density and culture techniques on protoplast regeneration and early protonema development in a moss,Physcomitrellapatens[J].Journal of Plant Physiology,2003,160(2):209-212.
30.杭璐璐,张楠,季梦成.不同培养基和蔗糖质量浓度对细叶小羽藓孢子萌发的影响[J].浙江农林大学学报,2012,29(3):383-387.
Hang L L,Zhang N,Ji M C.Haplocladium microphyllum spore germination with different culture mediums and sucrose concentrations[J].Journal of Zhejiang A&F University,2012,29(3):383-387.
31.Reutter K,Atzorn R,Hadeler B,et al.Expression of the bacterial ipt gene inPhyscomitrellarescues mutations in budding and in plastid division[J].Planta,1998,206(2):196-203.
32.Schulz P,Reski R,Maldiney R,et al.Kinetics of cytokinin production and bud formation inPhyscomitrella:analysis of wild type,a developmental mutant and two of its ipt transgenics[J].Journal of Plant Physiology,2000,156(5-6):768-774.
33.王振杰,黄士良,李志,等.不同pH值和培养基对金灰藓(Pylaisiellapolyantha)孢子萌发的影响[J].河北师范大学学报:自然科学版,2008,32(6):813-816.
Wang Z J,Huang S L,Li Z,et al.The effect of different pH and cultures on thePylaisiellapolyanthaspore germination[J].Journal of Hebei Normal University:Natural Science Edition,2008,32(6):813-816.
The Light of West China of Chinese Academy of Sciences(2014-91);The Fundamental Research Funds for the Central Universities (2014YQ006);The National Nature Science Foundation of China(41541008)
introduction:ZHAO Yang(1992—),female,master students,engaged in the rapid cultivation of moss crust’s protonema.
date:2016-11-03
TheResearchofKeyInfluenceFactorsofRapidCultureoftheProtonemaofDidymodonditrichoides
ZHAO Yang1,2LI Xiao-Ming4LI Ru-Xue3WANG Chun3BU Chong-Feng1,3*
(1.Institute of Soil and Water Conservation,Chinese Academy of Sciences and Ministry of Water Resources,Yangling 712100;2.University of Chinese Academy of Sciences,Beijing 100049;3.Institute of Soil and Water Conservation,Northwest A&F University,Yangling 712100;4.College of Nature Resource and Environment,Northwest A&F University,Yangling 712100)
In order to provide a rich source of mass vaccination for the field restoration of moss crust, we used two kinds of disinfection method, 0.1% NaClO(10, 15, 20, 30, 45, 60, 120 s) and 0.1% HgCl2(10, 15, 20, 30, 45, 60, 120 s), with Knop, MS and Hoagland as culture media, and set the pH values(5.5, 6, 6.5, 7, 7.5, 8, 8.5), through the single factor experiment design method, we determined the survival rate of the cormus of [Didymodonditrichoides(Broth.)], protonema length and number of branches, thereby exploring key factors that affect the propagation of the protonema ofD.ditrichoides. The results are as follows: (1)The disinfection method, culture medium and pH value have significant influence upon the survival rate of the cormus ofD.ditrichoides, length of protonema and number of branches(P<0.05), in a descending order of disinfection method, culture medium, and pH value; (2)The most suitable disinfection method is 0.1% NaClO with a duration of 15-20 s; (3)The most suitable culture medium for the growth of the protonema ofD.ditrichoidesis Knop and Hoagland; (4)The most suitable pH value for the growth of protonema ofD.ditrichoidesis 7.5. Therefore, the best combination of factors for rapid cultivation of the protonema ofD.ditrichoidesis 0.1% NaClO disinfection 15-20 s+Hoagland/Knop+pH=7.5. Our experiment can be determined to shorten the growth cycle ofD.ditrichoidesand realize rapid propagation, thereby providing experience for the rapid culture and engineering application of moss crust.
Didymodonditrichoides;protonema;disinfection method;culture medium;pH
中国科学院西部之光(2014-91);中央高校优秀青年科研业务专项基金(2014YQ006);国家自然科学基金(41541008)
赵洋(1992—),女,硕士研究生,主要从事苔藓结皮原丝体的快速培育研究。
* 通信作者:E-mail:buchongfeng@163.com
2016-11-03
* Corresponding author:E-mail:buchongfeng@163.com
S154
A
10.7525/j.issn.1673-5102.2017.02.005
