腾格里沙漠不同组成生物结皮特征及其对土壤酶活性的影响
2022-08-15厉萌萌刘德权张凌基刘可欣何明珠
王 凯,厉萌萌,刘德权,张凌基,刘可欣,许 华,唐 亮,何明珠,张 珂,4,*
1 郑州轻工业大学材料与化学工程学院,郑州 450000 2 森特士兴集团股份有限公司,北京 100176 3 中国科学院西北生态环境资源研究院沙坡头沙漠研究试验站,兰州 730000 4 环境污染治理与生态修复河南省协同创新中心,郑州 450000
土壤酶在土壤生态系统中参与着物质循环和能量流动,与土壤肥力和土壤健康紧密联系[1]。当土壤条件发生变化(如土地利用方式、土地退化及土壤恢复等)时,土壤酶活性也会迅速发生变化,因此,土壤酶活性是土壤质量变化的敏感指标[2—5]。在众多土壤酶中,土壤过氧化氢酶活性的增加可以提高土壤氧化还原条件[6];土壤蛋白酶和脲酶直接参与土壤中氮的转化,土壤蛋白酶可以将蛋白质转化成氨基酸[7],土壤脲酶可以将尿素转化成铵态氮[1];土壤碱性磷酸酶是土壤有机磷矿化和微生物活性的良好指标[8];土壤蔗糖酶活性的提高可以增加土壤碳的周转[9]。因此,了解生态系统中土壤酶活性的变化,可以为土壤酶活性与土壤质量及可持续性的关系提供理论支撑。
生物结皮是由土壤颗粒、隐花植物及土壤中微生物等形成的有机复合体,在增强土壤稳定性、固碳和固氮、调节土壤水分、促进维管植物的建立和改善微生物多样性等方面起到重要作用[10—16]。目前,有关生物结皮对土壤酶活性的研究主要集中在生物结皮的存在、生物结皮类型、植被下的生物结皮等对土壤酶活性的影响。如:Miralles等[17]对西班牙东南部塔贝纳斯沙漠的藻结皮和2种主要优势物种不同的地衣结皮的研究发现,参与碳、氮、磷三种循环的水解酶的活性要比裸地水解酶的活性要高;刘艳梅等[12]在腾格里沙漠进行的研究发现,虽然人为踩踏生物结皮会导致其下方土壤酶活性下降,但生物结皮的存在提高了土壤酶的活性;孙永琦等[7]在毛乌素沙地油蒿灌丛的研究发现,与灌丛裸地相比,灌丛下生物结皮的存在更能显著提高蔗糖酶和脲酶的活性。除此之外,研究表明,随着生物结皮的演替,结皮厚度和叶绿素a呈增加趋势,且后期藓结皮下的土壤酶活性高于早期藻结皮下的土壤酶活性[18—21]。生物结皮通常由丝状蓝藻的生长发育开始,通过丝状蓝藻所分泌的大量胞外聚合物来缠绕、粘结土壤颗粒,并在沙地表层形成藻结皮,同时,胞外聚合物(主要成分为胞外多糖和蛋白质)可作为微生物活动和酶分解的重要碳源和氮源,进而提高土壤酶活性和增加土壤养分[22—24]。那么,在不同组成的生物结皮中胞外聚合物的含量将如何变化?胞外聚合物对土壤酶活性的影响如何?此外,生物结皮中胞外聚合物是荒漠生态系统碳循环的主要C源,其占据土壤表层有机质碳的70%—75%[25—26]。而且,生物结皮中叶绿素a的含量变化是其光合作用固定碳能力的体现,且结皮中的蓝藻又可对氮进行固定[12—13]。那么,不同组成生物结皮的养分特征又将如何变化,其对土壤酶活性的影响又是如何?对上述问题的研究将有助于进一步明确不同组成生物结皮对土壤酶活性的贡献,同时,将丰富对生物结皮的研究并对荒漠土壤的恢复和提高土壤肥力具有重要的生态意义。
本文以中国科学院沙坡头沙漠试验研究站红卫天然植被区的藻结皮、地衣结皮、地衣-藓结皮、藓结皮4种生物结皮及流沙(对照)为研究对象,分析了不同组成生物结皮层的厚度、叶绿素a、胞外多糖和蛋白质、全碳(C)、全氮(N)和全磷(P)含量及结皮层下方土壤酶活性的变化特征,探讨不同组成生物结皮以结皮层的厚度、叶绿素a、胞外聚合物及C、N、P含量为生物结皮主要特征的变化规律及其对结皮层下土壤酶活性的影响,以期为明确生物结皮在荒漠生态系统中的作用提供理论依据。
1 材料与方法
1.1 研究区概况
研究区位于宁夏腾格里沙漠东南缘中国科学院沙坡头沙漠试验研究站以西22 km的红卫天然植被区(37°32′—37°26′N,105°02′—104°30′E,海拔约1300 m)。该区属于典型的荒漠化草原气候,年均气温10 ℃,年均降雨量为186 mm,且降雨量主要集中在7—9月,年蒸发量约2400 mm,年平均风速2.6 m/s[27]。该区土壤基质主要为灰钙土和风沙土,植被区灌木和半灌木主要包括油蒿(Artemisiaordosica)、驼绒藜(Ceratoideslatens)、柠条(Caraganakorshinskii)等,优势草本植物主要包括茵陈蒿(A.capillaris)、冷蒿(A.frigida)、雾冰藜(Bassiadasyphylla)和小车前(Plantagominuta)等[28]。该区域的生物结皮的演替通常始于丝状蓝藻(具鞘微鞘藻)定殖于稳定沙丘,然后小球藻、绿藻等侵入丝状蓝藻内部空间形成藻结皮,随着藻结皮对土壤表面稳定性的增加和水分利用的提高,地衣和藓逐渐生长和定殖[29]。试验区域分布有藻结皮、地衣结皮、混生结皮和藓结皮,结皮总盖度为83%,其中藻结皮、地衣结皮、混生结皮和藓结皮的盖度分别为9%、33%、10%和31%[28]。
1.2 样品采集
于2019年3月在中国科学院沙坡头沙漠研究试验站红卫天然植被区选择藻结皮、地衣结皮、地衣-藓结皮、藓结皮,并以流沙作为生物结皮未发育的初始阶段(对照)共5个不同组成生物结皮类型进行样品采集。选择不同组成生物结皮约占90%的区域分别设置3个25 cm×25 cm的小样方进行结皮层(流沙取表层0—2 mm)、结皮下0—5 cm和5—10 cm土壤进行样品采集。采集结皮样品前,先用蒸馏水润湿结皮表面,以保证采集过程中样品的完整性。采集的结皮和土壤样品分别放进培养皿和自封袋中并进行标记。结皮样品用于测定结皮的厚度、叶绿素a、胞外聚合物、C、N和P。土壤样品储存于4℃恒温冰箱中用于测定土壤酶活性。
1.3 样品测定
生物结皮厚度用游标卡尺(SL01—22,上海鼎棱实业发展有限公司)测量。
叶绿素a的提取:取2 cm×2 cm大小的生物结皮,放入离心管中,加入5 mL提取液(95%丙酮和95%乙醇2∶1混合液)在暗室环境下振荡过夜,于第二天取出离心5 min,然后,取上清液定容至10 mL,在663 nm与645 nm波长下测量吸光度,进行结皮生物量的测定。公式如下:
叶绿素a(μg/cm2)=(12.7×OD663—2.69×OD645)×V/S
式中,OD663和OD645分别为在波长663 nm和645nm下的吸光度;V为显色液体积;S为结皮面积。
生物结皮中胞外聚合物利用氢氧化钠、氯化钠及福尔马林进行提取[30—31]。胞外多糖的测定采用苯酚—硫酸法[32],胞外蛋白质的测定采用考马斯亮蓝法[33]。生物结皮层及流沙表层C、N含量用德国元素分析仪(a vario MACRO CUBE elementar,Germany)进行测定,P含量用H2SO4-H2O2消煮法进行测定[34]。土壤过氧化氢酶、蔗糖酶、脲酶、碱性磷酸酶和蛋白酶分别采用高锰酸钾(KMnO4)滴定法、3,5-二硝基水杨酸比色法、苯酚钠-次氯酸钠比色法、磷酸苯二钠比色法、茚三酮比色法进行测定[35]。
1.4 数据处理
利用Excel对数据进行初步整理,用OriginPro 8.5绘图。利用SPSS 18.0对生物结皮特征和结皮下土壤酶活性进行方差分析,采用双因素方差分析对不同组成生物结皮和土壤深度对结皮下土壤酶活性的影响进行分析。采用Pearson相关分析分析不同土壤酶活性之间、土壤酶活性与环境因子的相关关系。采用Canoco 5.0软件以土壤酶活性为响应变量,结皮特征为解释变量进行冗余分析。
2 结果与分析
2.1 不同组成生物结皮特征
与流沙相比,藻结皮、地衣结皮、地衣-藓结皮、藓结皮的结皮厚度、叶绿素a、胞外多糖、胞外蛋白质、C、N、P、C/N、C/P和N/P均显著增加(P<0.001)。从生物结皮特征变异系数来看,胞外多糖、P和C/N表现为中等变异性,结皮厚度、叶绿素a、胞外蛋白质、C、N、C/N、C/P均表现为强变异性。流沙表层的叶绿素a、胞外多糖、胞外蛋白质、C、N、P及其化学计量比均为最低。从藻结皮到藓结皮,结皮厚度、叶绿素a含量分别增加了3.91和4.50倍;胞外多糖和蛋白质含量分别由(14.60±1.26)mg/kg、(13.16±0.89)mg/kg增加到(20.39±0.29)mg/kg和(19.37±1.48)mg/kg,但胞外多糖和蛋白质含量在地衣结皮、地衣-藓结皮和藓结皮间无显著性差异(P>0.05)。C、N、P及其化学计量比在不同组成生物结皮的变化范围分别为:0.38—51.42 g/kg、0.11—3.36 g/kg、0.11—0.54 g/kg、4.00—15.32、3.38—94.98、0.91—6.23,其中C和C/P在不同组成生物结皮间呈显著性差异(P<0.05),N和P在地衣-藓结皮和藓结皮间无显著性差异(P>0.05),C/N和N/P在藻结皮、地衣-藓结皮和藓结皮间无显著性差异(P>0.05)(表1)。

表1 不同组成生物结皮特征
2.2 不同组成生物结皮下土壤酶活性的变化特征
不同组成生物结皮下土壤酶活性均呈增加趋势,且五种土壤酶活性的最小值均出现在流沙中。在0—5 cm土层,沿着藻结皮、地衣结皮、地衣-藓结皮和藓结皮的方向,土壤过氧化氢酶和蔗糖酶活性在不同生物结皮间呈显著性差异(P<0.05),且分别增加了1.96、3.47倍;脲酶和碱性磷酸酶活性在不同生物结皮下呈显著性差异(P<0.05),且均在地衣结皮下最小(分别为(0.15±0.03)mg g-1(24h)-1,(0.13±0.001)mg g-1(2h)-1),藓结皮下最大(分别为(0.40±0.02)mg g-1(24h)-1,(0.27±0.0004)mg g-1(2h)-1);土壤蛋白酶活性在藻结皮下最小((0.43±0.03)mg g-1(24h)-1),在地衣-藓结皮下最大((1.69±0.001)mg g-1(24h)-1),但蛋白酶活性在地衣结皮和藓结皮间无显著性差异(P>0.05)。5—10 cm土壤的土壤酶活性均低于0—5 cm土壤的土壤酶活性(图1)。
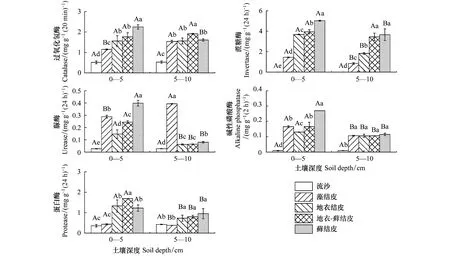
图1 不同组成生物结皮土壤酶活性特征
双因素方差分析显示,5种土壤酶活性在不同组成生物结皮中的变化均呈显著性差异(P<0.01)。除土壤过氧化氢酶外,蔗糖酶、脲酶、碱性磷酸酶和蛋白酶酶活性在0—5 cm和5—10 cm间均呈显著性差异(P<0.01)。不同组成生物结皮和土壤深度的交互作用对过氧化氢酶、蔗糖酶、脲酶、碱性磷酸酶和蛋白酶活性均有显著影响(P<0.01)(表2)。

表2 生物结皮及土壤深度对土壤酶活性影响的方差分析
2.3 生物结皮特征与土壤酶活性的关系
Pearson相关性分析结果显示,除碱性磷酸酶、脲酶与蛋白酶无显著相关关系外,结皮下土壤的其余酶活性间均呈极显著正相关关系(P<0.01)。结皮厚度、叶绿素a、胞外多糖和蛋白质、C、N、P及其化学计量特征与5种酶活性均呈显著正相关关系(P<0.05)(表3)。
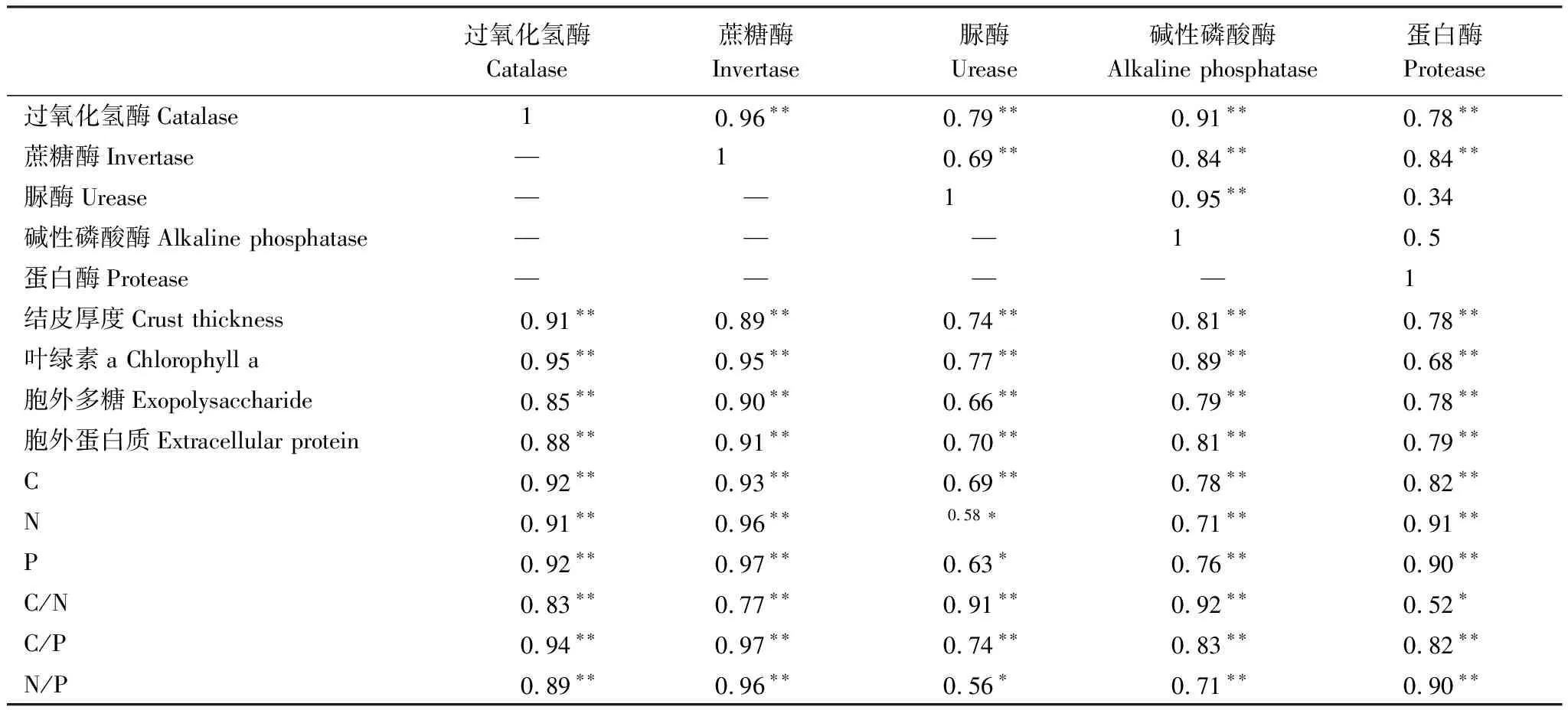
表3 生物结皮特征与土壤酶活性的相关关系
生物结皮特征对结皮下土壤酶活性影响的冗余分析发现。单独效应结果可见,生物结皮特征对结皮下土壤酶活性影响的重要性大小为:胞外蛋白质>胞外多糖>C/N>P>C/P>N/P>叶绿素a>N>结皮厚度>C,以上结皮特征对结皮下土壤酶活性的影响均达到显著水平,对酶活性大小的解释量分别为92.2%、90%、75%、68.9%、62.8%、62.3%、59.6%、57%、56.8%、52.1%(表4)。由条件效应结果可见,生物结皮特征对结皮下土壤酶活性影响的关键影响因子主要为胞外蛋白质含量(92.2%)、C/N(4%)和P(2.2%)。由图2可知,C/N与脲酶有较小的夹角;胞外多糖、胞外蛋白质及叶绿素a与过氧化氢酶和蔗糖酶有较小的夹角;N和N/P与蛋白酶有较小的夹角(表4、图2)。

表4 生物结皮对土壤酶活性的单独效应及条件效应

图2 生物结皮对土壤酶活性影响的冗余分析
3 讨论
在不同组成生物结皮中,结皮特征呈现显著变化。其中,结皮厚度在一定程度上代表结皮的发育程度,一般而言,随着发育时间的增加,结皮厚度呈增加的趋势[37]。结皮厚度的增加可以提高固沙能力和改善土壤水热条件,进而促进生物结皮的生长发育[12,38]。王翠萍等[19]在黄土高原半干旱地区的研究发现,结皮厚度的变化规律为苔藓—藻结皮>藻结皮>薄层藻结皮>无结皮,且随着结皮厚度的增加贮水能力增加;吴丽等[39]对库布齐沙漠接种蓝藻后发现,随着生物结皮的类型发生改变,土壤表层的结皮厚度和结皮生物量增加。与上述研究结果一致,在本研究中,不同组成生物结皮厚度随藻结皮、地衣结皮、地衣-藓结皮和藓结皮也呈显著增加,结皮厚度的变化规律为藓结皮>地衣-藓结皮>地衣结皮>藻结皮。
叶绿素a是光合作用的基础物质,且叶绿素a含量很大程度上可以反应生物结皮生长状况和光合作用能力,因此,可用叶绿素a含量反映结皮的生物量[40—41]。Wang等[42]在对沙地接种藻类实验的研究发现,在接种第二年出现藓类,且叶绿素a含量随着接种时间的延长而增加;Kidron等[43]对生物结皮的叶绿素a含量测定发现,叶绿素a含量表现为藓结皮>地衣结皮>藻结皮。这与本研究结果一致,沿藻结皮、地衣结皮、地衣-藓结皮、藓结皮方向,叶绿素a含量显著增加,说明结皮生物量和光合作用能力得到提升。同时,研究表明,生物结皮通过光合作用合成并分泌的胞外多糖和胞外蛋白质,是影响土壤形成及养分特征的重要因子,在生物结皮的发育中起到重要的作用[23,44—46]。在本研究中,蓝藻是分泌胞外聚合物的主要物种,且蓝藻是藻结皮的优势物种,由于不同组成生物结皮优势物种发生改变,从而导致胞外聚合物含量在地衣结皮、地衣-藓结皮和藓结皮间无显著差异[25,47]。
在本研究中,沿藻结皮、地衣结皮、地衣-藓结皮、藓结皮方向,结皮层的C、N和P含量呈显著增加,说明生物结皮的固碳和固氮能力随结皮组成的变化显著增加[40,48]。不同组成生物结皮C、N含量的变异性高于P含量的变异性,这可能是因为结皮层的P主要来源于成土母岩的风化,且干旱地区降雨量少和频率低的特点降低了地表径流对P的迁移,从而导致生物结皮层的P含量增加不显著[47]。C、N、P化学计量比是衡量土壤有机构成和元素平衡的重要指标,可有效反映土壤供肥能力和质量状况。高丽倩等[41]对黄土丘陵区不同演替阶段生物结皮的研究发现,生物结皮显著影响C、N、P化学计量特征,且随着演替进行呈增加趋势;杨巧云等[48]认为生物结皮对C、N的影响主要集中在表层,而对P的影响较低,导致C/P增加显著。在本研究中,C/N、C/P和N/P在藻结皮、地衣结皮、地衣-藓结皮、藓结皮方向上均呈显著增加,但由于C、N较P有较高的变异系数,导致C/P和N/P的变异性较强。此外,植物N/P可作为养分限制类型的预测指标,N/P小于14表示植物受到N限制,N/P大于16则表示植物受到P限制,N/P在14—16之间是受到N和P的共同影响[49]。Güsewell等[50]研究发现,当苔藓作为一个单独植被时,苔藓与维管植物有相同的临界氮磷比。在本研究中,尽管结皮的N含量沿藻结皮、地衣结皮、地衣-藓结皮、藓结皮方向显著增加,但不同组成生物结皮的N/P均小于14,由此说明,不同组成生物结皮更易受N的限制。
土壤酶是土壤中最活跃的有机成分之一[51]。在荒漠生态系统中,生物结皮可以显著提高结皮下土壤酶活性,但是随着生物结皮组成发生变化,不同生物结皮的优势物种将发生变化,必然会影响结皮下土壤酶活性[17—19]。Ghiloufi等[52]在西班牙干旱生态系统中研究发现,生物结皮的出现显著提高结皮下水解酶的活性,且地衣结皮较藻结皮更能提高酶活性;Liu等[29]在腾格里沙漠的研究表明,藓结皮下土壤酶活性大于藻—地衣结皮下的土壤酶活性。本研究与上述研究结果一致,生物结皮显著提高了结皮下5种土壤酶活性,且藓结皮下土壤酶活性高于藻结皮下土壤酶活性。此外,在本研究中,随着土壤深度的增加,土壤酶活性呈下降的趋势,且生物结皮与土壤深度的交互作用对土壤酶活性有显著影响,这与以往的研究[52—53]一致,其原因可能是土壤酶活性有表聚性特征,从而导致土壤酶活性随着土壤深度的增加而降低[54]。
在本研究中,不同组成生物结皮特征对结皮下土壤酶活性有显著正相关关系。进一步通过冗余分析发现,虽然单独效应表明生物结皮特征与结皮下土壤酶活性均达到显著影响水平,但是条件效应分析发现,胞外蛋白质、C/N、P是影响土壤酶活性的3个重要因素。可能的原因是:(1)胞外蛋白质作为胞外聚合物的主要物质之一,一方面通过直接参与生物结皮的形成影响土壤酶活性,另一方面,胞外蛋白质能够作为酶分解的底物,从而提高土壤酶活性[12,39,44—45];(2)C/N不仅能够用于衡量生物结皮层的C、N平衡状况,还能对微生物的组成产生影响,进而影响土壤酶活性[55—58];(3)本研究通过生物结皮的N/P推断出不同组成生物结皮主要受N限制,而结皮自身具备的固氮能力可为结皮的发育提供N源,因此,导致结皮中较为稳定的P是影响结皮下土壤酶活性的主要因素之一[12—13,59]。
4 结论
本文通过对不同组成生物结皮特征变化及其对土壤酶活性的影响研究发现,沿藻结皮、地衣结皮、地衣-藓结皮、藓结皮方向,叶绿素a、结皮厚度、胞外多糖和蛋白质均呈显著增加,但胞外多糖和胞外蛋白质在地衣结皮、地衣-藓结皮和藓结皮间无显著差异;不同组成生物结皮更利于C和N的积累,但均受到N的限制;生物结皮下土壤过氧化氢酶、蔗糖酶、脲酶、碱性磷酸酶、蛋白酶活性均沿着藻结皮、地衣结皮、地衣-藓结皮、藓结皮方向呈显著增加,但随土壤深度的增加而减小;生物结皮特征中胞外蛋白质、C/P、P含量是影响结皮下土壤酶活性的主要因子。本研究结果将为进一步揭示荒漠地区不同组分生物结皮特征对土壤酶活性的贡献及荒漠生态系统的恢复和科学管理提供理论依据。
