cry1Ac基因启动子表达Vip3Aa蛋白特性分析
2017-11-08孙海燕高继国
刘 明,孙海燕,高继国
(1.东北农业大学生命科学学院,哈尔滨 150030;2.黑龙江八一农垦大学测试中心,黑龙江 大庆 163319)
cry1Ac基因启动子表达Vip3Aa蛋白特性分析
刘 明1,2,孙海燕2,高继国1*
(1.东北农业大学生命科学学院,哈尔滨 150030;2.黑龙江八一农垦大学测试中心,黑龙江 大庆 163319)
苏云金芽胞杆菌cry基因启动子常用于构建蛋白表达载体。为探讨苏云金芽胞杆菌cry基因启动子指导Vip3Aa蛋白表达情况及杀虫活性,以pUC19载体为基础,运用重叠引物PCR方法构建Vip3Aa11表达载体,并与由T7启动子指导的Vip3Aa11表达蛋白杀虫活性、抗胰蛋白酶稳定性比较,初步探索发酵条件。结果表明,cry1Ac启动子与T7启动子均在上清液中表达大小为88 ku Vip3Aa11蛋白,对甜菜夜蛾、棉铃虫杀虫活性差异不显著,cry1Ac基因启动子在37℃、48 h更适合Vip3Aa11蛋白的表达,为vip基因表达、功能验证及杀虫机理等研究提供新思路。
苏云金芽胞杆菌;cry1Ac启动子;Vip3Aa;蛋白表达
苏云金芽胞杆菌(Bacillus thuringiensis,Bt)为一种革兰氏阳性细菌,可产生多种具有杀虫活性蛋白质,如杀虫晶体蛋白(Insecticidal crystal proteins,ICPs)和营养期杀虫蛋白(Vegetative insecticidal proteins,VIPs)[1]。作为目前应用最广泛的微生物杀虫剂和转基因抗虫育种资源[2],Bt对多种昆虫、线虫、原生动物等有特异杀虫活性。苏云金芽胞杆菌可大量表达杀虫蛋白,主要驱动表达启动子具有较高活性,目前已有cry基因启动子成功应用于构建表达cry基因载体,主要有cry1A[3]、cry3A[4-5]、cry4A[6]、cry8E[7-8]启动子。cry1Ac启动子为重叠双启动子BtⅠ和 BtⅡ,二者分别由σE和σK调控[9]。pBMB1A以低拷贝载体pHT304为基础,cry1Ac启动子指导的穿梭表达载体,可快速克隆表达不同类别Cry蛋白;pBlueAc以克隆载体pBlue为基础,cry1Ac启动子指导的克隆表达载体,可在大肠杆菌中表达Cry蛋白,表达产物与Bt蛋白具有相似性质,目前已应用于快速克隆表达Cry1Ac及Cry1Ie蛋白[10-11]。
Vip蛋白在Bt菌株营养生长期分泌到胞外,对多种Cry蛋白不敏感的鳞翅目昆虫具有较好杀虫活性,与Cry蛋白进化上无同源性,杀虫机理不同。Vip蛋白被认为是Bt第二代杀虫蛋白,可扩大Bt基因应用范围,延缓害虫抗性,应用前景广阔[12]。截止目前,已发现并命名的vip基因有142个,其中vip3类106个,包含64个vip3Aa、2个vip3Ab、1个vip3Ac、6个vip3Ad、1个vip3Ae、4个vip3Af、15个vip3Ag、1个vip3Ah、1个vip3Ai、2个vip3Aj、2个vip3Ba、3个vip3Bb、4个vip3Ca。有关vip3Aa杀虫机制、活性区、蛋白表达及蛋白结构等成为研究热点[13]。
目前关于cry基因启动子用于构建Bt Cry蛋白表达载体研究较多,但用cry基因启动子在大肠杆菌中表达Vip蛋白研究鲜有报道。本研究以cry1Ac基因启动子和vip3Aa11基因为试验材料,分析vip3Aa11在大肠杆菌中表达情况,并与利用T7启动子pET28a表达载体表达的Vip3Aa11蛋白作功能及特性比较,旨在为vip基因表达及功能验证、杀虫机理等研究提供新思路。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
东北农业大学生物化学与分子生物学实验室

表1 菌株与质粒Table 1 Strains and plasmids
1.1.2 培养基
LB液体培养基:1%胰蛋白胨,1%氯化钠,0.5%酵母提取物。
LB固体培养基:液体培养基基础上加1.5%琼脂粉。
2×LB液体培养基:2%胰蛋白胨,2%氯化钠,1%酵母提取物。121℃,湿热灭菌15 min。
1.1.3 试剂
限制性内切酶及DNA连接试剂盒购自TaKaRa公司,凝胶回收及质粒提取试剂盒购于Axygen公司,KOD-Plus DNA polymerase购自TOYOBO公司,其他试剂均为国产分析纯和生化试剂。
1.1.4 供试昆虫
甜菜夜蛾(Spodoptera exigua)、棉铃虫(Heliothis提供试验菌株和质粒,特征见表1。armigera)及饲料购自河南省济源白云实业有限公司。
1.2 方法
1.2.1 引物设计及PCR反应
根据cry1Ac序列设计用于扩增cry1Ac启动子序列的引物c1AcPF/c1AcPV3AaR,根据vip3Aa11基因序列设计用于扩增vip3Aa11全长基因序列的引物V3Aac1AcPF/V3AaR,引物序列如表2所示,下划线部分为酶切位点,在引物c1AcPF 5'端上引入BamHⅠ酶切位点,引物V3AaR 5'端上引入SalⅠ酶切位点。
PCR反应体系为50μL,包含1μL模板,10 μmol· L-1引物各1 μL,5 μL dNTPs,5 μL 10×KOD Buffer、2 μL MgSO4、1 μL KODPlus DNA polymerase,最后去离子水补至50μL体积。PCR程序:94℃ 2 min;94℃ 20 s,55℃20 s,68 ℃ N min(扩增效率为1 kb · min-1),30 cycles;68℃ 10 min。回收PCR产物,选用SalⅠ、BamHⅠ限制性内切酶同时酶切PCR回收产物及pUC19载体,凝胶电泳回收后,按照载体与目的片段物质的量比为1:3连接,转化大肠杆菌JM109感受态细胞,37℃培养12 h。用引物M13F和M13R鉴定阳性克隆。由吉林省库美生物科技有限公司测序,DNAMAN软件分析DNA序列。

表2 引物名称及序列Table 2 Primers and sequences
1.2.2 蛋白表达分析
pAc19vip3Aa11-JM109菌株培养:在固体LB培养基划线培养,挑单菌落接种含氨苄青霉素的LB液体培养基试管中,37℃,220 r·min-1培养8 h,按照1%接种量至含100 mL 2×LB液体培养基三角瓶中,37℃,220 r·min-1培养48 h。
pET28a-vip3Aa11-BL21菌株培养:在固体LB培养基划线培养,挑单菌落接种于含卡纳霉素的LB液体培养基试管中,37℃,220 r·min-1培养8 h,按照1%接种至含100 mL LB液体培养基三角瓶中,37℃,220 r·min-1培养至OD600为0.5左右,加入终浓度为1 mM的IPTG,16℃诱导12 h。
8 000 r·min-1离心收集菌体,用20 mM的Tris·HCl(pH 8.0)将菌体混合均匀,超声波破碎(70%,3 s,3 s),12 000 r·min-1,4 ℃离心10 min,收集上清。pAc19-vip3Aa11-JM109沉淀用2%的Triton-X100清洗,12 000 r·min-1,4 ℃离心10 min,清水冲洗沉淀,用20 mmol·L-1的Tris-HCl(pH 8.0)悬浮。pET28a-vip3Aa11-BL21沉淀直接用 20 mmol· L-1的 Tris· HCl(pH 8.0)悬浮。SDS-PAGE检测蛋白表达情况。
1.2.3 生物活性测定
甜菜夜蛾:将粗提蛋白用20 mmol·L-1的Tris·HCl(pH 8.0)稀释成不同浓度,取1 mL待测样品溶液加入10 g人工饲料中混匀,均匀分装于24孔板中,选用未经取食的初孵健康幼虫(孵化后12 h内)作为试虫,在26~30℃室温下,每孔接1头,3次重复,同时设置空白对照,放入25℃光照培养箱中,72 h后调查死、活虫数,计算致死中浓度(LC50)。
棉铃虫:将粗提蛋白用20 m mmol·L-1的Tris·HCl(pH 8.0)稀释成不同浓度,取1 mL待测样品溶液加到10 g人工饲料中混匀,均匀分装于24孔板中,选用未经取食的初孵健康幼虫(孵化后12 h内)作为试虫,在26~30℃室温下,每孔接1头,3次重复,同时设置空白对照,放入30℃光照培养箱中,72 h后调查死、活虫数,计算致死中浓度(LC50)。
1.2.4 胰蛋白酶消化分析
将可溶组份蛋白与1 mg·mL-1胰蛋白酶以10:1(体积比)比例混合,37℃水浴, 分别在30、120 min后取样,SDS-PAGE检测分析。
1.2.5 表达条件分析
在不同培养温度及培养时间条件下,按照1.2.2中步骤提取蛋白,通过SDS-PAGE分析目的蛋白表达情况。
2 结果与分析
2.1 pAc19-vip3Aa11构建
以LBH97基因组DNA为模板,c1AcPF和c1AcPV3AaR为引物对,利用KOD-Plus DNA polymerase(TOYOBO),扩增出368 bpcry1Ac启动子序列。以质粒pET28a-vip3Aa11为模板,V3Aac1AcPF和V3AaR为引物对, KOD-Plus DNA polymerase扩增出2 370 bpvip3Aa11全长序列。以两者PCR回收产物为模板,c1AcPF和V3AaR为引物对, KOD-Plus DNA polymerase作PCR扩增2 738 bp的带cry1Ac启动子vip3Aa11序列(见图1)。回收PCR产物,经SalⅠ、BamH Ⅰ双酶切后,连接SalⅠ、BamHⅠ消化后pUC19载体,将其转化大肠杆菌JM109。经PCR鉴定、测序验证转化子。经鉴定的重组子命名为pAc19vip3Aa11。
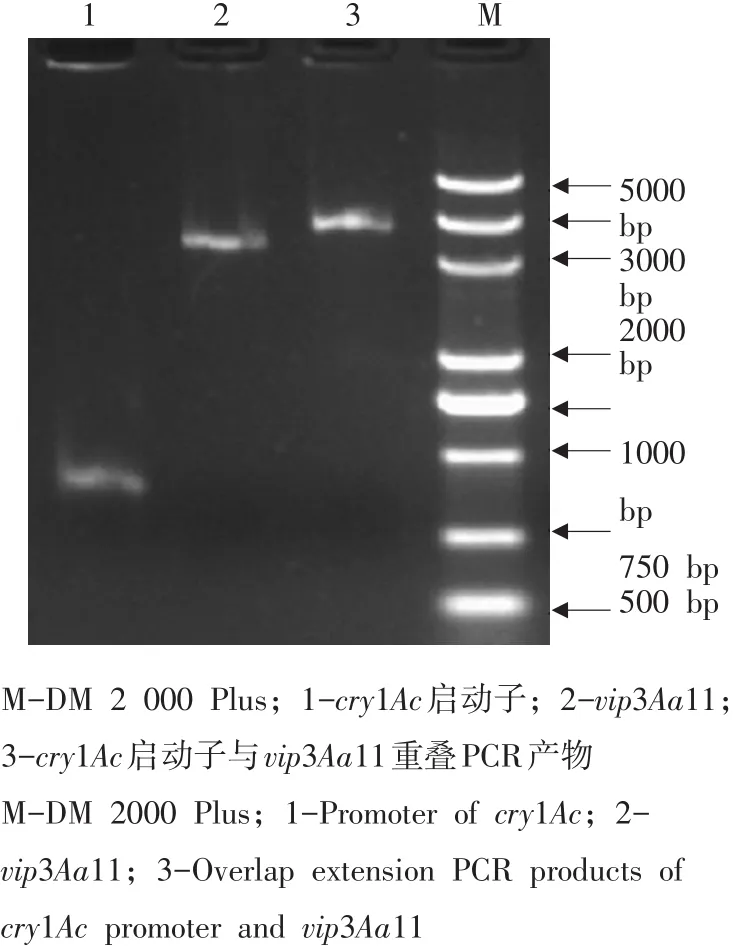
图1 重叠PCR产物的琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of overlap extension PCRamplified products
2.2 SDS-PAGE分析cry1Ac基因启动子与T7启动子表达Vip3Aa11
cry1Ac启动子表达Vip3Aa11蛋白上样量为10μL,T7启动子表达的Vip3Aa11蛋白上样量为3μL(见图2)。SDS-PAGE分析结果表明,cry1Ac启动子可以指导Vip3Aa11在大肠杆菌JM109中可溶性表达,其蛋白条带大小与T7启动子在大肠杆菌中表达Vip3Aa11蛋白大小一致,为88 ku,但是在蛋白表达量上,经Quantity One软件分析,T7启动子表达量明显高于cry1Ac启动子。

图2 cry1Ac基因启动子与T7启动子表达Vip3Aa11的SDS-PAGE分析Fig.2 SDS-PAGE analysis of the Vip3Aa11 produced by promoter of cry1Ac and T7 in E.coli
2.3 杀虫活性测定
通过Quantity One软件及标准BSA对两种不同启动子表达粗蛋白定量后,将pAc19vip3Aa11和pET28avip3Aa11粗蛋白设定为80、40、20、2、1和0.2μg·mL-16个浓度梯度作甜菜夜蛾杀虫活性测定,设定320、160、80、40、20、10和1 μg·mL-17个浓度梯度作棉铃虫杀虫活性测定。72 h后统计死、活虫数,计算致死中浓度LC50。
杀虫活性结果见表3,cry1Ac基因启动子表达的Vip3Aa11蛋白对甜菜夜蛾及棉铃虫LC50分别为2.24和52.11 μg·mL-1,T7 启动子表达Vip3Aa11蛋白对甜菜夜蛾及棉铃虫LC50分别为2.47 和40.24 μg·mL-1。

表3 不同启动子表达的Vip3Aa11杀虫活性Table3 Insecticidal effect of Vip3Aa11 produced by promoter of cry1Ac and T7
2.4 胰蛋白酶消化分析
两种不同启动子表达Vip3Aa蛋白与1 mg·mL-1胰蛋白酶按10:1体积比混合,37℃水浴30 min,120 min后,SDS-PAGE分析出现不同结果。T7启动子表达Vip3Aa蛋白在30 min时已完全消化,而cry1Ac启动子表达Vip3Aa蛋白120 min时,才完全消化,产生66 ku核心区蛋白片段。说明在蛋白与胰蛋白酶体积比为10:1,37℃,30 min情况下,二者抗胰蛋白酶稳定性上存在显著差异,而在120 min时,无显著差异。

图3 胰蛋白酶处理后SDS-PAGE分析Fig.3 SDS-PAGE analysis of Vip3Aa11 by trypsin treatment
2.5 不同培养温度及时间对蛋白表达量影响
为优化cry1Ac启动子指导Vip3Aa11蛋白表达条件,设计不同温度及培养时间。接种于2倍LB培养基,分别在30和37℃,220 r·min-1条件下分别培养24、48和72 h后提取粗蛋白,影响结果见图4。
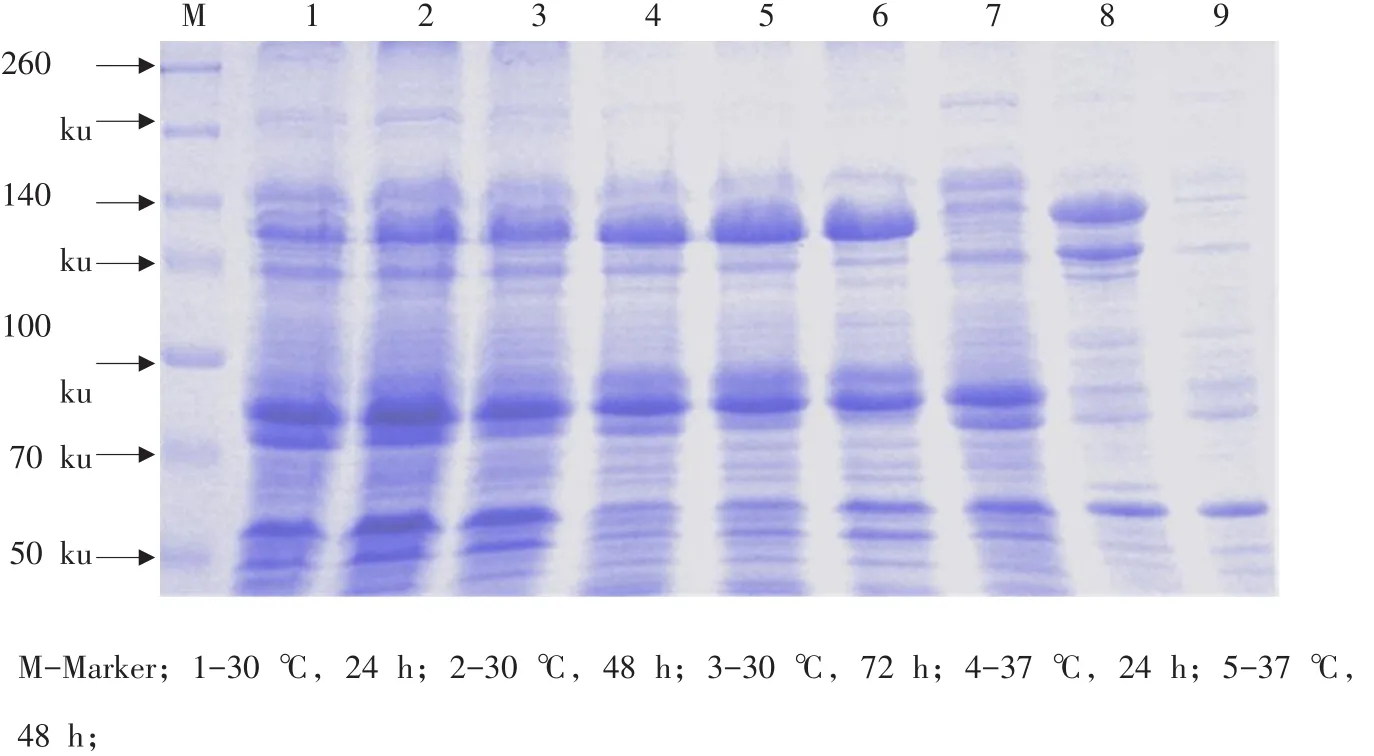
图4 不同温度及时间对cry1Ac启动子指导的Vip3Aa11蛋白表达影响Fig.4 Effect of temperatureand time on Vip3Aa11 produced by promoter of cry1Ac in E.coli JM109
经SDS-PAGE和Quantity One软件分析发现,温度对Vip3Aa表达影响较大。37℃对Vip3Aa表达有利。另外,同一温度下,培养时间对蛋白表达量影响不显著。
3 讨论与结论
cry1Ac启动子由芽胞期转录起始因子σE、σK等调控因子调控,苏云金芽胞杆菌与大肠杆菌中σ因子具有较高相似性,在大肠杆菌中,cry1Ac启动子指导基因表达与苏云金芽胞杆菌在调控上具有一致性[14]。本研究所用cry1Ac启动子区包含cry1Ac重叠双启动子 BtⅠ和BtⅡ,分别受σE和σK控制,但蛋白表达量上与T7启动子相比有所降低。T7启动子属于强启动子,商业化表达载体运用较多,被T7 RNAP识别后起始转录活跃,可完整转录下游DNA序列,蛋白表达量较高[15]。
大肠杆菌中,由cry1Ac启动子指导Cry1Ac蛋白表达与苏云金芽胞杆菌来源的Cry1Ac蛋白在抗胰蛋白酶稳定性及小菜蛾杀虫活性方面一致性较好[10]。而由cry1Ac启动子指导Cry1Ie蛋白表达与T7启动子指导Cry1Ie蛋白表达相较,小菜蛾杀虫活性提高10.5倍,在胰蛋白酶稳定性方面显著差异[11]。本研究中cry1Ac启动子与T7启动子指导Vip3Aa11表达蛋白相比,对甜菜叶蛾及棉铃虫杀虫活性无显著性差异。试验发现,蛋白与胰蛋白酶10:1比例混合,37℃反应30 min时,二者在抗胰蛋白酶稳定性上差异显著。cry1Ac启动子指导的Vip3Aa11在30 min时,不生成66 ku核心区蛋白片段,直到120 min时,完全生成66 ku核心区蛋白片段。而T7启动子指导的Vip3Aa11在30 min时已经完全生成66 ku的核心区蛋白片段。
试验中通过设定两个不同温度,3个不同培养时间分析pAc19vip3Aa11蛋白表达条件发现,37℃较30℃表达量提高,但杀虫活性测定需大量表达蛋白,尚需进一步优化条件,提高蛋白表达量。
[1] Sanahuja G,Banakar R,Twyman R M,et al.Bacillus thuringiensis:A century of research,development and commercial applications[J].Plant Biotechnology Journal,2011,9(3):283-300.
[2] 朱延明,郜庭,张凤,等.Cry2Aa9m抗虫基因植物表达载体构建及对大豆的遗传转化[J].东北农业大学学报,2013,44(1):1-6.
[3] 郑文,叶伟星,彭东海,等.基于cry1Ac表达调控元件的苏云金芽孢杆菌表达载体构建[J].湖北农业科学,2012,51(2):400-405.
[4] 宋福平.苏云金芽孢杆菌特异性cry基因的研究[D].哈尔滨:东北农业大学,2001.
[5] Wang G J,Zhang J,Song F P,et al.EngineeredBacillus thuringiensisG033A with broad insecticidal activity against lepidopteran and coleopteran pests[J].Applied Microbiology and Biotechnology,2006,72(5):924-930.
[6] Kant S,Kapoor R,Banerjee N.Identification of acataboliteresponsive element necessary for regulation of the cry4 gene of subsp.israelensis[J].Journal of Bacteriology,2009,191(14):4687-4692.
[7] 李朝睿,杜立新,彭琦,等.苏云金芽胞杆菌高效表达载体的构建[J].微生物学通报,2013,40(2):350-361.
[8] 杜立新.苏云金芽胞杆菌cry8E基因转录调控机制研究[D].保定:河北农业大学,2011.
[9] Sedlak M,Walter T,Aronson A,et al.Regulation by overlapping promoters of the rate of synthesis and deposition into crystalline inclusions of Bacillus thuringiensisδ-Endotoxins[J].Journal of Bacteriology,2000,182(3):734-741.
[10] 马君兰,束长龙,刘东明,等.大肠杆菌中利用苏云金芽胞杆菌强启动子p1Ac指导Cry1Ac蛋白表达的特性分析[J].生物技术通报,2011,(2):80-84.
[11] 张春鸽,赵灿,束长龙,等.不同启动子表达Cry1Ie蛋白的特性分析[J].生物技术通报,2012(11):192-196.
[12] Chakroun M,Banyuls N,Bel Y,et al.Bacterial vegetative insecticidal proteins(Vip)from entomopathogenic bacteria[J].Microbiol Mol Biol Rev,2016,80(2):329-350.
[13] 翟元娜,张杰,高继国.苏云金芽孢杆菌营养期杀虫蛋白Vip3A研究进展[J].东北农业大学学报,2009,40(8):123-
Analysis on expressed Vip3Aa protein by cry1Ac promoter/
LIU Ming1,2,SUN
Haiyan2,GAO Jiguo1
(1.School of Life Sciences,Northeast Agricultural University,Harbin 150030,China;2.Testing Center,Heilongjiang Bayi Agricultural University,Daqing Heilongjiang 163319,China)
cry promoter of Bacillus thuringiensis is commonly engineered to construct protein express vectors.In order to explore cry promoter of Bacillus thuringiensis that expresses Vip3Aa and analyzes the insecticidal activity,a vip3Aa11 gene was fused to cry1Ac promoter by overlap extension PCR,and then inserted into pUC19 vector,expressed in E.coli JM109.In this study,compared with Vip3Aa11 protein expressed under the promoter cry1Ac and T7 in insecticidal effect,resistances to trypsin and fermentation condition were analyzed,respectively.The results showed that both were expressed 88 ku protein in the supematant,the insecticidal activity of expressed protein under the promoter of cry1Ac and T7 had no significant difference to Spodoptera exigua and Helicoverpa Armigera,respectively.cry1Ac gene promoter was more suitable for Vip3Aa protein expression in 37and 48 h.The results would provide a convenient way for vip gene expression,function verification and insecticidal mechanism etc.
Bacillus thuringiensis;cry1Ac promoter;Vip3Aa;protein expression
Q786
A
1005-9369(2017)09-0036-07
时间 2017-10-22 8:33:51 [URL]http://kns.cnki.net/kcms/detail/23.1391.S.20171022.0833.002.
刘明,孙海燕,高继国.cry1Ac基因启动子表达Vip3Aa蛋白特性分析[J].东北农业大学学报,2017,48(9):36-42.
Liu Ming,Sun Haiyan,Gao Jiguo.Analysis on expressed Vip3Aa protein by cry1Ac promoter[J].Journal of Northeast Agricultural University,2017,48(9):36-42.(in Chinese with English abstract)
2017-07-20
国家自然科学基金(31401812);黑龙江省自然科学基金(C2016025)
刘明(1984-),男,助理研究员,博士研究生,研究方向为生防微生物分子生物学。E-mail:liuming_84@live.cn
*通讯作者:高继国,教授,博士生导师,研究方向为苏云金芽胞杆菌基因发掘、抗性机理及生物安全性。E-mail:gaojiguo1961@hotmail.com
