合成冰片草酸酯中间体成分气相色谱分析方法的研究与应用
2017-11-07袁晓敏张平辉涂永元李冬梅赵振东
袁晓敏, 张平辉, 涂永元, 王 婧,3, 李冬梅, 赵振东,3
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.福建省香产品质量检验中心,福建 泉州 362600; 3.中国 林业科学研究院 林业新技术研究所,北京 100091)

YUAN Xiaomin
合成冰片草酸酯中间体成分气相色谱分析方法的研究与应用
袁晓敏1, 张平辉1, 涂永元2, 王 婧1,3, 李冬梅1, 赵振东1,3*
(1.中国林业科学研究院 林产化学工业研究所;生物质化学利用国家工程实验室;国家林业局 林产化学工程重点开放性实验室;江苏省 生物质能源与材料重点实验室,江苏 南京 210042;2.福建省香产品质量检验中心,福建 泉州 362600; 3.中国 林业科学研究院 林业新技术研究所,北京 100091)
以自制的草酸二葑醇酯(DFO)、草酸二龙脑酯(DBO)、草酸二异龙脑酯(DIBO)、草酸龙脑异龙脑酯(BIBO)、草酸龙脑葑醇酯(BFO)和草酸异龙脑葑醇酯(IBFO)等为对照物质,建立了用气相色谱分析合成冰片主要草酸酯中间体的定性方法,以DFO和DBO为标准样品测定合成冰片中间体含量的外标定量方法。研究表明:气相色谱程序升温条件对中间体成分的分离影响较大,且对照物质DFO及DBO等进行气相色谱分析时需在正己烷等惰性溶剂中才能稳定存在和检测。通过对照样品加入法、合成混合酯样品谱图比对法等进行气相色谱分析,定性鉴定出合成冰片酯液中的主要中间体成分依次出峰顺序为:DFO、BFO、IBFO、DBO、BIBO和DIBO,保留时间依次为46.46、49.92、50.75、53.68、54.42和54.89 min。分别以DFO和DBO为外标物质,在质量浓度为1~25 g/L和5~25 g/L范围内建立的外标曲线回归方程为y1=93 622x1-48 633,y2=99 480x2-55 787,相关系数为r1=0.998 9和r2=0.999 2。平均加标回收率分别为103.2%和106.9%,相对标准偏差分别为1.72%和0.76%。应用建立的定性分析方法和定量分析方法检测了4个合成冰片酯液样品中的主要草酸酯中间体成分的组成及含量,结果表明该方法可满足科研及工业生产中对草酸酯中间体组成及含量的定性、定量测定,操作更为简单的峰面积归一化法可以根据需求进行选用。
合成冰片;草酸酯中间体;气相色谱方法;外标曲线法
冰片(又名龙脑),具有开窍醒神、清热止痛和明目退翳等功效[1],广泛应用于香料及医药行业。由于天然资源的限制,工业上主要使用合成冰片。生产合成冰片时,主要工艺过程为松节油或α-蒎烯与草酸进行加成重排酯化、皂化水解、水蒸气蒸馏和汽油重结晶等[2]。对合成冰片的研究,虽然注重了酯化反应[3]、皂化反应、产品提纯精制工艺条件优化等方面,但忽视了整体的过程分析、检验和过程控制等方面。由于没有建立合适的中间体分析检验方法,有关冰片中间体的组成、成分形成与变化以及对产品质量影响等研究至今未见报道,生产过程及产品质量的全程监控更是无法进行。作为一种简单、快捷的定性及定量分析检测手段,气相色谱法[4- 9]广泛应用于有机化合物的分析和检测。在冰片含量测定方面,中华人民共和国药典(2015年版一部)[1]规定了合成冰片中的龙脑含量,用气相色谱法测定不得低于55.0%;李结秋等[10]采用气相色谱内标法测定了冰片中龙脑的含量;汪汝沛等[11]在研究冰片含量的测定方法时报道了气相色谱法在检测制剂中冰片含量的重要作用。由蒎烯异构化形成的冰片酯液中有多种草酸酯,其中可能含有已被合成及表征的草酸二龙脑酯[12- 13]、草酸二异龙脑酯[14]和草酸二葑醇酯[15],还可能含有葑醇、龙脑、异龙脑等两两分别与草酸进行交互反应生成的混合酯类化合物。为了改善工业生产的合成工艺、提高产品质量及产品中正龙脑含量、对中间体及产品进行全程质量监控,无论是科学研究还是工业生产,都迫切需要建立草酸酯类中间体成分的气相色谱定性及定量分析方法。本研究在对气相色谱程序升温方法及溶解样品所用溶剂等方面进行优化的基础上,对冰片酯液中可能存在的主要酯类成分进行定性鉴定,确定合成冰片酯液中草酸酯中间体的组成,并在绘制草酸二葑醇酯及草酸二龙脑酯标准工作曲线基础上,建立定量测定草酸二葑醇酯和草酸二龙脑酯乃至合成冰片酯液中所有草酸酯类中间体成分的气相色谱外标法。
1 实 验
1.1原料、试剂与仪器
α-葑醇,GC纯度99.27%,南宁辰康生物科技有限公司生产;龙脑(冰片),GC纯度99.29%,贵州苗药有限公司;异龙脑,自制,由乙酸异龙脑酯皂化后,经重结晶提纯获得,GC纯度99.27%;冰片酯液样品,有自制[2]样品,也有来源于云南林缘香料有限公司生产车间的样品;正己烷、乙醇、甲醇和三氯甲烷均为市售分析纯试剂。草酸二葑醇酯(DFO)和草酸二龙脑酯(DBO)为自制[12,14]对照品,GC纯度99.99%;草酸二异龙脑酯(DIBO)[13]为自制品,GC纯度92.57%,结构式如下:
GC-2014AF型气相色谱仪(配10 μL全自动进样器),日本岛津公司,FID检测器,Rtx-5型毛细管色谱柱(30 m×0.25 mm×0.25 μm);AL104型万分之一分析天平,梅特勒-托利多仪器(上海)有限公司。
1.2标准溶液的配制
准确称取自制的草酸二葑醇酯0.627 0 g、草酸二龙脑酯0.628 1 g,分别置于25 mL容量瓶中,加入正己烷至刻度,摇匀,分别得到质量浓度为25.080、 25.124 g/L的对照品储备液。准确移取0.4、 2、 4、 6和 8 mL 的草酸二葑醇酯对照品储备液于10 mL容量瓶中,加正己烷稀释定容配制成梯度质量浓度为1.003、 5.016、 10.032、 15.048和20.064 g/L的草酸二葑醇酯标准溶液,置暗处室温保存备用。分别移取2、 4、 6和8 mL的草酸二龙脑酯对照品储备液,同样操作配制得梯度质量浓度为5.025、10.050、15.074和20.099 g/L的草酸二龙脑酯标准溶液。
1.3样品溶液的制备
1.3.1冰片酯液试样的配制 将1~3 g草酸冰片酯液置于25 mL容量瓶中,用正己烷定容,摇匀,暗处室温保存备用。
1.3.2草酸混合酯类的合成 将葑醇、异龙脑和龙脑中的任意两种各0.77 g(共1.54 g),按质量比 1∶1 混合加入100 mL三口圆底烧瓶,用正己烷20 g溶解,于35 ℃缓慢滴加草酰氯0.762 g,反应4 h,以碱和盐水洗至中性,分别制得含有草酸龙脑葑醇酯(BFO)、草酸异龙脑葑醇酯(IBFO)、草酸龙脑异龙脑酯(BIBO)等的草酸混合酯类样品,置暗处室温保存备用。草酸混合酯类结构式如下:

1.4气相色谱分析
进样及检测温度均为280 ℃,载气为N2(纯度大于99.999%)。采用恒压分流法进样,进样量 1 μL,压力100 kPa,分流比65∶1,总流量85.7 mL/min,柱流量1.25 mL/min。程序升温条件:起始温度70 ℃,保持2 min,以3 ℃/min升至115 ℃,以5 ℃/min升至180 ℃,以2 ℃/min升至250 ℃,最后以 10 ℃/min 升至270 ℃。
2 结果与讨论
2.1分析条件的优化
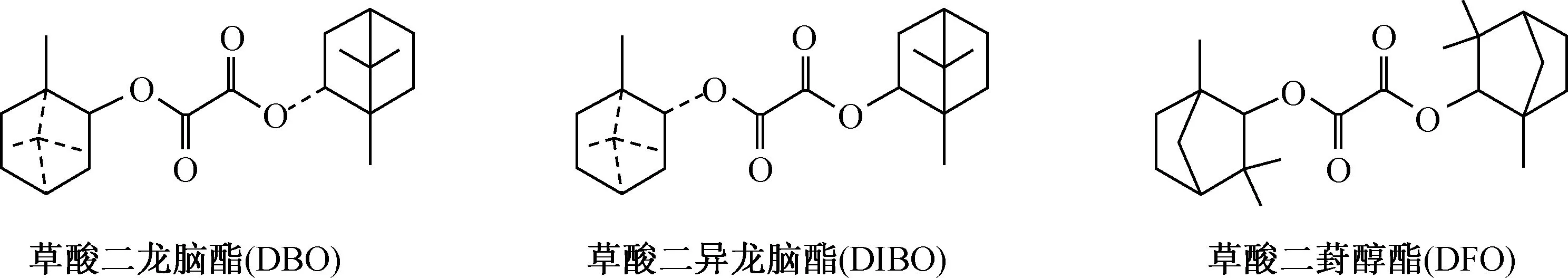
2.1.1程序升温条件的选择 在其他色谱条件相同时,采用不同的程序升温方案(方案a~d,详见表1)对冰片酯液各组分进行分离试验,结果分别见图1(a)~(d)。

表1 GC分析程序升温试验方案1)Table 1 Temperature test programs for GC analysis
1) 括号内为保持时间 holding time in brackets
按方案a分析测定时,由于130 ℃至270 ℃时升温速率过快,致使重合油(即聚合油,主要为萜烯聚合物)与草酸冰片酯出峰时间相近,并且酯类部分出峰时间相距太小,分离度较低(见图1(a));方案b将130 ℃至270 ℃升温速率降为5 ℃/min,分离状况有所改进,但酯类部分分离度仍不理想,具体见图1(b);将130 ℃至270 ℃升温速率降为2 ℃/min,按方案c查看分离度,此时分离度较好,但是分析时间过长,见图1(c)。综合考虑冰片酯液中主要包含的轻油(5~20 min)、重合油(30~45 min)及草酸冰片酯类(45~60 min),要使这3部分物质都能得到很好的分离,且分析时间适中,选择气相色谱分析程序升温方案d,此时一次分析时间为67 min,见图1(d)。
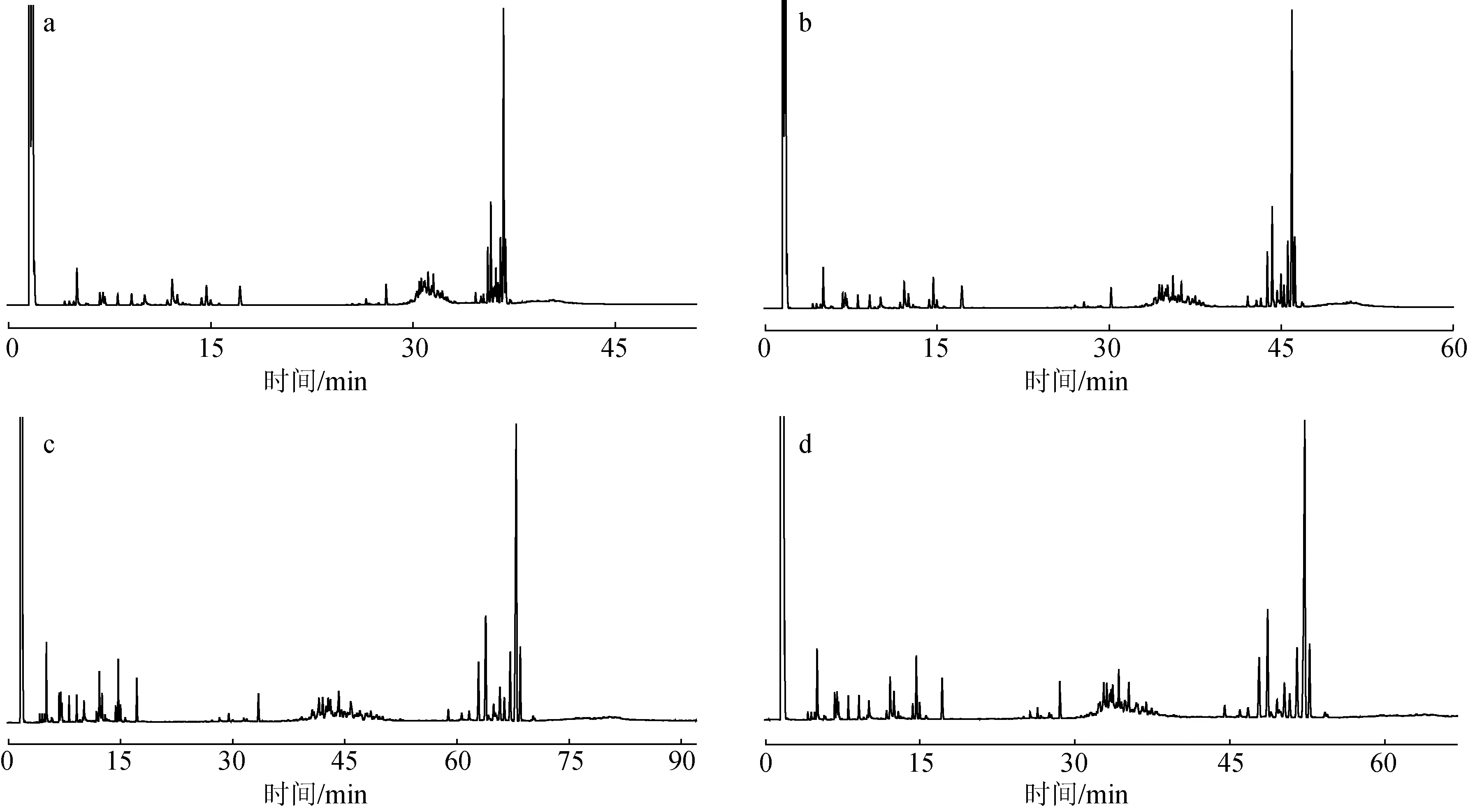
图1 冰片酯液的GC色谱图
2.1.2溶剂的选择 气相色谱分析分别用溶剂乙醇、甲醇、三氯甲烷、正己烷溶解草酸二葑醇酯和草酸二龙脑酯进行试验,结果见图2。由图2可知,草酸二葑醇酯、草酸二龙脑酯溶于醇类溶剂时会有部分分解,草酸二龙脑酯的分解程度比草酸二葑醇酯更大,而溶于三氯甲烷、正己烷时则可稳定存储。由于三氯甲烷遇光照不稳定,会与空气中的氧发生作用,逐渐分解而生成剧毒的光气(碳酰氯)和氯化氢,并不适合长期用作色谱分析溶剂。因此,无论是本研究还是今后的应用中均应采用正己烷作为试样溶解及GC分析用溶剂。
图2 不同溶剂对DFO(a)和DBO(b)GC色谱分析的影响
2.2冰片酯液的定性分析
2.2.1葑醇酯、龙脑酯及异龙脑酯的定性分析 按1.4节所述(即经2.1节优化得到的,下同)气相色谱(GC)分析条件分别对自制并经过结构鉴定的DFO[15]、DBO[12]和DIBO[14]样品进行检测,3种酯的保留时间分别为: 46.46、 53.68和54.89 min。
2.2.2混合酯类成分的定性分析 按1.4节所述气相色谱分析条件分别检测按1.3.2节所得含有BFO、IBFO和BIBO的样品溶液,通过保留时间的对比分析可以确定,草酸混合酯类成分的出峰位置都分别处于已经过结构鉴定的两种单纯草酸二酯色谱峰之间(如图3所示)。也就是说,BFO的出峰位置在DFO和DBO之间(如图3(a)),其保留时间为49.92 min;IBFO位于DFO和DIBO之间(图3(b)),其保留时间为50.75 min;BIBO位于DBO和DIBO之间(图3(c)),其保留时间为54.42 min。

图3 混合酯液的GC谱图
2.2.3冰片酯液的中间体成分定性分析 冰片酯液中酯类部分的GC谱图见图4。对比了相同色谱条件下上述6种物质与冰片酯液中各组分的保留时间,同时分别以草酸二异龙脑酯或草酸二龙脑酯为基准计算各色谱峰的相对保留时间,结果见表2。

图4 冰片酯液中酯类部分的GC谱图Fig.4 Gas chromatogram of oxalates in broneol ester solution
通过比对出峰顺序、保留时间和相对保留时间,可确定冰片酯液中的酯类部分6个主要成分及其出峰顺序(见图4)为:草酸二葑醇酯、草酸龙脑葑醇酯、草酸异龙脑葑醇酯、草酸二龙脑酯、草酸龙脑异龙脑酯和草酸二异龙脑酯,其相应的保留时间分别为46.46、 49.92、 50.75、 53.68、 54.42和54.89 min,与上述6种酯的保留时间完全一致。鉴于异冰片、龙脑(龙脑)以及相应的草酸酯比较容易得到,分别以草酸二异龙脑酯及草酸二龙脑酯为参照物计算所得的相对保留时间见表2,可供今后工业生产或科学研究应用中对冰片酯液中间体成分进行GC定性鉴定时参考。
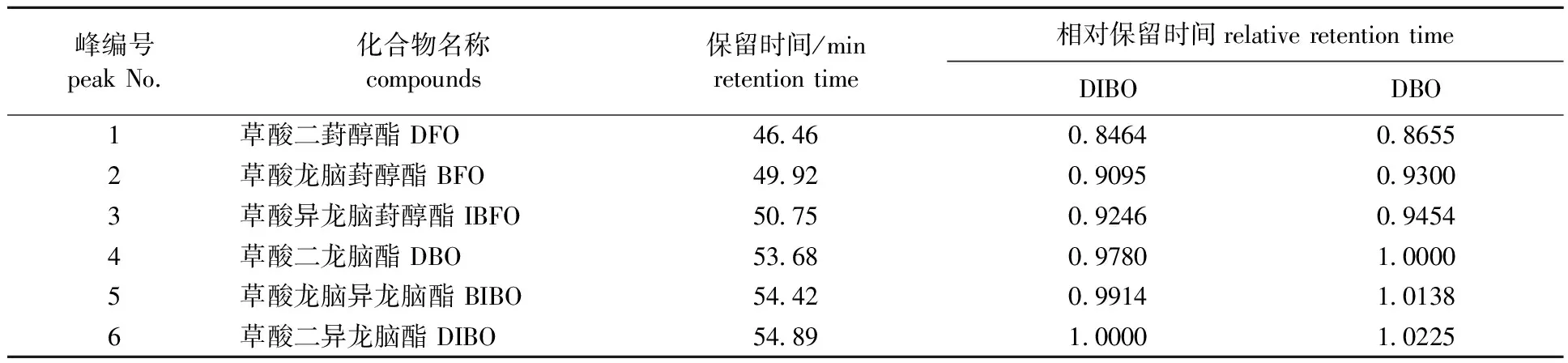
表2 冰片酯液主要中间体酯类成分GC保留时间Table 2 The retention times and relative retention times of the main ester intermediates
2.3冰片酯液中的葑醇酯及龙脑酯定量分析
2.3.1标准工作曲线 按1.4节所述条件,用毛细管气相色谱分别分析不同浓度的草酸二葑醇酯及草酸二龙脑酯的浓度梯度标准溶液,测定峰面积,并以峰面积为纵坐标(y),以质量浓度为横坐标(x),绘制标准工作曲线,测得草酸二葑醇酯及草酸二龙脑酯的回归方程分别为y1=93 622x1-48 633,y2=99 480x2-55 787,线性相关系数分别为r1=0.998 9和r2=0.999 2,线性范围分别为1~25 g/L和5~25 g/L。
2.3.2精密度试验 取质量浓度为10 g/L的草酸二葑醇酯及草酸二龙脑酯标准溶液,分别连续进样测定6次,草酸二葑醇酯的峰面积分别为926 023、 915 028、 919 159、 965 292、 926 760和915 182 μV·s,平均值为927 907 μV·s,RSD为2.0%;草酸二龙脑酯的峰面积分别为1 116 648、 1 183 303、 1 109 728、 1 164 066、 1 195 840和1 187 789 μV·s,平均值为1 159 562 μV·s,RSD为3.2%。说明仪器的测量精密度良好,符合毛细管气相色谱定量分析检测要求[16]。
2.3.3试样溶液的稳定性试验 分别取质量浓度为10 g/L的草酸二葑醇酯及草酸二龙脑酯标准溶液,置于暗处室温保存,期间分别在1、4、7、12和24 h取样进行分析,草酸二葑醇酯的峰面积分别为 926 023、 919 159、 926 760、 873 125和939 917 μV·s,平均值为916 997 μV·s,RSD为2.8%;草酸二龙脑酯的峰面积分别为1 116 648、 1 109 728、 1 195 840、 1 072 992和1 187 789 μV·s,平均值为 1 136 599 μV·s,RSD为4.7%。可以看出,相对标准偏差均在5%以下,表明草酸二葑醇酯及草酸二龙脑酯的试样溶液在24 h内是稳定的,符合毛细管气相色谱定量分析检测要求[16]。
2.3.4加标回收率试验 取6份冰片酯液样品,分别加入不同质量的标准草酸二葑醇酯和草酸二龙脑酯,以此2种酯类含量为标准,配制成此2种酯类标准品添加量占样品溶液中相应酯类物质质量50%、100%和150%的3个质量浓度,进行加标回收试验,各浓度进行3次平行测定,计算得到平均加标回收率及相对标准偏差(见表3)。表3的结果表明,草酸二葑醇酯和草酸二龙脑酯在3个质量浓度添加水平下的平均回收率分别为103.2%和106.9%,其相对标准偏差(RSD)分别是1.72%和0.76%。也就是说,该方法回收率良好,符合毛细管气相色谱定量分析检测的要求[16]。
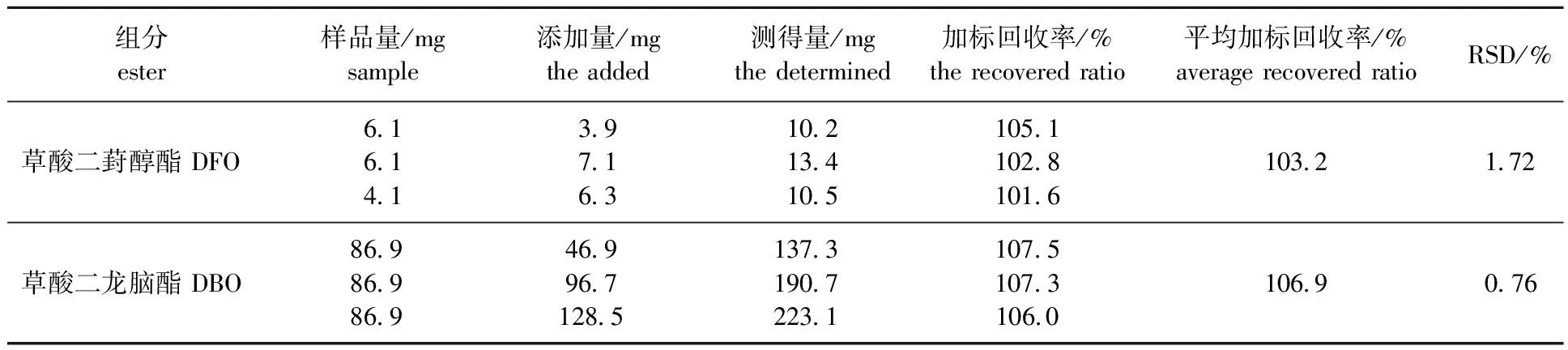
表3 草酸二葑醇酯和草酸二龙脑酯加标回收率及相对标准偏差Table 3 The mean recoveries and relative standard deviations(RSDs) of the DFO and DBO
2.4样品分析应用与实践
分别称取适量的冰片酯液样品,置于5 mL容量瓶中用正己烷定容,摇匀,按上述2.3节建立的实验方法进行分析,测定冰片酯液中草酸二葑醇酯和草酸二龙脑酯的含量。1#为自制样品, 2#~4#为企业生产过程样品。冰片酯液样品中的6种主要酯类化合物,是结构类型差别非常小的同分异构体,在GC分析中可视为同一类物质。依据同分异构体具有近似的响应因子的原理,可采用同分异构体的标准曲线进行分析,故分别用草酸二葑醇酯(方法M1)和草酸二龙脑酯(方法M2)作为外标物质分别测定6种主要的草酸酯中间体成分的含量及总含量(测定结果见表4)。另外,还用峰面积归一化法分析(方法M3)分别测定了样品1#~4#的6种草酸酯成分含量,结果亦见表4。
由表4可知,使用草酸二葑醇酯作为外标物的方法可以应用于冰片中间体草酸二葑醇酯和草酸二龙脑酯的定量分析,实现二者的测定。然而,由于在合成冰片酯液草酸酯中间体成分之中,草酸二葑醇酯、草酸异龙脑葑醇酯和草酸二异龙脑酯等3个组分的含量都比较低,超出了所建立相关标准曲线的线性范围,所测结果误差可能会比较大。在实际应用过程中,可以考虑将这3个组分合并进行计算,这样3个组分合并含量即可落入线性范围,可以减少测量误差。
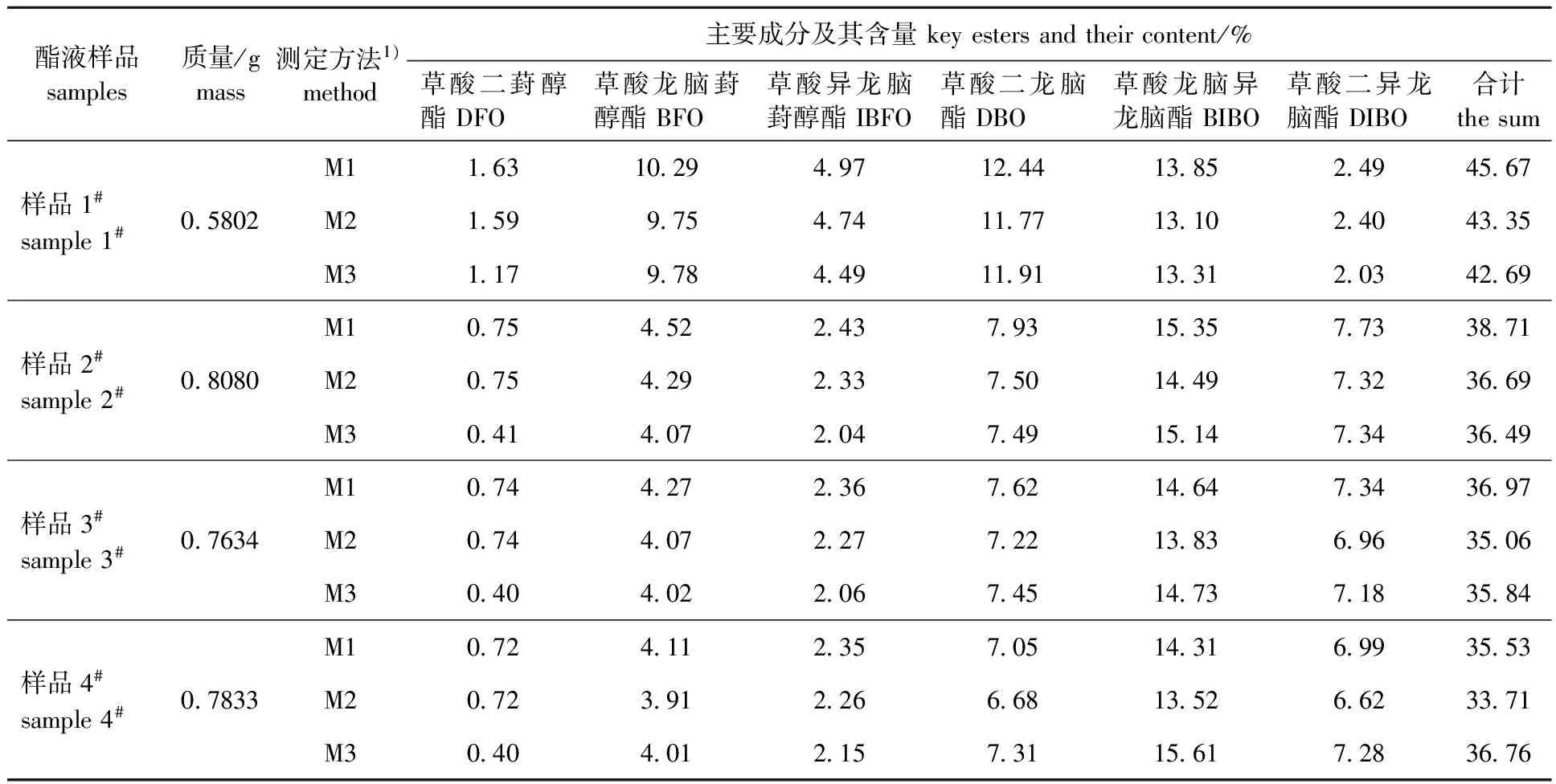
表4 冰片酯液中主要草酸酯成分含量测定Table 4 The determination of key oxalates in borneol ester solution
1) M1:应用草酸二葑醇酯为外标物的标准曲线法external std method via DFO;M2:应用草酸二龙脑酯为外标物的标准曲线法external std method via DBO;M3:峰面积归一化法peak area normalization method
由表4还可看出,根据冰片酯液中的草酸酯类中间体成分的化学组成相同且结构差异非常小的特点,将所建立的2条标准曲线分别用于测定冰片酯液中的草酸酯类中间体成分时,结果非常相近。也就是说,无论使用草酸二葑醇酯还是草酸二龙脑酯作为外标物质,都能对冰片中间体草酸酯成分进行定量测定,但使用草酸二葑醇酯作为外标物时各成分测定结果总体上比使用草酸二龙脑酯时稍微有所偏高。
由于在实际检测分析过程中,外标法和内标法(由于暂时没有合适的内标物,本研究没有对比结果)都显得比较繁琐,而峰面积归一化法则相对方便。对于冰片酯液而言包括重合油在内的所有成分基本上都能够从色谱柱中洗脱出来,这样就具备了利用峰面积归一化法进行检测分析的基础。本研究将峰面积归一化法(M3)与外标法(M1和M2)分析结果进行了对比分析,结果表明:6种草酸酯成分中,含量低于5%(样品1#中的DFO、IBFO和DIBO;样品2#~4#中的DFO、BFO和IBFO)时,峰面积归一化法测定结果比外标法测定结果略微偏低,而含量高于5%时,峰面积归一化法测定结果与外标法测定结果基本一致或个别成分略微偏高。也就是说,在一般的研究和工业控制过程中,需要简化操作时,也可以使用峰面积归一化法对冰片酯液中间体进行检测和分析。
3 结 论
3.1建立了定性分析合成冰片酯液中草酸酯中间体的毛细管气相色谱方法。用自制草酸酯类和草酸混合酯类产品作为对照物质,通过综合比对相关色谱峰的保留时间、相对保留时间、出峰顺序、相对位置及强度等信息,定性鉴定了合成冰片酯液中的主要草酸酯类成分,其出峰顺序为:草酸二葑醇酯、草酸龙脑葑醇酯、草酸异龙脑葑醇酯、草酸二龙脑酯、草酸龙脑异龙脑酯和草酸二异龙脑酯,其保留时间分别为46.46、 49.92、 50.75、 53.68、 54.42和54.89 min。
3.2建立了定量测定酯液中草酸二葑醇酯及草酸二龙脑酯含量的气相色谱外标曲线法。草酸二葑醇酯、草酸二龙脑酯分别在质量浓度1~25 g/L和5~25 g/L范围内呈现良好线性关系(r>0.99),其平均加标回收率在所选进样浓度范围内分别为103.2%和106.9%,相对标准偏差(RSD)分别为1.72%和0.76%。
3.3将建立的外标分析方法试用于测定冰片酯液的6种草酸酯类成分的含量,明确了合成冰片酯液中各主要草酸酯中间体成分的含量分布规律。检验时,可以分别使用草酸二葑醇酯或草酸二龙脑酯作为外标物质进行外标曲线法测定,或根据需求还可选用峰面积归一化方法进行分析。
[1]国家药典委员会. 中华药典:一部[S]. 2015年版. 北京:化学工业出版社,2015:146.
Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia:1st volume[S]. 2015 ed. Beijing:Chemical Industry Press,2015:146.
[2]赵振东,刘先章. 松节油的精细化学利用(V)—松节油合成药理活性物质[J]. 林产化工通讯,2001,35(5):35 - 40.
ZHAO Z D,LIU X Z. Fine chemical utilization of turpentine(V):The synthesis of pharmacological active substances from turpentine[J]. Journal of Chemical Industry of Forest Products,2001,35(5):35 - 40.
[3]袁晓敏,张平辉,赵振东,等.α-蒎烯酯化-皂化法合成龙脑催化剂研究进展[J]. 工业催化,2015,23(6):424 - 428.
YUAN X M,ZHANG P H,ZHAO Z D,et al. Research advances in the catalysts for synthesis of borneol from α-pinene by esterification-saponification method[J]. Industrial Catalysis,2015,23(6):424 - 428.
[4]傅若农. 近两年国内气相色谱的进展[J]. 分析试验室,2011,30(5):88 - 122.
FU R N. The advances of gas chromatography in recent two years[J]. Chinese Journal of Analysis Laboratory,2011,30(5):88 - 122.
[5]肖泽文,王燕杰,胡小刚.气相色谱技术及其发展[J]. 大学化学,2012,27(3):84 - 88.
XIAO Z W,WANG Y J,HU X G. Gas chromatography technology and its development[J]. University Chemistry,2012,27(3):84 - 88.
[6]曹环礼. 气相色谱技术的研究进展及其应用[J]. 广东化工,2009,36(8):100 - 120.
CAO H L. Research progress and application of gas chromatography technologh[J]. Guangdong Chemical Industry,2009,36(8):100 - 120.
[8]YUSAI I,KYOKO I,WAKANA S,et al. Analysis of residual solvents in annatto extracts using a static headspace gas chromatography method[J].American Journal of Analytical Chemistry,2012,3(9):638 - 645.
[9]ZHANG Y P,MA X G,FAN Y M. A rapid and sensitive method for determination of melamine in fish,shrimp,clam,and winkle by gas chromatography-mass spectrometry with microwave-assisted derivatization[J]. Food Analytical Methods,2014,7(9):1763 - 1769.
[10]李结秋,徐邦牢,廖军,等. 气相色谱法测定冰片中龙脑的含量[J]. 广州医药,2008,39(5):62 - 64.
LI J Q,XU B L,LIAO J,et al. In gas phase chromatography determination borneol borneo camphor content[J]. Guangzhou Medical Journal,2008,39(5):62 - 64.
[11]汪汝沛,戚进,余伯阳. 冰片含量测定方法研究进展[J]. 药学进展,2010,34(8):359 - 364.
WANG R P,QI J,YU B Y. Recent progress in the content determination method for borneol[J]. Progress in Pharmaceutical Sciences,2010,34(8):359 - 364.
[12]张平辉,赵振东,徐士超,等. 草酸二龙脑酯的合成及其表征[J]. 精细化工,2014,31(11):1402 - 1405.
ZHANG P H,ZHAO Z D,XU S C,et al. Synthesis and characterization of dibornyl oxalate[J]. Fine Chemicals,2014,31(11):1402 - 1405.
[13]袁晓敏,陈金凤,衣晓庆,等. 草酸龙脑酯手性异构体的合成及谱学性质对比研究[J]. 林产化学与工业,2016,36(5):15 - 22.
YUAN X M,CHEN J F,YI X Q,et al. Synthesis and spectral properties of chiral isomers of dibornyl oxalate[J]. Chemistry and Industry of Forest Products,2016,36(5):15 - 22.
[14]张平辉,郭利群,袁晓敏,等. 草酸二异龙脑酯的合成及其结构表征[J]. 林产化学与工业,2015,35(3):33 - 37.
ZHANG P H,GUO L Q,YUAN X M,et al. Synthesis and structural characterization of diisobornyl oxalate[J]. Chemistry and Industry of Forest Products,2015,35(3):33 - 37.
[15]赵振东,袁晓敏,徐健,等.一种合成草酸小茴香酯的方法:CN105348093A[P]. 2016 - 02 - 24.
ZHAO Z D,YUAN X M,XU J,et al. One synthesis method of fenchyl oxalate:CN105348093A[P]. 2016 - 02 - 24.
[16]金鑫荣. 气相色谱法[M]. 北京:高等教育出版社,1987:303 - 304.
JIN X R. Gas Liquid Chromatography[M]. Beijing:Higher Education Press,1987:303 - 304.
Gas Chromatographic Methodology and Its Application to Analyze Intermediate Oxalates of Synthetic Borneol
YUAN Xiaomin1, ZHANG Pinghui1, TU Yongyuan2, WANG Jing1,3, LI Dongmei1, ZHAO Zhendong1,3
(1.Institute of Chemical Industry of Forest Products,CAF;National Engineering Lab. for Biomass Chemical Utilization;Key and Open Lab. of Forest Chemical Engineering,SFA;Key Lab. of Biomass Energy and Material,JiangsuProvince, Nanjing 210042, China; 2.Fujian Quality Inspection Center for Incense Products,Quanzhou 362600,China; 3.Research Institute of Forestry New Technology,CAF, Beijing 100091, China)
While the synthesized difenchyl oxalate(DFO), dibornyl oxalate(DBO), diisobornyl oxalate(DIBO), bornyl isobornyl oxalate(BIBO), bornyl fenchyl oxalate(BFO), and isobornyl fenchyl oxalate(IBFO) were used as reference substances, the qualitative and quantitative analytic methodologies were studied and established for the main intermediates of borneol by gas chromatography(GC), and then an external reference calibration curve method was also established to determine quantitatively difenchyl, dibornyl oxalates or the similar oxalate intermediates. As the results, it was shown that, difenchyl and dibornyl oxalates as reference substances must be dissolved in an inert solvent such as hexane, and the separation performance of the intermediate oxalates may be influenced obviously by the programmed temperature conditions. By means of reference substance addition and chromatogram comparison methods, the intermediate oxalates of synthetic borneol were separated and identified or predicted to be as difenchyl oxalate(DFO), bornyl fenchyl oxalate(BFO), isobornyl fenchyl oxalate(IBFO), dibornyl oxalate(DBO), bornyl isobornyl oxalate(BIBO), diisobornyl oxalate(DIBO) with the retention time of 46.46,49.92,50.75,53.68,54.42 and 54.89 min etc. The calibration curves for fenchyl and dibornyl oxalates were plotted linearly in the ranges of 1-25 g/L and 5-25 g/L asy=93 622x-48 633(r1=0.998 9) andy=99 480x-55 787(r2=0.999 2), by which their mean recoveries were determined as 103.2% and 106.9% with the relative standard deviations(RSDs) 1.72% and 0.76%, respectively. It is considered that the established qualitative GC method and quantitative mathematic equations would supply the demand to determine either qualitative components or quantitative contents of intermediate oxalates in research fields or industry production process. The common peak area normalization method would also be selected for the content determination for convenience.
synthetic borneol;intermediate oxalates;gas chromatographic methodology;external calibration curve method
2017- 03-24
国家林业局林业科技成果推广项目([2015]30号)
袁晓敏(1990— ),女,河南安阳人,硕士生,主要从事应用化学研究;E-mailyxmcfu@163.com
*通讯作者:赵振东,研究员,博士生导师,主要从事萜类化学、天然产物化学、应用化学、松树病虫害化学等方面的研究与利用;E-mail: zdzhao@189.cn。
10.3969/j.issn.0253-2417.2017.05.012
TQ351.4
A
0253-2417(2017)05- 0093- 08
袁晓敏,张平辉,涂永元,等.合成冰片草酸酯中间体成分气相色谱分析方法的研究与应用[J].林产化学与工业,2017,37(5):93 - 100.
