疏水性离子液体[C4mim][PF6]对木质纤维预水解液的脱毒作用
2017-11-07程逸超杨金龙朱均均余世袁
程逸超, 杨金龙, 朱均均,3, 徐 勇,3, 勇 强, 余世袁
(1.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037;2.南京林业大学 化学工程学院,江苏 南京 210037; 3.江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037)

CHENG Yichao
疏水性离子液体[C4mim][PF6]对木质纤维预水解液的脱毒作用
程逸超1,2, 杨金龙1,2, 朱均均1,2,3*, 徐 勇1,2,3, 勇 强1,2, 余世袁1,2
(1.南京林业大学 江苏省林业资源高效加工利用协同创新中心,江苏 南京 210037;2.南京林业大学 化学工程学院,江苏 南京 210037; 3.江苏省生物质绿色燃料与化学品重点实验室,江苏 南京 210037)
将稀酸蒸汽爆破预处理后的玉米秸秆进行预水解,以离子液体1-丁基-3-甲基咪唑六氟磷酸盐([C4mim][PF6])萃取脱除预水解液中的抑制物,并对萃取脱毒条件进行优化,进一步分析了离子液体的脱毒效果。研究结果表明,最佳萃取条件为:水油相体积比1∶2、35 ℃、250 r/min下萃取60 min。在此条件下,水解液中的主要抑制物甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛、糠醛和总酚的去除率分别达到24.72%、21.84%、47.99%、82.76%、100%和39.70%,且可发酵性糖几乎无损失。通过对主要抑制物与离子液体脱毒性能分析可知,随着离子液体[Cnmim][PF6](n=4, 6, 8)中阳离子烷基碳链增长,离子液体对抑制物萃取能力下降;抑制物疏水性越强,与离子液体的氢键作用越强,萃取分离效果越好;pH值越低,对抑制物的去除效果越好;乙酸、5-羟甲基糠醛、4-羟基苯甲醛在[C4mim][PF6]中去除率基本不随抑制物初始质量浓度改变而发生变化。
木质纤维原料;抑制物;离子液体;萃取;脱毒
燃料乙醇作为一种辛烷值高的清洁燃料正越来越受到人们的关注[1]。农林废弃物是一种不与粮食作物竞争,且可低成本大规模生产燃料乙醇的可再生木质纤维原料[2]。木质纤维原料生产燃料乙醇主要包括原料预处理、纤维素酶水解、微生物乙醇发酵和产品分离回收四大关键步骤[3],其中,在原料预处理过程中木质纤维水解产生的部分化合物会抑制酶水解与发酵,从而影响乙醇的生产[4]。因此,寻找有效的“脱毒”方法,在发酵前去除抑制物成为提高发酵效率的必要手段之一[5]。然而传统的脱毒方法,如乙酸乙酯萃取、过中和、离子交换树脂和微生物等等,均无法有效地一次性去除不同的抑制物,而多种脱毒方法的结合使用既提高了成本又增加了工艺难度[5- 8]。离子液体因其在很宽的温度范围内都呈液态、蒸气压低、稳定性好、可循环使用、污染小等特性,被认为是一种新型绿色溶剂[9]。离子液体在萃取分离方面相比传统有机溶剂,具有低挥发性及功能可调的优势,已有研究显示离子液体可以萃取包括有机酸[10]、呋喃类[11]、酚类[12]在内的多种有机化合物。因此,采用离子液体对木质纤维预水解液进行脱毒成为一种新思路。目前,将离子液体用于去除木质纤维生物炼制过程中抑制物的相关研究还较少报道。在本课题组前期研究[13]的基础上,选择烷基咪唑六氟磷酸盐离子液体[Cnmim][PF6](n=4, 6, 8)作为萃取剂,对其萃取脱毒条件进行优化;同时考察了离子液体[Cnmim][PF6](n=4, 6, 8)的碳链长度、抑制物疏水性、抑制物初始浓度、pH值等对离子液体萃取脱毒效果的影响,为后续离子液体在脱毒工艺中的应用提供基础数据。
1 实 验
1.1原料、试剂与仪器
玉米秸秆来源于内蒙古呼和浩特市,粉碎至粒径3~5 cm,备用。1-丁基-3-甲基咪唑六氟磷酸盐([C4mim][PF6])、 1-己基-3-甲基咪唑六氟磷酸盐([C6mim][PF6])、 1-辛基-3-甲基咪唑六氟磷酸盐([C8mim][PF6])均购于上海成捷化学有限公司;Folin-Ciocalteu试剂,购于美国Sigma公司。
INNVOA 4RR型恒温摇床;SHA-C型恒温振荡器;FE20型pH计;Legend Mach 1.6 R型离心机,美国Thermo公司;UV-2100pro型紫外分光光度计,美国Amersham公司; Agilent 1100、1260型高效液相色谱(HPLC)仪,美国Agilent公司。
1.2稀酸蒸汽爆破玉米秸秆预水解
1.2.1原料预处理 玉米秸秆用质量分数为0.50%~1.00%的硫酸浸泡润胀1~3 h后,脱水至固体质量分数(固含量)为30%~40%,在3 L的蒸汽爆破预处理设备中于1.6~2.0 MPa、维压5~10 min条件下处理,瞬间打开爆破装置的排料阀,将物料喷放到料槽中,收集物料,备用。
1.2.2预水解液的制备及浓缩 按固液比为1∶15(g∶mL,下同),60 ℃左右温水分3次洗滤物料,分别收集滤液和滤渣。为了后续利用预水解液发酵时有较高的糖浓度,将得到的滤液在水浴温度70 ℃、压力1.7×104Pa的条件下进行减压蒸发,浓缩至木糖质量浓度为50 g/L,即为预水解液。
1.3离子液体萃取脱毒
1.3.1萃取工艺的影响 分别移取5.00 mL 的离子液体[C4mim][PF6]于50 mL的三角瓶中,按不同水油相体积比(水油相比)加入pH值为2.0的酸爆玉米秸秆预水解液,用封口膜密封三角瓶口后放入摇床中,在不同温度、不同转速的摇床内反应不同时间。反应结束后,取出三角瓶,静置分层后,分别收集有机相和水相,采用HPLC测定水相中的糖、抑制物,Folin-Ciocalteu比色法测定总酚等。
1.3.2离子液体碳链长度和抑制物疏水性的影响 由于离子液体[C2mim][PF6]和[C10mim][PF6]是固体,只有[C4mim][PF6]、[C6mim][PF6]和[C8mim][PF6]是液体,因此研究离子液体碳链长度对萃取效果的影响时,只能选择这3者。分别移取5.00 mL的[Cnmim][PF6](n=4, 6, 8)于50 mL三角瓶中,再在每个三角瓶中分别加入5.00 mL pH值2.0的单一抑制物的标准溶液,乙酸、5-羟甲基糠醛、4-羟基苯甲醛、香草醛、紫丁香醛和对香豆酸均为400 mg/L;受限于溶解度,阿魏酸质量浓度调整为 200 mg/L。混合均匀后,密封三角瓶口,置于30 ℃摇床内,在150 r/min条件下萃取60 min。萃取结束后,取出三角瓶,静置1 h分层,分别收集有机相和水相,采用HPLC和反向高效液相色谱(R-HPLC)分析水相中抑制物浓度,并计算其去除率(E)。
1.3.3抑制物初始质量浓度的影响 移取5.00 mL的[C4mim][PF6]于50 mL三角瓶中,再分别加入 5.00 mL pH值2.0的单一抑制物标准溶液,乙酸、5-羟甲基糠醛、香草醛、4-羟基苯甲醛质量浓度梯度为250~4 000 mg/L,紫丁香醛质量浓度梯度为200~1 000 mg/L,对香豆酸质量浓度梯度为 50~400 mg/L,阿魏酸质量浓度梯度为40~200 mg/L。混合均匀后,按1.3.2节方法操作,并计算E。
1.3.4预水解液pH值的影响 移取5.00 mL的[C4mim][PF6]于50 mL三角瓶中,再分别加入 5.00 mL pH值1.0、2.0、4.0、6.0、8.0和10.0的单一抑制物的标准溶液(质量浓度同1.3.2节)。混合均匀后,按1.3.2节方法操作,并计算E。
1.4分析测定方法
1.4.1糖及抑制物含量的测定 可发酵性糖及碳水化合物降解产物的含量采用HPLC测定,按参考文献[14]进行;9种木质素降解产物的含量采用R-HPLC测定,按参考文献[15]进行。
1.4.2总酚含量的测定 总酚含量采用Folin-Ciocalteu比色法进行测定[16]。向1 mL待测溶液(或稀释液)中分别加入1mL 0.6 mol/L的Folin-Ciocalteu试剂、3 mL 6%的Na2CO3溶液,并补加蒸馏水定容至10 mL后置于30 ℃水浴中反应2 h,反应结束后于745 nm下测定吸光度。以没食子酸作为标准样品,根据没食子酸标准曲线方程y=90.035x-9.552,R2=0.999 4(质量浓度范围20~80 mg/L)计算不同待测溶液中的总酚含量。
1.4.3糖及抑制物去除率的计算 糖及抑制物的去除率(E)均按下式计算:
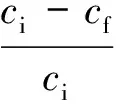
式中:ci—预水解液中糖或抑制物的初始质量浓度,mg/L;cf—离子液体萃取后预水解液中糖或抑制物的质量浓度,mg/L。
2 结果与讨论
2.1酸爆玉米秸秆预水解液成分分析
采用HPLC、R-HPLC和Folin-Ciocalteu比色法对预水解液中的成分进行分析,结果如表1所示。由于稀酸以及蒸汽爆破的双重作用,使得半纤维素(主要是木聚糖)发生水解生成木糖,同时不可避免地使得碳水化合物和木质素发生降解生成一系列对酶水解和微生物发酵有影响作用的抑制物[17]。从表1可以看出,酸爆玉米秸秆预水解液中主要成分为可发酵性糖、碳水化合物降解产物和木质素降解产物,其中葡萄糖和木糖质量浓度分别达到8.54和49.38 g/L,而碳水化合物降解产物中乙酸质量浓度最高(1.60 g/L),乙酸来源于预处理过程中半纤维素上乙酰基的水解[14]。而木质素大分子在酸性和高温条件下发生各种降解反应,同时小分子降解产物发生聚合反应,得到了一系列芳香化合物,其中单酚类化合物的抑制性最强[18],表1列举了9种典型木质素降解产物(均为单酚类化合物)的含量。通过测定,预水解液中总酚(单酚和多酚之和)达到3.51 g/L。虽然木质纤维预水解液中抑制物浓度差别较大,但这些抑制物之间的协同作用导致酶水解和微生物发酵抑制作用明显[5, 14]。因此,采用脱毒的手段是降低或消除这些抑制物对酶水解和微生物发酵抑制作用的方法之一[18]。
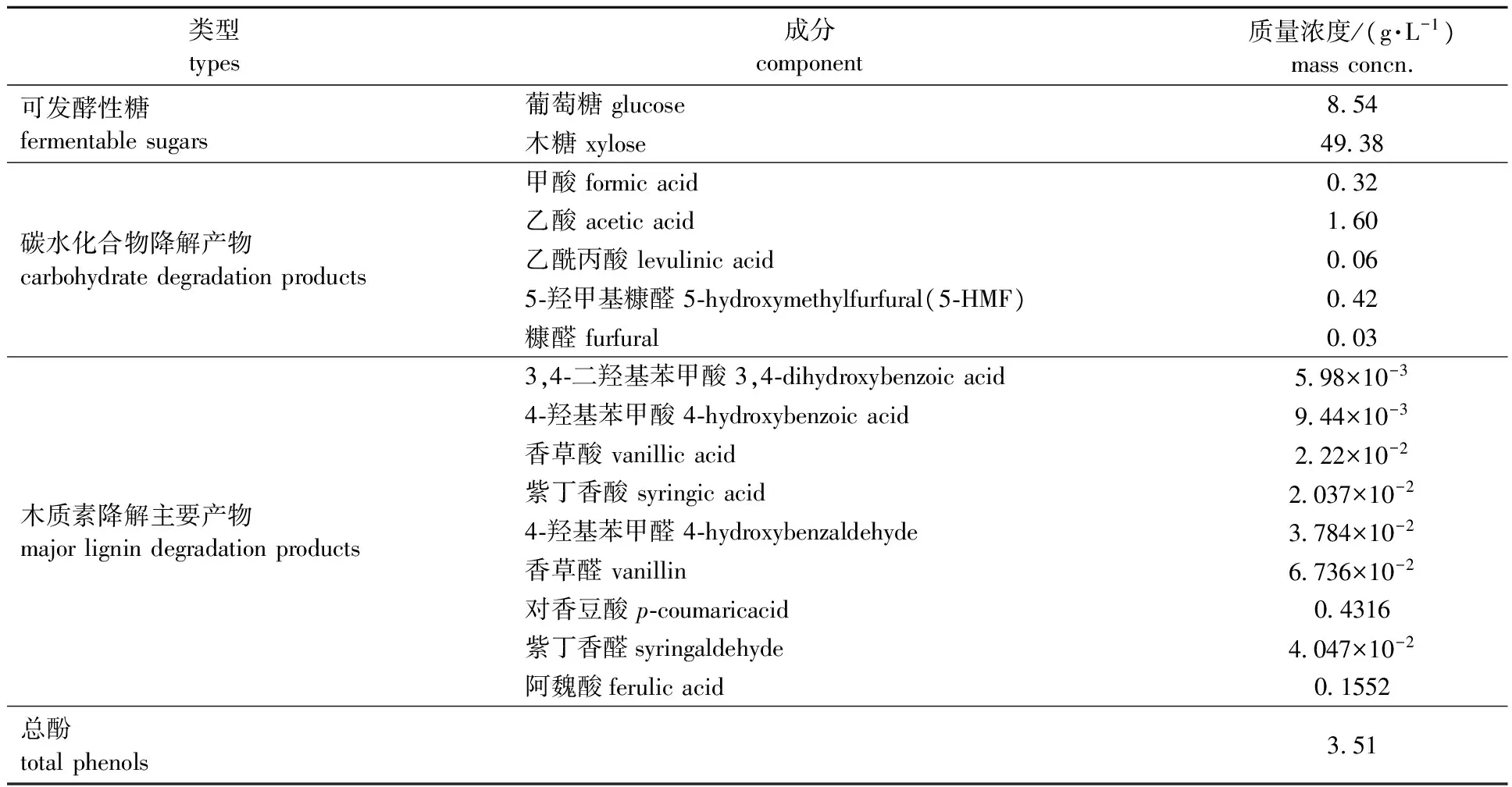
表1 酸爆玉米秸秆预水解液的成分分析Table 1 Composition analyses of acid-catalysed steam-exploded corn stoverprehydrolyzate
2.2离子液体萃取脱毒条件优化
2.2.1时间的影响 将酸爆玉米秸秆预水解液和[C4mim][PF6]按水油相比1∶1充分混合后,在 30 ℃、150 r/min下反应一定的时间(10~80 min),反应时间对抑制物及糖去除率的影响见图1。
从图1可以看出,[C4mim][PF6]萃取酸爆玉米秸秆预水解液时,10 min左右基本上就达到了平衡,水相中的成分基本维持稳定。其中,糠醛可100%去除;此时甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛和总酚的去除率分别为11.33%、15.68%、32.28%、65.47%和32.58%,而葡萄糖和木糖的去除率(损失率)分别仅为3.30%和3.94%。随着时间的延长,去除率基本不变,而可发酵单糖损失率却略有下降。因此,为了保证大规模实验中的准确性和重复性,选择60 min作为最佳萃取时间。
2.2.2温度的影响 将酸爆玉米秸秆预水解液和[C4mim][PF6]按水油相比1∶1充分混合后,在 150 r/min 下萃取60 min,反应温度对抑制物及糖去除率的影响见图2。
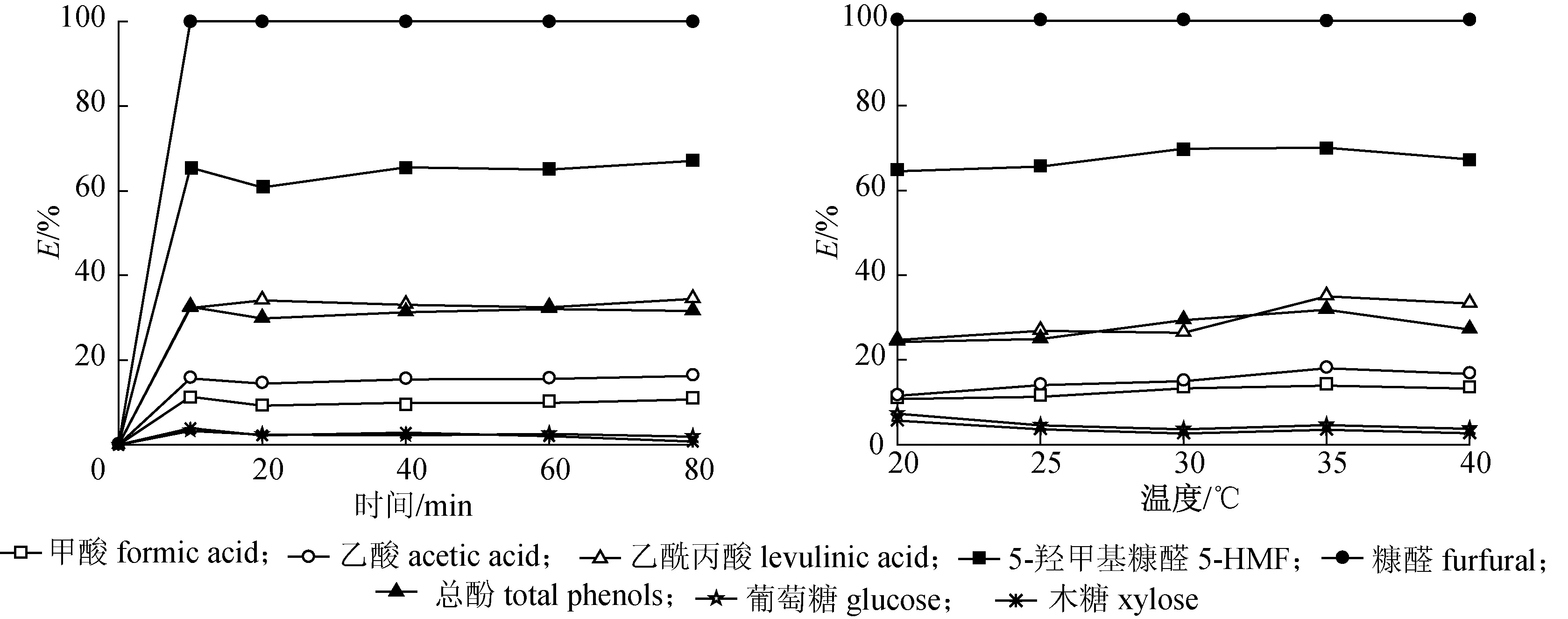
图1反应时间对抑制物及糖去除率的影响
Fig.1Effectofreactiontimeontheremovalrateofinhibitorsandsugars
图2反应温度对抑制物及糖去除率的影响
Fig.2Effectofreactiontemperatureontheremovalrateofinhibitorsandsugars
从图2可以看出,随着萃取温度的升高,预水解液中可发酵单糖的损失率略微下降,这说明提高温度可以减少脱毒过程中糖的损失;而抑制物除糠醛100%去除外,其他抑制物去除率均呈现先略微上升后下降的趋势。当温度达到35 ℃时,抑制物去除率达到最高,甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛和总酚的去除率分别达到13.93%、18.00%、34.97%、70.05%和31.85%;而在此温度下,葡萄糖和木糖的损失率分别仅为3.73%和2.67%。由于温度会影响萃取体系的分配系数和离子液体在水中的溶解度,温度升高,黏度下降,有利于传质,但也会影响物质的萃取能力[21],此外温度升高,离子液体的亲水性增加也导致其溶解度增加。因此,综合考虑,选择35 ℃作为最佳萃取温度。毛世越等[22]研究了[C8mim][PF6]和[C8mim][BF4]对2-氯苯酚、4-氯苯酚、2,4-二氯苯酚、2,4,6-三氯苯酚的萃取性能,当温度在 15~35 ℃ 范围内离子液体的萃取性能随温度升高而增大。
2.2.3水油相比的影响 将酸爆玉米秸秆预水解液和[C4mim][PF6]按不同水油相比(1∶2~4∶1)充分混合后,在35 ℃、150 r/min下萃取60 min,水油相比对抑制物及糖去除率的影响见图3。
从图3可以看出,随着酸爆玉米秸秆预水解液与[C4mim][PF6]水油相比的增加,离子液体[C4mim][PF6]用量减少(预水解液用量固定为5 mL),对各种抑制物(除糠醛100%去除之外)的去除率均呈明显下降趋势;而葡萄糖和木糖的损失率则呈现略微上升的趋势,这说明离子液体对抑制物和糖的萃取性能不同。当水油相比为1∶2时,甲酸、乙酸、乙酰丙酸和5-羟甲基糠醛去除率均达到最高,分别为29.17%、24.56%、47.19和84.93%,而葡萄糖和木糖损失率分别仅为0.21%和0.57%,继续降低水油相比,势必会增加离子液体的用量。因此,综合考虑,选择最佳水油相比为1∶2。万辉等[12]选择[C8mim][BF4]作为萃取剂,采用不同水油相比对7种酚类化合物进行萃取,得到与本研究相一致的结果。
2.2.4转速的影响 将酸爆玉米秸秆预水解液和[C4mim][PF6]按水油相比1∶2充分混合后,在35 ℃下萃取60 min,不同转速对抑制物及糖去除率的影响见图4。

图3水油相比对抑制物及糖去除率的影响
Fig.3Effectoftheratioofaqueoustoorganicphaseontheremovalrateofinhibitorsandsugars
图4转速对抑制物及糖去除率的影响
Fig.4Effectofrotationspeedontheremovalrateofinhibitorsandsugars
从图4可以看出,随着萃取转速的提高,抑制物中乙酰丙酸去除率随之上升,其他抑制物去除率均变化不大,转速的高低,可能会影响到离子液体与水相的混合程度。预水解液中可发酵单糖浓度几乎无变化,甚至出现略微增加的趋势(表现为去除率出现负值,因此未在图中列出),可能是离子液体部分吸水导致。当转速为250 r/min时,甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛、糠醛和总酚的去除率分别达到24.72%、21.84%、47.99%、82.76%、100%和39.70%。与漆酶等专一性去除木质素降解产物的脱毒方法(去除率77.50%)相比[5],离子液体对总酚的去除率较低,但因其对碳水化合物降解产物和木质素降解产物均具有一定的去除效果,因此,采用离子液体进行脱毒具有一定的优势。综合各种抑制物的去除率来看,在转速为250 r/min时,萃取效果最佳。
2.3离子液体脱毒效果分析
2.3.1离子液体阳离子碳链长度与抑制物疏水性 在1.3.2节的实验条件下,考察了离子液体碳链长度对酸爆玉米秸秆预水解液萃取的影响,结果如表2所示。
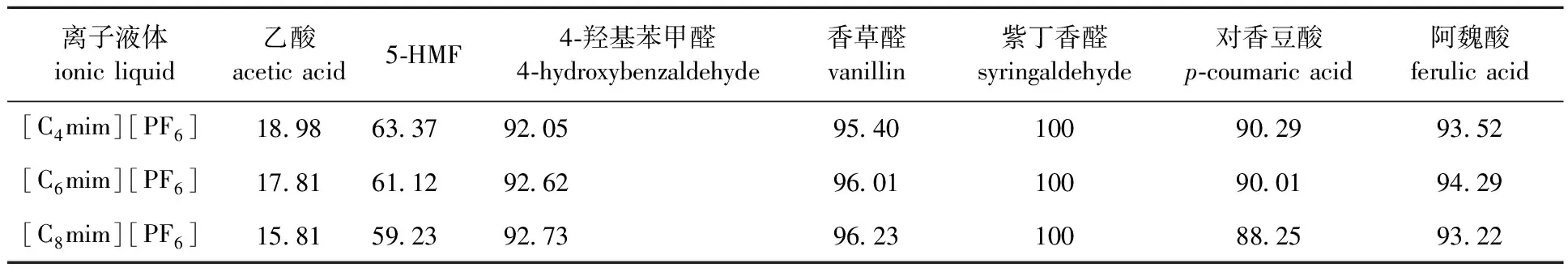
表2 主要抑制物在[Cnmim][PF6](n=4,6,8)中的去除率Table 2 Extraction efficiency of main inhibitors in[Cnmim][PF6](n=4,6,8) %
从表2可以看出,随着[Cnmim][PF6](n=4, 6, 8)阳离子碳链长度的增加,离子液体疏水性增强,乙酸、5-HMF、对香豆酸的去除率逐渐降低,而其他抑制物变化不大。离子液体与被萃取物分子之间的主要相互作用包括氢键、π-π、范德华力和静电力,其中氢键发挥最主要作用[23],可以通过阴离子与有机酸、酚类等抑制物的特殊官能团(—OH、—COOH)之间的氢键作用而将其萃取分离[24]。而在离子液体中咪唑环上烷基碳链的长度,决定了产生空间位阻效的大小,链长越长,空间位阻越大,不利于乙酸等抑制物与离子液体相互作用[25]。

2.3.2抑制物初始质量浓度 在1.3.3节的实验条件下,考察了抑制物初始质量浓度对酸爆玉米秸秆预水解液萃取的影响,结果如图5所示。
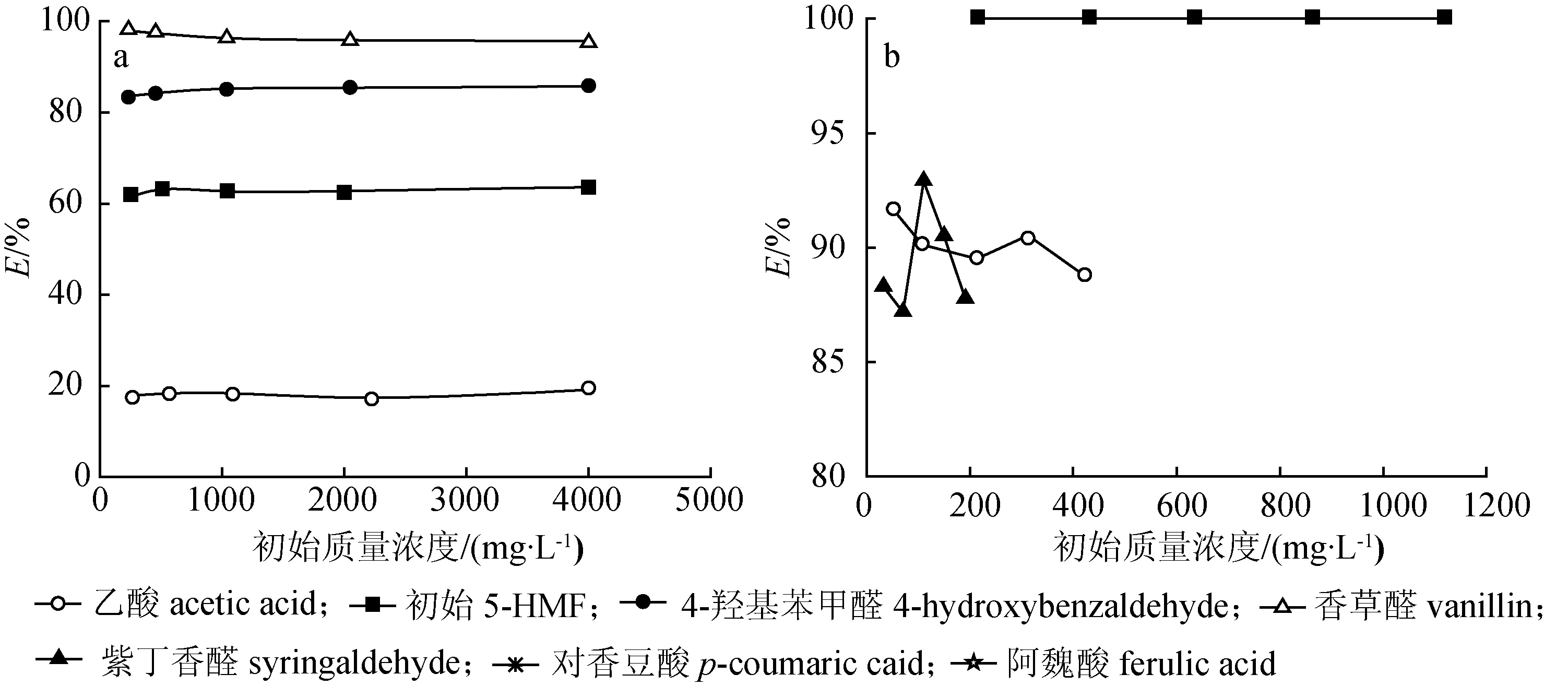
图5 抑制物初始浓度对萃取效果的影响
从图5(b)可以看出,受限于溶解度,紫丁香醛、对香豆酸、阿魏酸浓度梯度范围较小,紫丁香醛在 200~1 000 mg/L范围内100%被萃取,而对香豆酸和阿魏酸在各自浓度梯度内基本不受影响,去除率稳定在90%左右。由图5(a)可知,初始质量浓度由250 mg/L增加到4 000 mg/L左右时,香草醛在[C4mim][PF6]中去除率略有下降,由97.95%降至95.67%。而乙酸、5-HMF、4-羟基苯甲醛在[C4mim][PF6]中去除率基本不随抑制物初始质量浓度改变而发生变化。
2.3.3预水解液pH值 在1.3.4节的实验条件下,考察了pH值对酸爆玉米秸秆预水解液萃取的影响,结果如表3所示。从表3可以看出,随着pH值的增加,几种主要抑制物在[C4mim][PF6]中去除率总体呈下降趋势。当溶液pH值由4.0上升至6.0时,乙酸去除率从15.54%下降到1.23%。这是因为在酸性溶液中,乙酸等抑制物以分子形式存在,其所带的—COOH和—OH与离子液体阴离子上的氟原子之间存在氢键作用,随着pH值升高,抑制物以离子分子共存的形式存在,其电离出的阴离子与离子液体的阴离子发生静电排斥,使得在离子液体中去除率下降。因而当pH值为6.0时,去除率出现明显下降。pH值为8时,4-羟基苯甲醛、香草醛、紫丁香醛在离子液体中去除率都出现明显下降,分别下降了53.39、31.30和32.56个百分点;因此,预水解液的pH值越低,对抑制物的去除效果越好。

表3 pH值对主要抑制物去除率的影响Table 3 Effect of pH on extraction efficiency of the main inhibitors %
3 结 论
3.1以1-丁基-3-甲基咪唑六氟磷酸盐([C4mim][PF6])为萃取剂,对稀酸蒸汽爆破预处理玉米秸秆预水解液进行萃取脱毒,得出最佳萃取条件为:水油相体积比1∶2、温度35 ℃、摇床转速250 r/min下萃取 60 min。在此条件下,水解液中的主要抑制物甲酸、乙酸、乙酰丙酸、5-羟甲基糠醛、糠醛和总酚的去除率分别达到24.72%、21.84%、47.99%、82.76%、100%和39.70%;而可发酵性单糖(葡萄糖和木糖)几乎无损失。
3.2离子液体脱毒效果分析结果表明:随着离子液体[Cnmim][PF6](n=4, 6, 8)中阳离子碳链长度的增长,离子液体对抑制物萃取能力下降;离子液体疏水性越强,对抑制物的萃取分离效果越好;预水解液的pH值越低,对抑制物的去除效果越好。改变抑制物初始浓度,香草醛在[C4mim][PF6]中去除率略有下降,而乙酸、5-羟甲基糠醛、4-羟基苯甲醛在[C4mim][PF6]中去除率基本不随抑制物初始质量浓度改变而发生变化。
[1]SRIVASTAVA N,RAWAT R,OBEROI H S,et al. A review on fuel ethanol production from lignocellulosic biomass[J]. International Journal of Green Energy,2015,12(9):949 - 960.
[2]BRETHAUERS,STUDER M H. Biochemical conversion processes of lignocellulosic biomass to fuels and chemicals:A review[J]. CHIMIA International Journal for Chemistry,2015,69(10):572 - 581.
[3]LIMAYEM A,RICKE S C. Lignocellulosic biomass for bioethanol production:Current perspectives,potential issues and future prospects[J]. Progress in Energy and Combustion Science,2012,38(4):449 - 467.
[4]SOUDHAM V P,BRANDBERG T,MIKKOLA J P,et al. Detoxification of acid pretreated spruce hydrolysates with ferrous sulfate and hydrogen peroxide improves enzymatic hydrolysis and fermentation[J]. Bioresource Technology,2014,166:559 - 565.
[5]JÖNSSON L J,ALRIKSSON B,NILVEBRANT N O. Bioconversion of lignocellulose:Inhibitors and detoxification[J]. Biotechnology for Biofuels,2013,6:16.
[6]PIENKOS P T,ZHANG M. Role of pretreatment and conditioning processes on toxicity of lignocellulosic biomass hydrolysates[J]. Cellulose,2009,16(4):743 - 762.
[7]JEONG S Y,TRINH L T P,LEE H J,et al. Improvement of the fermentability of oxalic acid hydrolysates by detoxification using electrodialysis and adsorption[J]. Bioresource Technology,2014,152:444 - 449.
[8]MITHRA M G,PADMAJA A G. Phenolic inhibitors of saccharification and fermentation in lignocellulo-starch prehydrolysates and comparative efficacy of detoxification treatments[J]. Journal of Biomass to Biofuel,2016,3:1 - 15.
[9]申园园. 超声辅助-纳米零价铁/过氧化氢降解离子液体[D]. 洛阳:河南科技大学硕士学位论文,2013.
SHEN Y Y. Detoxication of acid pretreated spruce hydrolysates with ferrous sulfate and hydrogen peroxide improves enzymatic hydrolysis and fermentation[D]. Luoyang:Master Degree Thesis of Henan University of Science and Technology,2013.
[11]赵扬,裴渊超,武坤,等. 利用咪唑类离子液体分离发酵液中的糠醛[J]. 河南师范大学学报:自然科学版,2007,35(4):212.
ZHAO Y,PEI Y C,WU K,et al. Separation of furfural from fermentation broth by using imidazoles ionic liquids[J]. Journal of Henan Normal University:Natural Science,2007,35(4):212.
[12]万辉,黄德英,蔡源,等.[omim]BF4离子液体萃取酚类化合物的研究[J]. 高校化学工程学报,2008,22(1):162 - 165.
WAN H,HUANG D Y,CAI Y,et al. Extraction of phenolic compounds with[omim]BF4ionic liquid[J]. Journal of Chemical Engineering of Chinese Universities,2008,22(1):162 - 165.
[13]杨金龙,荣亚运,高露,等. 咪唑类离子液体对木质纤维预水解液的脱毒[J]. 化工学报,2015,67(4):1490 - 1496.
YANG J L,RONG Y Y,GAO L,et al. Detoxification of lignocellulosic prehydrolyzate using imidazolium-based ionic liquid[J]. CIESC Journal,2015,67(4):1490 - 1496.
[14]ZHU J J,YANG J L,ZHU Y Y,et al. Cause analysis of the effects of acid-catalyzed steam-exploded corn stover prehydrolyzate on ethanol fermentation byPichiastipitisCBS 5776[J]. Bioprocess and Biosystems Engineering,2014,37(11):2215 - 2222.
[15]江智婧,朱均均,李鑫,等. 反相高效液相色谱法定量分析木质素的主要降解产物[J]. 色谱,2011,29(1):59 - 62.
JIANG Z J,ZHU J J,LI X,et al. Determination of main degradation products of lignin using reversed-phase high performance liquid chromatography[J]. Chinese Journal of Chromatography,2011,29(1):59 - 62.
[16]LI J B,HENRIKSSON G,GELLERSTEDT G. Lignin depolymerization/repolymerization and its critical role for delignification of aspen wood by steam explosion[J]. Bioresource Technology,2007,98(16):3061 - 3068.
[17]JÖNSSON L J,MARTíN C. Pretreatment of lignocellulose:Formation of inhibitory by-products and strategies for minimizing their effects[J]. Bioresource Technology,2016,199:103 - 112.
[18]LAI C H,LI X,ZHU J J,et al. Detoxification of steam-exploded corn stover prehydrolyzate with organobentonite enhances ethanol fermentation byPichiastipitis[J]. Bioresources,2016,11(1):1905 - 1918.
[19]宋旭东,李肖华,姬登祥,等. 咪唑类疏水性离子液体用于萃取苯酚的研究[J]. 浙江工业大学学报,2009,37(3):251 - 254.
SONG X D,LI X H,JI D X,et al. Research on extraction of phenol with imidazole-based hydrophobic ionic liquids[J]. Journal of Zhejiang University of Technology,2009,37(3):251 - 254.
[20]HOU Y C,REN Y H,PENG W,et al. Separation of phenols from oil using imidazolium-based ionic liquids[J]. Industrial and Engineering Chemistry Research,2013,52(50):18071 - 18075.
[21]吕廷婷,季金苟,夏之宁,等. 离子液体萃取有机物的研究进展[J]. 化工进展,2010,29(5):801 - 806.
LÜ T T,JI J G,XIA Z N,et al. Progress in room temperature ionic liquids for extraction of organic compounds[J]. Chemical Industry and Engineering Progress,2010,29(5):801 - 806.
[22]毛世越,刘汉兰. 疏水性离子液体萃取氯酚类物质[J]. 化工学报,2015,66(S1):260 - 264.
MAO S Y,LIU H L. Extraction of chlorophenols with imidazole-based hydrophobic ionic liquids[J]. CIESC Journal,2015,66(S1):260 - 264.
[23]YANG Q W,XING H B,SU B G,et al. The essential role of hydrogen-bonding interaction in the extractive separation of phenolic compounds by ionic liquid[J]. AIChE Journal,2013,59(5):1657 - 1667.
[24]张香平,白银鸽,闫瑞一,等. 离子液体萃取分离有机物研究进展[J]. 化工进展,2016,35(6):1587 - 1605.
ZHANG X P,BAI Y G,YAN R Y,et al. Progress in ionic liquids for extraction of organic compounds[J]. Chemical Industry and Engineering Progress,2016,35(6):1587 - 1605.
[25]CHEN D X,OUYANG X K,WANG Y G,et al. Liquid-liquid extraction of caprolactam from water using room temperature ionic liquids[J]. Separation and Purification Technology,2013,104:263 - 267.
[26]REICHARDT C,WELTON T. Solvents and Solvent Effects in Organic Chemistry[M]. New York:John Wiley & Sons,2011.
[27]李闲,张锁江,张建敏,等. 疏水性离子液体用于萃取酚类物质[J]. 过程工程学报,2005,5(2):148 - 151.
LI X,ZHANG S J,ZHANG J M,et al. Extraction of phenols with hydrophobic ionic liquids[J]. The Chinese Journal of Process Engineering,2005,5(2):148 - 151.
[28]WANG J J,PEI Y C,ZHAO Y,et al. Recovery of amino acids by imidazolium based ionic liquids from aqueous media[J]. Green Chemistry,2005,7(4):196 - 202.
Detoxification of Lignocellulosic Prehydrolyzate by Hydrophobic Ionic Liquid [C4mim][PF6]
CHENG Yichao1,2, YANG Jinlong1,2, ZHU Junjun1,2,3, XU Yong1,2,3, YONG Qiang1,2, YU Shiyuan1,2
(1.Jiangsu Co-innovation Center of Efficient Processing and Utilization of Forest Resources,Nanjing ForestryUniversity, Nanjing 210037, China; 2.College of Chemical Engineering,Nanjing ForestryUniversity, Nanjing 210037, China; 3.Jiangsu Key Lab of Biomass-based GreenFuel and Chemicals, Nanjing 210037, China)
In this study, a new green detoxification technology named-ionic liquid extraction was used for detoxification of the prehydrolyzate obtained from the washed acid-catalyzed steam-exploded corn stover in order to improve the ethanol fermentability of yeast. 1-butyl-3-methyl imidazole hexafluorophosphate([C4mim][PF6]) was selected as the extraction agent and its extraction conditions had been optimized. The optimal extraction conditions were as follows: the ratio of aqueous to organic phase 1∶2, 35 ℃, 250 r/min, and 60 min. Under these conditions, the removal rate of formic acid, acetic acid, levulinic acid, 5-hydroxymethylfurfural, furfural and total phenols in the hydrolysate reached 24.72%, 21.84%, 47.99%, 82.76%, 100% and 39.7% respectively, the extraction efficiencies of the main inhibitors were high and the loss of sugars was negligible. The results of detoxification mechanism indicated that the extraction efficiency of the inhibitors decreased with the increase of alkyl chain length on the cation of ionic liquid[Cnmim][PF6](n=4, 6, 8); the more hydrophobic the inhibitors were, the stronger the hydrogen bonding with ionic liquid was; the lower the pH value was, the better the extraction efficiency of inhibitors was.The removal rate of acetic acid, 5-hydroxymethylfurfural and 4-hydroxybenzaldehyde in[C4mim][PF6] did not change with the initial mass concentration of inhibitors.
lignocellulose; inhibitor; ionic liquid; extraction; detoxification
2017- 02-10
“十二五”国家科技支撑计划资助(2015BAD15B09);江苏省普通高校研究生科研创新计划资助项目(SJLX_0406);江苏高校优势学科建设工程资助项目(无编号)
程逸超(1992— ),男,安徽安庆人,硕士生,研究方向为生物化工
*通讯作者:朱均均,副教授,博士,研究领域为生物化工;E-mail: zhujj@njfu.edu.cn。
10.3969/j.issn.0253-2417.2017.05.006
TQ353
A
0253-2417(2017)05- 0045- 08
程逸超,杨金龙,朱均均,等.疏水性离子液体[C4mim][PF6]对木质纤维预水解液的脱毒作用[J].林产化学与工业,2017,37(5):45 - 52.
