颌面部感染的病原菌及耐药性
2017-11-07刘春林徐红云方玉飞邓德耀
刘春林,张 莉,陈 弟,徐红云,张 唤,李 红,方玉飞,邓德耀
(云南省第二人民医院/云南大学第一医院,云南 昆明 650021)
2017-03-09
云南省教育厅科学研究基金项目(2013Y285)
刘春林(1973-),男(汉族),云南省安宁市人,副主任技师,主要从事临床微生物学检验研究。
张莉 E-mail:13658898675@139.com
10.3969/j.issn.1671-9638.2017.11.017
·论著·
颌面部感染的病原菌及耐药性
刘春林,张 莉,陈 弟,徐红云,张 唤,李 红,方玉飞,邓德耀
(云南省第二人民医院/云南大学第一医院,云南 昆明 650021)
目的了解颌面部感染患者病原菌分布及其药物敏感性,为临床合理使用抗菌药物提供依据。方法收集2012年1月—2016年12月某医院口腔颌面部感染患者标本进行病原菌培养,对病原菌进行鉴定和药敏检测,分析病原菌分布及耐药性。结果882例颌面部感染患者中男性占32.20%,女性占67.80%;年龄为~40岁、~60岁组的患者较多,分别占35.38%和32.65%;共分离病原菌145株,革兰阴性菌88株,占60.69%,以肺炎克雷伯菌和铜绿假单胞菌为主;革兰阳性菌56株,占38.62%,以金黄色葡萄球菌为主。肺炎克雷伯菌对检测的16种药物的耐药率均<50%,对亚胺培南和美罗培南的耐药率最低,均为3.45%,11株为产超广谱β -内酰胺酶(ESBLs)阳性菌株;铜绿假单胞菌对检测的10种药物耐药率均<40%。金黄色葡萄球菌对替加环素、利奈唑胺、万古霉素均敏感,对青霉素的耐药率最高(66.67%),对苯唑西林的耐药率为20.83%。结论口腔颌面部感染病原菌以革兰阴性菌为主,不同病原菌耐药性差别较大,在临床治疗时,应根据药敏结果合理使用抗菌药物。
颌面部感染; 病原菌; 耐药性; 抗药性,微生物; 合理用药
[Chin J Infect Control,2017,16(11):1065-1068,1077]
口腔颌面部位于消化道和呼吸道的起端,通过口腔和鼻腔与外界相通,颌面及颌骨周围存在许多相互连通的潜在性的筋膜间隙[1]。口腔内含有多种正常菌群,当机体免疫功能下降或口腔内环境改变时均可引发条件致病菌繁殖、扩散,导致口腔颌面部间隙感染,其感染往往不局限于单个间隙,而是向邻近的组织和间隙扩散,严重时常合并海绵窦血栓性静脉炎,向上致颅脑感染、上呼吸道梗阻,向下致纵膈感染等严重的并发症,对患者健康及生命造成威胁。颌面部感染是口腔科常见疾病,以化脓性细菌感染为主,感染的发生发展一方面取决于细菌的种类、数量和毒力,另一方面取决于机体抵抗力、营养状态及抗菌药物合理使用等。若治疗及时正确,多数在1周内可治愈,若延误治疗,短期内发展为多间隙感染,继而引起全身性感染,出现败血症、感染性休克等严重并发症,甚至威胁患者的生命[2]。近年来,随着抗菌药物的大量使用,感染的病原菌构成发生了很大的变化,监测口腔颌面部间隙感染细菌及耐药谱演变,对指导临床规范应用抗菌药物,提高经验性抗菌药物治疗的准确率,改善口腔颌面部间隙感染患者预后具有深远意义。本研究对本院2012年1月—2016年12月口腔颌面部间隙感染患者的临床资料进行分析,探讨口腔颌面部间隙感染病原学分布特点及耐药状况,为临床治疗该疾病提供理论依据。
1 对象与方法
1.1 研究对象 2012年1月—2016年12月云南省第二人民医院口腔外科的颌面部感染患者。
1.2 样本采集 严格遵循无菌操作,用无菌注射器刺入脓肿抽取脓液约0.5 mL,标本尽快送检。
1.3 主要仪器与试剂 VITEK 2 Compact全自动微生物分析仪、细菌鉴定卡和药敏卡由法国BioMerieux公司生产,抗菌药敏纸片和MH琼脂平板(Mueller-Hinton agar)为英国OXOID公司产品。
1.4 试验方法 按照《全国临床检验操作规程》(第3版)进行病原菌的分离培养,采用VITEK 2 Compact全自动微生物分析系统进行菌落鉴定和药敏试验,部分药敏试验采用K-B纸片扩散法进行。
1.5 质控菌株 质控菌株为大肠埃希菌(ATCC 25922)、铜绿假单胞菌(ATCC 27853)、粪肠球菌(ATCC 29212)和金黄色葡萄球菌(ATCC 25923),均购自卫生部临床检验中心。
1.6 统计学分析 应用WHONET软件进行统计学分析。
2 结果
2.1 不同性别患者细菌培养情况 882例颌面部感染患者中,男性284例(占32.20%),女性598例(占67.80%);140份标本培养出病原菌,男性患者培养阳性率为13.03%,女性患者培养阳性率为17.22%。见表1。
表1不同性别患者颌面部感染细菌培养阳性情况
Table1Positive bacterial culture results of maxillofacial infection in patients of different genders
2.2 不同年龄患者细菌培养情况 患者年龄30 d~85岁,其中~40岁、~60岁组患者较多,分别占35.38%、32.65%;各年龄段病原菌培养阳性率分别为12.80%、18.27%、15.28%、14.48%、16.67%、15.87%。见表2。
表2不同年龄段患者颌面部感染细菌培养阳性情况
Table2Positive bacterial culture results of maxillofacial infection in patients in different age groups

年龄段(岁)患者数构成比(%)培养阳性患者数阳性率(%)≤2012514.171612.80~4031235.385718.27~6028832.654415.28~8014516.442114.48>80121.36216.67合计882100.0014015.87
2.3 病原菌分布 共分离病原菌145株,其中混合感染5例。革兰阴性菌88株,占60.69%,以肺炎克雷伯菌和铜绿假单胞菌为主;革兰阳性菌56株,占38.62%,以金黄色葡萄球菌为主;真菌1株,占0.69%。见表3。
表3颌面部感染病原菌分布及构成
Table3Distribution and constituent of pathogens causing maxillofacial infection
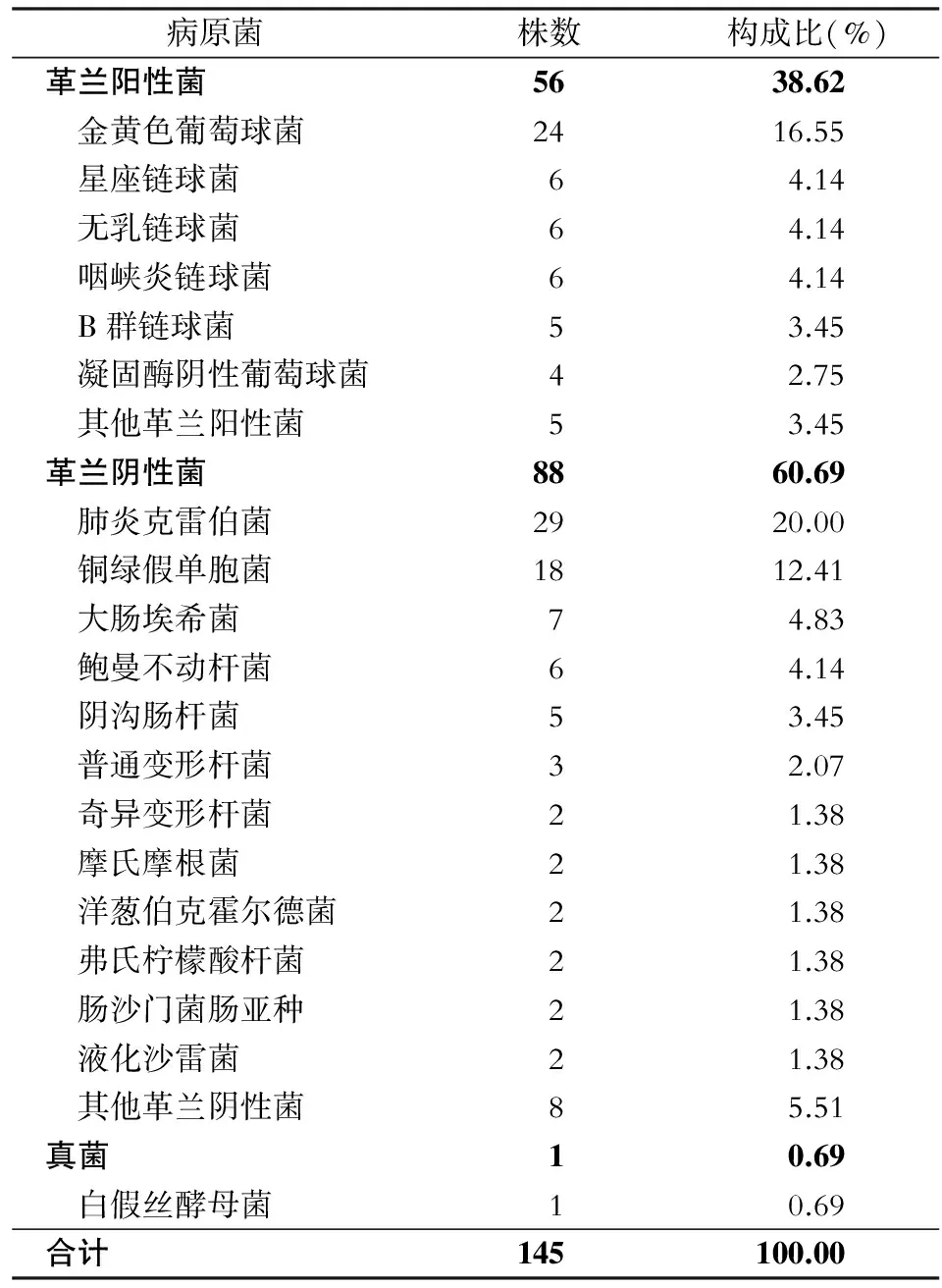
病原菌株数构成比(%)革兰阳性菌5638.62 金黄色葡萄球菌2416.55 星座链球菌64.14 无乳链球菌64.14 咽峡炎链球菌64.14 B群链球菌53.45 凝固酶阴性葡萄球菌42.75 其他革兰阳性菌53.45革兰阴性菌8860.69 肺炎克雷伯菌2920.00 铜绿假单胞菌1812.41 大肠埃希菌74.83 鲍曼不动杆菌64.14 阴沟肠杆菌53.45 普通变形杆菌32.07 奇异变形杆菌21.38 摩氏摩根菌21.38 洋葱伯克霍尔德菌21.38 弗氏柠檬酸杆菌21.38 肠沙门菌肠亚种21.38 液化沙雷菌21.38 其他革兰阴性菌85.51真菌10.69 白假丝酵母菌10.69合计145100.00
2.4 主要病原菌的药敏结果 肺炎克雷伯菌对检测的16种抗菌药物的耐药率均<50%,对哌拉西林/他唑巴坦和头孢哌酮/舒巴坦的耐药率较低(均为6.90%),对亚胺培南和美罗培南的耐药率最低,均为3.45%,11株为产超广谱β -内酰胺酶(ESBLs)阳性菌株;铜绿假单胞菌对头孢唑林,和呋喃妥因,对检测的10种抗菌药物耐药率均<40%,对亚胺培南和美罗培南的耐药率均为38.89%。见表4。金黄色葡萄球菌对呋喃妥因、莫西沙星、替加环素、利奈唑胺、万古霉素和喹奴普丁/达福普汀均敏感,对青霉素的耐药率最高(66.67%),其次为红霉素和克林霉素,耐药率均为54.17%,对苯唑西林的耐药率为20.83%。见表5。
表4颌面部感染肺炎克雷伯菌和铜绿假单胞菌对抗菌药物的药敏结果
Table4Antimicrobial susceptibility testing results ofKlebsiellapneumoniaeandPseudomonasaeruginosacausing maxillofacial infection
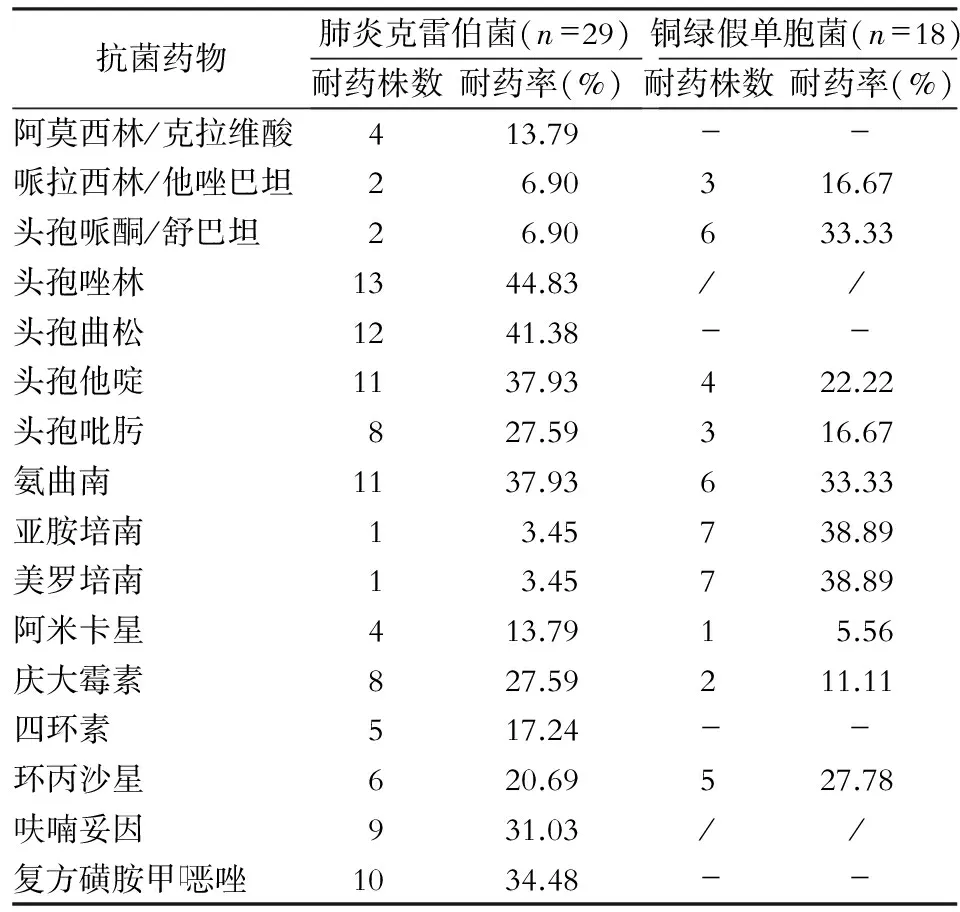
抗菌药物肺炎克雷伯菌(n=29)耐药株数耐药率(%)铜绿假单胞菌(n=18)耐药株数耐药率(%)阿莫西林/克拉维酸413.79--哌拉西林/他唑巴坦26.90316.67头孢哌酮/舒巴坦26.90633.33头孢唑林1344.83//头孢曲松1241.38--头孢他啶1137.93422.22头孢吡肟827.59316.67氨曲南1137.93633.33亚胺培南13.45738.89美罗培南13.45738.89阿米卡星413.7915.56庆大霉素827.59211.11四环素517.24--环丙沙星620.69527.78呋喃妥因931.03//复方磺胺甲口恶唑1034.48--
-:未做该试验; /:天然耐药
表5颌面部感染金黄色葡萄球菌对抗菌药物的药敏结果
Table5Antimicrobial susceptibility testing results ofStaphylococcusaureuscausing maxillofacial infection
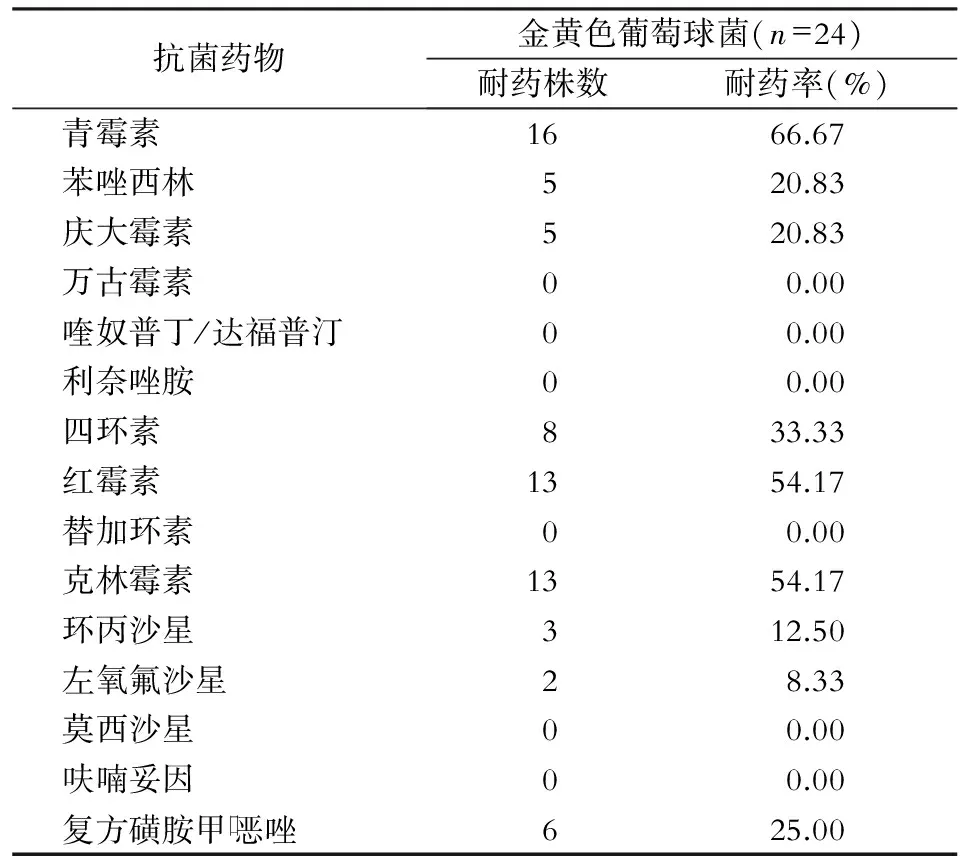
抗菌药物金黄色葡萄球菌(n=24)耐药株数耐药率(%)青霉素1666.67苯唑西林520.83庆大霉素520.83万古霉素00.00喹奴普丁/达福普汀00.00利奈唑胺00.00四环素833.33红霉素1354.17替加环素00.00克林霉素1354.17环丙沙星312.50左氧氟沙星28.33莫西沙星00.00呋喃妥因00.00复方磺胺甲口恶唑625.00
3 讨论
口腔颌面部解剖关系特殊,上通颅底下达纵隔的筋膜间隙,其间以疏松结缔组织填充。口腔颌面部间隙感染包含了面部、口腔、咽喉、颈部等部位,是口腔颌面部常见的感染性疾病[3]。由于口腔颌面部存在能够相互连通的筋膜间隙,可导致局部脓肿或弥散性蜂窝织炎,加之病原菌在口腔内部,细菌繁殖较快,可导致病情的快速发展[4-5]。口腔颌面部间隙感染一般以牙源性和腺源性来源为主,一旦发生并发症常威胁患者的生命安全[1,6]。十七世纪初牙源性感染引起的死亡就引起了人们的重视,二十世纪初我国口腔颌面部间隙感染导致患者病死率高达10%~40%[7]。随着医学迅速发展及抗菌药物广泛应用,口腔颌面部感染的病死率逐渐下降,但耐药问题已成为关注的重点[8]。
本研究中882例颌面部感染患者中男性占32.20%,女性占67.80%。丛丙峰等[9]研究中144例口腔颌面部感染患者中60岁以上患者占34.02%,其认为与老年人体质较差、免疫功能较低,以及多伴糖尿病、高血压、冠心病等全身系统性疾病有关,而本研究中60岁以上患者占17.80%,两个研究中老年患者比例不同。颌面部间隙感染可分为浅部间隙感染和深部间隙感染,根据感染的部位不同,细菌感染的类别有所差异[10]。有文献[11-13]对口腔颌面部间隙感染患者的病原菌进行检测,发现多以革兰阳性菌为主。本研究中分离的致病菌主要是革兰阴性菌(占60.69%),以肺炎克雷伯菌和铜绿假单胞菌为主。
本研究中肺炎克雷伯菌对检测的16种药物的耐药率均<50%,对亚胺培南和美罗培南的耐药率均为3.45%。蔡圳等[12]对口腔颌面部间隙感染患者中分离到的65株病原菌进行药敏结果统计,肺炎克雷伯菌对亚胺培南、阿米卡星、厄他培南100%敏感,对大多数抗菌药物的敏感性普遍较高,与本研究的结果不同,可能与蔡圳等研究中菌株数较少有关。
随着β-内酰胺类、氨基糖苷类及碳青霉烯类等抗菌药物的广泛使用,细菌易产生 ESBLs、头孢菌素酶(AmpC酶)、氨基糖苷类修饰酶(AMEs)及碳青霉烯酶,对抗菌药物呈现出严重的多重耐药性。本研究中29株肺炎克雷伯菌中分离出11株ESBLs菌株,24株金黄色葡萄球菌分离出5株耐甲氧西林金黄色葡萄球菌。ESBLs菌株对多种常用抗菌药物呈现耐药,与颌面部间隙感染的严重并发症相关[10],预后较差,导致临床抗菌药物治疗的失败和病程迁延。多重耐药菌株还可引起医院感染,应引起感染控制部门的重视。
口腔颌面部间隙多为密闭的深部组织,为厌氧菌的生存提供了良好的场所,牙源性感染成为人口腔颌面部间隙感染最主要的病因[9,14]。有研究[15-16]发现,牙源性口腔颌面部间隙感染患者分离的菌株中,除需氧菌外,还有厌氧菌,检出的厌氧菌多为口腔的优势菌株,如普雷沃菌、拟杆菌和梭杆菌等,说明口腔颌面部间隙感染可能主要来源于牙源性感染。本研究所选取的研究样本量较大,检出的病原菌类型和构成与以往文献[11,17]报道基本一致,说明口腔颌面部感染基本的感染类型是一致的。本研究存在一定的局限性,未深入分析不同的感染类型、感染来源的菌群分布及其耐药情况,未进行厌氧培养,漏掉了重要的厌氧菌感染,将在以后的研究中进一步深入探讨。
综上所述,口腔颌面部感染患者需氧培养病原菌以革兰阴性菌为主,不同病原菌对常见抗菌药物耐药情况不同,在临床选择药物时,要结合病原菌特点和药敏试验结果,参考本科室的耐药菌情况规范合理选择。
[1] 张志愿.口腔颌面外科学[M].7版. 北京:人民卫生出版社,2012.
[2] 曾晓燕,周维,张波,等.口腔颌面部间隙感染的临床分析[J]. 中华医院感染学杂志,2015,25(2):421-423.
[3] Cariati P, Cabello-Serrano A, Monsalve-Iglesias F, et al. Meningitis and subdural empyema as complication of pterygomandibular space abscess upon tooth extraction[J]. J Clin Exp Dent, 2016, 8(4): e469-e472.
[4] Rajaram P, Bhattacharjee A, Ticku S. Serratiopeptidase-A cause for spread of infection[J]. J Clin Diagn Res, 2016, 10(8): ZD31-32.
[5] Procacci P, Alfonsi F, Tonelli P, et al. Surgical treatment of oroantral communications[J]. J Craniofac Surg, 2016, 27(5): 1190-1196.
[6] 王愿林,程莉,王和平,等.口腔颌面部间隙感染患者治疗的临床研究[J].中华医院感染学杂志,2016,26(7):1606-1608.
[7] Al-Sebaei MO, Jan AM. A survey to assess knowledge, practice, and attitude of dentists in the Western region of Saudi Arabia[J]. Saudi Med J, 2016, 37(4): 440-445.
[8] 郑齐,王藕儿. 156例口腔颌面部间隙感染患者临床感染特点及病原菌分析[J].现代预防医学,2015,42(13):2478-2479,2489.
[9] 丛丙峰,丁明超,许方方,等. 144例颌面部间隙感染患者的流行病学分析[J]. 实用口腔医学杂志,2016,32(2):212-215.
[10] 李佳玮,蔡协艺.口腔颌面部间隙感染病原菌研究现状[J].口腔颌面外科杂志,2013,23(3):225-228.
[11] 吕继连,张瑞,闫大勇,等.口腔颌面部间隙感染的病原菌药敏分析[J].中华医院感染学杂志,2016,26(11):2565-2567.
[12] 蔡圳,朱德全.口腔颌面部间隙感染患者病原菌分布及药物敏感性分析[J].山东医学高等专科学校学报,2014,36(5):349-353.
[13] Mathew GC, Ranganathan LK, Gandhi S, et al. Odontogenic maxillofacial space infections at a tertiary care center in North India: a five-year retrospective study[J]. Int J Infect Dis, 2012, 16(4): e296-e302.
[14] 金佳敏,蔡协艺,张伟杰,等.口腔颌面部多间隙感染合并化脓性心包炎的诊断与治疗[J].中国口腔颌面外科杂志,2013,11(3):230-234.
[15] Rega AJ, Aziz SR, Ziccardi VB.Microbiology and antibiotic sensitivities of head and neck space infections of odontogenic origin[J]. J Oral Maxillofac Surg, 2006, 64(9): 1377-1380.
[16] 包振英,林琴,孟彦宏,等.厌氧菌检测技术在口腔颌面部感染治疗中的应用[J].北京大学学报(医学版),2016,48(1):76-79.
[17] 何淳,林海燕,刘翠梅.口腔颌面部医院感染患者不同部位病原菌分布与耐药性分析[J].中华医院感染学杂志,2017,27(8): 1821-1824.
Pathogensandantimicrobialresistanceinmaxillofacialinfection
LIUChun-lin,ZHANGLi,CHENDi,XUHong-yun,ZHANGHuan,LIHong,FANGYu-fei,DENGDe-yao
(TheSecondPeople’sHospitalofYunnanProvince/TheFirstHospitalofYunnanUniversity,Kunming650021,China)
ObjectiveTo investigate the distribution and antimicrobial susceptibility of pathogens causing maxillofacial infection in patients, and provide evidence for rational use of antimicrobial agents in clinical practice.MethodsSpecimens of patients infected with oral and maxillofacial infection in a hospital between January 2012 and December 2016 were performed microbial culture, pathogens were identified and performed antimicrobial susceptibility testing, distribution of pathogens and antimicrobial resistance were analyzed.ResultsOf 882 patients with maxillofacial infection, male and female accounted for 32.20% and 67.80% respectively; 35.38% and 32.65% of patients aged ~40 years and ~60 years respectively; a total of 145 strains were isolated, 88(60.69%) of which were gram-negative bacteria, mainlyKlebsiellapneumoniaeandPseudomonasaeruginosa; 56(38.62%) of which were gram-positive bacteria, mainlyStaphylococcusaureus. Resistance rates ofKlebsiellapneumoniaeto 16 kinds of antimicrobial agents were all<50%,resistance rates to imipenem and meropenem were the lowest, both were 3.45%, 11 strains were extended-spectrum β-lactamases-producing strains; resistance rates ofPseudomonasaeruginosato 10 kinds of antimicrobial agents were all<40%.Staphylococcusaureuswas susceptible to tigecycline, linezolid, and vancomycin, resistance rate to penicillin was the highest(66.67%),resistance rate to oxacillin was 20.83%.ConclusionThe main pathogens causing oral and maxillofacial infection are gram-negative bacteria, different pathogens have different antimicrobial resistance, antimicrobial agents should be used rationally during clinical treatment according to antimicrobial susceptibility testing result.
maxillofacial infection; pathogen; drug resistance, microbial; rational antimicrobial use
R782.3 R969.3
A
1671-9638(2017)11-1065-05
(本文编辑:豆清娅、左双燕)
