人脐带血体外扩增和临床应用的研究进展
2017-11-07楚晓婷李天宇周新王浩
楚晓婷,李天宇,周新,王浩
人脐带血体外扩增和临床应用的研究进展
楚晓婷,李天宇,周新,王浩
214023 无锡,江苏希瑞干细胞技术有限公司(楚晓婷、王浩);214023 无锡,南京医科大学附属无锡人民医院/无锡市儿童医院儿血液科(李天宇);214023 无锡,南京医科大学附属无锡人民医院血液科(周新)
1974 年人类第一次认识到脐带血中含有造血干细胞,并在 1988 年进行了全世界首例脐带血移植,且成功治愈了一位范可尼贫血患者[1],证明了脐带血移植的临床应用潜能。至今,在全世界范围内的脐带血移植案例已超过 4 万例。脐带血作为一种新的造血干细胞移植的供体,具有来源广泛、易于采集、对供体无伤害、HLA 配型要求低、造血干/祖细胞(HSPC)含量高等优点。而且,脐带血的制备时间相比于从一个匹配的无关供者体内获得造血干细胞所需的时间要短 4 ~ 5 周[2]。此外,脐带血移植(umbilical cord blood transplantation,UCBT)后的病情复发率和移植物抗宿主病的发病率相比于其他来源的造血干细胞移植也是较低的[3-4]。
然而,UCBT 应用于临床最大的局限就是脐带血中可提取到的总的有核细胞(total nucleated cell,TNC)数量过少。研究表明:HLA 匹配的位点越少,需要 TNC 的量就越多。根据疾病的类型,单份充足的脐带血数量被定义为:HLA 位点全相合需> 3 × 107TNC/kg,5 个位点相合需> 4 × 107TNC/kg,4 个位点相合则需> 5 × 107TNC/kg[5]。脐带血中所含的有核细胞数,仅有外周血和骨髓中可用有核细胞浓度的 5% ~ 10%[6],如若进行低数量的脐带血移植,会引起中性粒细胞恢复延迟并增加细菌及病毒的感染风险[7-8]。而双份脐带血移植,虽然扩大了成人使用脐带血进行移植的范围,但会增加移植物抗宿主病的发病率,延长血小板恢复时间,从而引发一系列问题[9]。
因此,许多科学家致力于研究如何提高脐带血移植的成功率。主要的研究方向有:脐带血的体外扩增、双份脐带血的移植(两份均为未扩增脐带血或其中一份为体外扩增的脐带血)、增加脐带血造血干细胞向骨髓的归巢能力等。本文依据近年来国内外研究的脐带血体外扩增的方法、研究进展和临床效果等进行了综述。扩增脐带血最直接的方法是通过体外扩增脐带血中的造血祖细胞。脐带血的扩增能够使粒细胞-巨噬细胞的集落形成单位数量增加,其数量高于骨髓和外周血,且脐带血扩增的能力也要优于骨髓和外周血。因此研究者们尝试了很多种方法来进行脐带血的体外扩增,例:细胞因子、小分子化合物、基因修饰、间充质干细胞共培养等。
1 单独添加细胞因子扩增脐带血
细胞因子是最早用来体外扩增脐带血的,不同的细胞因子对脐带血中 HSPC 的生长发育的作用也有所不同,虽然各类细胞因子的作用机制尚不完全明确,但目前应用最广、效果最为确切的细胞因子主要从以下 3 个方面来调节 HSC 的生长发育:①促进 HSC 从 G0 期向 G1 期的发育;②抑制 HSC 进入G0 期;③促进 S 期 HSC 的扩增[10]。例如:干细胞因子(stem cell factor,SCF)、血小板生成素(thrombopoietin,TPO)、fms 样酪氨酸激酶 3 的配体(fms-like tyrosine kinase 3 ligand,FLT-3L)、白介素(interleukin,IL)-3、IL-6、IL-11 和粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)等都能不同程度地诱导HSC 的增殖和分化。
目前国内外有很多科研工作者从事研究不同组合的细胞因子对人脐带血体外扩增的效果,优化筛选脐带血干细胞扩增的细胞因子。但到目前为止,细胞因子最佳组合及浓度都尚未有定论。许多研究仅证实了,不同的细胞因子在 HSC 扩增过程中具有协同作用[11]。脐带血经过细胞因子的扩增,虽然有核细胞及祖细胞的数量有所增加,细胞表面表达的相关分子能够促进细胞的归巢作用,但细胞发生了不同程度的分化[12]。因为,HSC 在体内是依赖于局部微环境以及包括转录因子、细胞周期调控因子、生长因子和黏附分子在内的复杂的内部和外部信号的严格调控,来维持自我更新和多向分化之间的平衡[13]。因此,体外扩增很难维持 HSC 原有的干性。大部分研究实验也证实了体外扩增的脐带血 HSPC 长期植入能力较差,而短期内脐带血HSPC 比例占据植入细胞的主导地位[14-15]。
早在 2003 年,杜克大学医学中心就做过经细胞因子单独进行扩增后的脐带血植入血液恶性肿瘤患者体内的相关临床试验[16],但其结果是令人失望的。这项研究将一份脐带血分成了两份,其中一份使用Aastrom Replicell 生物反应器来监控培养条件并连续灌注含有 PIXY321、GM-CSF、IL-3、EPO 和 FLT-3 配体等细胞因子的培养液进行 12 d 的扩增,使扩增后的 TNC 总量(平均扩增 2.4 倍)与未处理部分的 TNC 总量相同。但扩增部分 CD34+细胞却比未经处理的少 50%。移植后的中性粒细胞回升所需的中位时间为 22 d,血小板达到 50 × 109/L 所需的中位时间为94 d,此结果与未经处理的脐血移植相似。所以现在很多研究人员都将细胞因子作为辅助因子进行脐带血的扩增培养,在谋求 TNC 数量增加的同时减少对细胞干性的损伤。
2 利用特异性小分子扩增脐带血
从目前的研究来看,用细胞因子扩增脐带血,虽然 TNC 的总量有明显的增加,但因扩增的同时诱导了早期祖细胞分化成归巢能力较弱的细胞群,而使 UCBT 的成功率没有得到提高[17-20]。所以科学家们利用一些特异性小分子来阻止脐带血体外扩增时早期祖细胞的分化,使扩增的细胞减少分化,能够拥有更好的骨髓归巢能力。例如铜离子螯合剂 Copper Chelation(TEPA,StemEx)、Notch Ligand、烟酰胺(Nicotinamide)、Aryl Hydrocarbon Antagonist(StemRegenin 1,SR1)等。很多小分子扩增 HSPC 的试验都正在进行多中心的临床试验,其中 StemEx 已完成 III 期试验(表 1)。
2.1 Copper Chelator (StemEx)
四乙基五胺(TEPA)是一种铜离子螯合剂,铜离子作为多种细胞酶的辅助因子,在细胞增殖和分化过程中发挥重要作用。它不仅可以调控原始造血细胞的分化和增殖,同时能够阻断细胞因子诱导的早期祖细胞的分化[19-20]。最新研究也表明了,通过高亲和力铜离子螯合剂 TEPA 调节铜离子浓度可延迟 HSC 分化,提高增殖活性[21]。使用含有 TEPA 和 FLT3 配体、IL-6、TPO 和 SCF 的培养基对脐带血中纯化的 CD133+细胞进行为期 3 周的扩增培养,得到的 CD34+细胞的数量能够增加约 89 倍;同时集落形成单位数也能增加 172 倍。这说明 TEPA 对脐带血的体外扩增具有很好的效果。Peled 等[19]为了验证扩增培养的脐带血的可行性和安全性,首先对清髓后的小鼠进行了移植,结果表明:扩增的细胞不仅能够提高移植的可能性还能够维持分化成各种造血细胞的潜能。
基于这些鼓舞人心的结果,后续在 10 个高危性恶性血液病患者体内完成了 I/II 期的临床试验。将每份脐带血分成两份,一份用于扩增,一份不作处理,先输入未经处理的脐带血,24 h 后再输注扩增后的脐带血。结果显示:9 位有效植入者中性粒细胞和血小板的中位植入时间分别为 30 和 48 d。因为这个结果与未经处理的单份脐带血移植的结果没有显著差异,所以又进行了一次大规模多中心的试验。试验组为 101 位患者,对其进行单份脐带血移植;对照组为 295 位患者,对其进行了双份脐带血移植。单份脐带血经过扩增后(一部分扩增,一部分不做处理),给患者灌输的 TNC 和 CD34+细胞的中位浓度分别为 2.2 × 107和9.7 × 105/kg,中性粒细胞和血小板的中位植入时间分别为21 和 54 d(对照组为:28 和 105 d),100 d 的存活率为 84.2%(对照组为 74.6%),表明用 TEPA 联合细胞因子进行扩增的脐带血移植效果优于对照组[22]。
2.2 Notch Ligand
Notch 信号通路是人体内重要的转导通路之一,它能影响细胞正常形态发生的多个过程,包括多能祖细胞的分化、细胞凋亡、细胞增殖及细胞边界的形成;且在造血功能激活过程中也发挥重要作用,可通过与 HSPC 表面的受体 Notch1-4 结合调节其生存和增殖过程[23]。其中 CD34+细胞主要是通过 Notch 受体 Deltal1 的刺激来提高 HSPC 的扩增效率[24]。而且,在细胞因子 SCF、IL-6、IL-11 和FLT-3 配体的共同作用下细胞能够连续扩增 8 个月而维持不分化状态。而在 GM-CSF 和另一些细胞因子刺激下又能恢复其分化能力[25]。
因此,利用重组的 Notch 配体转导入纯化的CD34+细胞,后与细胞因子联合培养 16 d,CD34+细胞平均扩增倍数可达 222 倍[26]。这无疑对脐血移植是非常有益的。Delaney 等[26]进行了首次临床试验,对 10 位患者进行了双份脐带血移植,未经处理的脐血(TNC 和 CD34+的中位浓度分别为:3.3 × 107/kg 和 2.4 × 105/kg)移植 4 h 后植入扩增的 CD34+细胞(TNC 和 CD34+的中位浓度分别为:4.6 × 107/kg 和 60.3 × 105/kg),结果显示:患者的中性粒细胞和血小板的中位植入时间分别为 16 和 26 d,但在 3 个月后外周血嵌合度分析结果表明:维持造血作用的细胞大多来源于未经处理的脐带血,扩增的脐带血仅在移植早期起作用。
总体来说基于 Notch 信号通道扩增的脐带血的移植相对于传统脐带血移植是有优势的。且一项多中心、计划纳入 160 例患者的随机临床试验正在进行,以确定 Notch 信号通路扩增脐带血进行 UCBT 的疗效(clinicaltrials.gov,临床试验备案代码 NCT01175785)。
2.3 烟酰胺
烟酰胺是维他命 B3 的衍生物,烟酰胺腺嘌呤二核苷酸(NAD)的前体和 NAD 分解酶的有效抑制剂。在细胞培养液中加入烟酰胺能够通过调节去乙酰化酶 Sirtuin(SIRT)作用于脐带血 HSPC 中 CD34+细胞,使其分化延迟,并促进其归巢、植入[27]。且能保持这些细胞在体外培养时不会丢失原来的生理功能,使它们在植入患者体内后更好地发挥作用。至目前为止,采用烟酰胺扩增出来的产品Nicord 已成功完成了 I/II 期临床试验,于 2016 年夏天开始进行 III 期临床,现患者招募已经完成,计划于 2018 年 7 月完成试验。
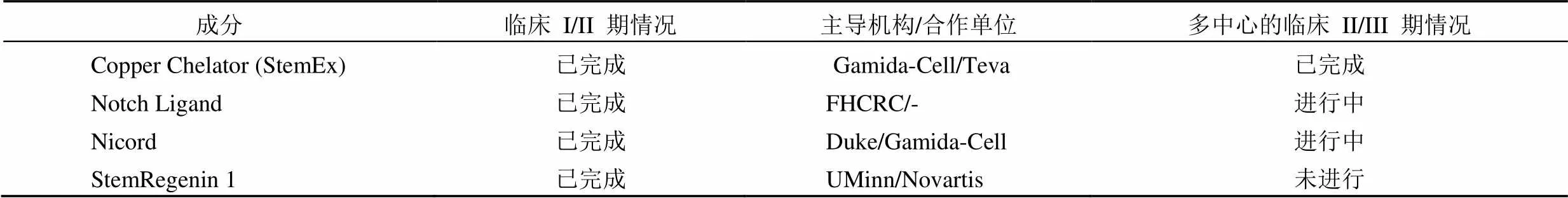
表 1 脐带血体外扩增的临床进展
Nicord 来源于单份脐带血,包括扩增的 CD133+细胞和未经处理的 CD133–细胞。首先将单份脐带血分成两部分:CD133–细胞和 CD133+细胞,CD133–细胞则继续深低温冷冻保存;CD133+细胞则与含有 NAM 和 TPO、IL-6、FLT-3 ligand、SCF 的培养基共同扩增培养 21 d,得到 CD34+细胞大约扩增 72 倍,TNC 扩增约 486 倍。预试验在扩增培养结束后,将 Nicord 和另一份未经处理的脐带血一起植入预先进行清髓处理的 11 位患者体内,其中性粒细胞和血小板的中位植入时间分别为 11 和 31 d,3 年存活率为 67%,且在这 8 位患者体内 Nicord 相比于另一份未经处理的脐带血占明显优势[28]。
于是,在 2014 年 GamidaCell 公司进行了 Nicord 的 I/II 期的临床试验,与预试验不同的是,植入患者体内的仅为 Nicord 单份脐带血,最终植入浓度为:TNC:3.1 × 107/kg;CD34+细胞:35.0 × 105/kg。其中性粒细胞和血小板的中位植入时间分别为 11 和 33 d,一年的完全存活率为 56%,长期植入比例为 60% ~ 80%。试验结果表明,Nicord 与普通脐带血移植相比在很多临床指标上有显著改善。例如植入成功率更高,植入的细胞可以更快生成中性粒细胞和血小板,植入细胞的有效期更长,患者因为移植手术而被感染的机会降低等[28]。
2.4 StemRegenin 1
StemRegenin 1(SR1)是一种嘧啶类衍生物,通过拮抗 AHR 信号通路调控造血干细胞的自我更新和扩增。2010 年,明尼达州的一个科研小组报道,低浓度的 SR1 可使 CD34+细胞扩增 50 多倍,具有移植能力的 HSC 扩增17 倍,极大的维持了造血干细胞的自我更新能力。且联合 SCF、FLT-3L、TPO 及 IL-6等细胞因子一起培养扩增 CD34+细胞,能使其维持未分化状态[29]。
随后多项研究也验证了 SR1 在 HSPC 扩增中的确切作用,CD34+细胞扩增效率约为 328 倍[29-30]。且利用 SR1 进行脐带血扩增的相关临床试验也已经展开,两份脐带血同时进行移植。将一份细胞数较少的脐带血中 CD34+细胞纯化出来,用 SR1 联合细胞因子扩增培养 15 d。CD34–细胞则继续低温保存,直到扩增结束后,先将未经处理的细胞量较多的脐带血植入患者,再将扩增的细胞和 CD34–细胞一起植入患者体内,移植后 17 位患者的中位粒细胞植入时间为 15 d,血小板植入时间为 49 d,长期植入比例约为 65%。移植的效果明显优于单独移植未经处理的脐带血[31]。综合考虑,利用 SR1 扩增的脐带血能够有效地促进患者造血功能的恢复。因此,Wagner 等正在计划进行单独移植扩增后的脐带血的相关临床试验。
2.5 前列腺素E2
前列腺素 E2(PGE2)是一种体内含量十分丰富的类花生酸,具有多种生理活性,对造血系统有着重要的调节作用。它能提高 HSC 在移植过程中的归巢、存活和增殖能力,以及 HSC 的长期再植能力[32-34]。此外,PGE2 还可以增强辐射损伤后 HSC 造血系统的重建能力,维持造血系统的稳定性。由于 PGE2 的半衰期非常短(1 ~ 2 min),在体外和临床研究中常使用 PGE2 的稳定修饰物 16,16-二甲基前列腺素 E2(dmPGE2)。
Goessling 等[35]采用斑马鱼体内实验证明了 PGE2 和 Wnt 信号通路通过调节 β-actin 的稳定性来维持HSC 的稳态,调节胚胎发育期的细胞凋亡和生长。灵长类动物移植实验证明,在骨髓受到损伤后,PGE2 可促进 HSC 的重建,加速造血系统的恢复。PGE2 预处理后的 HSC 移植已经在灵长类动物中证明是安全的。Cutler 等[36]在 I 期临床试验中的结果也证实了,用 dmPGE2 对脐血 CD34+细胞进行预处理再移植,其安全性是可以保障的,并且能够加快中性粒细胞的植入时间。
2.6 UM171
Fares 等[37]在对 5000 多种化合物进行筛选后,发现了一族小分子,可用于脐带血干细胞的体外增殖。UM171 是一个合成的 UM729 的类似物。UM729 能够增加人的 CD34+CD45RA–外周血细胞,但UM171 的扩增能力是 UM729 的 10 ~ 20 倍。
据报道:UM171 是一类标准的 AHR 的抑制剂,与 SR1 具有协同作用,可以增加短期造血祖细胞的扩增,而 UM171 自身也可以选择性地提高长期造血干细胞的再生能力。试验显示:将 UM171 或 DMSO 处理的 CD34+CB 细胞注射到 NSG 小鼠中,在约 300 只小鼠中评估人细胞的植入水平,并以热图的形式表示。数据分析表明:UM171 在淋巴缺陷分化中起重要作用。且 UM171 对长期造血干细胞的影响在移植后 30 周仍然存在,在高细胞剂量时其多向贡献明显。UM171 不仅对体外扩增脐带血细胞数量有明显作用,还能大大减少与干细胞相关的并发症[37]。所以,UM171 会是 HSPC 移植治疗中的有利候补物质。
3 与间充质干细胞共培养扩增脐带血
干细胞微环境是干细胞生长的微环境,其在维持 HSC 自我更新及多向分化中发挥重要作用[38]。而通过模拟造血微环境促进 HSC 的体外扩增技术也日益成熟。MSC 对 HSC 就拥有重要的造血支持作用[39],主要因为:MSC 能够提供多种体外扩增的信号通路,这些信号通路在基于单独利用细胞因子来进行 HPC 悬浮培养中是没有的。MSC 可通过直接接触或分泌内源性细胞因子等方式调控 HSC。而且,利用 MSC滋养层培养扩增 HSPC 可避免 CD34 及 CD133 分选造成的细胞数的减少。
3.1 骨髓间充质干细胞
利用骨髓间充质干细胞(BM-MSC)作为饲养层扩增脐带血已经完成了 I/II 期的临床试验[40],该试验将脐带血与贴壁的BM-MSC、造血相关细胞因子共培养 7 d,然后单独使用细胞因子再扩增培养 7 d。最终实现脐带血 HSPC中CD34+细胞数目中位值增长为原有细胞中位数目的30 倍。该体外扩增培养所得的脐带血应用于双份 UCBT,未经操作的脐血复苏清洗后静脉注射,然后再注射扩增的脐血,注射后的第一天开始每天用粒细胞集落刺激因子注射至中性粒细胞恢复。
试验表明,患者中性粒细胞的植入时间为 15 d,血小板的中位植入时间为 42 d。约 50%的患者在UCBT 后3 ~ 4 周呈现混合性嵌合状态,但长期植入(> 12 个月)的脐带血 HSPC 主要来源于未扩增的那一份脐带血。可能原因是培养的过程中耗尽了细胞长期增殖的能力。与未经处理的脐带血相比,用 MSC 扩增的脐血增加了单核细胞和粒细胞的比例,但是减少了 T、B 细胞的比例。但总的来说,利用 MSC 共培养技术来扩增脐带血是可行的,能够明显缩短细胞植入时间,提高成功率。
3.2 与球状体 BM-MSC 共培养
Futrega 等[41]利用高通量聚二甲硅氧烷(polydimethylsiloxane,PDMS)微孔适当地改善了体外 HSPC 的扩增。PDMS 微孔的作用是使 MSC 成球形,提供一个三维的培养体系。接种前先在微孔表面预涂 5% 的普朗尼克(pluronic F127)以防止 MSC 贴壁,接种后离心使细胞聚合,在微孔中形成球形,再接入 CD34+细胞进行共培养。这种球状三维的共培养体系扩增出的 CD34+细胞的数量与二维单层细胞共培养并无明显区别,但 CD34+CD38–的细胞数量却远超二维培养体系。甚至他们发现在没有 MSC 的情况下,仅使用 PDMS 微孔进行培养时 CD34+CD38–的细胞数量也会增加。但是这些三维体系扩增的细胞在动物实验上并没有增加其移植成功率,仅与利用单层 MSC 作为饲养层来扩增的脐带血的移植率相似。总的来说,虽然球形 MSC 共培养并没有解决 CD34+细胞扩增培养过程中长期植入能力的消耗问题,但却发现了 PDMS 微孔对 CD34+细胞扩增具有一定作用。
3.3 脐带华通氏胶间充质干细胞
新加坡的一个项目研究组针对采用脐带华通氏胶培养出来的 MSC 单层细胞作为饲养层进行扩增脐带血的效果做了大量研究[42]。研究表明,脐带华通氏胶间充质干细胞(UCWJ-MSC)与成人的 BM-MSC 相比具有直接可用、供者痛苦少、病毒感染率低等优点,且具有更好的扩增能力,耗时也会较短。表达的与脐血扩增相关的标志物和分子也比 BM-MSC 多,这些分子都在脐血扩增中起重要作用。不仅是 WJ-MSC 能够起到扩增培养脐带血的作用,单独使用其培养液也能对脐带血扩增起到一定作用[43]。但目前这项研究还没有正式进入临床试验。
Fong 等[44]做了相关的临床预试验,结果表明同时灌注 UCWJ-MSC 和 UCB-HS/PC 能够提高造血细胞移植成功率。UCWJ-MSC 和没有经过处理的 UCB 一起灌注,比单独灌注没有处理过的 UCB,粒细胞和血小板的回升天数要短。
4 与成骨细胞共培养扩增脐带血
近年来相关研究证实:成骨细胞是构建造血生态位区至关重要的支撑部分,并对其中的 HSPC 发育、增殖和分化及成熟等生理活动发挥着关键的调控作用[45-46]。有研究认为成骨细胞与 HSPC 直接接触对于CD34+细胞有数量上的维持;成骨细胞也可以通过分泌各种细胞因子来刺激造血细胞扩增和干细胞特性的维持[47]。
最新研究发现,成骨细胞分泌的胞外囊泡中含有许多的生物活性物质,可以调节造血干细胞的生长。特别是胞外囊泡中存在的 miRNA,如:miR-21-5p、miR-100-5p 和 let-3 家族。其中 miRNA-29a 对于HSPC 的增殖、凋亡、细胞周期和细胞外基质黏附都有影响。Morhayim 等[48]将成骨细胞胞外囊泡、脐带血CD34+细胞与细胞因子一起培养扩增 10 d 后,TNC 总量和 CD34+细胞总量都有明显增加,集落形成单位 CFU 数量相较于对照组也增加了 10% ~ 45%。将数量相等的扩增后的细胞和未经处理的细胞分别植入 NSC 小鼠体内,分别在 19 周和 21 周后对其外周血和骨髓中的细胞做了流式分析,结果表明,经过成骨细胞胞外囊泡共同培养的 CD34+细胞能够成功进行移植和重建小鼠的造血功能,其效果和对照组无明显差别。
5 与内皮祖细胞共培养扩增脐带血
在主动脉性腺中肾区,HSPC 与内皮细胞位置相近,且在胚胎发育过程中,造血细胞和内皮细胞是来源于同一前体细胞的[49],这就说明了内皮祖细胞和 HSPC 也有着紧密的联系。在 BM 微环境中,两者的相互作用有助于 HSPC 的自我更新和分化[50-51]。Qu 等[52]将脐带血中的内皮祖细胞分离培养后,作为滋养层细胞体外扩增 HSPC。实验表明:EPCs 通过产生多种生长因子和通路分子来为 HSPC 的体外扩增提供合适的微环境。例如:EPCs 能够高表达造血相关因子 IL-6 和 ANGPT1,且在 EPCs与 HSPC 共培养时 WNT5A 基因会出现高水平的转录,能够激活 wnt 信号通路。
EPCs 作为滋养层与 HSPC 直接接触共培养 7 d,CD34+细胞扩增约为 5.38 倍,CD34+CD38–细胞则扩增了约 156.17 倍。而单独用细胞因子培养的对照组,CD34+细胞扩增了(3.25 ± 0.59)倍,而 CD34+CD38–细胞仅扩增了约 79 倍。将扩增后的 HSPC 和未经处理的 HSPC 以相同细胞数分别植入到免疫缺陷的非肥胖糖尿病小鼠体内,8 周后检测小鼠骨髓中人 CD45 细胞的比率,结果显示其百分比分别为:(13.3 ± 11.0)% 和(16.0 ± 14.3)%[52]。此结果可以说明 EPCs 共培养也是体外扩增 HSPC 的一种有效方法,但要运用到临床还需要做更深入的研究。
6 应激诱导的脐带血的体外扩增
6.1 p38α
p38MAPK 通路在造血细胞调节过程中占重要地位,抑制 p38MAPK 通路可一定程度缓解造血干细胞功能下降[53]。来自日本的科学家们发现在骨髓移植等应激情况下,造血干细胞和祖细胞内的p38MAPK 能够激活嘌呤代谢推动细胞进入细胞周期促进细胞增殖,从而对应激产生应答反应[54]。
报告称,p38MAPK 家族中的一个成员 p38α 在小鼠应激造血过程中启动造血干细胞和祖细胞(HSPC)的增殖方面发挥重要作用。在受到应激后,HSPC 中的 p38MAPK 会立即被磷酸化,促进 HSPC 进入细胞周期。p38α 信号途径能够增加 HSPC 中一种叫做肌苷-5'-单磷酸脱氢酶 2(IMPDH2)的分子的表达,导致氨基酸和嘌呤相关代谢物水平发生变化,同时还会在体内和体外情况下改变细胞周期进展。而条件敲除 p38α 会导致应激造血过程的损伤,造成 HSPC 增殖启动被延误[54]。这项研究解释了 p38α 介导的信号途径改变 HSPC 代谢从而产生应激应答促进细胞周期恢复的机制,这对于应用造血干细胞进行血液疾病治疗,或者可以通过这种机制进行造血干细胞扩增有重要意义。
6.2 低氧应激
造血干细胞在体内所处的位置都属于低氧环境。然而,到目前为止,许多造血干细胞研究结果都是基于非生理条件下的氧分压,即常氧。但在常氧下培养易导致细胞的氧化损伤,低氧对维持造血干细胞干性具有重要作用。在不同氧浓度下,造血干细胞具有不同的增殖潜能、周期分布和存活能力。
目前,就低氧环境对造血干细胞扩增的研究主要集中于影响其扩增的机制,主要是通过 HIF 信号通路和活性氧刺激来进行。低氧能阻止已经在 G0 期的细胞退出周期,还能使处在周期中的细胞进入静息,这两种途径会增加 G0 期的细胞数[55-56],从而维持细胞的干性。最新研究成果也发现,在低氧环境(3% O2)或添加环孢霉素 A 可作用于线粒体通透性转换孔,增加 HSPC 的收集量[57-58]。
但是什么样的低氧浓度和低氧作用时间对于脐带血的扩增和细胞周期的静止最有利还没有定论,且其相关的机制还需进一步的研究,但低氧对细胞扩增的优势是毋庸置疑的。
7 利用基因修饰技术扩增脐带血
随着对细胞信号转导途径及其机制的认识,研究者们可以利用基因修饰技术,控制细胞增殖分化以获得我们所需要的细胞类型。
HoxB4 为同源盒基因家族的一个成员,在早期造血细胞中高表达,随着 HSC 的分化,其表达逐渐下降直至消失。研究者尝试用转导 HoxB4 基因的 MSC 联合细胞因子来体外扩增脐血 CD34+细胞[59-60]。结果可以更加有效地体外扩增脐血 CD34+细胞,这也可能与 HoxB4 对维持 HSC 自我更新等干细胞特性的功能有关。此外,Amsellem 等[61]将 HoxB4 导入 MS-5 细胞株,用这种细胞株作为脐带血的饲养层细胞,获得的结果也是类似的。
JAK2 在造血干细胞的自我更新中起着重要作用,SCF、FLT 和 G-CSF 等大多数细胞因子是通过 JAK2 来传递信号的。通过构建一个含有 JAK2 的逆转录病毒载体将该载体转入 HSPC。通过给予小分子靶向基因合成药物 AP20187 来诱导 JAK2 二聚化[62]。JAK2 激活后能够启动细胞内信号来实现脐带血干细胞的大量扩增与调控。
miR-17 在造血系统中也起着重要的调节作用,在人造血细胞开始分化时它的表达水平会下调。Yang 等[63]通过构建载体将 miR-17 的基因片段转染至人脐带血 CD34+细胞中,使其在细胞中大量表达。这些细胞经与细胞因子共同培养后,CD34+细胞有明显增加,相反若 miR-17 表达受限的话 CD34+细胞则会减少。实验表明:虽然扩增后的 CD34+细胞在体内的造血重建能力降低,但它能够分泌黏附因子,使 CD34+细胞黏附到其生态位区。因此,可以说 miR-17 在造血系统发育中起着关键的调节作用。这对今后研究细胞信号转导及开展干细胞和基因治疗都有潜在应用价值。
8 总结
近年来,大量的脐带血体外扩增体系已经建立起来,多个独立的相关临床试验均取得了较好的结果。在现行的体外扩增技术中,细胞因子仍是重要工具,上述方法中无论哪种都会运用到细胞因子的几种组合来进行辅助性的扩增培养。但由于多因素的影响以及体内造血微环境的复杂性之间的相互作用,扩增效果与体外扩增的条件之间没有明确的定量关系,也没有一个标准化的方案来实现最佳扩增。但是随着技术的迅速进步,相信未来的 HSPC 的体外扩增技术在解决脐带血的数量问题上将有重大的发展前景。而一旦脐带血扩增问题得到解决,脐带血在医疗中的应用价值将会更加巨大。
[1] Gluckman E, Broxmeyer HA, Auerbach AD, et al. Hematopoietic reconstitution in a patient with Fanconi's anemia by means of umbilical-cord blood from an HLA-identical sibling. N Engl J Med, 1989, 321(17):1174-1178.
[2] Barker JN, Krepski TP, DeFor TE, et al. Searching for unrelated donor hematopoietic stem cells: availability and speed of umbilical cord blood versus bone marrow. Biol Blood Marrow Transplant, 2002, 5(8):257-260.
[3] Brunstein CG, Gutman JA, Weisdorf DJ, et al. Allogeneic hematopoietic cell transplantation for hematologic malignancy: relative risks and benefits of double umbilical cord blood. Blood, 2010, 116(22):4693-4699.
[4] Majhail NS, Brunstein CG, Tomblyn M, et al. Reduced-intensity allogeneic transplant in patients older than 55 years: unrelated umbilical cord blood is safe and effective for patients without a matched related donor. Biol Blood Marrow Transplant, 2008, 14(3):282-289.
[5] Stanevsky A, Shimoni A, Yerushalmi R, et al. Cord blood stem cells for hematopoietic transplantation. Stem Cell Rev, 2011, 7(2):425-433.
[6] Gluckman E, Rocha V, Boyer-Chammard A, et al. Outcome of cord-blood transplantation from related and unrelated donors. Eurocord Transplant Group and the European Blood and Marrow Transplantation Group. N Engl J Med, 1997, 337(6):373-381.
[7] Ren HY. Clinical evaluation and main problems of umbilical cord blood transplantation. Chin J Hematol, 2006, 27(11):791-792. (in Chinese)
任汉云. 脐血移植临床评价和主要问题探讨. 中华血液学杂志, 2006, 27(11):791-792.
[8] Oran B, Shpall E. Umbilical cord blood transplantation: a maturing technology. Hematology Am Soc Hematol Educ Program, 2012, 2012:215-222.
[9] Wagner JE Jr, Eapen M, Carter S, et al. One-unit versus two-unit cord-blood transplantation for hematologic cancers. N Engl J Med, 2014, 371(18):1685-1694.
[10] Li M, Sheng HX, Zhang B, et al. Study progress of ex vivo expansion of human cord blood hematopoietic stem cell. Chin J Cell Stem Cell (Electronic Ed), 2016, 6(2):127-133. (in Chinese)
李猛, 盛宏霞, 张斌, 等. 脐血来源造血干细胞体外培养扩增技术研究进展. 中华细胞与干细胞杂志(电子版), 2016, 6(2):127-133.
[11] Guo R, Du X, Chen BB, et al. In vitro expansion of CD34+ cell from cord blood in the presence of several cytokines. J Huazhong Univ Sci Technol (Health Sci), 2003, 32(6):607-609. (in Chinese)
郭荣, 杜欣, 陈波斌, 等. 多种细胞因子组合对脐血CD34+细胞的体外扩增. 华中科技大学学报(医学版), 2003, 32(6):607-609.
[12] Wang DD, He XP, Wu WJ, et al. Isolation and in vitro expansion of CD34+ hematopoietic stem cells from human umbilical cord blood. Harbin Med J, 2013, 33(1):26. (in Chinese)
王丹丹, 贺雪萍, 武文杰, 等. 人脐血CD34+造血干细胞的分离和体外扩增培养问题. 哈尔滨医药, 2013, 33(1):26.
[13] Wang J, Sun ZM, Li Q, et al. Study on influence of the homing related molecules on umbilical cord blood CD34+ cells after amplified with cytokines in vitro. J Clin Transfus Lab Med, 2013, 15(3):219-224. (in Chinese)
汪健, 孙自敏, 李庆, 等. 体外扩增对脐带血 CD34+细胞归巢相关分子影响的研究. 临床输血与检验, 2013, 15(3):219-224.
[14] Zandstra PW, Conneally E, Petzer AL, et a1. Cytokine manipulation of primitive human hematopoietic cell self-renewal. Proc Natl Acad Sci U S A, 1997, 94(9):4698-4703.
[15] Notta F, Doulatov S, Laurenti E, et a1. Isolation of single human hematopoietic stem cells capable of long-term multilineage engraftment. Science, 2011, 333(6039):218-221.
[16] Jaroscak J, Goltry K, Smith A, et al. Augmentation of umbilical cord blood (UCB) transplantation with ex vivo-expanded UCB cells: results of a phase 1 trial using the AastromReplicell System. Blood, 2003, 101(12):5061-5067.
[17] Williams DA. Ex vivo expansion of hematopoietic stem and progenitor cells--robbing Peter to pay Paul? Blood, 1993, 81(12): 3169-3172.
[18] McNiece I, Kubegov D, Kerzic P, et al. Increased expansion and differentiation of cord blood products using a two-step expansion culture. Exp Hematol, 2000, 28(10):1181-1186.
[19] Peled T, Mandel J, Goudsmid RN, et al. Pre-clinical development of cord blood-derived progenitor cell graft expanded ex vivo with cytokines and the polyamine copper chelator tetraethylenepentamine. Cytotherapy, 2004, 6(4):344-355.
[20] Peled T, Landau E, Prus E, et al. Cellular copper content modulates differentiation and self-renewal in cultures of cord blood-derived CD34+ cells. Br J Haematol, 2002, 116(3):655-661.
[21] Huang X, Pierce LJ, Cobine PA, et al. Copper modulates the differentiation of mouse hematopoietic progenitor cells in culture. Cell Transplant, 2009, 18(8):887-897.
[22] Montesinos P, Peled T, Landau E, et al. StemEx® (copper chelation based) ex vivo expanded umbilical cord blood stem cell transplantation
(UCBT) accelerates engraftment and improves 100 day survival in myeloablated patients compared to a registry cohort undergoing double unit UCBT: results of a multicenter study of 101 patients with hematologic malignancies. Blood, 2013, 122(21):295.
[23] Mliner LA, Bigas A. Notch as a mediator of cell fate determination in hematopoiesis: evidence and speculation. Blood, 1999, 93(8):2431- 2448.
[24] Mayani H. Notch signaling: from stem cell expansion to improving cord blood transplantation. Expert Rev Hematol, 2010, 3(4):401-404.
[25] Varnum-Finney B, Xu L, Brashem-Stein C, et al. Pluripotent, cytokine-dependent, hematopoietic stem cells are immortalized by constitutive Notch1 signaling. Nat Med, 2000, 6(11):1278-1281.
[26] Delaney C, Heimfeld S, Brashem-Stein C, et al. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nat Med, 2010, 16(2):232-236.
[27] Bordone L, Guarente L. Calorie restriction, SIRT1 and metabolism: understanding longevity. Nat Rev Mol Cell Biol, 2005, 6(4):298-305.
[28] Horwitz ME, Chao NJ, Rizzieri DA, et al. Umbilical cord blood expansion with nicotinamide provides long-term multilineage engraftment. J Clin Invest, 2014, 124(7):3121-3128.
[29] Wagner JE, Brunstein CG, Mckenna D, et al. Safety and exploratory efficacy of ex vivo expanded umbilical cord blood (UCB) hematopoietic stem and progenitor cells (HSPC) using cytokines and stem-regenin 1 (SR1): interim results of a phase 1/2 dose escalation clinical study. Blood, 2013, 122(21):698.
[30] Wagner JE, Brunstein C, McKenna D, et al. StemRegenin-1 (SR1) expansion culture abrogates the engraftment barrier associated with umbilical cord blood transplantation (UCBT). Blood, 2014, 124(21):728.
[31] Wagner JE Jr, Brunstein CG, Boitano AE, et al. Phase I/II trial of stemregenin-1 expanded umbilical cord blood hematopoietic stem cells supscports testing as a stand-alone graft. Cell Stem Cell, 2016, 18(1):144-155.
[32] Pelus LM, Hoggayy J, Singh P, et al. Pulse exposure of haematopoietic grafts to prostaglandin E2 in vitro facilitates engraftment and recovery. Cell Prolif, 2011, 44 Suppl 1:22-29.
[33] Pelus LM, Hoggatt J. Pleiotropic effects of prostaglandin E2 in hematopoiesis; prostaglandin E2 and other eicosanoids regulate hematopoietic stem and progenitor cell function. Prostaglandins Other Lipid Mediat, 2011, 96(1-4):3-9.
[34] Hoggatt J, Singh P, Sampath J, et al. Prostaglandin E2 enhances hematopoietic stem cell homing, survival, and proliferation. Blood, 2009, 113(22):5444-5455.
[35] Goessling W, Allen RS, Guan X, et al. Peostaglandin E2 enhances human cord blood stem cell xenotransplants and shows long-term safety in preclinical nonhuman primate transplant models. Cell Stem Cell, 2011, 8(4):445-458.
[36] Cutler C, Multani P, Robbins D, et al. Prostaglandin-modulated umbilical cord blood hematopoietic stem cell transplantation. Blood, 2013, 122(17):3074-3081.
[37] Fares I, Chagraoui J, Gareau Y, et al. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science, 2014, 345(6203):1509-1512.
[38] Sugimura R. Bioengineering hematopoietic stem cell niche toward regenerative medicine. Adv Drug Deliv Rev, 2016, 99(Pt B):212-220.
[39] Chu PP, Bari S, Fan X, et al. Intercellular cytosolic transfer correlates with mesenchymal stromal cell rescue of umbilical cord blood cell viability during ex vivo expansion. Cytotherapy, 2012, 14(9):1064- 1079.
[40] de Lima M, McNiece I, Robinson SN, et al. Cord-blood engraftment with ex vivo mesenchymal-cell coculture. N Engl J Med, 2012, 367(24):2305-2315.
[41] Futrega K, Atkinson K, Lott WB, et al. Spheroid coculture of hematopoietic stem/progenitor cells and monolayer expanded mesenchymal stem/stromal cells in polydimethylsiloxane microwells modestly improves in vitro hematopoietic stem/progenitor cell expansion. Tissue Eng Part C Methods, 2017, 23(4):200-218.
[42] Bakhshi T, Zabriskie RC, Bodie S, et al. Mesenchymal stem cells from the Wharton’s jelly of umbilical cord segments provide stromal support for the maintenance of cord blood hematopoietic stem cells during long-term ex vivo culture. Transfusion, 2008, 48(12):2638- 2644.
[43] Lo Iacono M, Anzalone R, La Rocca G, et al. Wharton’s Jelly mesenchymal stromal cells as a feeder layer for the ex vivo expansion of hematopoietic stem and progenitor cells: a review. Stem Cell Rev, 2017, 12(1):35-49.
[44] Fong CY, Gauthaman K, Cheyyatraivendran S, et al. Human umbilical cord Wharton's jelly stem cells and its conditioned medium support hematopoietic stem cell expansion ex vivo. J Cell Biochem, 2012, 113(2):658-668.
[45] Lemischka IR, Moore KA. Stem cells: Interactive niches. Nature, 2003, 425(6960):778-779.
[46] Engin F, Lee B. NOTCHing the bone: insights into multi-functionality. Bone, 2010, 46(2):274-280.
[47] Suda T, Arai F, Hirao A. Hematopoietic stem cells and their niche. Trends Immumal, 2005, 26(8):426-433.
[48] Morhayim J, van de Peppel J, Braakman E, et al. Osteoblasts secrete miRNA-containing extracellular vesicles that enhance expansion of human umbilical cord blood cells. Sci Rep, 2016, 6:32034.
[49] Choi K, Kennedy M, Kazarov A, et al. A common precursor for hematopoietic and endothelial cells. Development, 1998, 125(4):725- 732.
[50] Li B, Bailey AS, Jiang S, et al. Endothelial cells mediate the regeneration of hematopoietic stem cells. Stem Cell Res, 2010, 4(1): 17-24.
[51] Ding L, Saunders TL, Enikolopov G, et al. Endothelial and perivascular cells maintain haematopoietic stem cells. Nature, 2012, 481(7382):457-462.
[52] Qu Q, Liu L, Chen G, et al. Endothelial progenitor cells promote efficient ex vivo expansion of cord blood-derived hematopoietic stem/progenitor cells. Cytotherapy, 2016, 18(3):452-464.
[53] Zou J. Maintain the character of umbilical cord blood stem cell: downregulation of abnormal raised ROS and p38MAPKα signal pathway. Wuhan: Huazhong University of Science and Technology, 2011. (in Chinese)
邹菁. 维持体外扩增脐带血干细胞干性: 下调异常升高的ROS和p38MAPKα信号. 武汉: 华中科技大学, 2011.
[54] Karigane D, Kobayashi H, Morikawa T, et al. p38α activates purine metabolism to initiate hematopoietic stem/progenitor cell cycling in response to stress. Cell Stem Cell, 2016, 19(2):192-204.
[55] Shima H, Takubo K, Tago N, et al. Acquisition of G0 state by CD34-positive cord blood cells after bone marrow transplantation. Exp Hematol, 2010, 38(12):1231-1240.
[56] Guitart AV, Hammoud M, Dello Sbarba P, et al. Slow-cycling/quiescence balance of hematopoietic stem cells is related tophysiological gradient of oxygen. Exp Hematol, 2010, 38(10):847-851.
[57] Broxmeyer HE, O'Leary HA, Huang X, et al. The importance of hypoxia and extra physiologic oxygen shock/stress for collection and processing of stem and progenitor cells to understand true physiology/pathology of these cells ex vivo. Curr Opin Hematol, 2015, 22(4):273-278.
[58] Mantel CR, O'Leary HA, Chitteti BR, et al. Enhancing hematopoietic stem cell transplantation efficacy by mitigating oxygen shock. Cell, 2015, 161(7):1553-1565.
[59] Fei XM, Zhou XY, Wang LX, et al. Human bone marrow mesenchymal stem cells transferred HOXB4 support in vitro amplification of cord blood CD34+ cells. Jiangsu Med J, 2010, 36(4): 428-432. (in Chinese)
费小明, 周小玉, 王丽霞, 等. 转HOXB4基因人骨髓MSC促进脐血CD34+细胞体外扩增. 江苏医药, 2010, 36(4):428-432.
[60] Chen T, Zhang P, Fan W, et al. Co-transplantation with mesenchymal stem cells expressing a SDF/HOXB4 fusion protein markedly improves hematopoietic stem cell engraftment and hematogenesis in irradiated mice. Am J Transl Res, 2014, 6(6):691-702.
[61] Amsellem S, Pflumio F, Bardinet D, et al. Ex vivo expansion of human hematopoietic stem cells by direct delivery of the HOXB4 homeoprotein. Nat Med, 2003, 9(11):1423-1427.
[62] Zhao S, Weinreich MA, Ihara K, et al. In vivo selection of genetically modified erythroid cells using a JAK2-based cells growth switch. Mol Ther, 2004, 10(3):456-468.
[63] Yang Y, Wang S, Miao Z, et al. miR-17 promotes expansion and adhesion of human cord blood CD34(+) cells in vitro. Stem Cell Res Ther, 2015, 6:168.
10.3969/j.issn.1673-713X.2017.05.010
无锡市科技发展资金(CBE01G1603);江苏省科教强卫创新团队(CXTDB2017016);无锡市科教强卫发展学科(FZXK001);无锡市卫生局重大项目(Z201302)
王浩,Email:wanghao@cruilife.com
2017-08-04
