孤立性心房颤动患者左房应变率与房内传导时间关系的研究
2017-11-07郭春艳赵树梅李莉刘杰昕张谦沈潞华
郭春艳 赵树梅 李莉 刘杰昕 张谦 沈潞华
100050 首都医科大学附属北京友谊医院心血管中心
孤立性心房颤动(lone atrial fibrillation,LAF)是指不存在结构性心脏病或其他已知病因,年龄小于60岁患者的良性心房颤动(atrial fibrillation,AF)[1]。目前关于LAF与病理性AF是否为两种需要不同治疗对策的疾病,即LAF是否为真正“孤立性”AF仍存在争议。对左房功能进行检测和定量分析可能有助于预测和预防LAF的发生。目前关于LAF的二维斑点追踪成像(two-dimensional speckle tracking echocardiography,2D-STE)研究少有报道。
心房的电-机械重构可促使AF发生,通过组织多普勒方法测定心电图P波开始至左房收缩的时间,即总的心房传导时间(total atrial conduction time with tissue Doppler imaging,PA-TDI)可反映这种电-机械重构[2]。PA-TDI较左房内径更能够反映左房的电重构和机械重构,den Vijl等[3]的研究显示,PA-TDI预测导管射频消融后AF复发的准确性优于左房容量参数。
本研究应用超声心动图明确LAF患者左房心肌应变特点及PA-TDI改变,并探讨二者相关性。
1 对象和方法
1.1 研究对象
LAF组:入选对象为2014年1月至2015年12月在我院诊为LAF的53例患者,其中男29例,女24例,年龄35~60岁,平均(51.4±7.7)岁。纳入标准:(1)符合指南LAF诊断标准[1];(2)既往心电图或24 h动态心电图记录≥1次阵发性AF;(3)超声心动图检查时为窦性心律且检查前1个月内未服用抗心律失常药物。排除标准:(1)年龄≥60岁;(2)持续性AF;(3)瓣膜性心脏病、冠状动脉粥样硬化性心脏病、先天性心脏病、高血压、糖尿病、慢性阻塞性肺病、甲状腺疾病;(4)围术期;(5)心脏收缩功能受损[左室射血分数(left ventricular ejection fraction,LVEF)<55%];(6)肥胖、酗酒;(7)药物继发性AF;(8)曾行导管射频消融治疗。对照组:无心血管疾病的健康志愿者50名,其中男27例,女23例,年龄35~60岁,年龄(50.1±7.2)岁。
本研究经首都医科大学附属北京友谊医院伦理委员会批准,所有受试者在入选前均签署知情同意书。
1.2 研究方法
应用Vivid E9超声心动图仪,配置1.7~3.3 MHz的心脏超声探头进行检查。受检者左侧卧位,平静呼吸,根据美国超声心动图学会指南[4-5]获得标准切面测量左室舒张末内径(end-diastolic diameter,EDD)、左室收缩末内径(end-systolic diameter,ESD)。应用脉冲多普勒检测二尖瓣血流频谱,获得舒张早期峰值流速(E)、舒张晚期峰值速度(A)、E/A、左室等容舒张时间(isovolumetric relaxation time,IVRT)、E峰减速时间(deceleration time,DT)。应用Simpson法测量LVEF。根据美国超声心动图学会指南测量左房容量[4],二尖瓣开放前即刻在二维切面测量左房最大容量(maximum LA volume,LAVmax),在心房排空开始前测量左房收缩前容量(LA pre-atrial contraction volume,LAVpreA),在舒张末期测量左房最小容量(LA minimum volume, LAVmin)。左房总排空分数=(LAVmax-LAVmin)/LAVmax×100%;左房主动排空分数=(LAVpreA-LAVmin)/LAVpreA×100%;左房被动排空分数=(LAVmax-LAVpreA)/LAVmax×100%;左房容量指数(left atrial volume index,LAVI)由LAV除以体表面积获得。每项指标均为3个心动周期测量的平均值。
按照标准的TDI技术获得心肌运动速度[6]。在心尖四腔心切面将取样容积分别置于二尖瓣环与室间隔、左室侧壁交界处的心肌,在心尖两腔心切面将取样容积置于二尖瓣环与下壁、前壁交界处的心肌。分别测量收缩期的峰值速度(S′),舒张早期峰值速度(E′),舒张晚期峰值速度(A′)。最终计算四个位点的平均值,计算E/ E′和E′/A′。
应用超声心动图组织多普勒方法测定PA-TDI间期[3]。在窦性心律下,取心尖四腔心切面,脉冲多普勒采样容积放在二尖瓣环上的左房侧壁,从体表心电图Ⅱ导联P波的起始时间至组织多普勒追踪A′波波峰的时间间期,即为PA-TDI间期。测定3个心动周期,取其平均值(图1)。
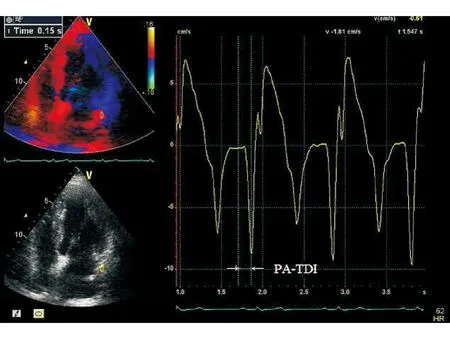
图1 应用超声心动图组织多普勒方法测定PA-TDI间期(箭头所示)
应用2D-STE技术和EchoPAC(113版本)对左房心房肌的应变率进行分析。在定量组织速度图(tissue Doppler velocity,TVI)条件下,经心尖四腔心切面和心尖二腔心切面,储存3个新的周期的动态超声心动图图像以备脱机分析。选择心尖四腔心切面观察左房的房间隔和侧壁,选择心尖二腔心切面观察左房的前壁和下壁,每个房壁分为基底段、中段和上段。应用EchoPAC软件系统,手动描记心房内壁,系统自动勾画出所有分析的感兴趣区(ROI),如果追踪不满意,可以进行手工调整,直至各个节段追踪成功。最终系统自动给出时间-应变率曲线。将心电图R波作为参考点,在左房时间-应变率曲线上测量收缩期应变率(strain rate during LV systole,SRs),舒张早期应变率(strain rate during early diastole,SRe)和左房收缩期应变率(strain rate during atrial contraction,SRa)[7]。每个参数取3个心动周期的平均值,分别计算12个节段心房壁SRs、SRe和SRa平均值。
1.3 统计学方法
相关分析评价左房应变率参数与PA-TDI之间的关系。应用Logistic多元回归分析评价左房应变率参数、PA-TDI和容量参数对AF的预测意义。应用受试者工作特征曲线(receiver operating characteristic,ROC)评价预测AF指标的诊断准确性。P<0.05为差异有统计学意义。
2 结果
2.1 一般临床资料
LAF 组与对照组的临床资料特点见表1。两组间年龄、性别、体质指数、血压和糖化血红蛋白比较差异均无统计学意义(均为P>0.05)。
2.2 两组间常规超声心动图参数比较
LAF组的左房VImax大于对照组,DT较对照组延长(均为P<0.05)。两组间EDD、LVEF、E、A、E/A比值、IVRT、LAVIpreA、LAVImin和LAEF比较差异均无统计学意义(均为P>0.05),见表2。
2.3 两组间组织多普勒及LA应变率参数比较
与对照组比较,LAF组左房心肌的SRs、Sa和SRa明显降低(均为P<0.001),见图2。LAF组左房心肌SRe有降低趋势,但两组比较差异无统计学意义(P>0.05),见表3。
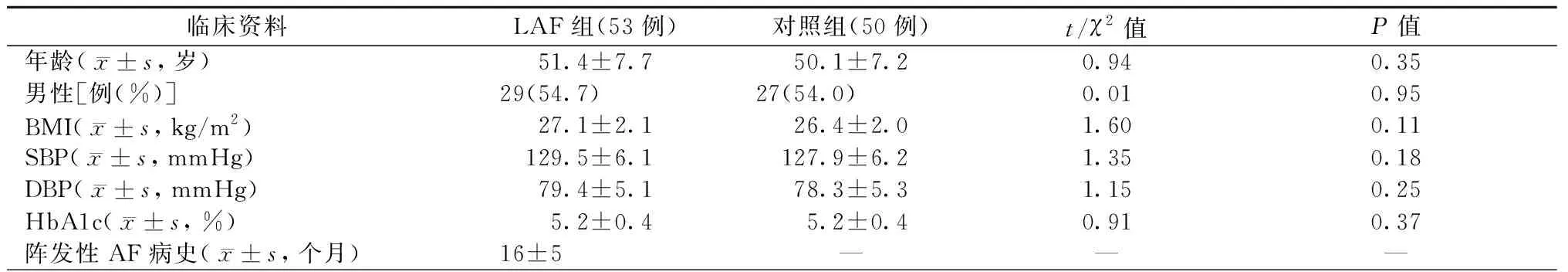
表1 LAF组与对照组的临床资料特点
注:BMI:体质指数;SBP:收缩压;DBP:舒张压;HbA1c:糖化血红蛋白
表2 LAF组与对照组的常规超声心动图参数
注:EDD:左室舒张末内径;LVEF:左室射血分数;LAVI:左房容量指数;LAEF:左房排空分数;E:二尖瓣舒张早期峰值流速;A:二尖瓣舒张晚期峰值速度;IVRT:左室等容舒张时间;DT:E峰减速时间
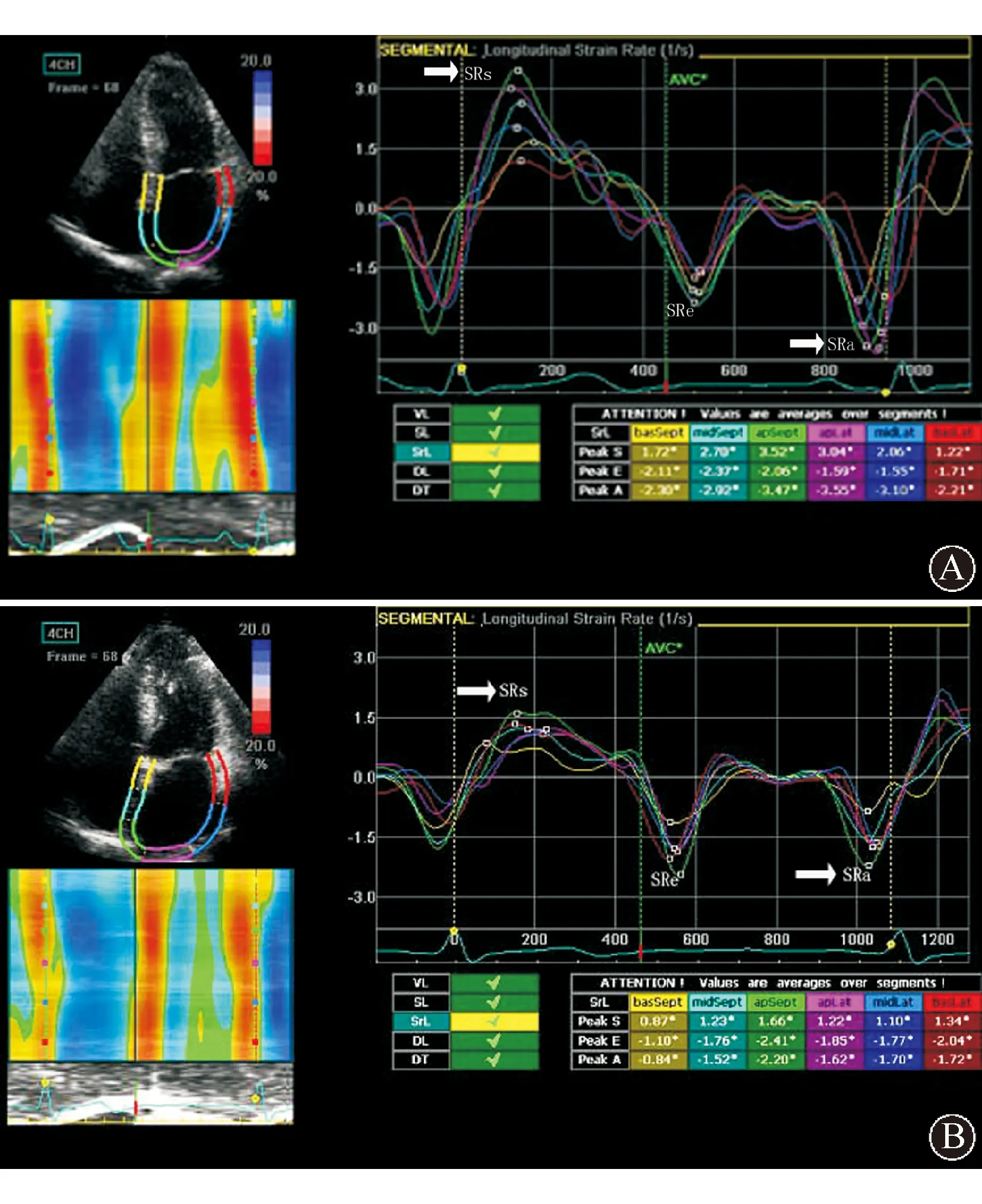
A:对照组的应变率分析;B:LAF组的应变率分析。左室收缩期测量正向峰值SRs,左室舒张早期测量负向峰值SRe,左房收缩期P波后测量负向峰值SRa。LAF组左房心肌的SRs、Sa和SRa明显低于对照组图2 应用2D-STE技术分析左房心房肌的应变率
2.4 相关分析及Logistic多元回归分析
对照组左房心肌SRs与PA-TDI间期呈负相关(r=-0.436,P=0.002),左房心肌SRa与PA-TDI 间期呈正相关(r=0.377,P=0.01)。LAF组左房心肌SRs与PA-TDI间期呈负相关(r=-0.468,P=0.001),左房心肌SRa与PA-TDI间期呈正相关(r=0.390,P=0.004)。LAVImax与PA-TDI间期呈正相关(r=0.332,P=0.02),与SRa呈正相关(r=0.257,P=0.04),与SRs呈负相关(r=-0.282,P=0.04)。Logistic多元回归分析显示,PA-TDI是唯一可独立预测LAF发生的超声心动图参数(OR=1.28,95%CI:1.02~1.54,P=0.005),见表4。PA-TDI间期的ROC曲线下面积为0.775。PA-TDI间期预测LAF的界点为>141.5 ms,敏感度为70.0%,特异度为70.0%。
3 讨论
AF引发的心房结构重构是其电重构的基础,进一步促使AF的发生发展。近年来,对左房机械功能的无创性评价引起人们的兴趣。2D-STE是超声心动图领域最新发展的技术之一,与多普勒技术相比,2D-STE 能够避免角度依赖,因此被推荐用于评估左房的机械变形功能[8]。 关于左房的2D-STE 分析显示AF 患者左房的应变和应变率降低,并且心房应变率是AF复律后维持窦性心律的良好预测因子[9]。然而,目前对LAF患者的左房应变率特点仍不甚了解。
本研究入选AF发生≤2年且无并发症的LAF患者,研究显示LAF早期左房功能受损。左房功能包括左室收缩期的储血功能、舒张早期的管道功能和舒张晚期的辅泵功能。2D-STE技术可评价上述功能,SRs、SRe和SRa分别反映左房储血功能、管道功能和辅泵功能。本研究发现,LAF患者的左房储血功能和辅泵功能较对照组明显降低,提示左房心肌的变形能力,代表左房的顺应性和压力,在AF发生后早期即发生损伤。既往研究显示,在AF发生后出现心房肌细胞不同程度的纤维化、肥厚、凋亡等异常,这些病理改变导致心房壁僵硬,心房顺应性降低和收缩力减弱[10],可能是导致左房应变率降低的原因。本研究显示,与对照组比较,LAF组管道功能的差异无统计学意义,提示LAF患者的左房管道功能仍可代偿。左房可直接受左室舒张功能的影响,然而本研究显示两组间左室舒张功能无明显差异,表明LAF患者左房储血功能和辅泵功能受损是由于左房本身重构,而非受左室舒张功能的影响。
表3 LAF组与对照组的组织多普勒和应变率参数
注:S′:二尖瓣环收缩期的峰值速度;E′:二尖瓣环舒张早期峰值速度;A′:二尖瓣环舒张晚期峰值速度;PA-TDI:组织多普勒测量总的心房内传导时间;SRs:收缩期应变率;SRe:舒张早期应变率;SRa:左房收缩期应变率
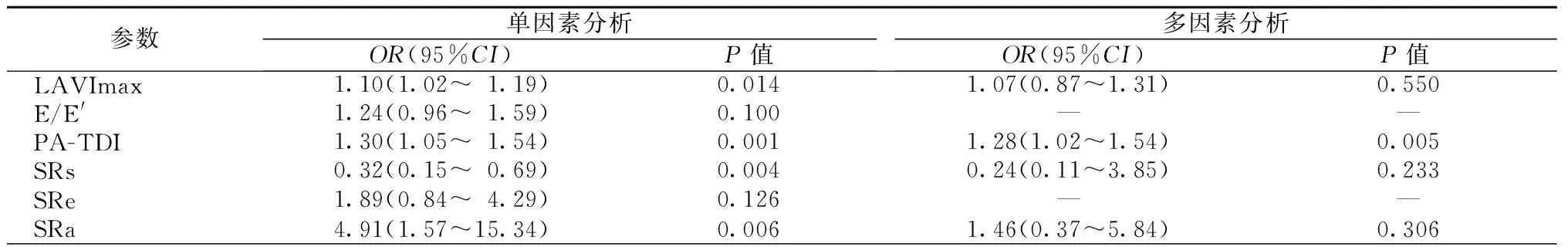
表4 Logistic回归分析
注:LAVImax:最大左房容量指数;E:二尖瓣舒张早期峰值流速;E′:二尖瓣环舒张早期峰值速度;PA-TDI:组织多普勒测量总的心房内传导时间;SRs:收缩期应变率;SRe:舒张早期应变率;SRa:左房收缩期应变率
本研究另一项重要结果是LAF组患者PA-TDI间期较对照组延长,与Weijs等[11]的研究结果一致。既往研究显示,PA-TDI间期能够反映心房重构引起的结构和电活动变化。而本研究显示,降低的左房储血和辅泵功能与延长的PA-TDI 间期具有相关性。既往文献尚未曾报道过这种结构重构与电重构之间的线性相关关系。以上结果提示左房应变率参数不仅反映左房结构重构,还能反映其电生理重构。既往学者认为,左房大小和容量与AF预后及其他心血管并发症相关[12], 而本研究显示LAF患者左房最大容量指数较对照组增高,但其与PA-TDI间期仅有较弱的相关性。降低的左房储血和辅泵功能在评价LAF患者左房功能方面更优于这些指标。左房应变率降低和PA-TDI间期延长可能是AF发作的结果,也可能是潜在基础疾病的表现。二者的相关关系同样提示多种致病因素同时导致了心房组织和电生理损伤,引起心房肌肥大、纤维化与房内电传导延迟、不均一,最终导致AF发生。本研究还显示,PA-TDI是AF发生的独立预测因子,提示检测PA-TDI间期可能有助于预测LAF发生或AF潜在危险因素的存在,对其预后和治疗有重要意义。
总之,LAF患者左房应变率降低,PA-TDI间期延长;反映左房结构的应变率指标与反映左房电重构的PA-TDI间期呈正相关。PA-TDI是LAF发生的独立预测因子。本研究局限性:样本量较小,需扩大样本量才能反映群体特征;此外,应用研究左室心肌应变的软件来分析左房心肌应变,且目前尚未建立2D-STE评价左房功能的参考值,其可靠性尚需进一步研究证实。
利益冲突:无
