低稳定性绿色荧光蛋白EGFP-PEST的载体构建及表达验证
2017-11-06袁龙郑幽范杰梁剑青牛祖彪高丽华黄红艳陈昭烈管静芝孙强
袁龙,郑幽,范杰,梁剑青,牛祖彪,高丽华,黄红艳,陈昭烈,管静芝,孙强
1.山西医科大学 第二临床医学院,山西 太原 030001;2.军事医学科学院 生物工程研究所,北京 100071;3.首都医科大学附属北京世纪坛医院 肿瘤内科,肿瘤治疗性疫苗北京市重点实验室,北京 100038;4.解放军第309医院 肿瘤内科,北京 100091
低稳定性绿色荧光蛋白EGFP-PEST的载体构建及表达验证
袁龙1,2,郑幽2,范杰2,梁剑青2,牛祖彪2,高丽华2,黄红艳3,陈昭烈2,管静芝4,孙强2
1.山西医科大学 第二临床医学院,山西 太原 030001;2.军事医学科学院 生物工程研究所,北京 100071;3.首都医科大学附属北京世纪坛医院 肿瘤内科,肿瘤治疗性疫苗北京市重点实验室,北京 100038;4.解放军第309医院 肿瘤内科,北京 100091
目的:构建含有蛋白降解基序PEST序列的增强型绿色荧光蛋白(EGFP)融合基因表达载体pQCXIP-EGFPPEST-N1,并检测其对蛋白稳定性的调节。方法:以NFATx6-mPro-EGFP-PEST-YES为模板,PCR扩增EGFP-PEST序列,克隆入逆转录病毒载体pQCXIP-EGFP-N1构建pQCXIP-EGFP-PEST-N1,病毒包装后感染293FT细胞获得稳定细胞系;用蛋白酶体抑制剂MG-132处理细胞,Western印迹检测EGFP的表达变化。结果:构建获得逆转录病毒载体pQCXIP-EGFP-PEST-N1,感染293FT细胞后,与对照组相比,EGFP表达显著降低,并且该降低可被MG-132处理逆转。结论:构建了EGFP-PEST蛋白的表达载体,PEST可以介导EGFP蛋白发生蛋白酶体依赖的降解。为实现基因编辑效果的可视化筛选奠定了基础。
PEST序列;基因编辑;蛋白酶体;绿色荧光蛋白
PEST序列是许多短周期蛋白中相对保守的一段区域,它富含脯氨酸(P)、谷氨酸(E)、丝氨酸(S)、苏氨酸(T)、天冬酰胺(N)、谷氨酰胺(Q),两侧一般由精氨酸和赖氨酸构成。早在1986年,Rogers等通过对PEST稳定性及序列的研究,推测PEST可能能够调控细胞内的蛋白表达水平[1]。随后越来越多的研究证明PEST序列可通过泛素蛋白酶体途径引起蛋白降解,其主要过程是:泛素被泛素激活酶(E1)激活后,可转移到泛素结合酶(E2)并与之结合,随后E2与泛素连接酶(E3)共同识别PEST序列并使其泛素化,最后含泛素化PEST序列的蛋白被26S蛋白酶体降解[2-3]。去除或突变PEST序列均会增强蛋白的稳定性,减少蛋白的降解[4-5]。研究发现,当含PEST序列的蛋白与其他蛋白在物理结构上发生紧密结合时,也会增加其结合蛋白的降解[6]。但并非所有含PEST序列的蛋白都会直接通过泛素蛋白酶体途径降解,一些PEST序列只有在被激酶磷酸化后才会通过泛素蛋白酶体途径引起蛋白降解;并且PEST序列中磷酸化位置的不同也会产生不同的结果,如血管内皮生长因子PEST序列中的酪氨酸位点被磷酸化后使蛋白更加稳定,而它的丝氨酸位点被磷酸化后会引起蛋白降解[7]。因此,可以通过融合PEST序列来调节特定蛋白的表达水平。
在进行基因编辑时,我们常使用增强型绿色荧光蛋白(EGFP)作为报告分子。但由于EGFP蛋白相对稳定,降低了其对微弱基因编辑效果的报告敏感性。为此,我们尝试构建EGFP-PEST融合蛋白表达载体,利用PEST序列可通过泛素蛋白酶体途径降解蛋白的功能,加快EGFP的降解,从而使得EGFP能够更为灵敏地指示基因编辑效果,为实现基因编辑的可视化筛选奠定基础。
为了获得稳定表达EGFP-PEST的细胞系,我们构建了逆转录病毒载体pQCXIP-EGFP-PESTN1,用所产生的病毒感染293FT细胞建立稳定表达细胞株,以此为基础检测PEST序列对EGFP表达水平的影响。
1 材料和方法
1.1 材料
人胚肾细胞293FT来自美国ATCC细胞库(采用Hyclones公司的DMEM-High Glucose培养基培养);pQCXIP-EGFP-N1和NFATx6-mPro-EGFPPEST-YES载体均由本实验室构建;蛋白酶体抑制剂MG-132、EGFP抗体购自Sigma公司;胎牛血清购自德国PAN公司;质粒提取试剂盒、胶回收试剂盒购自田根生化科技有限公司;Q5高保真DNA聚合酶、限制性内切酶、T4DNA连接酶均购自NEB公司;pGEM-T载体购自Promega公司;脂质体LipofectAMINE 2000购自Invitrogen Technolo⁃gy公司;引物由北京博迈德生物技术有限公司合成;测序由北京擎科生物技术有限公司完成。
1.2 EGFP-PEST序列的扩增及pQCXIP-EGFPPEST载体的构建
以NFATx6-mPro-EGFP-PEST-YES载体为模板,设计上游引物(5'-ACCGGTCGCCACCATGGT GAGCAAGG-3')和下游引物(5'-CAATTGTTAGA CGTTGATCCTGGCGCTG-3'),利用PCR扩增获得EGFP-PEST的编码序列(扩增条件:98℃预变性30s;98℃变性10s,60℃退火30s,72℃延伸30s,循环30次;72℃终延伸120s),PCR反应采用Q5高保真DNA聚合酶进行。用胶回收试剂盒回收PCR产物,Taq酶加A后连入pEGM-T载体,双酶切及测序结果鉴定正确后分别用AgeⅠ/MfeⅠ双酶切,回收目的片段连入pQCXIP-EGFP-N1载体的AgeⅠ/MfeⅠ位点,获得逆转录表达载体pQCXIP-EGFP-PEST-N1(图1)。
1.3 病毒包装、感染
将1×106/孔293FT细胞接种于六孔板,12h后进行病毒包装。将400ng目的逆转录病毒载体(pQCXIP-EGFP-N1和pQCXIP-EGFP-PESTN1)与200ng Gag/Pol、250ng VSV-G加入100μL Opti-MEM中 ,再将2.5μL LipofectAMINE 2000加入100μL Opti-MEM中,静置5min;将上述2种液体轻轻混匀,室温放置25min,向混合液中补加800μL Opti-MEM,最后将混合液加入已接种细胞的六孔板中。6h后更换成有血清的DMEM培养基,24、48h后分别收取病毒上清,用4.5μm滤器过滤备用。靶细胞293FT按2×105/孔接种六孔板,12h后取上述病毒上清1mL+1mL全培养基+2μL Polybrene混合后感染293FT细胞,6h后换2mL新鲜培养基培养,感染后24h用1μg/mL嘌呤霉素筛选3d,获得稳定细胞系。
1.4 Western印迹检测
获得稳定细胞系后,将细胞按照5×105/孔接种于六孔板中,12h给予MG-132(终浓度为4μmol/L)处理,24h后收集细胞蛋白(每孔加入100μL含蛋白酶抑制剂和蛋白磷酸酶抑制剂的细胞裂解液,冰上裂解30min后于4℃、12 000r/min离心15min,取上清进行蛋白定量,各样品按照上样量10μg进行蛋白电泳并转印至PVDF膜,经封闭、一抗过夜孵育(1∶1000稀释)、二抗孵育等步骤后进行ECL显色)。
2 结果
2.1 pQCXIP-EGFP-PEST表达载体的构建
以NFATx6-mPro-EGFP-PEST-YES为模板,PCR扩增EGFP-PEST的编码序列,获得约850bp片段(图2A),与预期大小(843bp)相符,提示扩增成功。将目的片段连入pGEM-T载体,挑取2个克隆测序,结果均正确(测序结果未示)。将鉴定正确的克隆连入逆转录载体pQCXIP-EGFP-N1,挑取8个克隆进行菌液PCR鉴定,得到与预期相符合的条带(图2B),随后将鉴定正确的克隆送测序并进行双酶切鉴定,结果与预期相符(图2C),序列正确(图2D),提示pQCXIP-EGFPPEST-N1表达载体构建成功。
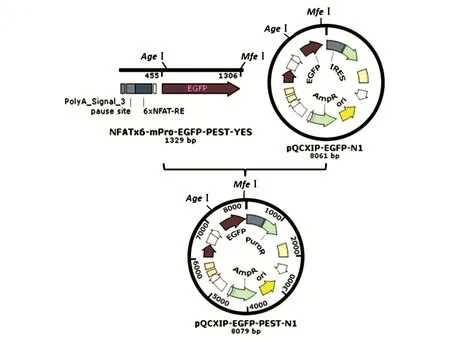
图1 pQCXIP-EGFP-PEST-N1表达载体构建示意图
2.2 PEST序列功能的检测
为了检测EGFP-PEST融合蛋白中PEST序列的功能,将载体pQCXIP-EGFP-N1和pQCXIPEGFP-PEST-N1进行病毒包装进而感染293FT细胞,获得稳定细胞系。荧光显微镜下观察2种细胞的GFP荧光强度,显示EGFP-PEST的荧光强度明显低于EGFP(图3)。提示PEST的融合表达能够降低细胞中EGFP的表达水平。
2.3 PEST序列作用机制检测
为了检测PEST对EGFP表达的影响是否通过泛素蛋白酶体途径实现,我们用MG-132处理细胞,收集蛋白后用Western印迹检测EGFP的表达变化,结果(图4)显示,MG-132处理后EGFPPEST的表达明显上调,而EGFP的表达水平没有明显改变。说明PEST序列对EGFP蛋白表达水平的调节依赖于蛋白酶体降解途径。
3 讨论

图2 EGFP-PEST的PCR扩增和表达载体构建

图3 EGFP-PEST荧光减弱(荧光显微镜20×)

图4 EGFP-PEST的降解依赖于蛋白酶体通路
蛋白质的降解在生物学过程中起重要作用,尤其是信号通路中的一些调节蛋白的水解会激活或失活下游信号分子,引发一系列生物反应。PEST序列广泛存在于细胞内多种蛋白中,它作为泛素蛋白酶体途径的降解信号,参与细胞的运动、应激、代谢、增殖分化等过程[2,4-5,8]。
在以EGFP作为基因编辑效果报告分子时,由于EGFP表达稳定,使得微弱的基因编辑效果难以被有效捕捉。为此,我们构建了EGFP-PEST融合蛋白,PEST序列能够被蛋白酶体识别,进而降解融合表达的EGFP,使细胞内的EGFP荧光强度显著减弱甚至消失。较短的半衰期使得EGFP-PEST的水平能够及时灵敏地反映新合成蛋白的表达水平,为基因编辑的可视化筛选奠定了基础。
PEST在疾病的发生和治疗中也有着关键作用。已有研究报道,将亨廷顿蛋白抗体编码序列与PEST融合表达,可长时间而高效地降解亨廷顿蛋白,达到治疗小鼠模型舞蹈病的效果[9];淋巴细胞白血病基因1(lymphoblastic leukemia1,LYL1)编码的蛋白是一种与白血病发展密切相关的促肿瘤转录因子,其蛋白序列中包含PEST序列,并且可通过泛素蛋白酶体途径降解,提示PEST序列与白血病的发生密切相关[10];真核翻译起始因子4E-结合蛋白会引起糖尿病诱导的视力障碍,通过对这种蛋白序列进行分析发现其中存在PEST区域,而当PEST上苏氨酸糖基化时可阻断该蛋白通过泛素蛋白酶体途径降解,这一结果提示PEST序列可能与糖尿病诱导的视力障碍发生有关[11]。因此,本研究有望为探究疾病机理提供新的工具。
[1] Rogers S,Wells R,Rechsteiner M.Amino acid se⁃quences common to rapidly degraded proteins:the PEST hypothesis[J].Science,1986,234(4774):364-368.
[2] Xing Hongyan,Hong Yiling,Sarge K D.PEST se⁃quences mediate heat shock factor 2 turnover by inter⁃acting with the Cul3 subunit of the Cul3-RING ubiq⁃uitin ligase[J].Cell Stress Chaperones,2010,15(3):301-308.
[3] Badi I,Cinquetti R,Frascoli M,et al.Intracellular ANKRD1 protein levels are regulated by 26S protea⁃some-mediated degradation[J].FEBS Lett,2009,583(15):2486-2492.
[4] Spencer M L,Theodosiou M,Noonan D J.NPDC-1,a novel regulator of neuronal proliferation,is degraded bythe ubiquitin/proteasomesystem through aPEST degradation motif[J].J Biol Chem,2004,279(35):37069-37078.
[5] Wallace A D,Cao Y,Chandramouleeswaran S,et al.Lysine 419 targets human glucocorticoid receptor for proteasomal degradation[J].Steroids,2010,75(75):1016-1023.
[6] Wang Hong-Mei,Xu-Yun Fei,Ning Shang-Lei,et al.The catalytic region and PEST domain of PTPN18 dis⁃tinctly regulate the HER2 phosphorylation and ubiqui⁃tination barcodes[J].Cell Res,2014,24(9):1067-1090.
[7] Meyer R D,Srinivasan S,Singh A J,et al.PEST mo⁃tif serine and tyrosine phosphorylation controls vascu⁃lar endothelial growth factor receptor 2 stability and downregulation[J].MolCellBiol,2011,31(10):2010-2025.
[8] Lee M Y,Ajjappala B S,Kim M S,et al.DUB-1,a fate determinant of dynein heavy chain in B-lympho⁃cytes,is regulated by the ubiquitin-proteasome pathway[J].J Cell Biochem,2008,105(6):1420-1429.
[9] Butler D C,Messer A.Bifunctional anti-Huntingtin proteasome-directed intrabodies mediate efficient degra⁃dation of mutant Huntingtin exon 1 protein fragments[J].PLoS One,2011,6(12):e29199.
[10]Lukov G L,Goodell M A.LYL1 degradation by the proteasome is directed by a N-terminal PEST rich site in a phosphorylation-independent manner[J].PLoS One,2010,5(9):e12692.
[11]Miller W P,Mihailescu M L,Chen Y,et al.The translational repressor 4E-BP1 contributes to diabetesinduced visual dysfunction[J].Invest Ophthalmol Visu⁃al Sci,2016,57(3):1327-1337.
Constructing Vector for the Expression of EGFP-PEST,a Modified Enhanced Green FluorescentProtein with Low Stability
YUAN Long1,2,ZHENG You2,FAN Jie2,LIANG Jian-Qing2,NIU Zu-Biao2,GAO Li-Hua2,HUANG Hong-Yan3,CHEN Zhao-Lie2,GUAN Jing-Zhi4*,SUN Qiang2*
1.Second Medical College,Shanxi Medical University,Taiyuan 030001;2.Beijing Institute of Biotechnology,Bei⁃jing 100071;3.Department of Medical Oncology,Beijing Shijitan Hospital,Capital Medical University,Beijing Key Laboratory of Cancer Therapeutic Vaccine,Beijing 100038;4.Department of Medical Oncology,PLA 309 Hos⁃pital,Beijing 100091;China
*Co-corresponding authors,GUAN Jing-Zhi,E-mail:jzjz1970@hotmail.com;SUN Qiang,E-mail:sunq@bmi.ac.cn
Objective:To construct retroviral vector pQCXIP-EGFP-PEST-N1 for the expression of EGFP-PEST protein,and examine the effects of PEST motif on EGFP stability.Methods:DNA fragment containing EGFPPEST was amplified by PCR from NFATx6-mPro-EGFP-PEST-YES as template,and then cloned into the retrovi⁃ral expression vector pQCXIP-EGFP-N1 to generate pQCXIP-EGFP-PEST-N1,which was packaged into retrovirus to infect 293FT cells.Western blot was employed to examine changes at protein level upon treatment of protea⁃some inhibitor(MG-132).Results:Compared with pQCXIP-EGFP-N1 virus,retroviral vector of pQCXIP-EGFPPEST-N1 produced significantly lower EGFP in 293FT cells,and MG-132 treatment reverted the expression of EGFP-PEST but not EGFP,suggesting effective PEST-mediated degradation via proteasome.Conclusion:A vector has been constructed to express EGFP-PEST,and PEST motif has been proved to effectively mediate EGFP degra⁃dation in a proteasome-dependent manner.This work set a basis for visualing target screen in gene edition.
PEST motif;gene edition;proteasome;EGFP
Q78
A
1009-0002(2017)04-0405-05
2017-01-12
国家自然科学基金(81572799,31671432);国家重点研发计划(2016YFC1303303)
袁龙(1989- ),男,硕士研究生,(E-mail)1020264077@qq.com;郑幽(1989- ),女,助理研究员,(E-mail)zhengyousic@163.com
管静芝,(E-mail)jzjz1970@hotmail.com;孙强,(E-mail)sunq@bmi.ac.cn
10.3969/j.issn.1009-0002.2017.04.001
