EH-L-Fc在CHO细胞中的表达、纯化及活性分析
2017-11-06庞玉红刘玉斌于爱平吕英涛
庞玉红,刘玉斌,于爱平,吕英涛
1.青岛科技大学,山东 青岛 266042;2.军事医学科学院 放射与辐射医学研究所,北京 100850
EH-L-Fc在CHO细胞中的表达、纯化及活性分析
庞玉红1,刘玉斌2,于爱平2,吕英涛1
1.青岛科技大学,山东 青岛 266042;2.军事医学科学院 放射与辐射医学研究所,北京 100850
目的:为延长重组新蛭素(EH)的半衰期,制备通过连接肽连接的重组新蛭素与IgG1 Fc的融合蛋白EH-LFc,并对其进行功能分析。方法:采用重叠PCR技术构建Eh-L-Fc融合基因,克隆至表达载体pcDNA3.1,用脂质体将重组表达载体转染至中国仓鼠卵巢细胞(CHO)中,G418抗性筛选稳定克隆株;Western印迹检测培养上清中EH-LFc蛋白的表达,用有限稀释法对G418抗性筛选出的混合克隆单克隆化,通过Protein A亲和层析柱纯化融合蛋白,Lowry法检测蛋白浓度,SDS-PAGE、HPLC法检测目的蛋白纯度,质谱法分析相对分子质量,凝血因子Ⅹa裂解融合蛋白后采用纤维蛋白凝块法测定其抗凝活性。结果:构建了重组表达载体pcDNA3.1-Eh-L-Fc,并获得稳定表达EHL-Fc的细胞株。表达产物的相对分子质量为72 168,HPLC检测亲和层析获得的EH-L-Fc纯度达93.9%。完整的EH-L-Fc无抗凝活性,经凝血因子Ⅹa裂解后其抗凝比活性为96.6 ATU/mg。结论:获得稳定表达EH-L-Fc的CHO细胞株和较高纯度的重组融合蛋白,且该重组融合蛋白经凝血因子Ⅹa裂解后可释放抗凝活性。EH-L-Fc融合蛋白的获得为研究新蛭素的长效剂型奠定了重要基础。
新蛭素;抗凝;Fc融合蛋白
水蛭素(hirudin,HV)是水蛭唾液腺分泌的一种酸性多肽,是目前已知的最强有力的凝血酶天然抑制剂[1-2],有良好的抗凝血和抗血栓作用[3]。虽然水蛭素不会引起血小板减少症,且不依赖抗凝血酶Ⅲ,但其同样存在出血副作用[4],这极大地限制了它的广泛应用。本实验室前期构建表达了能靶向血栓释放抗凝活性的水蛭素衍生物——新蛭素(neorudin,EH)[5],它是在水蛭素N端连接能够被凝血因子Ⅹa(FⅩa)和Ⅺa(FⅪa)识别并切割的短肽谷氨酸-脯氨酸-精氨酸(EPR),该短肽可以封闭水蛭素的抗凝活性。当体内发生血栓或凝血系统被激活时,该短肽可被富集于血栓局部的FⅩa和FⅪa识别并切割,释放出有活性的水蛭素,从而发挥抗栓作用。通过这种作用机制,使EH能够靶向作用于血栓局部,从而降低全身的出血副作用。然而,EH是一条短肽,其相对分子质量只有7300,很容易被肾小球过滤,经尿液排出,这就使得EH在体内的血浆半衰期较短,只有1~2h,临床上需要多次滴注给药。因此,如何延长EH半衰期,减少给药次数,提高患者的生活质量,成为一个有价值的课题。
将蛋白药物与免疫球蛋白Fc段融合构建融合蛋白,是延长蛋白药物半衰期的一种重要方法。Fc融合蛋白主要通过2种方式延长目的蛋白的半衰期:通过提高相对分子质量,减少肾小球过滤;Fc融合蛋白与Fc新生受体(neonatal Fc re⁃ceptor,FcRn)结合,通过FcRn介导的胞吞转运循环模型延缓融合蛋白被蛋白酶降解[6-8]。在本研究中,我们将EH与人IgG1的Fc融合,用刚性连接肽(linker)将EH蛋白和Fc结构域连接,通过增加2个蛋白间的空间距离[9]而减少蛋白间的相互影响,以期在不影响EH抗凝功能的前提下,延长其血浆半衰期。
1 材料与方法
1.1 材料
CHO细胞由本实验室保存;大肠杆菌感受态细胞DH5α购自北京康为世纪生物科技有限公司;携带Eh(204bp)片段的pUCK-Eh由上海生工公司合成;携带Fc(669bp)片段的pET-22a-V、pcDNA3.1由本实验室保存;山羊抗人IgG-Fc(HRP)购自Abcam公司;质粒提取试剂盒购自天根生化科技有限公司;FⅩa、限制性内切酶HindⅢ和XhoⅠ为NEB公司产品;KOD-Plus-Neo购自Toyobo公司;LipofectAMINE 3000 Reagent Proto⁃col购自Invitrogen公司;Opti-MEM、DMEM-F12培养基购自Gibco公司;酵母粉和蛋白胨购自默克公司;优级胎牛血清购自浙江天杭生物科技有限公司;Protein A亲和层析预装柱购自Thermo公司;牛纤维蛋白原、人凝血酶购自中国食品药品检定研究院。
1.2 重组表达载体pcDNA3.1-Eh-L-Fc的构建
为确保EH-L-Fc融合蛋白分泌到培养基中,在Eh-L-Fc融合基因的5'端融合一段分泌信号肽(SP)序列,5'引物为 SP-FP。分别以 EH-FP、Fc-FP为正向引物,EH-RP、Fc-RP为反向引物,原核表达载体pUCK-Eh、pET-22a-Fc为模板进行PCR扩增Eh、Fc(反应条件:94℃预变性2min,98℃变性 10s,68℃退火/延伸 30s,30个循环,延伸 7min);以SP-FP为正向引物、EH-RP为反向引物、Eh为模板,PCR扩增Eh(反应条件:68℃退火30s,68℃延伸30s,扩增30个循环);以SP-FP为正向引物,linker-RP为反向引物,Eh、Linker为模板,连接扩增Eh-Linker(反应条件:68℃退火/延伸30s,30个循环);最后以SP-FP为正向引物,Fc-RP为反向引物,Eh-Linker、Fc为模板,连接扩增Eh-L-Fc(反应条件:68℃退火/延伸 30s,30个循环)。重叠PCR流程见图1,引物信息见表1。
PCR产物Eh-L-Fc与质粒pcDNA3.1分别经HindⅢ、XhoⅠ双酶切后,用T4DNA连接酶连接,42℃热激,转化大肠杆菌感受态细胞DH5α,挑取阳性单克隆于LB培养基中,过夜培养后离心取菌体,提取质粒,用HindⅢ、XhoⅠ双酶切鉴定重组载体后,测序鉴定。
1.3 瞬时转染验证重组质粒在CHO细胞中的表达
1.3.1 前期细胞预处理 转染前一天,取对数生长期的CHO细胞,用0.25%胰蛋白酶消化,离心重悬后接种于6孔细胞培养板,每孔2×105个细胞,于37℃、5%CO2、饱和湿度的细胞培养箱中过夜培养,细胞培养基为DMEM/F12+10%胎牛血清,当贴壁细胞汇合度达70%~90%时,将细胞培养基更换无血清Opti-MEM培养基。
1.3.2 转染 取3.75μL LipfectAMINE 3000加入125μL Opti-MEM 培养基中;取 5μg重组质粒加入250μL Opti-MEM培养基中,再加入10μL P3000 Reagent混匀;按1∶1的比例混合上述2种溶液,室温静置5min,将质粒混合液分别按标记加入6孔细胞培养板中,转染6h后,更换含10%胎牛血清的DMEM/F12培养基。
1.3.3 转录水平和翻译水平验证蛋白表达 转染24h后,用0.25%胰蛋白酶消化收集细胞,提取RNA,RT-PCR获得cDNA;以SP-FP为正向引物、Fc-RP为反向引物、RT-PCR获得的cDNA为模板,68℃退火/延伸30s,30个循环;转染48h后,收集培养基,用0.25%胰酶消化收集细胞,提取胞内蛋白。将收集到的培养基与提取的胞内蛋白进行SDS-PAGE后,转印至PVDF膜,用5%脱脂牛奶封闭,孵育二抗(1∶5000)后,发光试剂显影。
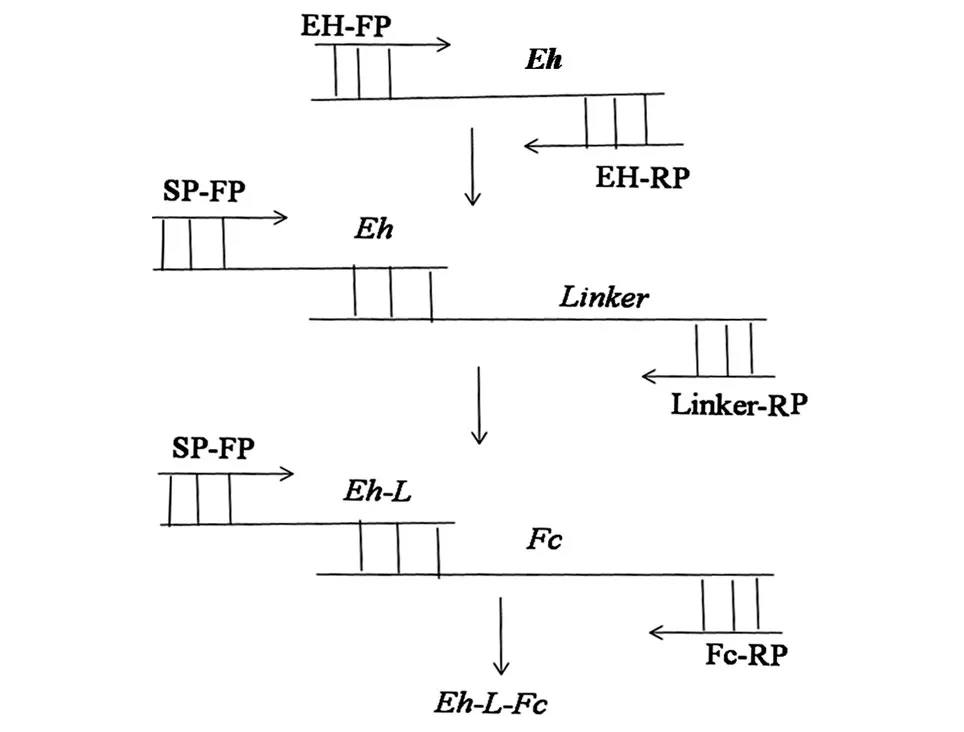
图1 重叠PCR扩增Eh-L-Fc融合基因流程图
1.4 稳定高表达细胞株的筛选
将瞬时转染得到的培养24h的细胞用0.25%胰蛋白酶消化转至100mm培养皿中,培养液为DMEM/F12+10%胎牛血清,加入终浓度为800μg/mL的G418进行抗性筛选,以转染空载体和未转染组为对照。14d后挑取细胞克隆于24孔板中扩增,有限稀释法将细胞稀释至100/mL后再依次梯度稀释铺入96孔板培养,待细胞长满后依次转入24孔板、6孔板、100mm培养皿扩大培养。
1.5 融合蛋白的表达与纯化
将筛选到的稳定转染单克隆细胞株培养2d后收集培养上清,用0.22μm滤膜过滤,Protein A-Agarose亲和层析柱纯化,用pH7.2、0.15 mol/L NaCl、100mmol/L的磷酸盐缓冲液平衡柱子,pH3.0、0.1 mol/L的甘氨酸缓冲液洗脱蛋白,pH8.5的1 mol/L Tris-HCl中和洗脱蛋白液至pH7.4。
1.6 纯化蛋白的浓度与纯度检测
采用Lowry法检测纯化后融合蛋白的浓度[10];采用SDS-PAGE灰度分析法与反向高效液相色谱法(RP-HPLC)检测纯化后融合蛋白的纯度(HPLC条件:C18柱子,A相为水,B相为乙腈,A、B相中分别加入1‰三氟乙酸,5%~70%浓度乙腈线性洗脱,检测波长280nm,流速1mL/min,上样量1μg)。

表1 实验所用引物和连接肽的序列
1.7 融合蛋白相对分子质量测定
采用还原SDS-PAGE法与基质辅助激光解吸飞行时间质谱法(MALDI-TOF-MS)检测融合蛋白的相对分子质量。
1.8 体外活性检测
牛源FⅩa(1 mg/mL)37℃裂解融合蛋白6h,取 10μL 裂解产物,加入20μL 8 IU/mL 的凝血酶,轻轻混匀后再加入20μL 5 mg/mL的纤维蛋白原,轻弹混匀,室温静置15min,轻弹管壁,观察凝块形成情况。以同体积去离子水代替裂解的EH-L-Fc溶液和凝血酶溶液,其他条件不变作为空白对照;以同体积去离子水代替裂解的EHL-Fc溶液,其他条件不变作为阳性对照;以未经裂解的EH-L-Fc溶液代替裂解的EH-L-Fc溶液,其他条件不变作为裂解前对照。用下式计算抗凝比活性:
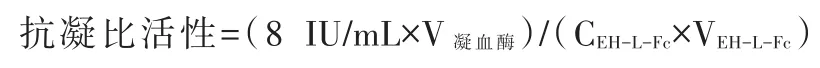
其中,8 IU/mL为凝血酶活性单位,V凝血酶为凝血酶体积,CEH-L-Fc为 EH-L-Fc浓度,VEH-L-Fc为 EH-LFc溶液体积。
2 结果
2.1 重组表达载体的构建及验证
采用瑞士模型工作区(Swiss-Model Work⁃space)对设计的融合蛋白空间结构进行预测,预测结构如图2A,显示刚性连接肽通过形成3个α螺旋连接EH和Fc,使得2个结构域不存在空间位阻,提示Fc不会影响EH功能,即可以按照图2B所绘的重组表达质粒图谱进行后续重组质粒构建实验。
利用前述方法和引物,经SOE-PCR扩增融合目的基因Eh-L-Fc(990bp),将获得的产物片段进行1%琼脂糖凝胶电泳,结果显示扩增条带约1000bp,与理论值相符(图3A)。将获得的重组融合基因Eh-L-Fc克隆至表达载体pcDNA3.1并转化大肠杆菌感受态DH5α,提取质粒进行HindⅢ、XhoⅠ双酶切验证,琼脂糖凝胶电泳结果显示酶切获得1000bp左右的条带,与重组融合基因Eh-L-Fc理论大小相符(图3B)。核苷酸测序结果也显示,重组融合基因未发生碱基或核苷酸序列突变,说明我们获得了正确的重组表达载体pcDNA3.1-Eh-L-Fc。
2.2 转录水平检测融合基因的表达
将转染重组表达载体pcDNA3.1-Eh-L-Fc获得的瞬转CHO细胞系和转染空载体的CHO细胞系提取RNA,经试剂盒反转录获得cDNA,以获得的cDNA为模板,SP-FP和Fc-RP为引物进行PCR,将获得的PCR产物进行琼脂糖凝胶电泳分析,结果显示pcDNA3.1-Eh-L-Fc瞬转CHO细胞系在1000bp左右有目的核苷酸片段存在,而转染空载体的CHO系在相同位置未见任何条带(图4),说明重组表达载体成功转入CHO细胞。
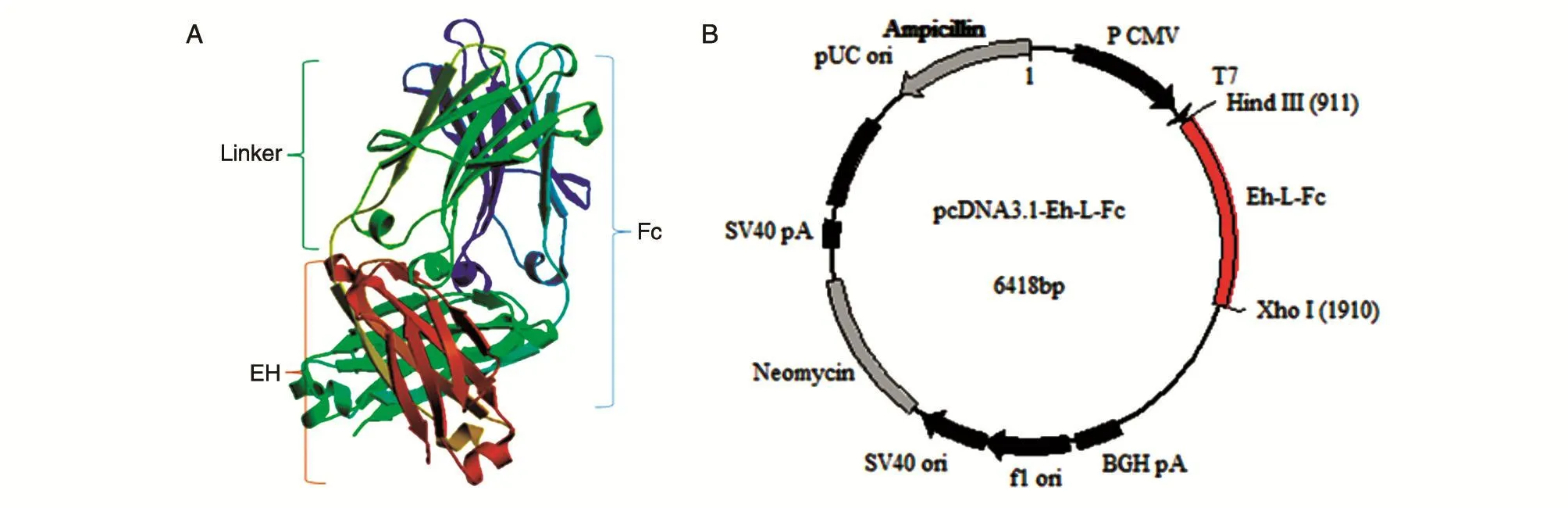
图2 EH-L-Fc融合蛋白空间结构预测图谱及质粒构建图谱
2.3 翻译水平检测融合蛋白的表达情况
为检测重组蛋白在转染重组质粒pcDNA3.1-Eh-L-Fc的CHO细胞和经过抗性筛选、克隆化的CHO细胞中的表达,采用山羊抗人IgG-Fc(HRP)抗体对分泌到细胞培养基中的目的蛋白和CHO胞内蛋白进行检测,图5A显示转染后的CHO细胞表达EH-L-Fc融合蛋白,且为分泌表达(图5B),图5C显示不同阳性细胞克隆表达量不同。
2.4 EH-L-Fc蛋白的纯化及检测
用ProteinA-Agarose亲和层析柱纯化pcDNA3.1-Eh-L-Fc高表达的CHO细胞系培养上清中的EH-L-Fc蛋白,亲和层析图谱见图6,层析洗脱峰的SDS-PAGE结果见图7,电泳结果均显示只有1条蛋白带。经Lowry法测得纯化后蛋白浓度为0.66 mg/mL,经扫描灰度分析,层析产物纯度为90.96%,HPLC结果显示层析产物纯度为93.9%(图8),质谱显示EH-L-Fc的相对分子质量为72 168(图9)。综上可知,获得了较高纯度的重组融合蛋白EH-L-Fc。
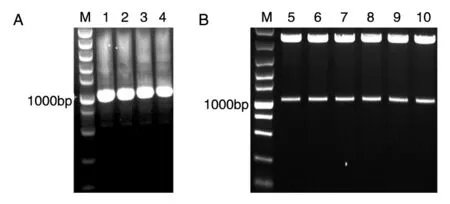
图3 重组质粒pcDNA3.1-Eh-L-Fc的构建过程核酸电泳图
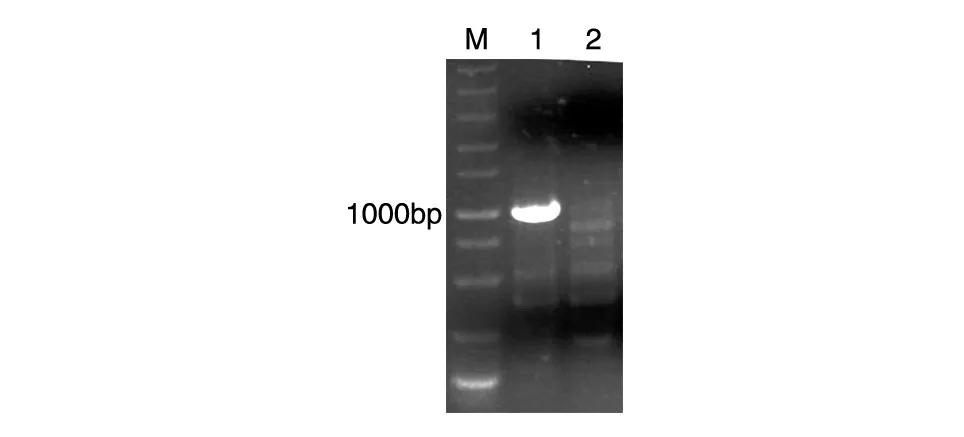
图4 瞬染CHO细胞系中RT-PCR检测pcDNA3.1-Eh-L-Fc的表达
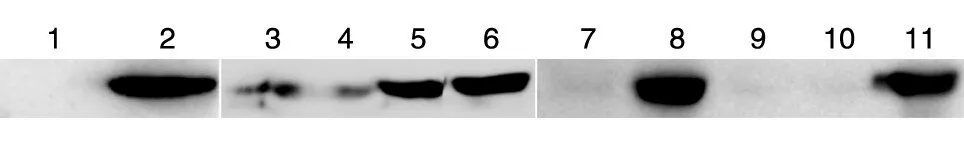
图5 Western印迹检测EH-L-Fc融合蛋白的表达
2.5 EH-L-Fc生物活性检测
用纤维蛋白凝块法测定EH-L-Fc蛋白活性,结果见表2。未裂解的EH-L-Fc融合蛋白和阳性对照均有凝块形成,即无抗凝活性,表明EH-LFc融合蛋白本身无抗凝活性,只有经FⅩa裂解后才具有抗凝活性。按照前述体外活性检测中提及的抗凝比活性计算公式,计算得抗凝活性为96.6 ATU/mg。
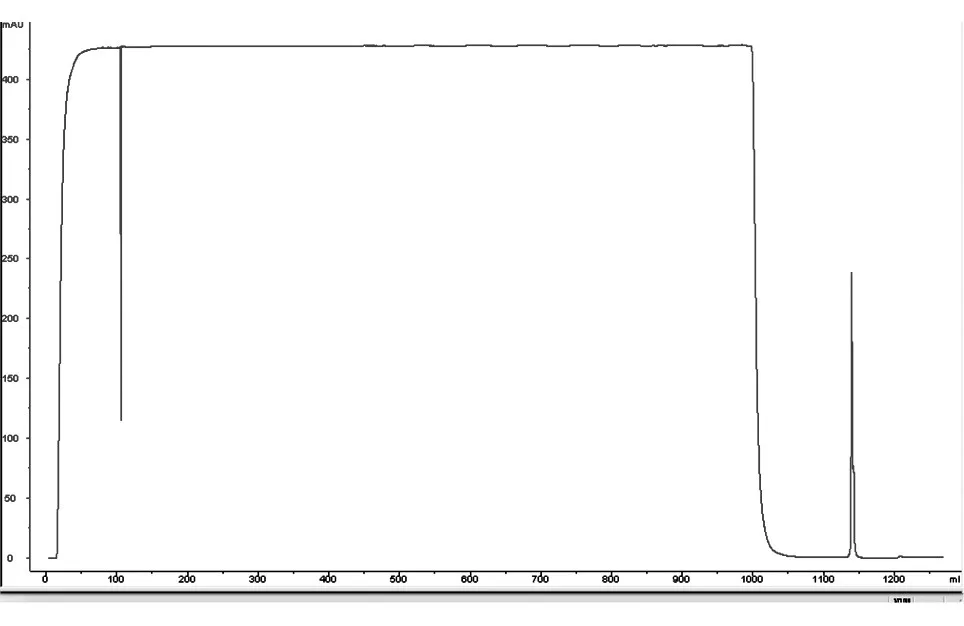
图6 pcDNA3.1-Eh-L-Fc高表达的CHO细胞系培养基的Protein A亲和层析图谱
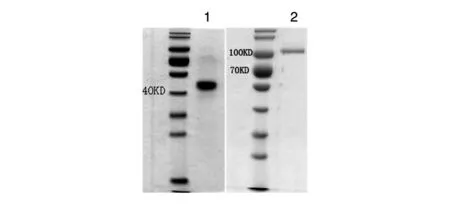
图7 亲和层析产物的SDS-PAGE
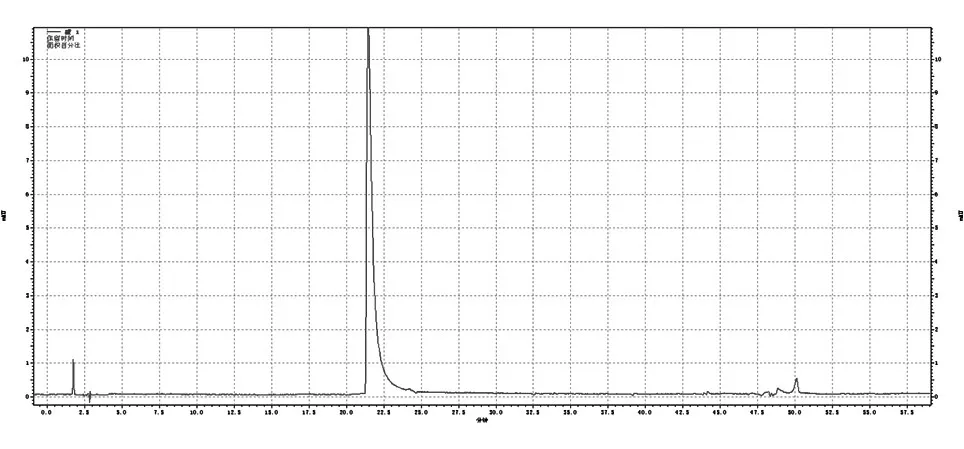
图8 亲和层析产物的HPLC检测
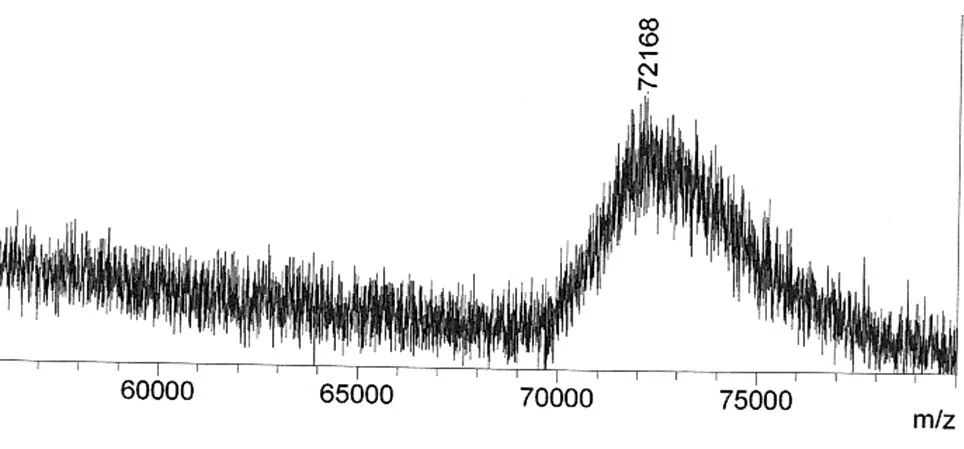
图9 EH-L-Fc的质谱检测

表2 EH-L-Fc的抗凝比活性
3 讨论
血栓形成和血栓栓塞2种病理过程所引起的疾病,临床上称为血栓性疾病,目前是人类死亡的最主要原因之一,病死率居高不下。血栓一旦形成往往造成不可逆的后果,因此血栓性疾病的治疗以预防为主。目前,不管是临床上常用的肝素类、华法令类抗凝药,还是新上市的凝血酶抑制剂、FⅩa抑制剂等抗栓药物,都存在出血副作用[11],因此降低出血副作用成为抗凝药物研发的重要方向。
水蛭素能与游离的或与纤维蛋白原结合的凝血酶以1∶1结合,形成紧密的非共价可逆性化合物,进而抑制凝血酶的活性。自1986年水蛭素cDNA被克隆后[12],经过30年的研究和应用,重组水蛭素取得巨大成就,并在真核、原核多种载体中获得表达[13]。为解决水蛭素的出血副作用问题,本实验室前期构建表达了新蛭素,在体内外证明[14]完整的新蛭素没有抗凝血酶活性,经FⅩa切割后可以释放水蛭素的抗凝活性[14],大鼠颈动脉血栓模型和大鼠后腔静脉血栓模型实验结果显示,动物给予EH后血栓形成时间明显延长,血栓质量显著减小,同时对凝血参数影响较弱,动物出血时间、凝血酶原时间和凝血酶时间明显低于阳性对照药水蛭素[15]。因而,体内外实验结果均表明,EH能够在发挥抗凝活性的前提下,降低出血副作用。
EH相对分子质量为7300,远小于肾小球过滤拦截的70 000的分子大小,因而易被肾小球过滤,经尿液排出,从而导致其体内半衰期较短。本实验室前期实验结果也显示,EH在实验动物体内主要以原型形式经尿液排泄,消除半衰期只有1个多小时。因而,EH在临床上须一天2次静脉滴注给药,静滴时间较长,影响患者的生活质量,这就使得延长EH的半衰期势在必行。
以往,延长半衰期主要通过结合线性或支链的聚乙二醇(PEG)[16-17]来增加相对分子质量和流体半径。虽然PEG已被美国FDA批准为安全分子(general recognized as safe,GRAS),但依然存在一些问题,如在肾外皮管上皮细胞形成空泡、在体内不被降解、价格昂贵、与蛋白间化学结合后需要再纯化结合物等,因此许多研究者也在努力寻求更安全价优的取代物。另一种提高药代动力学参数的方法为糖基化,以此降低降解,延长半衰期[18]。利用融合蛋白提高多肽和小分子蛋白的药代动力学参数被广泛应用,最常用的融合活性蛋白或多肽为白蛋白、人免疫球蛋白IgG的Fc片段和没有结构的多聚肽链,如XTEN,目前有43种融合蛋白处于Ⅱ、Ⅲ期临床阶段,其中20种被确认可以延长目的蛋白的半衰期[18]。
Fc融合蛋白的理念在1980年代首次提出,1998年,第一个Fc融合蛋白依那西普(etanercept)获准上市。至2015年5月,11种不同类型的Fc融合蛋白被美国FDA批准上市。其中,2014年上市的 Eloctate、Alprolix、Trulicity的半衰期分别从 12h、18h、1~2min提高到 19h、83h、3.75d[17]。因此,利用Fc与目的蛋白融合来延长半衰期不仅具有研究价值,更有市场价值。
本实验将EH与Fc进行融合,把Fc设计在EH的下游,保证EH的N端EPR充分暴露,可以被FⅩa和FⅪa识别并裂解,从而保留其抗凝活性的靶向性释放。EH与Fc之间采用一段刚性α螺旋连接肽(AEAAAKEAAAKEAAAKA),以此降低EH和Fc分子间的相互影响。
我们通过瞬时转染,初步确定了重组蛋白能在CHO细胞里表达,筛选了稳定表达的单克隆细胞株,培养上清经亲和层析获得了纯度较高的融合蛋白。单链融合蛋白EH-L-Fc理论相对分子质量为33 880,我们获得的融合蛋白经质谱分析,其相对分子质量为72 168,说明EH-L-Fc以二聚体形式存在,但表达产物的分子比二聚体理论分子量大,其原因可能是融合蛋白发生了糖基化,这有待后续实验验证。本实验结果显示完整的EH-L-Fc蛋白的确无抗凝活性,但经FⅩa酶切后可释放其抗凝活性,其抗凝比活性为96.6 ATU/mg,EH抗凝活性为512 ATU/mg,该抗凝比活性换算成摩尔分子抗凝活性时,与EH的摩尔分子抗凝活性(数据)相当,说明与Fc融合后,EH的生物特性基本没有受到影响。
本实验结果表明,通过CHO表达系统可以获得保留EH生物特性的EH-L-Fc融合蛋白,初步显示了EH-L-Fc融合蛋白的成药可能性。后续工作将继续改进完善纯化工艺,并验证融合蛋白在体内延长半衰期的效果。
[1] Markwardt F.Hirudin as alternative anticoagulant-a historical review[J].Semin Thromb Hemost,2002,28(5):405-414.
[2] Greinacher A,Warkentin T E.The direct thrombin in⁃hibitorhirudin[J].Thromb Haemost,2008,99(5):819-829.
[3] Zaidi S M,Jameel S S,Zaman F,et al.A systematic overview of the medicinal importance of sanguivorous leeches[J].Altern Med Rev,2011,16(1):59-65.
[4] Di Nisio M,Middeldorp S,Buller H R.Direct throm⁃bin inhibitors[J].N Engl J Med,2005,353(10):1028-1040.
[5] Zhang C,Yu A,Yuan B,et al.Construction and func⁃tional evaluation of hirudin derivatives with low bleed⁃ing risk[J].Thromb Haemost,2008,99(2):324-330.
[6] Roopenian D C,Akilesh S.FcRn:the neonatal Fc re⁃ceptor comes of age[J].Nat Rev Immunol,2007,7(9):715-725.
[7] Rath T,Baker K,Dumont J A,et al.Fc-fusion pro⁃teins and FcRn:structural insights for longer-lasting and more effective therapeutics[J].Crit Rev Biotech⁃nol,2015,35(2):235-254.
[8] Sockolosky J T,Szoka F C.The neonatal Fc receptor,FcRn,as a target for drug delivery and therapy[J].Adv Drug Deliv Rev,2015,91:109-124.
[9] Chen X,Zaro J L,Shen W C.Fusion protein linkers:property,design and functionality[J].Adv Drug Deliv Rev,2013,65(10):1357-1369.
[10]国家药典委员会.中华人民共和国药典(三部)[S].北京:中国医药科技出版社,2015:附录,34-35.
[11]刘敬.血栓栓塞性疾病抗栓治疗的研究[J].当代医学,2009,15(15):111-113.
[12]Harvey R P,Degryse E,Stefani L,et al.Cloning and expression of a cDNA coding for the anticoagulant hi⁃rudin from the bloodsucking leech,Hirudo medicinalis[J].Proc Natl Acad Sci USA,1986,83(4):1084-1088.
[13]郑琳,郭长虹,马军,等.重组水蛭素研究进展[J].中医药学报,2007,35(4):59-60.
[14]秦晓永,于爱平,王文文,等.抗凝蛋白EH体外活性检测条件的建立[J].中国生物工程杂志,2010,31(5):108-112.
[15]王文文,徐向伟,赵专友,等.谷氨酸-脯氨酸-精氨酸-水蛭素抑制血栓形成的实验研究[J].中国药学杂志,2013,2(48):111-115.
[16]Hutt M,FarberSchwarz A,Unverdorben F,et al.Plas⁃ma half-life extension of small recombinant antibodies by fusion to immunoglobulin-binding domains[J].J Bi⁃ol Chem,2012,287(7):4462-4469.
[17]Werle M,Bernkop-Schnurch A.Strategies to improve plasma half life time of peptide and protein drugs[J].Amino Acids,2006,30(4):351-367.
[18]Strohl W R.Fusion proteins for half-life extension of biologics as a strategy to make biobetters[J].Bio⁃Drugs,2015,29(4):215-239.
Expression,Purification and Function Analysis of EH-L-Fc Fusion Protein
PANG Yu-Hong1,LIU Yu-Bin2,YU Ai-Ping2*,LYU Ying-Tao1*
1.Qingdao University of Science and Technology,Qingdao 266042;2.Institute of Radiation Medicine,Academy of Military Medical Sciences,Beijing 100850;China
*Co-corresponding authors,LYU Ying-Tao,E-mail:ytlv@sina.com;YU Ai-Ping,E-mail:yuap117@163.com
Objective:To prolong the half-life of recombinant neorudin(EH),a new form of recombinant neoru⁃din(EH-L-Fc) was constructed by fusion of the neorudin gene and the coding sequence for fragment of human IgG1 with a rigid linker peptide,and the function of EH-L-Fc was analyzed.Methods:The fusion gene was ob⁃tained by SOE-PCR,and constructed into expression vector pcDNA3.1.The recombinant pcDNA3.1-Eh-L-Fc was transfected into CHO cells by liposomes.Stable gene expression cell lines were selected by geneticin(G418) resis⁃tance screening.The expression of EH-L-Fc protein in the cell culture supernatant was measured by Western blot⁃ting.The monoclone was selected from the resistance screening polyclone by limiting dilution analysis.The fusion protein was purified by Protein A affinity chromatography,and then the purity of the EH-L-Fc protein was ana⁃lyzed by SDS-PAGE and RP-HPLC.The fusion protein was cleaved by coagulation factorⅩa and the anticoagu⁃lant activity was determined in vitro by fibrin clot method.Results:The results showed that the recombinant ex⁃pression vector pcDNA3.1-Eh-L-Fc was successfully constructed,and the stable cell clone CHO-pcDNA3.1-Eh-LFc was obtained.The expression product is a dimer with a molecular weight of 72 168 Da.The purity of the re⁃combinant protein was 93.9%with a 96.9 ATU/mg anticoagulant specific activity after cleaved by factorⅩa.The complete recombinant EH-L-Fc has no anticoagulant activity.Conclusion:The stable CHO cell line harboring the recombinant Eh-L-Fc was successfully obtained.The EH-L-Fc fusion protein with a high purity and bioactivity af⁃ter cleavage by factorⅩa provides an important foundation for the further research of long acting EH-L-Fc.
neorudin;anticoagulant;Fc-fusion protein
Q78
A
1009-0002(2017)04-0422-07
2017-02-10
国家科技重大专项“重大新药创制”(2012ZX09102301-008)
庞玉红(1991- ),女,硕士研究生,(E-mail)15201048952@163.com
于爱平,(E-mail)yuap117@163.com;吕英涛,(E-mail)ytlv@sina.com
10.3969/j.issn.1009-0002.2017.04.004
