伪狂犬病病毒单克隆抗体制备及特征分析
2017-11-06叶华虎陈建宇周小军王进代艳艳韩宇刘珩袁菊芳
叶华虎,陈建宇,2,周小军,王进,代艳艳,韩宇,刘珩,袁菊芳
1.军事医学科学院 实验动物中心,北京 100071;2.内蒙古大学 生命科学学院,内蒙古 呼和浩特 010021
伪狂犬病病毒单克隆抗体制备及特征分析
叶华虎1,陈建宇1,2,周小军1,王进1,代艳艳1,韩宇1,刘珩1,袁菊芳1
1.军事医学科学院 实验动物中心,北京 100071;2.内蒙古大学 生命科学学院,内蒙古 呼和浩特 010021
目的:制备伪狂犬病病毒(PRV)单克隆抗体,为PVR防控奠定基础。方法:用PRV疫苗毒株Bartha-k61免疫小鼠,取免疫小鼠脾脏B淋巴细胞与SP2/0细胞融合,用酶联免疫吸附实验筛选阳性杂交瘤细胞并制备腹水,用病毒中和实验检测单克隆抗体(腹水)对PRV的中和作用。结果:通过细胞融合,共得到11株针对PRV的杂交瘤细胞。中和实验结果显示,无论是对于PRV弱毒株Bartha-k61还是强毒株AV25,2株杂交瘤细胞产生的腹水都表现为明显的中和效应;但2株单抗的中和能力不同,其中1株杂交瘤细胞腹水的中和效价为1∶16~1∶32,另1株的效价为1∶4。交叉反应显示,11株单克隆抗体中,2株与单纯性疱疹病毒存在明显的免疫反应,1株与猴B病毒的gD蛋白存在明显交叉反应。结论:制备了PRV的单克隆抗体,并获得了对PRV具有中和作用的单克隆抗体,以及能与其他疱疹病毒交叉反应的单克隆抗体。
伪狂犬病病毒;单克隆抗体;中和抗体;交叉反应
伪狂犬病(pseudorabies,PR),又称 Aujeszky病,是由伪狂犬病病毒(pseudorabies virus,PRV)引起的一种猪的急性、传染性疾病,主要表现为母猪繁殖障碍、发热,以及仔猪急性死亡等症状。其中,仔猪的病死率极高,最高可达100%。除猪外,PRV也同样能感染牛、羊等多种家畜以及家禽和野生动物等,发病动物表现为急性传染性疾病特征[1-3]。
伪狂犬病的临床诊断并不复杂,通过典型临床症状及流行病学特征即可确认。虽然近年来随着疾病的持续发生,临床表现向非典型转化,但ELISA诊断试剂、胶体金试纸条、间接免疫荧光及分子诊断(主要是PCR)等方法的先后建立[4-6],极大地提高了疾病诊断的准确性。
但是,PRV的治疗目前仍是世界性难题。在世界养猪业发达国家,通过疫苗免疫接种、母猪野毒感染监测和净化,使该病得到了有效控制。而我国,尽管免疫接种受到高度重视并广泛实施,但由于免疫接种时机、持续监测手段、设施布局及饲养管理水平等原因,PRV时有发生甚至暴发,特别是自2011年以来,PRV在全国规模化猪场再次大面积暴发,由此引起的仔猪高死亡率给养猪业带来了严重的经济损失[7]。可见,有效的PRV治疗手段仍是我国养猪业面临的巨大挑战。
业已证实,中和抗体是PRV感染动物治疗的特效药物。国外已有中和抗体的制备及研究报道[8],国内学者针对PRV及其不同分子的抗体研究也开展了大量工作,如相继得到针对PRV的gB、gE、gD等分子的单克隆抗体,被证实可能用于病毒检测[9];孟日增等利用超浓缩PRV通过免疫家兔制备的高效价多抗,被证实对病毒具有中和作用,且中和效价约为1∶16[10]。
但影响抗血清制备的因素很多,因而难以保证批次间的中和效果。我们以当前应用最广的疫苗用PRV弱毒株Bartha-k61免疫小鼠,制备单克隆抗体,期望获得广谱的PRV中和抗体,为PRV防控提供新途径。
1 材料与方法
1.1 材料
BALB/c小鼠为军事医学科学院实验动物中心生产;SP2/0细胞、BHK-21细胞、单纯性疱疹病毒(herpes simplex virus,HSV)HSV-1和HSV-2为本室保存;PRV Bartha-k61株由北京市农林科学院李永清教授惠赠;PRV强毒株AV25购于中国兽药监测所;HAT培养基、HT、PEG、弗氏完全佐剂、弗氏不完全佐剂等购于Sigma公司;RPMI-1640、DMEM/F12(1∶1,简称 DF)培养基,胎牛血清,青霉素,链霉素等购于Gibco公司;高结合能力酶标板购于Nunc公司;羊抗鼠IgG标记抗体购于康为生物试剂公司;TMB单组分显色液购于湖州英创生物技术公司。
1.2 PRV的制备
将Bartha-k61接种于BHK-21细胞,待细胞完全病变后,将其冻融3次,高速离心(12 000r/min)收集细胞上清,然后超高速离心(11 000×g)浓缩病毒,最后通过蔗糖密度梯度离心进一步纯化病毒。
1.3 小鼠免疫
将弗氏完全佐剂与Bartha-k61充分混合均匀并形成油乳剂,分点皮下注射于3只3~4周龄BALB/c小鼠(100μL/只);2周后,用相同剂量的病毒与弗氏不完全佐剂混匀进行加强免疫,加强免疫共2次;最后一次加强免疫7d后,采鼠尾血检测血清抗体效价;选择效价≥1∶12 000(ELISA)的小鼠直接腹腔注射同等剂量的病毒,3d后无菌取小鼠脾脏,用于细胞融合。
1.4 细胞融合
无菌条件下取小鼠脾脏并去脂,用无菌生理盐水和RPMI-1640分别洗涤;将脾脏放入灭菌的200目滤网,用注射器芯挤压释放其中的脾淋巴细胞;加入5mL RPMI-1640洗涤滤网,过滤后的脾细胞用巴斯吸管轻轻吹打,加入30mL RPMI-1640,1200r/min离心;收集培养好的SP2/0细胞,用RPMI-1640培养基1200r/min离心洗涤1次;将2种细胞(比例为1∶3~1∶6)混合,加入RPMI-1640到30mL,1200r/min离心6min洗涤2次,弃上清;在台面上轻轻敲打细胞沉淀使其混匀;采用滴加方式缓慢加入1mL PEG(边加边混匀),最后在约5min内轻缓加入预热的RPMI-1640培养基29mL;800r/min离心6min,弃上清;加入含20%FBS的RPMI-1640培养基约50mL,用巴斯吸管轻轻吹打混匀,制备铺板。
铺板前2d无菌收集小鼠腹腔细胞,制备滋养层细胞;将融合处理的细胞加入滋养层细胞中,每孔 100μL;第 2d加 5×HAT 培养基 50μL(用含20%FBS的RPMI-1640配制),继续培养2~3d;采用半换量加入HT/HAT(1∶1)培养基(用含20%FBS的 RPMI-1640配制,0.5×HAT和 0.5×HT);2~3周后,用含 20%FBS和 1×HT的 RPMI-1640培养基换液,直到杂交瘤细胞长出;待杂交瘤细胞铺满孔的一半及以上时,取上清用于ELI⁃SA检测。
1.5 杂交瘤细胞检测
超浓缩的Bartha-k61用碳酸盐缓冲液(CBS,pH9.6)稀释至 1/100并包被,每孔 100μL,4℃过夜;酶标板用含0.5%BSA、0.2%水解酪蛋白的PBS封闭1h;加杂交瘤细胞培养上清100μL,37℃孵育40min,PBST洗涤3次,5min/次;加入1∶5000稀释的HRP山羊抗小鼠IgG(以含0.5%BSA 的 PBST稀释)每孔 100μL,37℃孵育 35min,PBST 洗涤 3次,5min/次;加入单组分 TMB液100μL,37℃避光15min;最后加入终止液(2 mol/L H2SO4)50μL,在测量波长为 450nm、参比波长为620nm下测定D值,D值大于3倍阴性对照平均值为阈值,筛选阳性杂交瘤细胞。
1.6 杂交瘤细胞单克隆化
根据ELISA检测结果,取D值最高的24个孔中的杂交瘤细胞转入24孔板中继续培养,待细胞铺满一半以上时继续进行ELSIA检测。对D值高的细胞进行无限稀释,接种于96孔板,待单克隆长出后检测。对来源于最初孔的细胞,每个挑选1个单克隆且D值高的细胞通过24孔板、6孔板和25mL培养瓶逐级放大培养,用于生产腹水。
1.7 杂交瘤细胞腹水制备
给6~8周龄以上的BALB/c雌性小鼠腹腔注射灭菌石蜡油0.5mL/只,12~15d后腹腔接种杂交瘤细胞 1×106~2×106/只,收集腹水。
1.8 单克隆抗体的中和作用测定
对腹水进行总蛋白测定,用PBS调整蛋白浓度为2.5 mg/mL;用含3%FBS及PRV为100倍TCID50的DMEM/F12培养基对其进行系列稀释,37℃孵育1h;将处理好的病毒-抗体液加入BHK-21细胞铺板的96孔板,每个稀释度4个复孔,每24h观察记录细胞病变。以抗犬细小病毒(canine parvoviurs,CPV)杂交瘤细胞生产的单克隆抗体(腹水)为对照。
1.9 单克隆抗体的交叉反应性
用前述病毒制备方法获得的HSV-1和HSV-2浓缩液,以及实验室前期纯化的猴B病毒(B vi⁃rus,BV)gD重组蛋白包板,对8株单克隆抗体进行ELISA检测(方法同前),了解PRV单克隆抗体与同源病毒(或分子)的交叉反应性。
2 结果
2.1 PRV杂交瘤细胞制备及单克隆化
将PRV免疫小鼠脾脏淋巴细胞与SP2/0细胞融合后,接种于5块96孔细胞培养板,经筛选培养,共有136个孔长出了杂交瘤细胞;ELISA结果显示,87个孔中的细胞上清都与PRV有明显的抗原-抗体反应,但各孔的D值存在明显差异,说明其中的抗体量不同。
根据细胞密度及ELISA所测D值,实验选取了24个高抗体分泌量的细胞进行单克隆化。即先将其转入24孔板培养,同时对上清进行检测,其后将稳定分泌抗体的细胞通过有限稀释法接种于96孔板,进行单克隆化。最后,从最初来源的各个孔中,每种细胞挑选1个单克隆化且稳定分泌抗体的杂交瘤细胞株。根据细胞状态、生长速度、ELISA检测D值的稳定性,最终获得了11株稳定分泌抗体的杂交瘤细胞株。
2.2 腹水制备及测定
将挑选的11株杂交瘤细胞由24孔板、6孔板和25mL培养瓶逐级放大培养,收集细胞,用RP⁃MI-1640基础培养基调整细胞密度为5×106~8×106/mL,腹腔接种于注射石蜡油的BALB/c雌性小鼠,每只0.2mL,收集腹水(在细胞注射后12~18d产生),测定腹水体积,用NanoDrop2000测定总蛋白浓度,ELISA测定效价,结果见表1,不同杂交瘤细胞的腹水平均产量、蛋白浓度及ELISA效价不同。
2.3 单克隆抗体对PRV的中和作用
将11株杂交瘤细胞生产的腹水分别用含3%牛血清的DMEM/F12(1∶1)培养基进行梯度稀释,并加入终浓度为100倍TCID50的Bartha-k61弱毒或AV25强毒,于37℃作用1h,接种于BHK-21细胞,每个稀释度接种4孔,同时以CPV单克隆抗体(腹水)为对照。结果,2种病毒株在CPV抗体组和不加抗体的阳性对照组于接种后24h即可见零星的细胞病变;48h,所有孔的细胞都出现病变,但CPV组的1/2稀释孔细胞病变较轻;72或96h,即使CPV组的1/2稀释孔细胞50%以上都出现病变,其他稀释组和阳性对照所有孔中80%以上细胞发生病变(图2A、C)。而PRV单克隆抗体组的细胞病变与单克隆株及稀释率有关,其中单克隆抗体株5C9接毒后96h,在1/2、1/4、1/8稀释度无细胞病变,1/16稀释度有1孔出现病变,1/32稀释度有2孔出现细胞病变,但细胞病变程度较轻,仅见小病变灶,周围细胞正常(图2D、E);1/64稀释度的4个孔全部出现病变。3C9株的1/2、1/4稀释度无细胞病变,1/8稀释度及以上全部孔病变。其余单克隆株接毒96h,仅在1/2稀释度有部分孔未出现病变,Bartha-k61弱毒株和AV25强毒株的病变情况基本一致。该结果表明,单克隆抗体株5C9对PRV有较好的中和作用,其中和效价为1∶16~1∶32,而3C9株的中和作用较弱,效价为1∶4。

表1 PRV单克隆抗体(腹水)的特征
2.4 PRV单克隆抗体的交叉反应性

图1 获得的单克隆化杂交瘤细胞株

图2 PRV单克隆抗体对病毒的中和作用
分别用HSV-1、HSV-2和BV gD重组蛋白包被板,对11株单克隆抗体进行ELISA检测。结果,单克隆抗体1A5株与gD存在明显的免疫反应,其D值为0.836,而单克隆抗体2D8和4B8能同时与HSV-1和HSV-2反应。
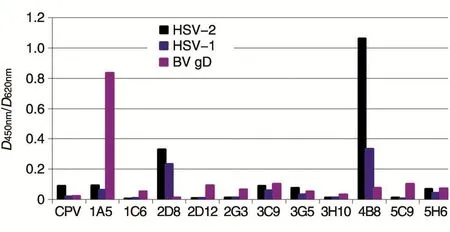
图3 PRV单克隆抗体(腹水)与其他同源病毒及分子的交叉反应
3 讨论
PRV是疱疹病毒科α疱疹病毒属成员,与该科其他病毒一样,PRV具有嗜神经性,动物一旦感染,病毒可在神经节中长期潜伏,感染动物因此终生可能成为潜在的疫源。可见,动物种群净化是疾病防控的根本[7,11]。
在西方养殖业发达国家,由于该病发现早、相关研究较为深入、检测和监测及净化措施到位、免疫接种合理,PRV的防控较为有效,猪群流行或暴发PRV较少发生。但是,在诸如我国等养殖业不发达国家,由于检测和监测手段不力、种群净化工作滞后,PRV在猪场时有发生甚至暴发,并造成巨大的经济损失。PRV因此在我国与猪瘟病毒、猪繁殖与呼吸综合征病毒、圆环病毒、口蹄疫病毒等并称为养猪业的重要病原。
鉴于PRV的严重危害,近年来国内学者对PRV的研究非常重视,并在疫苗研发及诊断方法等研究上取得了良好进展[2,4,12]。但由于毒株变异及种群净化缓慢等原因,对发病猪的控制,特别是发病仔猪的死亡仍然束手无策[13-14]。本实验以当前广泛使用的PRV疫苗毒株Bartha-k61为免疫原,通过细胞融合和多次ELISA筛选,获得了11株稳定生产抗体的单克隆细胞株。对11株单抗的基本特征分析发现,不同细胞株的腹水产量及腹水的蛋白含量存在较大差异,如3C9株的产量平均为4.2mL/只,而1C6株仅为0.9mL/只;就蛋白浓度而言,5H6为37.9 mg/mL,而2D8仅为19.9 mg/mL。表明杂交瘤细胞的差异性不仅影响抗体性质,而且对抗体生产同样起着决定作用。
最有意义的是,对11株单抗的中和作用评价显示,2株单抗对PRV都有中和作用,且对PRV弱毒株(Bartha-k61)和强毒株(AV25)中和效价一致。表明该抗体作用部位既是参与病毒感染的重要功能区,也是相对保守的区域。其中,5C9的中和效价接近1∶32,而3C9的中和效价只有1∶4。就作者所掌握的文献资料而言,Wathen早在1985年即报道了PRV的中和性单抗制备[8],但不清楚单抗的中和效价。国内学者虽然有较多关于PRV及其分子的单抗制备研究,但未见中和性单抗成功制备的报道。孟日增等以超浓缩(超高速离心)PRV闽A株免疫家兔,制备了高ELISA效价(1∶32 000)的抗血清,且对病毒具有中和作用,其中和效价为1∶16[10],略低于本实验所得到的5C9单抗细胞株。而其他作者报道,利用分离得到的PRV野毒或病毒的重组蛋白免疫动物,抗血清的中和效价最高接近1∶1000[15-16]。明显高于本实验的单克隆抗体及孟日增的结果。我们推测,中和效价的巨大差异可能不仅与抗血清本身有关,还可能与评价过程中使用的细胞系及病毒有关。但高效价抗血清制备过程繁琐,且容易受免疫程序中多个环节的影响。而本实验筛选得到的中和单抗细胞株,在中和抗体制备上具有明显的比较优势。
业已证实,α疱疹病毒属成员在病毒结构、感染机制、病毒受体等方面高度相似[17-19]。本实验进一步将获得的11株PRV单抗分别与HSV-1、HSV-2和重组猴B病毒gD蛋白进行ELISA检测,发现2株单抗(2D8和4B8)同时与HSV-1和HSV-2存在交叉反应,而1株单抗(1A5)与gD存在明显交叉反应。理论上,这些单抗所针对的表位在不同病毒中高度保守,而进化论认为,在物种进化过程中,保守部位通常是重要的功能区。但这些具有交叉作用的抗体对PRV都未表现中和活性。上述特征是否是病毒逃避免疫监视的机制之一[20-21],尚不清楚。
总之,我们成功制备了PRV的多株单克隆抗体,并筛选到对病毒具有较高中和作用的单抗,为PRV的防控奠定了坚实基础。
[1] Smith G.Herpesvirus transport to the nervous system and back again[J].Annu Rev Microbiol,2012,66:153-176.
[2] Dong B,Zarlenga D S,Ren X.et al.An overview of live attenuated recombinant pseudorabies viruses for use as novel vaccines[J].J Immunol Res,2014,2014:824630.
[3] Owen D J,Crump C M,Graham S C.Tegument as⁃sembly and secondary envelopment of alphaherpesvirus⁃es[J].Viruses,2015,7(9):5084-5114.
[4] Li X,Sun Y,Yang S,et al.Development of an immu⁃nochromatographic strip for antibody detection of pseu⁃dorabies virus in swine[J].J Vet Diagn Invest,2015,27(6):739-742.
[5] Meng X Y,Luo Y,Liu Y,et al.A triplex real-time PCR for differential detection of classical,variant and Bartha-k61 vaccine strains of pseudorabies virus[J].Arch Virol,2016,161(9):2425-2430.
[6] Serena M S,Geisler C,Metz G E,et al.Expression and purification of suid herpesvirus-1 glycoprotein E in the baculovirussystem and itsuse to diagnose Aujeszky's disease in infected pigs[J].Protein Expr Pu⁃rif,2013,90(1):1-8.
[7]Sun Y,Luo Y,Wang C H,etal.Controlof swine pseudorabies in China:opportunities and limita⁃tions[J].Vet Microbiol,2016,183:119-124.
[8] Wathen L M,Platt K B,Wathen M W,et al.Produc⁃tion and chraracterization of monoclonal antibodies di⁃rected against pseudorabies virus[J].Virus Res,1985,4(1):19-29.
[9] 孙海凤,顾真庆,董静,等.伪狂犬病病毒gB和gE蛋白单克隆抗体的制备与鉴定[J].中国兽医科学,2015,45(3):247-252.
[10]孟日增,刘韬,马文,等.猪伪狂犬病病毒多克隆抗体的制备及免疫学活性研究[J].中国畜牧兽医,2015,42(6):1417-1423.
[11]LipowskiA. Evaluation ofefficacy and safety of Aujeszky's disease vaccines[J].Pol J Vet Sci,2006,9(1):75-79.
[12]Wang C H,Yuan J,Qin H Y,et al.A novel gE-de⁃leted pseudorabies virus(PRV)provides rapid and com⁃plete protection from lethal challenge with the PRV variant emerging in Bartha-k61-vaccinated swine popu⁃lation in China[J].Vaccine,2014,32(27):3379-3385.
[13]黄元,陈晶,赵翠玲,等.伪狂犬病病毒变异株的鉴定及伪狂犬病的防控[J].中国畜牧兽医,2016,43(9):2461-2467.
[14]童武,郑浩,单同领,等.伪狂犬病毒变异株(JS-2012)对仔猪的致病性研究[J].中国动物传染病学报,2014,5:10-14.
[15]彭金美,安同庆,赵鸿远,等.猪伪狂犬病病毒新流行株的分离鉴定及抗原差异性分析[J].中国预防兽医学报,2013,35(1):1-4.
[16]刘飞,童武,梁超,等.猪伪狂犬病毒gB、gC和gD蛋白多抗制备及交叉中和抗体效价测定[J].中国预防兽医学报,2016,38(1):73-76.
[17]Abad C L,Razonable R R.α-Herpes virus infections among renaltransplantrecipients[J].Semin Nephrol,2016,36(5):344-350.
[18]James S H,Prichard M N.Current and future thera⁃piesfor herpes simplex virus infections:mechanism of action and drug resistance[J].Curr Opin Virol,2014,8:54-61.
[19]KramerT,EnquistL W.Alphaherpesvirus infection disrupts mitochondrialtransport in neurons[J].Cell Host Microbe,2012,11(5):504-514.
[20]Horst D,Verweij M C,Davison A J,et al.Viral eva⁃sion of T cell immunity:ancient mechanisms offering new applications[J].CurrOpin Immunol,2011,23(1):96-103.
[21]Le-Trilling V T,Trilling M.Attack,parry and riposte:molecular fencing between the innate immune system and humanherpesviruses[J].Tissue Antigens,2015,86(1):1-13.
Preparation and CharacterizationofMonoclonalAntibody Against Pseudorabies Virus
YE Hua-Hu1,CHEN Jian-Yu1,2,ZHOU Xiao-Jun1,WANG Jin1,DAI Yan-Yan1,HAN Yu1,LIU Heng1,YUAN Ju-Fang1*
1.Laboratory Animal Center,Academy of Military Medical Sciences,Beijing 100071;2.College of Life Sciences,Inner Mongolia University,Hohhot 010021;China
*Corresponding author,E-mail:yjf1014@tom.com
Objective:In order to control the harm of pseudorabies virus(PRV),monoclonal antibodies against PRV were produced and analyzed.Methods:Mice were immunized with PRV Bartha-k61 strain and then its spleen B lymphocytes were separated and fused with SP2/0 cells.The positive hybridoma cells were screened out by enzyme-linked immunosorbent assay(ELISA) and used to produce ascites.The neutralizing effect of monoclonal antibodies on PRV were detected by virus neutralization experiment.Results:A total of 11 hybridoma cells lines were obtained after the treatment of cell fusion and screening.The results of virus neutralization test showed that the ascites produced by two hybridoma cell lines blocked BHK-21 cells infection by PRV attenuated strain Bar⁃tha-k61 and virulent strain AV25.However,the ability of neutralization effect was different between the two mono⁃clonal antibodies.For monoclonal antibodies 5C9,the neutralization titer was 1∶16~1∶32 and only 1∶4 was in monoclonal antibodies 3C9.In addition,among the 11 monoclonal antibodies,2 showed obvious immunoreactionwith herpes simplex virus type 1 and type 2,and 1 showed a significant cross-reactivity with recombinant gD pro⁃tein of monkey B virus.Conclusion:Monoclonal antibodies against PRV were successfully prepared and the mono⁃clonal antibodies with neutralization effect was screened out.In addition,we found that some monoclonal antibod⁃ies could cross-react with other herpes viruses.
pseudorabies virus;monoclonal antibodies;neutralization effect;cross-reactivity
Q78;R392.1
A
1009-0002(2017)04-0441-06
2017-01-03
国家科技支撑计划(2015BAI08B03);国家自然科学基金(31272514,31501908)
叶华虎(1970- ),男,博士,(E-mail)huahuy512@126.com
袁菊芳,(E-mail)yjf1014@tom.com
10.3969/j.issn.1009-0002.2017.04.007
