B型肉毒毒素重组Hc亚单位疫苗的免疫原性研究
2017-11-06陈博阳周果师丹阳周晓巍余云舟
陈博阳,周果,师丹阳,周晓巍,余云舟
军事医学科学院 生物工程研究所,北京 100071
B型肉毒毒素重组Hc亚单位疫苗的免疫原性研究
陈博阳,周果,师丹阳,周晓巍,余云舟
军事医学科学院 生物工程研究所,北京 100071
目的:用大肠杆菌表达重组B型肉毒毒素受体结合区Hc抗原(BHc)作为亚单位疫苗,并研究其免疫原性。方法:构建pTIG-Trx-BHc原核表达载体,用大肠杆菌表达并纯化重组BHc抗原;免疫BALB/c小鼠以研究它的免疫原性。结果:大肠杆菌表达并纯化获得了重组BHc抗原,免疫小鼠后能刺激机体产生高效价的抗BHc抗体和保护性免疫反应。该重组BHc亚单位疫苗1μg剂量2次免疫小鼠即可产生对104LD50剂量B型肉毒毒素攻毒的完全保护,血清中和效价可达1.33 IU/mL。结论:大肠杆菌表达的重组BHc抗原具有良好的免疫原性,能够有效地保护小鼠抵抗B型肉毒毒素的攻击,该BHc抗原能够作为亚单位候选疫苗预防B型肉毒毒素中毒。
B型肉毒毒素;重链受体结合区C端片段(Hc);重组亚单位疫苗;免疫原性
肉毒毒素(botulinum neurotoxins,BoNT),又被称为肉毒神经毒素,是由厌氧的革兰阳性菌肉毒梭菌(Clostridium botulinum)产生的毒素蛋白,是已知毒性最强的蛋白质,按血清型分为A~G共7个亚型,其中A、B、E和F型可以导致人类肉毒中毒[1-3]。各亚型肉毒毒素都是具有类似结构的蛋白质,如具有内肽酶活性,相对分子质量(Mr)约150 000,由一条重链(HC,Mr约 100 000)和一条轻链(LC,Mr约50 000)通过二硫键相连[4-5]。对肉毒毒素晶体结构的分析表明,重链包含一个细胞受体结合域(HC,负责结合细胞表面的受体)和一个跨膜转运结构域(HN,负责将毒素转运到神经细胞内);轻链能够靶向到可溶性N-乙基马来酰亚胺敏感因子附着蛋白受体(soluble N-ethyl⁃maleimide sensitive factorattachmentprotein re⁃ceptor,SNARE),LC将SNARE切割会抑制神经递质小泡传递,从而抑制神经递质进行信号传导,导致肌肉松弛性麻痹[6-8]。
疫苗是预防肉毒毒素中毒最好的方法,早期的肉毒毒素疫苗研究主要集中在类毒素疫苗,然而后期的研究与应用发现类毒素疫苗在免疫原性、安全性、免疫后副作用等方面存在较大的问题,导致类毒素疫苗一直未能得到广泛使用。破伤风毒素(tetanus neurotoxin,TeNT)和肉毒毒素具有很多相似的结构,因此,研究人员借助于破伤风毒素Hc(重链受体结合区C端片段,C-termi⁃nal fragment of heavy-chain receptor)片段亚单位疫苗研究成功的策略来研制肉毒毒素亚单位疫苗[7]。肉毒毒素的Hc片段能介导毒素特异性结合到神经肌肉接点处的神经末梢,此外,Hc片段不存在锌肽链内切酶活性,没有毒性,免疫动物后能刺激产生保护性免疫反应[9-11]。基于这一重要发现,人们开始研究更为安全的Hc片段作为新一代的肉毒毒素疫苗[12]。
肉毒毒素Hc片段能够刺激机体产生很强的保护性免疫反应,其作为新型亚单位疫苗非常具有研究价值及应用前景。Holley等[13]用大肠杆菌表达的F型肉毒毒素Hc片段免疫小鼠,证明能够产生保护性免疫反应,并且能维持长期保护作用,疫苗接种10个月后对104LD50的BoNT/F仍具有保护作用。Liu等[14]利用酵母表达纯化制备了B型肉毒毒素受体结合区Hc,免疫动物证明其具有良好的免疫原性,能够刺激机体产生有效的保护性免疫反应。此外,本实验室也利用大肠杆菌表达系统高效表达了A、E和F型肉毒毒素受体结合区Hc,并且得到纯度很高的蛋白,免疫小鼠后能够产生十分强大的保护性免疫反应[15-16]。以上研究结果表明大肠杆菌表达系统可以实现各型肉毒毒素受体结合区Hc片段的高效表达,使得以大肠杆菌表达的重组Hc片段作为新型肉毒毒素亚单位疫苗成为可能。在本研究中,我们利用大肠杆菌BL21(DE3)菌株实现了B型肉毒毒素受体结合区Hc片段的可溶性表达,并且得到了纯度较高的重组BHc片段蛋白,通过免疫小鼠,初步评价了该原核表达的BHc的免疫原性和保护效果,为进一步研究肉毒毒素亚单位疫苗和研制多价肉毒毒素疫苗奠定了基础。
1 材料和方法
1.1 材料
BALB/c和KM小鼠(SPF级)购自军事医学科学院实验动物中心;pABE293-BHc载体(含B型肉毒毒素受体结合区Hc片段基因)和pTIG-Trx原核表达载体由本实验室保存;大肠杆菌Top10感受态细胞和DNA纯化回收试剂盒购自天根生化科技(北京)有限公司;大肠杆菌BL21(DE3)感受态细胞购自北京全式金生物技术有限公司;限制性内切酶购自NEB公司;DNA聚合酶Prime STAR和T4DNA连接酶购自TaKaRa公司;质粒小提试剂盒购自OMEGA公司;羊抗鼠IgG-HRP购自北京中杉金桥生物技术有限公司;羊抗鼠IgG1/IgG2a/IgG2b/IgG3/IgM-HRP购自Santa Cruz公司;IPTG购自Promega公司;Western印迹显色试剂盒购自Thermo公司;96孔酶联板购自Coring公司;引物合成、基因测序由上海生工生物工程股份有限公司完成;其他试剂均为国产分析纯产品。
1.2 原核表达载体的构建
以pABE293-BHc载体为模板,PCR扩增得到BHc基因片段,扩增时在片段两端分别加入BamHⅠ和XhoⅠ酶切位点,琼脂糖凝胶电泳后纯化回收目的DNA片段。将BHc基因片段和pTIG-Trx载体双酶切,琼脂糖电泳后用DNA纯化回收试剂盒纯化回收,回收产物经T4DNA连接酶于4℃连接过夜,然后转化大肠杆菌Top10,次日挑取单克隆菌落培养并抽提质粒酶切鉴定,选取阳性克隆测序验证。
1.3 重组BHc片段的表达和纯化
首先将测序验证序列正确的质粒转化(42℃,45s)大肠杆菌表达菌株 BL21(DE3),挑取单克隆于 5mL 2×YT培养基(含 100μg/mL氨苄西林)中,37℃摇床(220r/min)培养至菌液D600nm为0.6~1.0,按 1%的比例转接至 400mL 2×YT培养基(含100μg/mL氨苄西林)中,37℃摇床(220r/min)培养至菌液 D600nm为 0.6~1.0,加入0.2mmol/L IPTG诱导表达(30℃表达4~5h),8000r/min离心30min收集菌体沉淀,用20mmol/L的PB缓冲液(pH8.0)重悬菌体,用超声细胞粉碎仪对菌悬液在冰水浴条件下进行超声波破碎,超声完全后10000r/min离心20min,收集上清用0.45μm的滤膜过滤,过滤后的上清和HisTrap HP蛋白纯化柱(GE公司)结合,之后用A液(20mmol/L PB缓冲液,pH8.0)平衡,然后用不同浓度的B液(20mmol/L PB缓冲液,500mmol/L咪唑,pH8.0)洗脱并收集蛋白,SDS-PAGE检测纯化结果。
1.4 Western印迹检测目的蛋白
纯化后的目的蛋白经SDS-PAGE初步鉴定后,用Western印迹进一步鉴定。目的蛋白电泳结束后,按照下层滤纸、PVDF膜、胶、上层滤纸的顺序依次置于转膜仪上,将目的蛋白转移至PVDF膜(600 mA,25min),用5%脱脂牛奶室温封闭2h,一抗(抗BHc血清抗体)1∶1000稀释室温孵育 2h,TBS-T(8.0g/L NaCl,0.2g/L KCl,3.0g/L Tris,0.1%Tween-20,pH7.4)洗膜,二抗(羊抗鼠IgG-HRP)1∶5000稀释室温孵育30min,TBS-T洗膜,用Western印迹显色液在成像仪中曝光显影。
1.5 重组亚单位疫苗免疫动物
6~8周龄的SPF级雌性BALB/c小鼠随机分成3组,即 10μg组、1μg组和阴性对照组,每组 10只。将重组BHc亚单位疫苗用无菌PBS分别稀释至100和10μg/mL,并在配制疫苗时加入1/10体积的铝佐剂(10 mg/mL),采用肌内注射方式,注射体积100μL。免疫2周后剪尾采血,分离血清用于抗体免疫反应检测,之后进行加强免疫,免疫方案不变。
1.6 重组亚单位疫苗免疫后抗体水平、滴度和亚型测定
用原核表达的BHc抗原包被96孔酶联板,碳酸盐包被缓冲液稀释抗原使其浓度为2μg/mL,每孔加入100μL,4℃过夜;用 0.01mmol/L 的PBS-T(8.0g/L NaCl,0.2g/L KCl,1.44g/L 无水Na2HPO4,0.24 g/L KH2PO4,0.05% Tween-20,pH7.4)洗板6次;每孔加入200μL 2%的BSA封闭液在37℃恒温箱中孵育2h;每孔加入100μL 1∶100稀释的小鼠血清(测定抗体滴度和亚型的血清先1∶100稀释,然后1/4梯度稀释),37℃恒温箱中孵育2h;用PBS-T洗板6次,加入1∶2000稀释的羊抗鼠IgG-HRP(或羊抗鼠IgG1/IgG2a/IgG2b/IgG3/IgM-HRP),37℃恒温箱中孵育30min;用PBS-T洗板6次,加入新配制的ELISA显色液(240mmol/L柠檬酸,50mmol/L Na2HPO4,0.4 mg/mL OPD,0.1%的 H2O2)50μL/孔,避光显色 10min左右;加入终止液(2 mol/L H2SO4)50μL/孔终止显色,用酶标仪读取D492nm/D630nm值。终末稀释ELISA法计算小鼠血清中能特异性和BHc结合的抗体滴度,以D492nm≥0.3为阳性结果,免疫组小鼠血清抗体水平以单个血清样品的平均值来表示。
1.7 免疫后小鼠血清中和活性和中和效价测定
将毒素稀释至100 LD50/mL,每管加入1mL(每组5管),然后再依次加入不同剂量的2次免疫后的小鼠血清,最后用稀释液补齐至终体积为2.5mL,将毒素和抗体混合均匀,于37℃温箱中孵育15min,使毒素和抗体充分反应,然后对KM小鼠进行腹腔注射,每组4只小鼠,每只注射500μL,注射12h后观察小鼠存活情况,每隔24h观察一次,共观察1周。
1.8 B型肉毒毒素保护性试验
对2次免疫2周后的小鼠分别用103和104LD50的B型肉毒毒素攻击。将毒素稀释到2×103LD50/mL或2×104LD50/mL浓度,然后每只小鼠注射500μL,攻毒12h后观察小鼠存活情况,每隔24h观察一次,共观察1周,计算最终的小鼠存活率。
1.9 统计学分析
用SPSS 17.0统计学软件处理实验数据,实验结果以x±s表示,以单因素方差进行统计分析,P<0.05认为有统计学差异,对于配对实验采用Stu⁃dent-t检验进行统计分析。
2 结果
2.1 pTIG-Trx-BHc表达载体的构建
利用PCR从pABE293-BHc载体上扩增全长的BHc基因(1317bp),并在两端加入多克隆位点BamHⅠ和XhoⅠ。构建完成后提取质粒进行酶切鉴定(图1),对鉴定正确的载体测序验证,结果证实构建的抗原序列与预期一致。
2.2 重组BHc片段在大肠杆菌的表达与纯化
将pTIG-Trx-BHc表达载体转化原核表达菌株BL21(DE3),经IPTG诱导表达后用超声波细胞粉碎仪对菌体沉淀进行破碎,然后离心取上清进行SDS-PAGE检测蛋白表达,结果如图2,表达的目的蛋白BHc主要以可溶性方式存在于破菌上清中,Mr约为50 000,而空载体的破菌上清在同样位置未出现表达条带,说明诱导表达的产物为特异性表达。用HisTrap HP蛋白纯化柱对重组BHc蛋白进行纯化,经SDS-PAGE检测(图2),纯化到的目的蛋白大小正确,纯度达电泳级。West⁃ern印迹检测(图2)证实该重组BHc能特异性和抗BHc血清抗体结合,具有特异的结合活性。
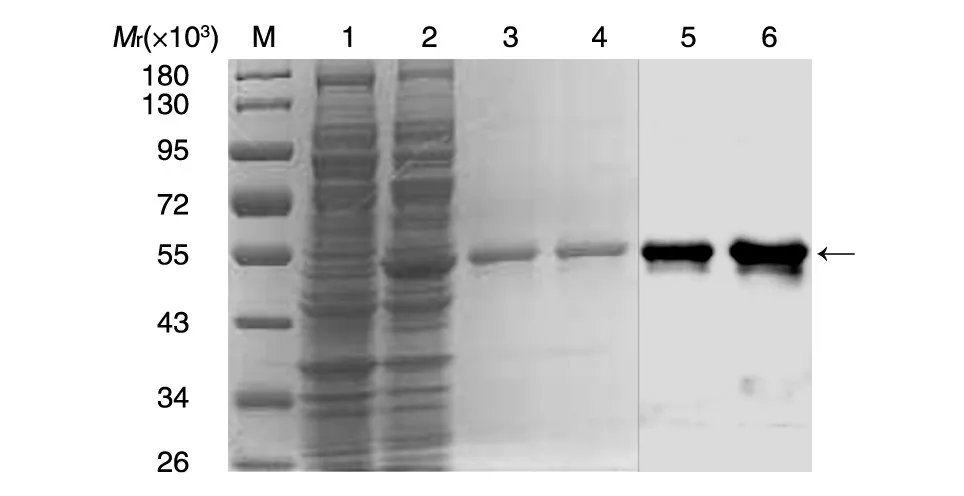
图2 目的蛋白表达后的SDS-PAGE和Western印迹鉴定图
2.3 重组亚单位疫苗免疫小鼠后体液免疫反应的测定
通过ELISA测定小鼠免疫后的体液免疫反应,结果如图3。虽然2组小鼠在初次免疫后产生的抗体水平都相对不高,且无明显差异(P>0.05),但加强免疫后抗体水平迅速增强,10μg组和1μg组的抗体水平相对于初次免疫有很明显的提高,抗体水平差异明显(P<0.001);此外,10μg组加强免疫后的抗体水平相对于1μg组也具有较大的差异(P<0.05)。抗体滴度测定结果表明(图4),初次免疫后10μg组和1μg组的血清抗体滴度均较低,加强免疫后抗体滴度明显增强,平均抗体滴度分别为1∶110 000和1∶80 000,最高抗体滴度可达1∶150 000左右,相对于初次免疫明显增强(P<0.001),而且免疫10μg组的抗体滴度相对于免疫1μg组也有较大的增强(P<0.05)。这些结果初步表明该原核表达的抗原BHc具有良好的免疫原性,作为亚单位疫苗免疫能刺激小鼠免疫系统产生特异性的免疫反应,并且在加强免疫后抗体滴度达到很高的水平,而这种特异性抗体的产生在对B型肉毒毒素的保护过程中起着至关重要的作用。
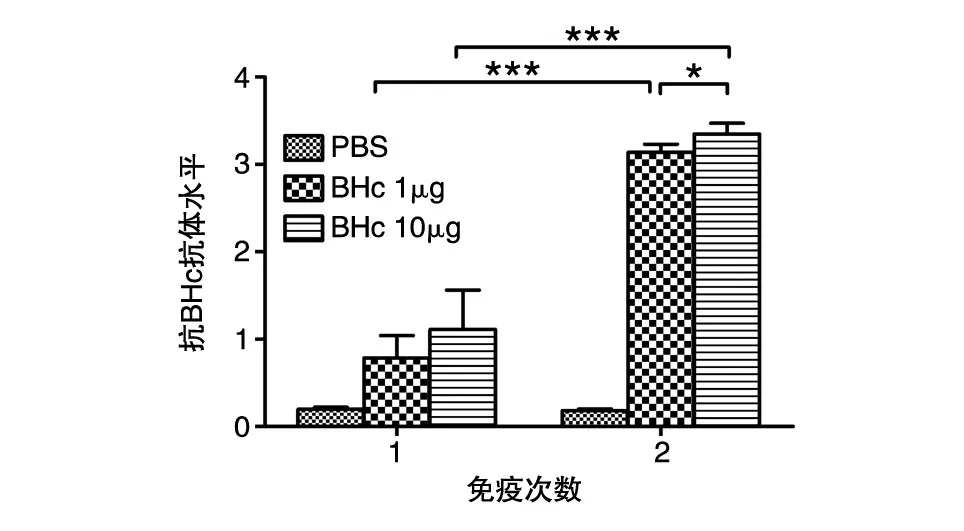
图3 重组亚单位疫苗免疫小鼠后产生特异性抗体水平
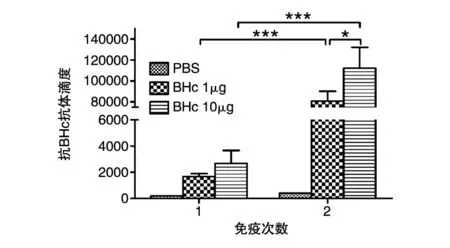
图4 重组亚单位疫苗免疫小鼠后的抗体滴度
对免疫后小鼠产生的抗体亚类的测定结果表明(图5),小鼠产生的特异性抗体主要为IgG1,同时也有较多的IgG2b,IgG2a的数量极少,IgG1/IgG2a的比值可达20,证明疫苗免疫后产生的抗体主要来源于Th2型免疫应答途径。
2.4 小鼠血清的中和抗体活性和中和效价检测
小鼠血清中和抗体测定结果表明10μg组和1μg组血清均可对小鼠产生保护作用,而阴性对照组小鼠无一幸存,证明该重组亚单位疫苗免疫小鼠后产生的抗体具有较强的中和活性,能够中和B型肉毒毒素的毒性。通过对中和实验的结果估算,10μg组和1μg组小鼠血清的中和效价分别为3.33和1.33 IU/mL(表1)。
2.5 重组亚单位疫苗免疫小鼠后对BoNT/B的保护作用
用B型肉毒毒素对2次免疫后的小鼠进行103LD50剂量攻击,结果表明(表1)10μg和1μg剂量免疫后均能够完全保护,提高攻毒剂量至104LD50后仍能够完全保护。这些结果表明该原核表达纯化的重组BHc亚单位疫苗具有良好的免疫原性和保护效果,可以作为候选疫苗进行更深层次的研究,尤其是为多价肉毒毒素疫苗的研制奠定了基础。
3 讨论
肉毒毒素受体结合区Hc片段能特异性结合到神经肌肉接点处的神经末梢细胞膜上,然后在HN片段的作用下将毒素转运到胞内发挥作用。此外,Hc片段不存在锌肽链内切酶活性,没有毒性,免疫动物后能刺激产生保护性免疫反应[9-11]。基于这些研究背景,以肉毒毒素受体结合区Hc为靶标研制新型肉毒毒素亚单位疫苗,成为肉毒毒素疫苗研制的新方向。因此,科研人员开始研究用大肠杆菌或酵母表达肉毒毒素受体结合区Hc片段。虽然利用酵母表达系统提高了可溶性蛋白的表达量,并且分泌性表达可降低纯化难度,但原核表达系统相对于酵母表达系统具有一定的优势,如表达工艺简单、成本低廉。最重要的还有免疫原性的差异,酵母属于真核生物,能够对翻译后的抗原进行糖基化修饰,糖基化抗原的免疫原性会降低;而大肠杆菌表达产物则不存在糖基化修饰,且其表达产物和肉毒梭菌一致,同为原核表达产物,可能更接近天然的表达产物的构象[14,17-18]。因此,为了获得更为有效的B型肉毒毒素亚单位疫苗,我们更倾向于对大肠杆菌表达的重组BHc片段进行研究,提高可溶性蛋白的表达量及免疫原性。
表1 重组亚单位疫苗免疫小鼠2次后保护性试验和中和效价测定
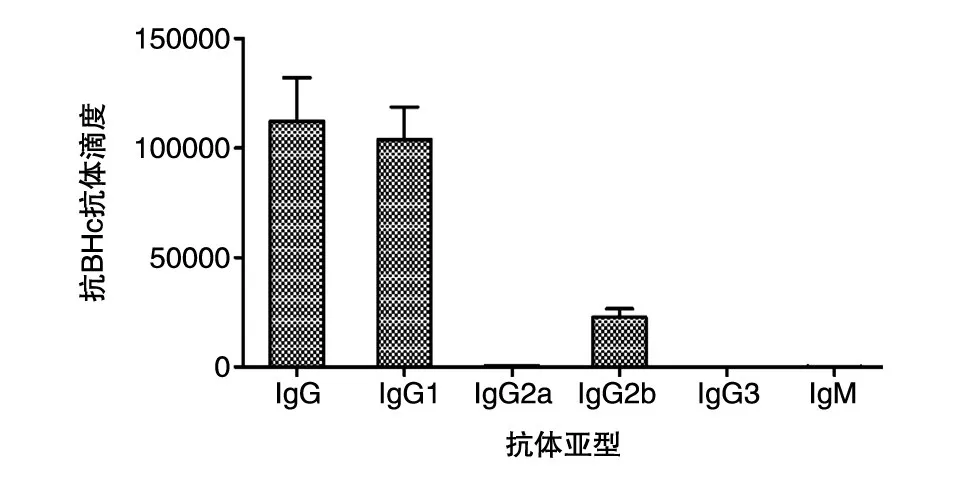
图5 重组亚单位疫苗免疫小鼠后抗体亚型测定
在本研究中,利用基因工程技术构建了能表达B型肉毒毒素受体结合区Hc片段的原核表达载体pTIG-Trx-BHc,并且实现了BHc在大肠杆菌中的可溶性表达,通过HisTrap HP蛋白纯化柱纯化到了纯度较高、稳定性良好的重组BHc抗原。通过Western印迹对纯化的蛋白进行鉴定,结果表明抗BHc血清抗体能特异性地结合该重组BHc片段蛋白,提示该蛋白可能具有天然的B型肉毒毒素受体结合区构象。通过免疫小鼠实验进一步研究该原核表达的BHc的免疫原性,结果表明该重组BHc亚单位疫苗免疫小鼠后能刺激机体产生良好的抗体反应,最高滴度达1∶150 000,且其血清中的抗体具有良好的中和活性,中和效价可达3.33 IU/mL。攻毒试验也证明该重组BHc亚单位疫苗具有十分强大的保护效果,1μg剂量免疫2次就能对104LD50的B型肉毒毒素产生完全保护作用。抗体亚型测定结果表明,该重组BHc亚单位疫苗刺激机体产生的抗体主要以IgG1和IgG2b为主,IgG2a含量极少,证明疫苗免疫后产生的抗体主要来源于Th2型免疫应答途径,Th2型免疫应答主要刺激机体的B细胞产生抗体,这种以Th2型免疫应答为主的特点能够产生较多的有效抗体,在抵抗毒素的攻击过程中具有极其重要的意义。后续,还要对该重组BHc亚单位疫苗进行深入研究,以获取更为详尽的数据,为B型肉毒毒素亚单位疫苗的研制提供可靠依据。同时,本研究也为肉毒毒素多价疫苗的研制奠定了基础。
[1] Smith L A,Rusnak J M.Botulinum neurotoxin vac⁃cines:past,present,and future[J].Crit Rev Immunol,2007,27(4):303-318.
[2] Dembek Z F,Smith L A,Rusnak J M.Botulism:cause,effects,diagnosis,clinical and laboratory identi⁃fication,and treatment modalities[J].Disaster Med Pub⁃lic Health Prep,2007,1(2):122-134.
[3] Schiavo G,Matteoli M,Montecucco C.Neurotoxins af⁃fecting neuroexocytosis[J].Physiol Rev,2000,80(2):717.
[4] Smith L A,Barrett A D T,Lu S,et al.Botulism and vaccines forits prevention[J].Vaccine,2009,27(47):D33-D39.
[5] Turton K,Chaddock J A,Acharya K R.Botulinum and tetanus neurotoxins:structure,function and thera⁃peutic utility[J].Trends Biochem Sci,2002,27(11):552-558.
[6] Shukla H D,Sharma S K.Clostridium botulinum:a bug with beauty and weapon[J].Crit Rev Microbiol,2005,31(1):11.
[7] Matak I,Lackovic'Z.Botulinum toxin A,brain and pain[J].Prog Neurobiol,2014,119-120(5):39-59.
[8] Rummel A,Bade S,Alves J,et al.Two carbohydrate binding sites in the H(CC)-domain of tetanus neurotox⁃in are required for toxicity[J].J Mol Biol,2003,326(3):835-847.
[9] Lapenotiere H F,Clayton M A,Middlebrook J L.Ex⁃pression of alarge,nontoxicfragment of botulinum neurotoxin serotype A and its use as an immunogen[J].Toxicon,1995,33(10):1383.
[10]Atassi M Z.Basic immunological aspects of botulinum toxin therapy[J].Mov Disord,2004,19(S8):S68.
[11]Villaflores O B,Hsei C M,Teng C Y,et al.Easy ex⁃pression of the C-terminal heavy chain domain of bot⁃ulinum neurotoxin serotype A as a vaccine candidate using a bi-cistronic baculovirus system[J].J Virol Methods,2013,189(1):58.
[12]Keller J E.Characterization of new formalin-detoxified botulinum neurotoxin toxoids[J].Clin Vaccine Immu⁃nol,2008,15(15):1374-1379.
[13]Holley J L,Elmore M,Mauchline M,et al.Cloning,expression and evaluation of a recombinant sub-unit vaccine againstClostridium botulinum,type F toxin[J].Vaccine,2000,19(2-3):288-297.
[14]Liu B,Shi D Y,Chang S H,et al.Characterization and immunological activity of different forms of recom⁃binant secreted Hc of botulinum neurotoxin serotype B products expressed in yeast[J].Sci Rep,2015,5(13):7678.
[15]Yu Y Z,Li N,Zhu H Q,et al.The recombinant Hc subunit of Clostridium botulinum,neurotoxin serotype A is an effective botulism vaccine candidate[J].Vac⁃cine,2009,27(21):2816-2822.
[16]Yu Y Z,Zhang S M,Ma Y,et al.Development and evaluation of candidate vaccine and antitoxin against botulinum neurotoxin serotype F[J]. Clin Immunol,2010,137(2):271-280.
[17]Moreira G M,Cunha C E,Salvarani F M,et al.Pro⁃duction of recombinant botulism antigens:a review of expression systems[J].Anaerobe,2014,28:130-136.
[18]Gurkan C,Ellar D J.Recombinant production of bacte⁃rial toxins and their derivatives in the methylotrophic yeast Pichia pastoris[J].Microb Cell Fact,2005,4(1):33.
Study on the Immunogenicity of Recombinant Hc Subunit Vaccine of Botulinum Neurotoxin Serotype B
CHEN Bo-Yang,ZHOU Guo,SHI Dan-Yang,ZHOU Xiao-Wei*,YU Yun-Zhou*
Beijing Institute of Biotechnology,Beijing 100071,China
*Co-corresponding authors,YU Yun-Zhou,E-mail:yunzhouyu@163.com;ZHOU Xiao-Wei,E-mail:amms832@126.com
Objective:The recombinant Hc domain antigen of botulinum neurotoxin serotype B(BoNT/B) was ex⁃pressed in Escherichia coli as a subunit vaccine,and its immunogenicity was studied.Methods:The prokaryotic expression vector pTIG-Trx-BHc was constructed,recombinant antigen BHc was expressed in E.coli and purified.BALB/c mice were immunized to study its immunogenicity.Results:The recombinant BHc antigen protein was suc⁃cessfully expressed and purified from E.coli and could stimulate the body to produce high titers of anti-BHc anti⁃bodies,and induce protective immune responses in immunized mice.The recombinant BHc subunit vaccine provid⁃ed complete protection against challenge with 104LD50of BoNT/B only after 1μg of two doses immunization,and serum neutralization titers reached 1.33 IU/mL.Conclusion:These findings suggest that the recombinant BHc anti⁃gen expressed in E.coli is efficacious in protecting mice against challenge with BoNT/B and that the recombinant BHc subunit vaccine may be a subunit candidate vaccine for prophylaxis against BoNT/B.
botulinum neurotoxin serotype B;C-terminal fragment of heavy-chain receptor(Hc);recombinant subunit vaccine;immunogenicity
R392.1;Q78
A
1009-0002(2017)04-0435-06
2017-03-09
陈博阳(1991- ),男,硕士研究生,(E-mail)chenboyang1991@163.com
余云舟,(E-mail)yunzhouyu@163.com;周晓巍,(E-mail)amms832@126.com
10.3969/j.issn.1009-0002.2017.04.006
