同源异型盒基因HOXA5对胃癌细胞BGC823侵袭能力的影响
2017-11-06周博
周 博
同源异型盒基因HOXA5对胃癌细胞BGC823侵袭能力的影响
周 博
目的检测人胃癌组织中HOXA5基因的表达情况,观察干扰HOXA5基因的表达之后,胃癌细胞BGC823的迁移和侵袭能力的变化,为阐明HOXA5在胃癌向远处转移的分子机制中提供新的思路。方法通过实时定量PCR(qRT-PCR)、Western blot以及免疫组织化学等技术,检测胃癌组织中HOXA5基因的表达。应用细胞转染的方法将HOXA5基因的过表达质粒转入胃癌细胞BGC823中,经qRT-PCR和Western blot验证HOXA5表达上调之后,利用Transwell侵袭实验检测BGC823细胞侵袭能力的变化。结果在收集的69例新鲜的胃癌组织以及相对应的癌旁组织中,免疫组织化学显示相比于癌旁组织的表达情况,胃癌组织中只有26例HOXA5的表达高于癌旁组织,比例为37.7%;qRT-PCR、Western blot检测发现相对于癌旁组织,胃癌组织中HOXA5的表达水平显著下调(mRNA水平下调3倍,蛋白水平下调2倍,差异具有统计学意义,P<0.05)。BGC823细胞转染了过表达质粒之后,HOXA5的表达能够被上调。过表达了HOXA5基因的BGC823细胞的侵袭能力下降。结论在胃癌组织中HOXA5的表达下调,而在胃癌细胞BGC823中增强HOXA5的表达能够降低细胞的侵袭能力,说明HOXA5在胃癌的发生发展和侵袭、转移中发挥着抑癌基因的作用,可作为一个新的治疗靶点。
HOXA5;胃癌;BGC823细胞;侵袭;转移
(ThePracticalJournalofCancer,2017,32:1406~1410)
胃癌的发生率在全球最常见的肿瘤中排第四位,然而它确是癌症死亡的第二大原因[1],这其中主要的原因是因其易复发和易转移的特点。我国陈万青教授等[2]领衔的研究发现在2009年我国胃癌新发病例30949例,死亡病例22120例,发病率为36.21/10万,死亡率为25.88/10万,虽然与2008年相比并没有大幅上升,但发病率和死亡率仍然很高。胃癌已经成为对公众健康有重大影响的疾病。目前对胃癌的治疗主要以手术切除为主,术后5年生存率约20%~30%[3],许多胃癌患者发现时即已经到了晚期。阐明其发生发展以及侵袭转移的机制对于更好地预防和治疗胃癌具有重要的意义。HOX 基因属于同源异形盒基因家族的一员,在进化上高度保守[4]。相关研究结果证明,人类多种恶性肿瘤的发生发展及预后也有HOX 基因的参与[5]。HOXA5为HOX 基因编码的1个蛋白之一,它可以与DNA结合进而激活或者抑制下游靶基因的表达。一项最近的研究表明,在乳腺癌中HOXA5的表达是抑制的,提示它是1个肿瘤抑制子,抑制乳腺癌的侵袭转移[6]。然而其他的研究者发现在食管鳞癌组织中它是高表达的[7],说明它又可能是1个促进肿瘤细胞增殖的癌基因。HOXA5在不同的肿瘤中是促癌还是抑癌争论性比较大,至于HOXA5在胃癌中表达如何,以及它在胃癌的生发发展、侵袭转移的过程中扮演什么角色,至今研究的人很少。为了解决这一科学问题,我们需要观察HOXA5如何影响胃癌细胞的侵袭、迁移能力,并阐明其表达情况,以便更科学的定义它在胃癌中的作用,为将来将其作为新的生物治疗靶点提供依据。
1 材料与方法
1.1 材料
BGC823细胞(人胃癌细胞株)购自中国科学院上海生命科学研究院。即用型第二代免疫组化Elivision plus广谱试剂盒购自南京盖博生物技术有限公司。RIPA裂解液、蛋白抽提试剂盒Ⅰ购自北京普利莱基因技术有限公司。LipofectaminTM2000购自Invitrogen公司(USA)。逆转录试剂盒、实时荧光定量试剂盒、质粒提取试剂盒等均购自宝大连生物工程有限公司(TaKaRa)。兔抗人HOXA5多克隆抗体购自美国ABcam公司,兔抗人GAPDH抗体购自美国Proteintech。山羊抗兔IgG(二抗)购自北京中杉金桥生物有限公司。TRIzol 试剂、化学发光检测试剂盒等购自北京天根生物科技有限公司。HOXA5过表达质粒购买自苏州吉玛基因股份有限公司。HOXA5和GAPDH的实时RT-PCR引物等均由生工(上海)有限公司合成。BCA蛋白浓度测定试剂盒购自碧云天生物技术研究所。
1.2 组织
病理组织来源于2012年5月至2014年7月期间在我院住院并接受胃癌根治术的患者手术切除的新鲜胃癌组织标本,标本均经病理确诊为胃癌,取距离癌组织5 cm的正常胃粘膜组织作为癌旁标本,本研究中共收集了69例,患者平均年龄(53.2±11.2)岁,所有患者手术之前均接受放化疗与抗肿瘤药物治疗。
1.3 方法
1.3.1 免疫组织化学检测组织蛋白表达 新鲜组织标本用福尔马林浸泡、固定,然后用石蜡包埋,切片后烘烤2 h。脱蜡后用pH 7.4的PBS冲洗3次,每次3 min。取一定量pH=6.0柠檬酸盐缓冲液,微波加热至沸腾,将脱蜡水化后的组织切片置于耐高温塑料切片架上,中档微波处理10 min,取出微波盒流水自然泠却,先用蒸馏水冲洗两次,之后用PBS冲洗3次,每次3 min。每张切片加1滴3% H2O2,室温下孵育10 min,PBS冲洗3次,每次3 min。去除PBS,然后再在每张切片上加1滴相HOXA5一抗抗体,室温孵育2 h;PBS冲洗3次,每次5 min。去除PBS,每张切片加1滴聚合物增强剂,室温孵育20 min;PBS冲洗3次,每次3 min。去除PBS,每张切片加1滴酶标抗鼠/兔聚合物,室温孵育30 min;PBS冲洗3次,每次5 min。除去PBS液,每张切片加1滴DAB液,静置5 min。苏木精复染,0.1%HCl分化,自来水冲洗,蓝化,切片经梯度酒精脱水干燥,晾干后显微镜下观察并拍照。
1.3.2 qRT-PCR检测HOXA5 mRNA 表达情况 将胃癌组织或癌旁组织研磨碎,或收集各组经处理的BGC823细胞,应用TRIzol试剂法提取各组细胞的总RNA,用逆转录试剂盒其反转录成cDNA反应条件:37 ℃ 15 min,85 ℃ 5 s,随后以此cDNA为模板进行qRT-PCR。qRT-PCR引物序列见表1 。PCR反应条件:95 ℃ 30 s ;95 ℃ 5 s、60 ℃ 30 s,共40 个循环。以2-ΔΔCt 值表示各基因 mRNA 的相对表达水平。
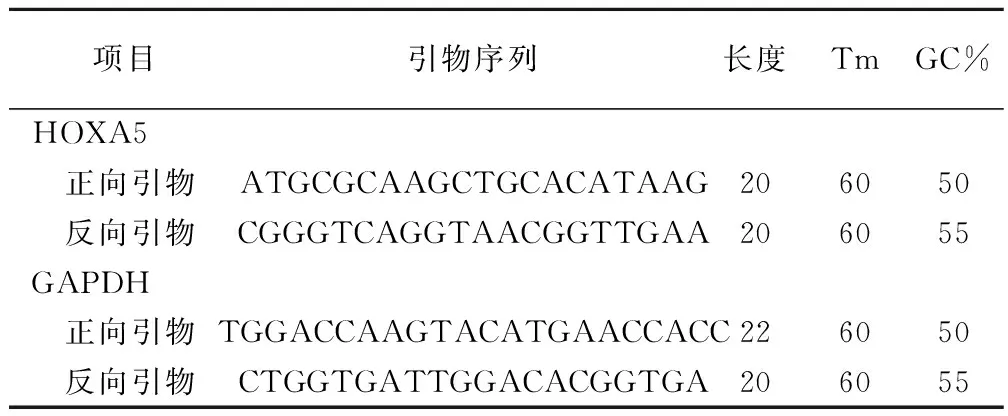
表1 qRT-PCR引物序列
1.3.3 Western blot检测HOXA5的蛋白表达情况 将胃癌组织或癌旁组织研磨碎,或收集各组经处理的BGC823细胞,提取细胞总蛋白。用10%SDS-PAGE胶将提取的蛋白质分离,然后将其转移至PVDF膜上,封闭1 h ;将相应的PVDF膜浸入含1∶1000的抗HOXA5和GAPDH抗体的一抗稀释液中4 ℃孵育;第二天将膜取出用TBST液漂洗3次,每次10 min,按1∶10 000稀释浓度加入羊抗兔IgG,室温孵育1 h;用TBST 液漂洗3 次,每次10 min;加入化学发光试剂显影成像,Image Lab 软件分析蛋白条带灰度值。蛋白的表达情况以HOXA5与GAPDH条带灰度值的比值表示。
1.3.4 HOXA5质粒大提 HOXA5过表达质粒购买自苏州吉玛基因股份有限公司。取适量均匀小摇,然后大摇。按照质粒提取试剂盒的说明书步骤提取质粒,备用。
1.3.5 细胞培养及转染 人胃癌细胞株BGC823置于37 ℃、CO2体积分数为5% 的培养箱中培养,用含100 U/ml双抗的DMEM(Gibco,USA) 培养液传代培养。转染前24 h接种细胞于6 cm培养皿中,当细胞融合度约70%时换无双抗的DMEN培养液饥饿培养4 h,然后用LipofectaminTM2000按照说明书将质粒转染入细胞中,转染分两组:HA-HOXA5组和HA-Vector组。于转染6 h后更换含有10%胎牛血清的培养液继续培养,24 h后取一半细胞提取RNA,48 h后提取剩余的总蛋白。
1.3.6 Transwell侵袭实验检测细胞侵袭能力 使用Transwell检测BGC823细胞的侵袭能力变化。取对数期的BGC823细胞,经过胰酶消化后,大约按2×105细胞数加入到每个小室,用不含血清的培养液进行培养,放置在含有10%的血清培养液的24孔板上,放置在5%CO2环境内孵育24 h,甲醛固定20 min,用PBS洗3遍。显微镜(×200)下计数迁移至滤膜外表面的细胞数,实验重复3次,取平均值。
1.4 统计学方法
应用SPSS 17.0统计软件,数据以均数±标准差表示,方差分析用于多组间数据的比较,t检验用于两组间数据的比较;而Tukey 法或Dunnett’s T3 法用于组间两两比较分析,P<0.05 为差异有统计学意义。
2 结果
2.1 免疫组化检测胃癌组织中HOXA5基因表达情况
应用免疫组织化法,在收集的69例胃癌以及对应的癌旁组织中对HOXA5的表达进行定性分析,发现只有26例患者的癌组织中HOXA5表达接近或者高于癌旁组织,染色强于癌旁组织者26例(37.7%),染色弱于癌旁组织者43例(62.3%)。
2.2 胃癌以及癌旁组织中HOXA5mRNA 和蛋白表达情况
应用qRT-PCR检测HOXA5mRNA的表达情况,与GAPDH对比进行定量分析。
结果发现:与癌旁组织相比,HOXA5在胃癌组织中表达降低,与GAPDH进行定量对比分析胃癌组织为(0.149±0.067),癌旁组织为(0.328±0.085),差异具有统计学意义(P<0.05)。
Western blot检测HOXA5的蛋白表达情况,结果如图1所示:胃癌组织中HOXA5表达明显低于癌旁组织,与GAPDH对比进行定量分析,结果为胃癌组织(0.342±0.024),癌旁组织(0.975±0.105),差异具有统计学意义(P<0.05)。
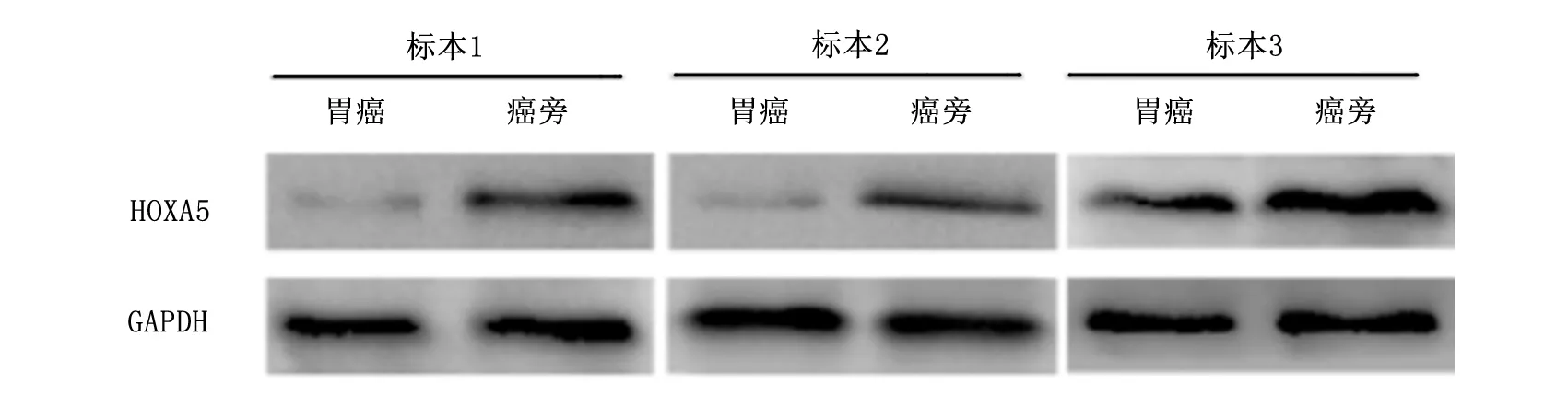
图1 胃癌和癌旁组织中HOXA5和GAPDH的Western blot成像图
2.3 HOXA5过表达质粒效果验证
应用qRT-PCR检测BGC823细胞中HOXA5mRNA的表达情况;48 h后提取细胞总蛋白,用Western blot检测BGC823细胞中HOXA5的蛋白表达情况发现,相比于转染了HA-Vector质粒组(0.5123±0.087),转染了HA-HOXA5质粒组的BGC823细胞HOXA5基因表达(1.639±0.088)明显上调,差异具有统计学意义(P<0.05),结果见图2。
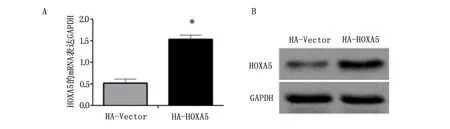
A为qRT-PCR量化柱状图,B为Western blot成像图。
2.4 上调HOXA5的表达导致BGC823细胞的侵袭能力下降
BGC823细胞分别转染HA-Vector和 HA-HOXA5质粒,48 h后经胰酶消化,细胞按2×105细胞数加入到每个Transwell小室,继续用培养液进行培养,36 h后经染色在显微镜(×200)下计数迁移至滤膜外的细胞,结果见图3。与HA-Vector组比较,HA-HOXA5组的BGC823细胞侵袭、迁移能力下降,差异具有统计学意义(P<0.05)。

A为Transwell侵袭实验;B为迁移至Transwell小室滤膜外的细胞数计数图。
3 讨论
同源异形盒基因是1类串联成簇地排列在不同染色体上的基因,即HOX基因。人类有39个HOX基因,分为HOXA、HOXB、HOXC和HOXD 4簇,其中HOXA位于chr17p14-15[4]。HOX 基因编码的蛋白可以与DNA结合进而激活或者抑制下游靶基因的表达[8],研究表明HOX基因可以控制细胞属性,比如细胞分化、细胞亲和力等[9],除此之外,HOX基因在肿瘤中的作用也越来越得到研究者的重视[10-13]。研究发现,HOX基因在肿瘤中的作用不是固定的,在不同的阶段和不同的肿瘤中发挥着不同的功能,以HOXB9为例,其表达越低的组织,淋巴结转移越早,患者生存期越短[14],而在结肠癌组织中确实高表达的[15],但是在晚期或者分化程度越低的结肠癌中表达越低,预后也越差。因此,研究HOX基因在不同的肿瘤中的表达以及其对肿瘤细胞生物学特征的影响,对充分了解HOX基因具有深远意义。有研究者发现HOXA5基因在非小细胞肺癌中低表达并能抑制肿瘤的侵袭转移[16];然而,在急性髓细胞性白血病(AML)中,HOXA5的高表达可导致AML的治疗效果更差,提示它与AML肿瘤细胞的耐药性有关[17]。HOXA5在胃癌中的作用,有研究[18]发现,上调miR-196a可使胃癌细胞的侵袭和迁移能力增加,而这一作用是通过miR-196a的靶基因HOXA5实现的,说明HOXA5在胃癌中可能发挥着抑癌的作用。为了进一步阐明HOXA5在胃癌发生发展中的作用,本文对HOXA5进行更进一步的研究。我们的研究发现,在胃癌组织中,HOXA5的表达的降低的(相对于癌旁组织);而在胃癌细胞BGC823中回复HOXA5的表达能抑制细胞的侵袭能力。综上所述,我们的研究首次报道了在胃癌组织中HOXA5的表达时降低的,并能够控制胃癌细胞的侵袭转移。HOXA5可作为诊断和治疗胃癌的一个新的生物标记和靶基因。
[1] Long ZW,Yu HM,Wang YN,et al.Association of IL-17 polymorphisms with gastric cancer risk in Asian populations〔J〕.World J Gastroenterol,2015,21(18):5707-5718.
[2] 郑朝旭,郑荣寿,陈万青.中国2009年胃癌发病与死亡分析〔J〕.中国肿瘤,2013,22(5):327-332.
[3] Qinghai Z,Yanying W,Yunfang C,et al.Effect of interleukin-17A and interleukin-17F gene polymorphisms on the risk of gastric cancer in a Chinese population〔J〕.Gene,2014,537(2):328-332.
[4] 牛苗苗,战 军,张宏权.HOX基因在肿瘤发生发展过程中的作用〔J〕.解剖学报,2014,45(3):430-436.
[5] Grier DG,Thompson A,Kwasniewska A,et al.The pathophysiology of HOX genes and their role in cancer〔J〕.J Pathol,2005,205(2):154-171.
[6] Raman V,Martensen SA,Reisman D,et al.Compromised HOXA5 function can limit p53 expression in human breast tumors〔J〕.Nature,2000,405(6789):974-978.
[7] Takahashi O,Hamada J,Abe M,et al.Dysregulated expression of HOX and ParaHOX genes in human esophageal squamous cell carcinoma〔J〕.Oncol Rep,2007,17(4):753-760.
[8] Bhattacharjee A,Ghangal R,Garg R,et al.Genome-wide analysis of homeobox gene family in legumes:identification,gene duplication and expression profiling〔J〕.PLoS ONE,2015,10(3):e0119198.
[9] Sánchez-Herrero E.Hox targets and cellular functions〔J〕.Scientifica,2013,2013:738257.
[10] Darda L,Hakami F,Morgan R,et al.The role of HOXB9 and miR-196a in head and neck squamous cell carcinoma〔J〕.PLoS ONE,2015,10(4):e0122285.
[11] Duan R,Han L,Wang Q,et al.HOXA13 is a potential GBM diagnostic marker and promotes glioma invasion by activating the Wnt and TGF-β pathways〔J〕.Oncotarget,2015,6(29):27778-27793.
[12] Lv X,Li L,Lv L,et al.HOXD9 promotes epithelial-mesenchymal transition and cancer metastasis by ZEB1 regulation in hepatocellular carcinoma〔J〕.J Exp Clin Cancer Res,2015,34:133.
[13] Hussain I,Bhan A,Ansari KI,et al.Bisphenol-A induces expression of HOXC6,an estrogen-regulated homeobox-containing gene associated with breast cancer〔J〕.Biochim Biophys Acta,2015,1849(6):697-708.
[14] Sha S,Gu Y,Xu B,et al.Decreased expression of HOXB9 is related to poor overall survival in patients with gastric carcinoma〔J〕.Dig Liver Dis,2013,45(5):422-429.
[15] Huang K,Yuan R,Wang K,et al.Overexpression of HOX-B9 promotes metastasis and indicates poor prognosis in colon cancer〔J〕.Chin J Cancer Res,2014,26(1):72-80.
[16] Wang CC,Su KY,Chen HY,et al.HOXA5 inhibits metastasis via regulating cytoskeletal remodelling and associates with prolonged survival in non-small-cell lung carcinoma〔J〕.PLoS ONE,2015,10(4):e0124191.
[17] 李丽丽,夏瑞祥.同源异型盒基因5在急性髓细胞性白血病中表达的研究〔J〕.安徽医学,2015,36(12):1459-1462.
[18] 尹凌帝,孙 倩,林梦洁,等.miR-196a调控HOXA5对人胃癌细胞MGC-803侵袭转移的影响及机制研究〔J〕.临床肿瘤学杂志,2014,19(3):193-198.
(编辑:吴小红)
EffectofHOXA5ontheInvasionAbilityofHumanGastricCancerCellLineBGC823
ZHOUBo.
TheFirstAffiliatedHospitalofHe'nanUniversityofScienceandTechnology,Luoyang,471003
ObjectiveTo detect the expression of HOXA5 in human gastric carcinoma;and observe the changes of gastric cancer cell BGC823’s migration and invasion ability after interference the expression of HOXA5 gene,and provide a new idea to clarify the molecular mechanism role of HOXA5 in the metastasis of gastric cancer.MethodsReal-time quantitative PCR(qRT-PCR),Western blot and immunohistochemistry were performed to detect the expression of HOXA5 gene in gastric cancer tissues.The overexpression plasmid of HOXA5 was transferred into gastric cancer cell BGC823 by the method of cell transfection,we use qRT-PCR and western blot to confirm the overexpression effect,and then the changes of invasion ability of BGC823 cells were detected by transwell invasion assay.ResultsIn the 69 cases of fresh gastric cancer tissue and the corresponding adjacent non-tumourous tissue,immunohistochemistry showed that in all gastric carcinoma tissue only 26 cases present HOXA5’s expression was higher than that in adjacent non-tumourous tissue,the proportion was 37.7%.Detection of qRT-PCR and western blot showed that the expression of HOXA5 was significantly lower in gastric cancer tissues than in adjacent non-tumourous tissue(the level of mRNA was down 3 times,and the protein was 2 times,the difference was statistically significant,P<0.05).In BGC823 cells,which have transfected overexpression plasmid of HOXA5,the expression of HOXA5 was up-regulated,and the invasion ability of BGC823 cells was decreased.ConclusionThe expression of HOXA5 in gastric carcinoma decreased.Enhance the expression of HOXA5 in gastric cancer cell line BGC823 can reduce the invasion ability of cells.HOXA5 is a tumor suppressor in the development,invasion and metastasis of gastric cancer.It can be a new therapeutic target.
HOXA5;Gastric carcinoma;BGC823 cell;Invasion;Metastasis
471003 河南科技大学临床医学院,河南科技大学第一附属医院
10.3969/j.issn.1001-5930.2017.09.004
R735.2
A
1001-5930(2017)09-1406-05
2016-10-24
2017-06-12)
