免疫抑制剂对26例周围神经系统副肿瘤综合征的动态作用分析
2017-11-06姜海伟胡晴鄢艳红高畅曹梦莹葛林通
姜海伟 胡晴 鄢艳红 高畅 曹梦莹 葛林通
2015年—2016年湖北省卫生计生指导性项目(项目编号为WJ2015052)
430033 武汉,湖北省第三人民医院神经内科
免疫抑制剂对26例周围神经系统副肿瘤综合征的动态作用分析
姜海伟 胡晴 鄢艳红 高畅 曹梦莹 葛林通
目的探讨免疫抑制治疗对副肿瘤性周围神经疾病相关抗体定量与临床症状评分的动态影响。方法对26例周围神经系统副肿瘤综合征患者进行规范化的免疫抑制剂治疗,在治疗前及治疗开始后1、4周、治疗结束后1周,治疗结束后3月五个时间点分别对患者血清抗-Hu抗体、抗-Yo抗体、 抗-Ri抗体进行定量检测,同时采用神经症状评分(NSS)、神经残疾评分(NDS)、改良神经功能(mRS)评分评估患者临床症状,并与抗体变化率进行相关性分析。结果抗-Hu抗体(F=7.634,P=0.00 )、抗-Yo抗体(F=6.21,P=0.00)、 抗-Ri抗体(F=3.80,P=0.02 )定量总体变化均具有明显差异;与治疗前比较,抗HU抗体在治疗开始1周后下降(t=3.70,P=0.01 ),但治疗结束后3月与治疗前比较无明显差异(t=1.00,P=0.33);mRS、NDS、NSS评分均在治疗后1周下降(mRS:t=2.37,P=0.03;NDS:t=2.58,P=0.02;NSS:t=3.39,P=0.00),但mRS评分(F=1.84,P=0.15 )评分总体变化无明显差异,NDS(F=3.27,P=0.02 )及NSS评分(F=4.89,P=0.01 )总体变化有明显差异,NDS评分治疗结束后1周仍明显下降(t=2.22,P=0.04)。治疗前相关抗体的定量与神经症状评分无明显关系(P>0.05),治疗开始后1周mRS及NSS评分的变化率与抗RI抗体的变化率呈正相关(mRS:r=0.46,P=0.02;NSS:r=0.40,P=0.04),而治疗开始后4周mRS评分的变化率与抗RI抗体的变化率(r=0.45,P=0.02)也呈正相关,其他抗体的变化与治疗开始后神经功能评分变化均无明显关系(P>0.05),而治疗结束后1周及治疗结束后3月抗体的变化与神经功能评分的变化均无明显关系(P>0.05)。结论免疫抑制剂对系统副肿瘤周围神经综合征患者的抗体定量滴度及NDS、NSS症状评分方面具有一定的临床作用,与治疗结束后的长期作用无明显关系。
免疫抑制剂 综合征周围神经系统 相关性抗体 神经症状 动态作用
癌肿通过远隔作用导致周围神经系统功能障碍的各种综合征,若能排除继发于肿瘤化疗、脑脊膜癌变、肿瘤直接侵润或转移、继发感染、缺血或代谢紊乱所致,则称之为副肿瘤性周围神经病,是神经系统副肿瘤综合征(PNS)的常见表现之一,早期诊断、早期原发癌肿切除、放疗或化疗可使少数症状部分或完全缓解,但大多数有关的神经功能缺损仍需进一步治疗。自2012年开始本研究以“免疫抑制剂对神经系统副肿瘤综合征的应用”为主题,搜集病例资料进行临床观察,目前已经将26例副肿瘤性周围神经疾病患者纳入临床观察,通过观察了解免疫抑制治疗对相关抗体动态的影响及相关抗体定量与临床症状评分变化的相关性。
1 资料与方法
1.1 一般资料
1.1.1 诊断要点 参考文献全国高等学校教材(8年制及7年制临床专业)《神经病学》(第2版)“神经系统副肿瘤综合征”的确诊标准要点[1]:(1)典型的神经综合征且在5年内发生肿瘤(神经抗体检查非必需);(2)非典型的神经综合征在对肿瘤行非免疫治疗后明显好转,而不是自发缓解;(3)非典型的神经综合征伴肿瘤神经抗体,并且在其后5年内发生肿瘤;(4)神经综合征(典型或非典型)伴特征性肿瘤神经抗体阳性,但未发现肿瘤)。
1.1.2 入选标准 (1)年龄20~80岁,性别不限;(2)临床表现以周围神经疾病损害为主,经肌电图检查明确有周围神经病变者;(3)已经确诊的实体肿瘤患者经治疗处于RECIST疗效标准SD以上者,在原发肿瘤的治疗(放疗、化疗等)间歇期者;(4)可耐受糖皮质激素或其他免疫抑制剂治疗者,且为首次接受治疗者;(5)签署知情同意书并愿意随访者。
1.1.3 排除标准 (1)由其他原因引起周围神经系统疾病不能排除者;(2)合并其他脏器功能严重衰竭或造血功能严重障碍者;(3)合并其他自身免疫性疾病者;(4)观察期间采用其他治疗方式如丙种球蛋白冲击、血浆置换可能影响抗体滴度者。
1.1.4 自2012年6月~2015年3月收集本院神经内科、肿瘤内科住院患者26例,其中已经发现并确诊为恶性肿瘤患者18例,肿瘤神经抗体阳性但尚未发现肿瘤患者8例。18例已经发现肿瘤的患者中肺癌10例、卵巢癌2例、淋巴瘤2例、乳腺癌1例、胃癌1例、结肠癌1例、直肠癌1例,所有病例均经X线片、CT、MRI、PET-CT、纤维支气管镜、胃镜等影像学或病理学检查发现肿瘤。其余8例患者均伴有典型周围神经疾病,同时肿瘤神经抗体阳性。26例患者中男16例,女10例,年龄36~78岁,平均年龄(52.24±7.07)岁,发病病程4月~7年,其中纯感觉型5例、纯运动型6例、感觉运动型11例和自主神经型4例。
1.1.5 试剂 抗Hu抗体(Catalog#:10457)、抗Yo抗体(Catalog#:10448)、抗-Ri抗体[(Catalog#:10445)、双抗夹-t]的ELISA试剂盒均由上海信裕生物科技有限公司提供。
1.2 治疗及副反应预防 针对患者个人体质及相关检查选用糖皮质激素(主要为地塞米松、泼尼松龙、甲泼尼龙等)或免疫抑制剂(环磷酰胺)治疗;疗程及服用方法依据患者具体情况及临床症状改善情况而定;二者根据情况连用,其中16例患者行激素冲击疗法,先静滴甲强龙注射液(500~1000 mg·d-1,连用3 d)或地塞米松(20~50 mg,1次·d-1,连用3 d),后改为泼尼松片剂口服(1.5~2 mg·kg-1·d-1,最大剂量60 mg·d-1,每2周减量5 mg,减至15 mg时每3周减量5 mg,直至减完),10例采用糖皮质激素冲击治疗后改用泼尼松片,同时联用环磷酰胺治疗(1000 mg·次-1,每周1次,目标剂量9000 mg,WBC<4.0×109·L-1停用);用药期间监测患者血常规、血糖及相关可能的不良反应指标,同时采用相关的预防性药物。以所有药物停止使用作为治疗终点。
1.3 观察指标 患者治疗前及治疗开始后1、4周、治疗结束后1周、治疗结束后 3月五个时间点进行血清抗-Hu抗体、抗-Yo抗体、 抗-Ri抗体的定量检测(酶联免疫吸附试验,ELISA);同时采用相关量表进行临床症状评分,主要量表包括神经症状评分(Neurological Symptom Scale,NSS)、神经残疾评分(Neurological Disability Scale,NDS)[2]、改良Rankin Scale(Modified Rankin Scale,mRS)评分对患者症状进行评分,并对治疗前各抗体滴度与各神经功能评分情况进行相关性分析,对治疗开始后1、4周各抗体的变化率与各神经功能评分的变化率进行相关性分析,其中治疗开始后1周变化率为(治疗开始后1周数据-治疗前数据)/治疗前数据×100%;治疗开始后4周变化率为(治疗开始后4周数据-治疗前数据)/治疗前数据×100%。
2 结 果
26例患者均完成随访,有24例患者均完成计划疗程,1例患者在治疗完成约2/3疗程后肿瘤出现进展,进行其他治疗,以停用时间作为治疗终点。1例患者自行加快口服泼尼松片停药速度,第17周停药。1例患者因无法耐受环磷酰胺不良反应,第5周停用环磷酰胺,继续口服泼尼松片完成疗程。
2.1 免疫抑制剂治疗前后抗-Hu、抗-Ri、抗-Yo抗体定量检测水平及临床症状量表评分 见表1~2。
2.2 治疗前及治疗开始后1、4周、治疗结束后1周、3月各抗体与临床症状评分变化率的相关性分析见表3~5。

表1 免疫抑制剂治疗前后抗-Hu、抗-Yo、抗-Ri抗体定量检测水平
注:与治疗前比较,▲P<0.05,*P<0.01

表2 免疫抑制剂治疗前后患者mRS,NDS及NSS评分
注:与治疗前比较,▲P<0.05,*P<0.01
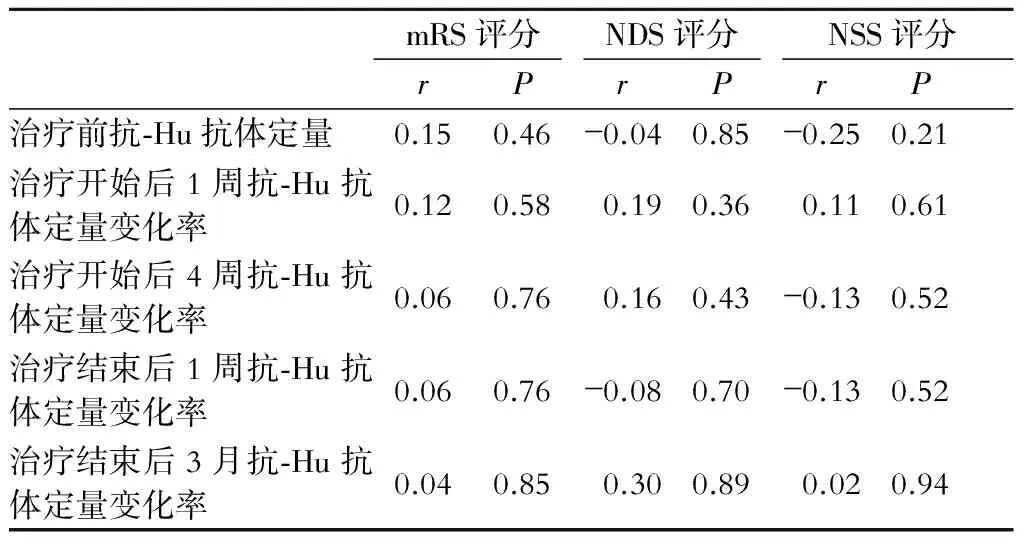
表3 治疗前及治疗开始后1、4周、治疗结束后1周、3月抗-Hu抗体定量与临床症状评分变化率的相关性分析

表4 治疗前及治疗开始后1、4周、治疗结束后1周、3月抗-Yo抗体定量与临床症状评分变化率的相关性分析

表5 治疗前及治疗开始后1、4周、治疗结束后1周、3月抗-Ri抗体定量与临床症状评分变化率的相关性分析
3 讨 论
PNS相关的免疫介导的抗体主要为抗-Hu抗体、抗-Yo抗体、抗-Ri抗体三种抗体。有研究表明,NPS组血清抗-Hu抗体、抗-Yo抗体、 抗-Ri抗体的定量明显高于非NPS组的肿瘤患者[3];前期研究发现免疫抑制剂对于PNS相关的抗-Hu抗体、抗-Yo抗体、抗-Ri抗体的定量滴度具有动态影响作用[4]。为进一步明确其动态变化与临床症状是否具有相关性,本研究主要观察了副肿瘤性周围神经疾病,分析抗-Hu抗体、抗-Yo抗体、抗-Ri抗体及相关神经症状评分的动态变化,同时对抗体定量变化与神经系统症状评分的变化情况进行相关性分析。
本研究对使用激素或环磷酰胺的副肿瘤性周围神经病的患者抗-Hu抗体、抗-Yo抗体、 抗-Ri抗体的定量总体变化进行了重复测量方差分析,提示三种抗体定量变化均具有统计学意义,其中与治疗前的比较,抗-Hu抗体在治疗开始后有所下降,但治疗结束后1周开始反弹,且与治疗前差异不显著,而抗-Yo、抗-Ri抗体的下降在治疗结束后1周与治疗前比较仍有显著变化,进一步证实前期的相关研究结果。在神经症状相关评分动态变化观察中本研究首先采用了常用的mRS(Modified Rankin Scale)评分,发现mRS评分在治疗后1周有所下降,其变化有统计学意义,但在之后的治疗中评分与治疗前比较及总体变化无统计学意义。同时,采用了周围神经系统疾病常用的NDS评分(神经残疾评分)及NSS评分(神经症状评分),发现NDS及NSS评分变化在治疗后1或4周后开始下降,且有统计学意义,NDS治疗后结束后1周的下降仍具有统计学意义,NSS评分在治疗结束后1周反弹,且与治疗前比较无统计学意义。目前mMRS评分是神经功能重要的评分标准,其评分的高低基本上可以反映患者的生存状况及生存能力,且包含中枢神经系统及周围神经疾病的功能评分,目前针对PNS观察大部分都采用RS或mRS评分。Shams'ili等[5]对9例anti-Hu或anti-Yo阳性PNS患者使用静脉输注利妥昔单抗治疗,其中有3例患者症状改善,Rankin Scale(RS)值下降1个点以上,1个边缘脑炎患者则得到显著改善 (RS从5下降到1)。de Jongste等[6]进行了针对西罗莫司治疗17例抗-Hu抗体阳性的PNS进行了非双盲实验研究,采用Rankin Scale(RS)评分来评估患者神经功能的改善情况,结果显示仅有极少数的患者(2例)出现神经功能改善,其他患者均没有神经功能改善,中位生存期为21个月。Orange等[7]研究了他克莫司在PNS中的应用,其设计是通过回顾单中心的用他克莫司治疗的26例PNS患者,结果显示其中位生存时间为诊断后52个月,部分患者mRS神经功能得到改善;该研究发现,治疗前及治疗后1、4周NDS评分与mRS具有明显关系。但为什么用不同的评分其改善的效果不甚一致呢?本研究考虑与评分的细化有关,mRS分值段从0~6分,且评分的主观性比较强。常用的周围神经系统NDS与NSS评分则比较细化,特别是NDS评分从颅神经、运动、感觉、反射均进行了细化,单侧最高得分140分,双侧最高得分280分,得分越高说明神经功能缺损越多[2]。从该研究结果来看,虽然mRS评分变化不明显,但对于分数细化之后,其评分的变化还是有一定的动态变化。这就给我们提出1个问题,以mRS作为PNS的神经功能评分是否能够全面反映其变化情况?是否应该根据不同系统的疾病进一步细化进行评分?
对相关抗体及症状评分的相关性分析发现,治疗前相关抗体的定量与神经症状评分都没有明显关系,临床发现抗体滴度的高低并不能直接反映病情的轻重及患者症状的研究程度[8],该研究数据的统计结果证实了临床的判断。但本研究发现二者随着用药时间点不同均有动态的下降,在治疗中随着改为口服药物后及治疗结束后都有不同程度反弹,那么这种动态变化的趋势是否具有相关性呢?对于这种变化趋势的分析,本研究采用了其变化率的相关性分析,通过比较分析发现这些数据均符合正态分布,本研究对其治疗前、治疗开始及治疗结束后不同的时间点临床症状评分与抗体滴度的变化率进行了相关性分析,结果表明抗-Hu抗体、抗-Yo抗体以及与NDS评分的变化均无明显关系,未反映出变化趋势具有相关性。在治疗开始后1周mRS及NSS评分的变化率与抗RI抗体的变化率呈正相关,而治疗开始后4周mRS评分的变化率与抗RI抗体的变化率呈正相关。但治疗结束后1周及治疗结束后3月的抗体的变化情况与神经功能评分均无明显关系。在治疗期间为什么采用不同的评分则相关的意义有所不同,是否与评分有关呢?但进一步分析发现也可能存在其他的原因,如抗Hu抗体阳性的患者本身多为预后不良的小细胞肺癌患者,其免疫治疗的效果可能有限[9],而抗-Yo抗体多见为卵巢癌及乳腺癌,临床以小脑变性及中枢性系统变化为主,多并发运动神经元病、脑脊髓病等表现,其免疫治疗效果也可能有限。抗Ri抗体常见的肿瘤为乳腺癌、肺癌、卵巢癌、胃肠道肿瘤等,其PNS临床症状表现多样,周围神经疾病患者轻重不一[11],且在一定程度上其抗体变化情况与临床症状变化的趋势呈一致性。对于为什么在治疗结束后包括抗Ri抗体及其他抗体的变化与神经症状评分的变化均无明显关系呢?随着免疫抑制剂作用的减弱,抗体在一定程度上反弹,抗体反弹提示对神经系统的免疫损害可能再次出现,但终归需要一定时间的作用,故抗体的反弹速度与临床症状的复发或加重在时间上可能是不一致的。
但对于PNS来说,其临床症状的影响因素及问题还有很多,如原发肿瘤的治疗直接关系到其症状的变化,而对于化疗药物及放疗本身亦可能损伤周围神经,本研究尽可能地排除了放化疗后引起的神经功能缺损加重的病例,但仍不能确定无变化的患者是与放化疗有关。由于神经系统副肿瘤综合征发病率较低,且较为分散,单纯的单中心病例很难具有说服力,因此对于PNS多中心的合作是推进PNS研究进一步深入的重要方法[12]。
[1] 吴江,贾建平,崔丽英.神经病学[M].北京:人民卫生出版社,2005:419-423.
[2] Dyck PJ.Detection,characterization,and staging of polyneuropathy: assessed in diabetics[J].Muscle Nerve,1988,11(1):21-32.
[3] 吕少萍.神经系统副肿瘤综合征的生物标志物检测[D].济南:山东大学,2013:25-32.
[4] 姜海伟,胡晴,鄢艳红,等.免疫抑制治疗对36例神经系统副肿瘤综合征相关抗体定量的动态影响[J].卒中与神经疾病,2016,23(2):80-83.
[5] Shams'ili S.Janet de beukelaar,Jan willem gratama,e t al.an uncontrolled trial of rituximab for antibody associated paraneoplastic neurological syndromes[J].J Neurol,2006,253(1):16-20.
[6] De Jongste AH,Van Gelder T,Bromberg JE,et al.A prospective open-label study of sirolimus for the treatment of anti-Hu associated paraneoplastic neurological syndromes[J].Neuro Oncol,2015,17(1):145-150.
[7] Orange D,Frank M,Tian S,et al.Cellular immune suppression in paraneoplastic neurologic syndromes targeting intracellular antigens[J].Arch Neurol,2012,69(9):1132-1140.
[8] Paul NL,Kleinig TJ.Therapy of paraneoplastic disorders of the CNS[J].Expert Rev Neurother,2015,15(2):187-193.
[9] 刘琳琳,刘冉.神经系统副肿瘤综合征抗体[J].国际神经病学神经外科学杂志,2012,39(1):98-101.
[10] Greenlee JE,Clawson SA,Hill KE,et al.Neuronal uptake of anti-Hu antibody,but not anti-Ri antibody,leads to cell death in brain slice cultures[J].J Neuroinflammation,2014,11(1):160.
[11] Nicola LMP,Timothy JK.Therapy of paraneoplastic disorders of the CNS[J].Neurother,2015,15(2):187-193.
[12] Giometto B,Vitaliani R,Lindeck-Pozza E,et al.Treatment for paraneoplastic neuropathies[J].Cochrane Database Syst Rev,2012,12: CD007625.DOI:10.1002/14651858.12.Dec.2012.
[13] Honnorat J.Early-onset immunotherapy by intravenous immunoglobulin and corticosteroids in well characterized onconeural-antibody-positive paraneoplastic neurological syndrome[J].Clin Exp Immunol,2014,178(Suppl 1):127-129.
Thedynamiceffectsonimmunosuppressivetherapyto26casesofparaneoplasticperipheralnervedisease
JiangHaiwei,HuQing,YanYanhong,et,al.
DepurtmentofNeurology,ThirdPeople’sHospitalofHubeiProvince,Wuhan430033
ObjectiveTo investigate the dynamic effect of the immunosuppressant on both paraneoplastic peripheral nerve disease related antibody titer and clinical symptom scores.Methods26 cases of paraneoplastic peripheral nerve disease were
standardized immunosuppressant treatment,The serum antibodies of anti -Hu,anti -Yo and anti -Ri were quantitatively detected by ELISA method before treatment,one week during treatment,four weeks during treatment,one week after treatment and three months after treatment respectively.At the same time,the clinical symptoms were astimated with the Neurological Symptom Scale (NSS),Neurological Disability Scale (NDS),Modified Rankin Scale (mRS).Then to analysis correlation between the antibody titers and clinical symptoms on the change rate with the time of treatment.ResultsThe overall changes on quantitative titer include of anti -Hu(F=7.634,P=0.00),anti -Yo(F=6.21,P=0.00),and anti -Ri(F=3.80,P=0.02) were statistically significant.Compared with before treatment,One weeks during the treatment,titer of anti Hu began to decline(t=3.70,P=0.01),but three months after treatment titer changes were not statistically significant compared with before treatment (t=1.00,P=0.33).Clinical symptom assessment: mRS,NDS,NSS in one weeks during treatment were decreased significantly (mRS:t=2.37,P=0.03;NDS:t=2.58,P=0.02;NSS:t=3.39,P=0.00) but the overall change on mRS (F=1.84,P=0.15)was not statistically significant,the overall change on NDS (F=3.27,P=0.02) and NSS (F=4.89,P=0.01) was statistically significant,NDS,NSS in four weeks after treatment were decreased significantly compared with before treatment (t=2.22,P=0.04).Before treatment,There was no significant correlation between the titer of antibody and neurological symptom score (P>0.05).In one weeks during treatment,the change rates of mRS and NSS were correlated with the rate of anti -RI(mRS:r=0.46,P=0.02;NSS:r=0.40,P=0.04).In four weeks during treatment,the change rate of mRS was correlated with the rate of anti -RI(r=0.45,P=0.02).There was no significant correlation in change rate beteween other antibodies and neurological symptom score during treatment (P>0.05).There was no significant correlation in change rate beteween all antibodies and neurological symptom score after treatment (P>0.05).ConclusionImmunosuppressive therapy could effectively inhibit the titer of antibody and properly relieve clinical symptoms associated with paraneoplastic peripheral nerve disease.It’s long-term effects after treatment was no significant correlation.
Immunosuppressive therapy Paraneoplastic peripheral nerve disease Related antibody Clinical neurological symptom Dynamic effects
R739.4
A
1007-0478(2017)05-0439-05
10.3969/j.issn.1007-0478.2017.05.014
(2016-12-13收稿)
