Nrf2激活对AGEs诱导大鼠海马损伤的抗炎、抗氧化保护作用
2017-11-06董泗芹徐松侯训尧罗鼎真陈健刘雪平
董泗芹 徐松 侯训尧 罗鼎真 陈健 刘雪平
国家自然科学基金(基金编号为30971036);山东省自然科学基金(基金编号为Y2008C13)
250021 济南,山东大学附属省立医院老年神经内科[董泗芹 徐松 侯训尧 罗鼎真 陈健 刘雪平(通信作者)]
Nrf2激活对AGEs诱导大鼠海马损伤的抗炎、抗氧化保护作用
董泗芹 徐松 侯训尧 罗鼎真 陈健 刘雪平
目的探讨核因子红系2相关因子2(nuclear factor erythroid derived 2-related factor 2,Nrf2)激活剂莱菔硫烷(sulforaphane,SFP)对糖基化终末产物(advanced glycation products,AGEs)诱导大鼠海马氧化应激损伤和炎症反应的保护作用及其机制。方法40只Wistar大鼠被随机分为4组:生理盐水组(Control组)、SFP对照组、AGEs组和SFP组,给予AGEs组及SFP组大鼠双侧海马立体定向注射AGEs 5 μL,造成AGEs组大鼠海马损伤,Control组及SFP对照组注射等量的生理盐水作为对照;造模前1周给予SFP组和SFP对照组大鼠5 mg· kg-1·d-1SFP腹腔注射,连续4周,AGEs组及Control组则同时给予同体积的生理盐水,造模结束后3周进行Morris水迷宫实验,测定大鼠逃避潜伏期及穿越平台次数;生化试剂盒检测大鼠海马超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)活性及丙二醛(MDA)水平;ELISA和Western blot法测定肿瘤坏死因子(TNF-α)以及白介素-1β(IL-1β)的表达水平。结果与Control组比较,AGEs组大鼠逃避潜伏期明显延长,穿越平台次数减少;海马氧化应激及炎症反应水平明显升高。SFP组较AGEs组逃避潜伏期显著降低、穿越平台次数明显增加;海马组织抗氧化系统水平升高;炎症因子表达减少。结论SFP作为Nrf2激动剂,能改善AGEs引起的氧化应激和炎症反应,具有神经保护作用。
糖基化终末产物 莱菔硫烷 氧化应激 p-NF-κB
糖基化终末产物(advanced glycation end products,AGEs)是蛋白质的氨基、脂类或核酸等生物大分子和葡萄糖及其他还原糖的羰基经过糖基化反应生成的一类终末不可逆聚合物。AGEs在体内随年龄的增长不断增多,可以与其受体(receptor for AGEs,RAGE)结合,从而激活下游信号传导通路,引起氧化应激、促炎症反应以及淀粉样蛋白的沉积等阿尔茨海默病(AD)样病理变化,也可引起糖尿病神经病变、血管病变、肾脏病变等诸多并发症的发生发展[1-2]。因此,阻断AGEs的作用或可成为AD等衰老相关疾病防治的有效手段之一。核因子红系2相关因子2(nuclear factor erythroid derived 2-related factor 2,Nrf2)是细胞内调节抗氧化反应的重要转录因子[3]。近年来多项研究表明Nrf2激活后可以对多种疾病状态下的神经元起保护作用[4]。但Nrf2激活对AGEs引起的神经元损伤作用及其机制仍不清楚,本研究拟探讨Nrf2激动剂莱菔硫烷(Sulforaphane,SFP)对AGEs所致的海马神经元损伤的保护作用,并从氧化应激和炎症反应来探讨其相关机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 40只健康成年雄性Wistar大鼠购自山东大学齐鲁医学部实验动物中心,体重250~280 g。给予标准啮齿类动物饲料喂养1周后继续自由进食和饮水,室温约25℃,湿度约50%。
1.1.2 主要试剂和仪器 SFP购自加拿大多伦多TRC公司;AGEs-BSA(10 mg/ml)购自Biovision公司,小鼠抗IL-1β多克隆抗体购自CST公司,兔抗TNF-α多克隆抗体购自ImmunoWay生物公司产品, SOD、GSH-Px、CAT及MDA试剂盒购自南京建成生物工程研究院。免疫组化二抗、DAB显色试剂盒购自北京中杉金桥生物技术有限公司,小鼠抗β-actin多克隆抗体购自美国Santa Cruz公司,组织总蛋白抽提试剂盒、BCA浓度测定试剂盒以及化学发光法(ECL)发光液为上海申能博彩产品,倒置相差显微镜为德国Leica公司产品。
1.2 方法
1.2.1 动物分组与模型建立 40只Wistar大鼠被随机分为生理盐水组(Control组)、SFP对照组、AGEs组与SFP组,每组大鼠各10只;大鼠麻醉后固定于立体定向仪上,头部备皮消毒,在颅顶正中线位置切开,采用微量注射泵海马立体定向注射法[5];AGEs组和SFP组大鼠双侧海马内分别注射AGEs 5 μL,造成AGEs海马损伤,Control组和SFP对照组按照同样方法注射等量生理盐水作为海马损伤模型的空白对照;造模前1周以5 mg· kg-1·d-1给予SFP组和SFP对照组腹腔注射SFP,连续给药4周,AGEs组、Control组则同时给予腹腔注射同样体积的生理盐水作为空白对照。
1.2.2 Morris水迷宫实验 水迷宫为一圆形水池,平均分为4个象限,将平台置于第一象限的中央;造模3周后5 d开始水迷宫试验,前4 d为定向航行试验,在同一时间段内分别训练4次;训练开始前在水迷宫池壁分别标4个方向的入水点,将平台置于西南象限正中,向水池中注入牛奶并高于平台,然后把大鼠从4个入水点放进迷宫若干次,训练大鼠寻找水下的平台的能力;第5 d任意选择1个入水点把大鼠放入水池,记录其每次找到平台的时间即为逃避潜伏期(Escape latency,EL),并记录大鼠60 s内穿越平台的次数。
1.2.3 标本采集 水迷宫试验结束后3%苯巴比妥腹腔注射麻醉大鼠,剪开胸腔,从左心室灌入生理盐水的同时剪开右心耳,等清亮液体从右心耳流出,然后断头取脑,分离海马用液氮保存,用于抗氧化酶生化试剂盒、ELISA以及Western blot检测。
1.2.4 SOD、GSH-Px、CAT酶活性,MDA水平检测 准确称取待测海马组织,按照重量体积比1:9加冰生理盐水制成10%海马组织匀浆,严格按照生化试剂盒说明书检测SOD活性、GSH-Px酶活性、CAT酶活性和MDA水平。其中SOD酶活性检测采用WT-1法,二硫代二硝基甲苯酸法检测GSH-Px酶活性,采用钼酸铵法检测CAT酶活性,硫代巴比妥酸法测定MDA水平。
1.2.5 Western印迹及ELISA法检测TNF-α和IL-1β表达水平 取冷冻好的海马组织提取蛋白,二喹啉甲酸(BCA)法测定提取蛋白浓度,将蛋白注入凝胶孔内,经聚丙烯酰氨凝胶电泳转移到聚偏乙烯(PVDF)膜上,然后采用封闭液封闭,10 mL的一抗稀释液孵育,4 ℃过夜,第2 d采用Tris盐酸缓冲液(TBST)洗膜3次,然后加入到同辣根过氧化酶结合的二抗于室温下一起孵育1 h;TBST洗膜3次后将膜置于X线片与增感屏接触,照相和条带密度扫描采用Alpha Imager 2000凝胶图像分析系统(美国Alpha innotech公司产品),最后计算目的蛋白表达相对水平:相对系数=目的带表达强度/β-actin表达强度,从而半定量分析;应用ELISA试剂盒测定IL-1β和TNF-α的水平,具体按说明书步骤操作;最后用分光光度计在450 nm 波长下测吸光度(A) 值,绘制标准曲线,根据曲线计算炎症因子TNF-α和IL-1β水平。

2 结 果
2.1 实验动物生存情况 实验过程中AGEs组大鼠死亡2只:1只死于手术时出血过多可能造成的颅内压增高;1只死于立体定向注射前麻醉过深;SFP组大鼠死亡1只,死于麻醉过深,死亡大鼠分别给以相应的补充。
2.2 Morris水迷宫实验 AGEs组大鼠学习记忆能力显著降低,表现为试验第5 d逃避潜伏期较Control组显著延长(P<0.01),穿越平台次数明显减少(P<0.01),SFP组较AGEs组逃避潜伏期明显减少(P<0.05),穿越平台次数增加(P<0.01)(图1)。

图1 各组大鼠Morris水迷宫实验第5d逃避潜伏期以及穿越平台的次数 与Control组比较,∗P<0.01;与SFP组比较,△P<0.05
2.3 海马SOD、GSH-Px、CAT酶活性及MDA水平 与Control组比较,AGEs组大鼠海马组织SOD、GSH-Px、CAT酶活性明显降低(P<0.01),而MDA水平显著升高(P<0.01);SFP组较AGEs组SOD、GSH-Px、CAT酶活性显著升高(P<0.05),而MDA水平下降(P<0.05)(表1)。
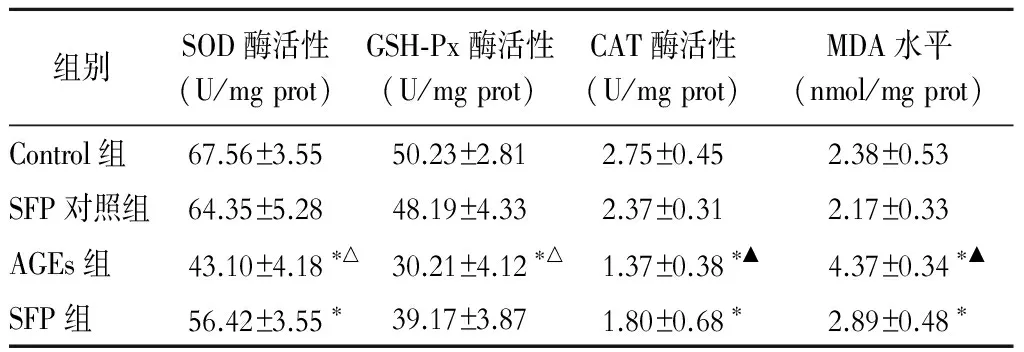
表1 各组大鼠海马组织SOD、GSH-Px及CAT酶活性及MDA水平
注:与Control组比较,*P<0.01;与SFP组比较,△P<0.05,▲P<0.01
2.4 ELISA法检测海马炎症因子TNF-α和IL-1β的表达水平 AGEs组TNF-α及IL-1β表达水平较Control组显著升高(P<0.01),SFP组TNF-α及IL-1β表达水平较AGEs组显著降低(P<0.01)(图2)。
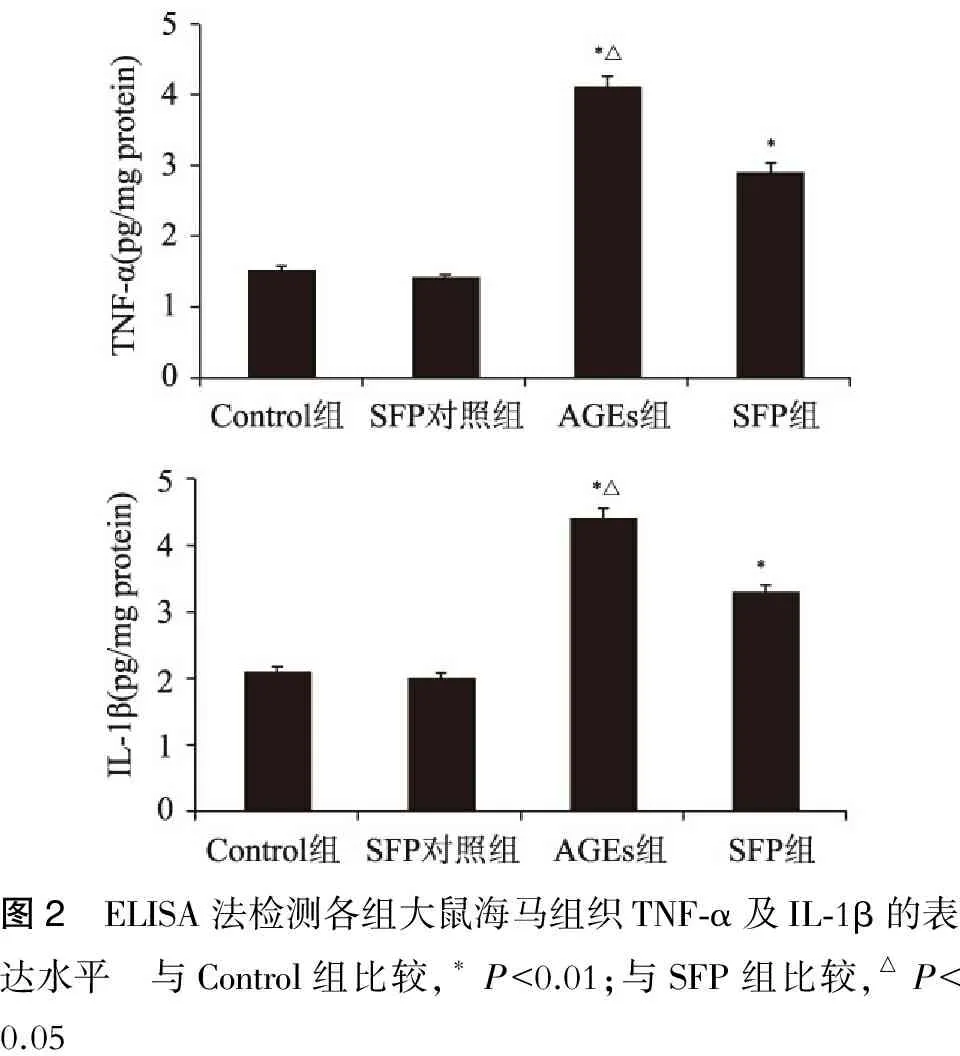
图2 ELISA法检测各组大鼠海马组织TNF⁃α及IL⁃1β的表达水平 与Control组比较,∗P<0.01;与SFP组比较,△P<0.05
2.5 Western blot检测大鼠海马组织TNF-α及IL-1β表达水平 AGEs组TNF-α及IL-1β表达水平较Control组显著升高(P<0.01),SFP组TNF-α及IL-1β表达水平较AGEs组显著降低(P<0.01)(图3)。

图3 Westernblot法检测各组大鼠海马组织TNF⁃α及IL⁃1β的表达水平 与Control组比较,∗P<0.01;与SFP组比较,△P<0.05
3 讨 论
随着社会经济发展,高糖、高脂等西方饮食越来越多被人们食用,而西方饮食富含糖基化终末产物(AGEs)与人类健康密切相关,故研究AGEs对人体的危害及防治具有重要意义。AGEs随个体年龄的增长在体内不断累积,可以引起许多毒性反应,AGEs直接修饰蛋白质、脂肪以及氨基酸,可改变其结构与功能,还可以与其受体(receptor for AGEs,RAGE)结合,激活下游信号传导通路,引起氧化应激和促炎症反应的产生,促进阿尔茨海默病(Alzheimer’s disease, AD)、糖尿病神经病变、肾脏病变等诸多并发症的发生发展[5-6]。
Moris水迷宫实验是当前应用最为广泛的一种评估啮齿类动物学习和记忆能力的实验方法[7]。根据Morris水迷宫实验结果,发现本研究所采用的Nrf2激动剂莱菔硫烷(SFP)具有增加认知能力的作用,具体表现为与AGEs组大鼠比较,逃避潜伏期(EL)和大鼠经过平台所在位置的次数分别显著缩短和增加,而SFP处理的大鼠则在实验过程中表现显著改善。以上结果表明SFP可以改善大鼠海马注射AGEs后受损的空间学习记忆能力。
有研究表明氧化应激是AD进展过程中的最早期事件[8]。过量的AGEs在脑内蓄积,与 RAGE结合后导致活性氧(reactive oxygen species,ROS)等氧化产物的积聚,引起脑组织氧化损伤;ROS产生可以诱导IL-1β、IL-6以及TNF-α等多种细胞炎症因子的表达[9]。SOD、GSH-Px及CAT等作为体内重要的抗氧化系统,可以有效地清除机体活性氧类和过氧化物的过度产生,也间接地反映了机体清除氧自由基、保护机体免受氧自由基氧化损伤的能力。MDA是体内脂质过氧化代谢产物,反映脂质过氧化的水平。AGEs可以造成大鼠脑组织和SH-SY5Y细胞SOD、GSH-Px、CAT活性降低,MDA水平增加[10]。本实验结果亦表明,AGEs海马注射可以造成大鼠海马内SOD、GSH-Px及CAT活性降低;Nrf2激动剂SFP腹腔注射可以明显增加SOD、GSH-Px及CAT的活性,显著降低海马内MDA的水平。提示Nrf2激活在对AGEs造成的氧自由基生成和氧化应激中具有保护作用。IL-1β及TNF-α是重要的神经炎症因子之一,AGEs可以引起大鼠脑组织内促炎症细胞因子IL-1β及TNF-α表达水平增加,阻断RAGE可以改善AGEs诱导的炎症反应[11]。本实验结果还表明AGEs海马注射可以引起IL-1β及TNF-α表达水平较Control组明显增加,SFP组炎症因子表达水平明显降低,提示SFP可以减轻海马内炎症反应。有研究表明,AGEs与RAGE结合后激活神经胶质细胞及小胶质细胞内信号转导通路,诱导核转录因子kappa B(nuclear transcription factor,NF-κB)表达,从而进一步上调多种炎症因子比如IL-1β及TNF-α的产生;NF-κB还可以诱导氧自由基的生成[12]。因此,氧自由基、炎症因子及其它炎症介质可导致神经元凋亡,进而引起AD等疾病的发生发展。未来将进一步探讨Nrf2在抗炎、抗氧化中可能存在的信号通路。
Nrf2作为机体内源性抗氧化系统的关键调节蛋白,在氧化应激条件下可发生核转位,与抗氧反应元件ARE结合, 从而启动下游一系列抗氧化酶基因的转录, 提高抗氧化酶表达水平,发挥抗氧化作用。大量研究表明,Nrf2诱导剂具有神经保护作用,在AD等神经退行性疾病模型中能减缓氧化应激、减轻炎症反应。激活Nrf2-ARE通路而发挥神经保护作用越来越受研究者重视。SFP是Nrf2通路的诱导剂,在西兰花等十字花科蔬菜中大量存在,大量研究表明SFP激活Nrf2的机制主要是改变Keap1半胱氨酸残基的构象,Nrf2入核积累并激活下游抗氧化酶的转录;SFP还能提高细胞内激酶活性,从而使Nrf2磷酸化或调节Nrf2的活性[13], 诱导II相酶的表达;在糖尿病心肌病模型中SFP能上调Nrf2表达和下游NQO1和HO-1基因的转录[14];SFP能逆转细胞凋亡,降低ROS的产生,增加Nrf2和下游HO-1等抗氧化酶的表达水平。此外,在肾功能障碍、肝纤维化和肿瘤等模型中SFP能减缓氧化应激, 改善炎症反应。临床研究显示, 口服SFP能增加上呼吸道中抗氧化酶的表达水平,如NQO1、HO-1、GSTM1和GSTP1等[16]。
本研究通过建立AGEs海马损伤大鼠模型,并采用Nrf2激动剂SFP干预,发现SFP可以显著改善大鼠学习记忆功能,减缓海马内氧化应激和炎症反应,揭示了Nrf2在神经保护作用中的可能机制。随着Nrf2激活对脑损伤的保护作用及其机制的深入研究,Nrf2或可成为AD等神经退行疾病防治的关键靶点。我们将进一步探讨Nrf2激活对神经保护作用的信号转导通路,为其应用于神经退行性疾病的治疗提供理论依据。
[1] Srikanth V,Maczurek A,Phan T,et al.Advanced glycation endproducts and their receptor RAGE in Alzheimer's disease[J].Neurobiol Aging,2011,32(5):763-777.
[2] Yan Fang,Barile R,D'agati Vivette,et al.The biology of RAGE and its ligands: uncovering mechanisms at the heart of diabetes and its complications[J].Curr Diab Rep,2007,7(2):146-153.
[3] Corbett M,Bogers WM,Heeney JL,et al.Aerosol immunization with NYVAC and MVA vectored vaccines is safe, simple, and immunogenic[J].Proc Natl Acad Sci U S A,2008,105(6):2046-2051.
[4] Lin MT,Beal MF.Mitochondrial dysfunction and oxidative stress in neurodegenerative diseases[J].Nature,2006,443(7113):787-795.
[5] Chen Xi,Walker G,Schmidt Marie,et al.RAGE: a potential target for Abeta-mediated cellular perturbation in Alzheimer's disease[J].Curr Mol Med,2007,7(8):735-742.
[6] Bierhaus Angelika,Humpert M,Morcos Michael,et al.Understanding RAGE, the receptor for advanced glycation end products[J].J Mol Med (Berl),2005,83(11):876-886.
[7] Morris R.Developments of a water-maze procedure for studying spatial learning in the rat[J].J Neurosci Methods,1984,11(1):47-60.
[8] Cai Z.Zhao B and ratka a[J].Oxidative stress and beta-amyloid protein in Alzheimer's disease.Neuromolecular Med,2011,13:223-250.
[9] Smith MA,Rottkamp CA,Nunomura A,et al.Qxidative stress in Alzheimer's disease[J].Biochim Biophys Alta,2000,1502(1):139-144.
[10] Yin Qing,Dong Fang,Dong Qin,et al.AGEs induce cell death via oxidative and endoplasmic reticulum stresses in both human SH-SY5Y neuroblastoma cells and rat cortical neurons[J].Cell Mol Neurobiol,2012,32(8):1299-1309.
[11] Hong Yan,Shen Chao,Yin Qingqing,et al.Effects of RAGE-Specific inhibitor FPS-ZM1 on amyloid-β metabolism and AGEs-Induced inflammation and oxidative stress in rat hippocampus[J].Neurochem Res,2016,41(5):1192-1199.
[12] Mecocci P,Mariani E,Polidori MC,et al.Antioxidant agents in Alzheimer's disease[J].Cent Nerv Syst Agents Med Chem,2008,8(1):48-63.
[13] Keum Sam.Regulation of the Keap1/Nrf2 system by chemopreventive sulforaphane: implications of posttranslational modifications[J].Ann N Y Acad Sci,2011,1229(1):184-189.
[14] Zhang Zhiguo,Wang Shudong,Zhou Shanshan,et al.Sulforaphane prevents the development of cardiomyopathy in type 2 diabetic mice probably by reversing oxidative stress-induced inhibition of LKB1/AMPK pathway[J].J Mol Cell Cardiol,2014,77(5):42-52.
[15] Lin Hao,Wei Bo,Li Guangsheng,et al.Sulforaphane reverses glucocorticoid-induced apoptosis in osteoblastic cells through regulation of the Nrf2 pathway[J].Drug Des Devel Ther,2014,8(2):973-982.
[16] Riedl A,Saxon Andrew,Diaz-Sanchez David.Oral sulforaphane increases Phase II antioxidant enzymes in the human upper airway[J].Clin Immunol,2009,130(3):244-251.
NeuroprotectiveeffectsofNrf2agonistonAGEsinducedhippocampusinjurybyattenuatingoxidativestressandneuroinflammation
DongSiqin,XuSong,HouXunyao,etal.
DepartmentofSenileNeurology,ShandongProvincialHospitalAffiliatedtoShandongUniversity,Jinan250021
ObjectiveTo investigate the protective effects of the Nrf2 agonist sulforaphane(SFP) on the advanced glycation products(AGEs)-induced oxidative stress and neuroinflammation and the related mechanisms.MethodsFourty Wistar rats were randomly divided into 4 groups: normal control(Control), SFP control, AGEs and SFP groups. The bilateral hippocampus of rats in AGEs group and SFP group were injected AGEs to make injuring rat models. Control group and SFP group were intraperitoneal injected SFP 5 mg·kg-1·d-1for 4 weeks before the animal models were produced, rats in AGEs and Control groups were injected equal volume of saline intraabominally. Morris water maze was used for testing escape latency and the number of crossing,related kits were used for detecting superoxide dismutase(SOD) activity, glutathione peroxidase(GSH-Px) activity, catalase(CAT) and malondialdehyde(MDA) content in the hippocampus, Western blot and enzyme-linked immunosorbent assay(ELISA) were used for detecting the expression level of neuroinflammation factors, tumor necrosis factor(TNF-α) and interleukin-1 beta(IL-1β).ResultsCompared with Control group, EL elevated, the number of crossings decreased, oxidative stress and neuroinflammatory cytokines levels increased significantly in AGEs induced injury rats. Compared with AGEs group, SFP obviously decreased EL, increased the number of crossings,increased SOD, GSH-Px, CAT activity and decreased MDA content, reduced the expression TNF-αand IL-1βin SFP group.ConclusionNrf2 agonist SFP obviously improved cognitive function in AGEs induced brain injury, also improved the antioxidant ability, lowered inflammation levels in the brain, and had neuroprotective effect.
Advanced glyctions(AGEs) Sulforaphane(SFP) Oxidative stress Inflammation
R742
A
1007-0478(2017)05-0388-05
10.3969/j.issn.1007-0478.2017.05.002
(2016-12-21收稿)
