sEHi对颈动脉狭窄患者内皮祖细胞增殖及PI3K/Akt信号通路的影响
2017-11-06严静陈俊艾志兵周岗丁立何国厚
严静 陈俊 艾志兵 周岗 丁立 何国厚
442000 湖北省十堰市湖北医药学院附属太和医院神经内科
sEHi对颈动脉狭窄患者内皮祖细胞增殖及PI3K/Akt信号通路的影响
严静 陈俊 艾志兵 周岗 丁立 何国厚
目的探讨可溶性环氧化物水解酶抑制剂 (sEHi) AUDA 调控颈动脉狭窄(CS)患者外周血内皮祖细胞(EPCs)增殖的分子机制。方法从CS患者外周血分离、培养内皮祖细胞,收集培养至第7 d的细胞,分为未处理组、AUDA组、PI3K抑制剂(LY294002)组和AUDA+ LY294002组,取无颈动脉狭窄患者的EPCs作为对照组,MTT法检测EPCs的增殖能力,Western blot法检测EPCs Akt磷酸化的水平。结果对照组EPCs增殖能力较未处理组增强,AUDA组较未处理组、AUDA+ LY294002组、LY294002组EPCs增殖能力增强,未处理组、AUDA+ LY294002组较LY294002组内皮祖细胞增殖能力增强;Western blot结果显示AUDA可以促进EPCs P-Akt蛋白的表达,而LY294002可以抑制上述作用。结论AUDA可能通过活化PI3K /Akt信号通路来促进内皮祖细胞的增殖。
可溶性环氧化物水解酶抑制剂 颈动脉狭窄 内皮祖细胞 PI3K/Akt信号通路
颈动脉狭窄是缺血性脑病的常见病因之一,其中严重狭窄还可能因血流动力学机制而引起低灌注性脑卒中。颈动脉狭窄的主要发病机理是动脉粥样硬化,现逐渐明确动脉壁内皮损伤是动脉粥样硬化的始动因素之一,因此受损血管内皮细胞的修复以及再生是延缓动脉粥样硬化的重要治疗靶点[1]。内皮祖细胞(endothelial progenitor cells,EPCs)是一类起源于骨髓、循环至外周血,能够分化增殖为成熟血管内皮细胞的祖细胞。EPCs参与血管新生及损伤后内皮修复等过程,在维持内皮环境稳定中起着重要作用。循环EPCs可作为储存库,随时替换功能失调的内皮细胞,从而在动脉粥样硬化形成的最早期阶段起保护作用[2]。已有研究表明,循环EPCs水平与心血管风险因子总数呈负相关,在一定程度上可以预测心脑血管不良事件发生的风险[3-5]。
环氧二十碳三烯酸( epoxyeicosatrienoic acids,EETs) 是由细胞色素 P450代谢花生四烯酸衍生的脂质化合物,是一类近几年备受重视的具有强大生物活性的内生性脂质环氧化合物,其中EETs改善血管功能的机制主要包括促进内皮细胞增殖、调节血管紧张度和促进血管生成等[6-8]。但是EETs在细胞内半衰期短,经可溶性环氧化物水解酶( soluble epoxide hydrolase,sEH)催化成弱生物活性的二羟基衍生物。通过可溶性环氧化物水解酶抑制剂( soluble epoxidehydrolase inhibition,sEHi) 是增加细胞内EETs浓度和效用的有效途径,AUDA[12-( 3-adamantan-1-y1-ureido ) -dodecanoic acid]是新合成的 sEHi[9]。Li等发现EETs通过诱导PI3K/Akt依赖性转录程序来促进造血干细胞的增殖[10]。许丹焰学者团队发现sEHi通过PI3K/Akt信号通路正向调节冠心病患者EPCs的黏附及成血管功能[11-13]。PI3K/Akt信号通路同样是调控EPCs增殖与凋亡等生理过程的最重要的信号转导通路之一[2],因而本研究主要探讨AUDA对EPCs增殖的影响及其分子机制。
1 资料与方法
1.1 一般资料
选择2015~2016年间在湖北医药学院附属太和医院神经内科住院经全脑血管造影检查确诊有颈动脉狭窄的患者40例为颈动脉狭窄组 ( CS 组),以同期在本院年龄、性别匹配的无颈动脉狭窄者30例作为对照组。有下列病史者予以排除:急、慢性肝肾疾病、慢性消耗性疾病及感染性疾病、冠心病、心脏瓣膜病、恶性肿瘤、外周血管病、自身免疫性疾病、血液系统疾病、重大手术或严重外伤等。
1.2 材料与试剂
EGM-2培养基购自Lonza公司,人纤维连接蛋白购自Millipore公司,胰蛋白酶和胎牛血清购自Gibco公司,LY294002 MTT试剂盒、AUDA、FITC标记的荆豆凝集素I(FITC-UEA-I)购自Sigma公司,Dil标记的乙酰化低密度脂蛋白(Dil-Ac-LDL)购自Molecular Probe公司,FITC-CD34、PE-CD133购自eBioscience公司,Akt、P-Akt抗体购自CST公司,β-Actin抗体购自Abmart公司,人淋巴细胞分离液购自天津灏洋公司。
1.3 EPCs细胞分离、培养和鉴定
所有入组对象行全脑血管造影术前在严格无菌条件下经鞘管从股动脉抽取动脉血30 mL,肝素抗凝,采用密度梯度离心法分离单个核细胞。人纤维连接蛋白预包被24孔细胞培养板,将单个核细胞接种在培养板中,置37 ℃,5%CO2培养箱培养,含体积分数10%胎牛血清的EGM-2完全培养基培养细胞至第4 d换液,以后隔日换液培养至第7 d,细胞与FITC-UEA-I和Dil-Ac-LDL孵育后于激光共聚焦显微镜下进行鉴定,FITC-UEA-I和Dil-AcLDL双染色阳性细胞为早期EPCs。用流式细胞仪鉴定细胞表型CD34、CD133 的表达。
1.4 EPCs实验分组
实验分为对照组、颈动脉狭窄组(未处理组、AUDA组、AUDA+LY294002组、LY294002组),其中AUDA为10 μmol/L、LY294002为10 μmol/L。
1.5 AUDA对EPCs增殖功能的影响
取出培养7 d的内皮祖细胞,制成单细胞悬液,将细胞密度调整至1×104个/mL;按照每孔100 μL(1×103个)接种到包被有人纤维连接蛋白96孔培养板培养8 h,加AUDA干预24 h,LY294002在加AUDA前作用2 h,每一标本做4个复孔,设空白对照,将96孔培养板移入37 ℃、5%CO2培养箱中,培养24 h后每孔加入MTT溶液(5 mg/mL)10 μL,继续培养4 h,每孔加入Formanzan溶解液培养4 h,用酶标仪于490 nm处检测OD值。
1.6 Western Blot检测相关蛋白表达水平
将ECPs以2×105个/mL接种于6孔板,当细胞融合达65%时加入药物干预,48 h后收集细胞并提取蛋白,BCA法进行蛋白定量;经过电泳、转膜后取下硝酸纤维膜,脱脂牛奶封闭1 h后以特异性一抗孵育,4 ℃过夜,洗膜后二抗室温孵育1 h,进行化学发光反应并显影、定影。将图片扫描后用 Image J 图像分析软件进行蛋白灰度分析。
1.7 统计学处理

2 结 果
2.1 研究对象临床资料比较
2组研究对象的年龄、性别、吸烟、饮酒、高血压病史、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白水平比较无明显差异(P>0.05)(表1)。

表1 2组研究对象一般情况比较
2.2 外周血EPCs 光镜下形态学特征
刚分离的外周血单个核细胞呈圆形,折光好,悬浮于培养液中(图1);培养至第4 d,可见细胞贴壁长,由圆形逐渐变为短梭形(图1); 培养至第7 d可见大量长梭形细胞,并呈“集落”样生长,即早期 EPCs(图1)。
2.3 双染法鉴定EPCs
从外周血分离单个核细胞培养至第7 d,贴壁细胞与FITC-UEA-I和Dil-Ac-LDL孵育后使用激光共聚焦显微镜对EPCs 进行鉴定,结合FITC-UEA-I的细胞发绿色荧光,摄取Dil-Ac-LDL的细胞发红色荧光,双染色阳性的细胞为在分化EPCs(图2)。
2.4 流式细胞仪鉴定EPCs 表型
外周血EPCs同时表达特异性抗原 CD34、CD133,其阳性率分别为 78.0、76.9% (图3)。
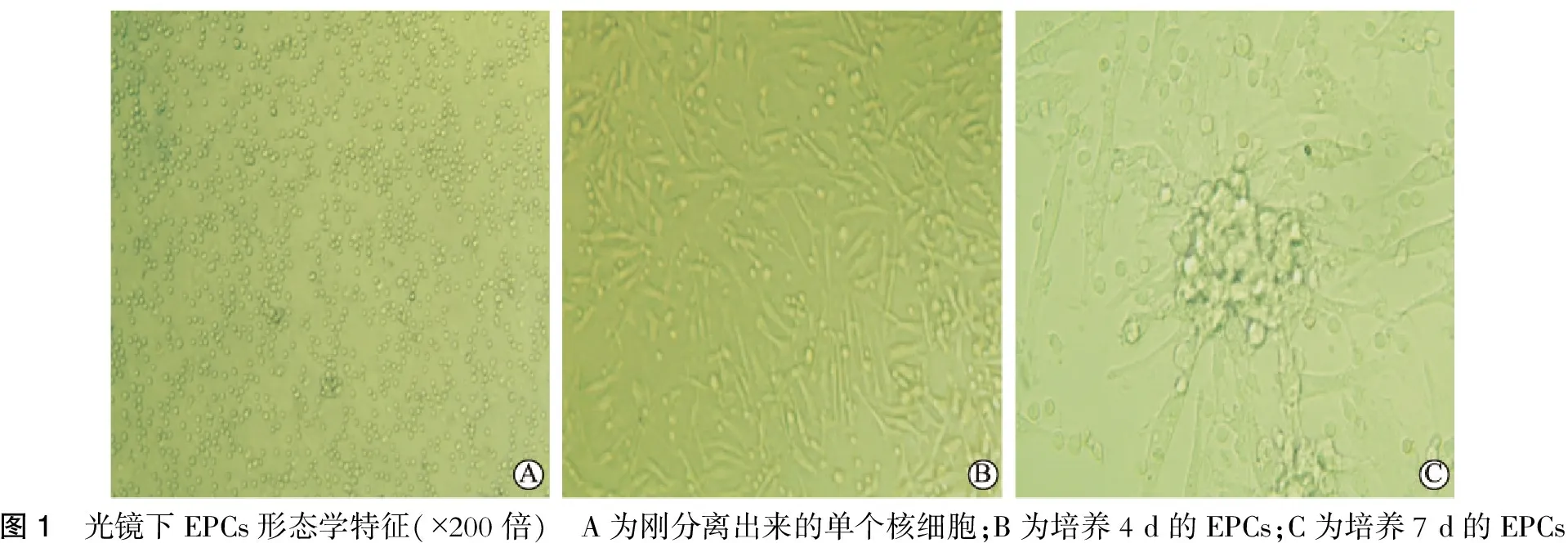
图1 光镜下EPCs形态学特征(×200倍) A为刚分离出来的单个核细胞;B为培养4d的EPCs;C为培养7d的EPCs

图2 激光共聚焦镜下的EPCs形态学特征(×200倍) A为DAPI染色;B为FITC⁃UEA⁃1染色;C为Dil⁃Ac⁃LDL双染色

图3 EPCs流式细胞术检测
2.5 AUDA及LY294002作用后对EPCs增殖功能的影响
与对照组相比,未处理组CS患者EPCs吸光度值较低(P<0.05)。与未处理组相比,AUDA单独给药后可以增加吸光度值(P<0.05),预先使用LY294002作用2 h后可明显抑制AUDA的上述作用(P<0.05),未处理组与AUDA+LY294002组OD值未见明显差异(P>0.05),单独使用LY294002后EPCs吸光度值最低(图4)。

图4 AUDA及LY294002作用后对内皮祖细胞增殖功能的影响
2.6 AUDA对内皮祖细胞P-Akt表达的影响
与对照组相比,未处理组CS患者早期 EPCs Akt的磷酸化水平下降(P<0.05)。与未处理组相比,AUDA作用后EPCs Akt的磷酸化水平升高(P<0.05),预先使用LY294002作用EPCs 2 h后AUDA对 EPCs Akt磷酸化的促进作用消失(P<0.05),未处理组与AUDA+LY294002组Akt磷酸化程度未见明显差异(P>0.05)(图5)。
3 讨 论
脑血管病是我国致死、致残率较高的疾病,其中颈动脉狭窄是缺血性脑血管病的常见发病原因,但是目前治疗颈动脉狭窄的方法在适应症及治疗效果上均有一定的局限性[14]。近年来,EPCs因其具有参与动脉内皮损伤后修复以及促进成人新生血管的生成能力,而成为众多学者研究的热点。根据体外培养时间的长短可分为早期和晚期EPCs,培养5~7 d的是早期EPCs,培养2~3周为晚期EPCs。EPCs参与血管生成的机制包括以旁分泌及分化为成熟内皮细胞的方式参与血管的动态维持和生理性重建[15]。诸多研究表明EPCs在延缓动脉粥样硬化的形成、发展以及促进梗死周围区域新生血管的生成过程中发挥重要作用[16]。Bitterli等学者对外周血管疾病的研究中发现EPCs数量和功能在内皮功能完整性的维护中占据中心地位,并直接影响外周动脉血管中的动脉粥样硬化的程度[17-18]。在对SD大鼠大脑中动脉闭塞模型的研究中发现经颈内动脉输入自体外周血源性EPCs通过增加梗死区新生毛细血管的密度来减少脑梗死的面积和神经功能缺损的程度[19]。增加EPCs的数目是减少血管疾病和功能失调的重要机制之一,因此目前研究主要侧重于调节内皮祖细胞功能、增殖及凋亡的途径。有研究表明肿瘤坏死因子、脂多糖通过下调PI3K/Akt 信号通路来减少EPCs的数量;雌激素、他汀类药物则通过上调PI3K/Akt 信号通路来促进EPCs的增殖[2]。

图5 Westernblot检测P⁃Akt/Akt表达水平 A为对照组;B为未处理组;C为AUDA+LY294002组;D为AUDA组;E为LY294002组
PI3K/Akt 信号通路是细胞内重要的信号转导通路之一,可以通过影响下游效应分子的活化状态,参与细胞内很多重要的生物学过程的调控,发挥着抑制细胞凋亡、促进增殖的作用。Akt是 PI3K 信号传导通路中一个重要的下游靶激酶。PI3K 活化产生 PIP3 使 Akt 转位到细胞膜,通过催化Akt的Ser473 和(或)Thr308 位点磷酸化而激活,引起信号通路的级联反应[20]。
AUDA作为新一代的sEHi能够有效地抑制sEH 将EETs分解为低活性的二羟基衍生物[8]。EETs保护心脑血管作用的机制包括降低血压、促进内皮细胞增殖、促进血管生成、减少炎症反应和维持血浆高密度脂蛋白的浓度等[21-22]。其中促进内皮细胞增殖的机制涉及到促进PI3K/AKt依赖的叉头转录因子磷酸化,从而下调下游促凋亡蛋白的表达[23]。既往研究表明在动脉粥样硬化患者中ox-LDL通过减少EPCs AKt的磷酸化、eNOS蛋白的表达以及促进LOX-1蛋白的表达来使EPCs的功能减弱、数量减少[2]。本研究结果显示CS患者未处理组外周血早期 EPCs较对照组外周血早期EPCs增殖能力减弱,而AUDA单独给药后可以使CS患者EPCs增殖能力增强,但是在给予PI3K抑制剂LY294002以后未再观察到AUDA对EPCs增殖能力的促进作用。通过Western blot的实验结果得到未处理组EPCs表达的Akt的磷酸化水平较对照组低,AUDA组Akt的磷酸化水平升高,同样在给予LY294002以后抵消了AUDA的促Akt磷酸化作用。
综上所述,本研究认为AUDA可能部分通过活化PI3K /AKT信号通路,促进内皮祖细胞增殖,但是否有其他信号通路参与以及 Akt激活后的下游信号通路的分子机制,还需进一步研究。
[1] Alagoz Neslihan,Acar Atlgan,Acar Türkan,et al.Relationship between carotid stenosis and infarct volume in ischemic stroke patients[J].Med Sci Monit,2016,22:4954-4959.
[2] Du FY,Zhou J,Gong R,et al.Endothelial progenitor cells in atherosclerosis[J].Front Biosci (Landmark Ed),2012,17:2327-2349.
[3] He GH,Zhang HM,Zhang XD,et al.The comparison of EPC count and function in the situation of vascular repair at early and late stage[J].J Thromb Thrombolysis,2013,36(3):271-276.
[4] Yoder MC.Human endothelial progenitor cells[J].Cold Spring Harb Perspect Med,2012,2(7):92-96.
[5] Aragona Oriana,Imbalzano Egidio,Mamone Federica,et al.Endothelial progenitor cells for diagnosis and prognosis in cardiovascular disease[J].Stem Cells Int,2016(9):8043792.
[6] Panigrahy Dipak,Kalish T,Huang Sui,et al.Epoxyeicosanoids promote organ and tissue regeneration[J].Proc Natl Acad Sci U S A,2013,110(33):13528-13533.
[7] Qiu Hong,Li Ning,Liu Yan,et al.Soluble epoxide hydrolase inhibitors and heart failure[J].Cardiovasc Ther,2011,29(2):99-111.
[8] Zhang Juan,Liu Sheng,Lu Hua.Therapeutic effects of the soluble epoxide hydrolase (sEH) inhibitor AUDA on atherosclerotic diseases[J].Pharmazie,2015,70(1):24-28.
[9] Rezaee Zavareh Elham,Hedayati Mahdi,Hoghooghi Rad Laleh,et al.Design,synthesis and biological evaluation of 4-benzamidobenzoic Acid hydrazide derivatives as novel soluble epoxide hydrolase inhibitors[J].Iranian Journal of Pharmaceutical Research,2014,13(Suppl):51-59.
[10] Li Pulin,Lahvic L,Binder Vera,et al.Epoxyeicosatrienoic acids enhance embryonic haematopoiesis and adult marrow engraftment[J].Nature,2015,523(7561):468-471.
[11] Xu DY,Chen C,Jiang Y,et al.Effect of soluble epoxide hydrolase inhibitor on the function of endothelial progenitor cells in patients with coronary heart disease [J].Zhong nan Da Xue Xue Bao Yi Xue ban,2010,35(7):685-692.
[12] Xu DY,Davis BB,Wang ZH,et al.A potent soluble epoxide hydrolase inhibitor,t-AUCB,acts through PPARγ to modulate the function of endothelial progenitor cells from patients with acute myocardial infarction[J].Int J Cardiol,2013,167(4):1298-1304.
[13] Deng min,Li ping,Xu yan,et al.Aerobic exercise-based rehabilitation affects the activities of progenitor endothelial cells through EETs pathway[J].Med Hypotheses,2015,85(6):1037-1038.
[14] Demaerschalk M,Howard George,Brott G.Carotid stenosis:to revascularize,or not to revascularize:that is the question[J].Neurology,2012,78(4):294.
[15] Minhajat Rahmawati,Nilasari Dina,Bakri Syakib.The role of endothelial progenitor cell in cardiovascular disease risk factors[J].Acta Med Indones,2015,47(4):340-347.
[16] Gong X,Shao L,Fu YM,et al.Effects of olmesartan on endothelial progenitor cell mobilization and function in carotid atherosclerosis[J].Med Sci Monit,2015,21:1189-1193.
[17] Bitterli Lukas,Afan Samuel,Bühler Stephan,et al.Endothelial progenitor cells as a biological marker of peripheral artery disease[J].Vasc Med,2016,21(1):3-11.
[18] Fadini Paolo,Coracina Anna,Baesso Ilenia,et al.Peripheral blood CD34+KDR+ endothelial progenitor cells are determinants of subclinical atherosclerosis in a middle-aged general population[J].Stroke,2006,37(9):2277-2282.
[19] Chen YL,Tsai TH,Wallace CG,et al.Intra-carotid arterial administration of autologous peripheral blood-derived endothelial progenitor cells improves acute ischemic stroke neurological outcomes in rats[J].Int J Cardiol,2015,201:668-683.
[20] Yu S,Cui Wei.Proliferation,survival and metabolism:the role of PI3K/AKT/mTOR signalling in pluripotency and cell fate determination[J].Development,2016,143(17):3050-3060.
[21] Roche Clothilde,Besnier Marie,Cassel Roméo,et al.Soluble epoxide hydrolase inhibition improves coronary endothelial function and prevents the development of cardiac alterations in obese insulin-resistant mice[J].Am J Physiol Heart Circ Physiol,2015,308(9):H1020-H1029.
[22] Shen Li,Peng Hongchun,Peng Ran,et al.Inhibition of soluble epoxide hydrolase in mice promotes reverse cholesterol transport and regression of atherosclerosis[J].Atherosclerosis,2015,239(2):557-565.
[23] Askari Ara,Thomson J,Edin L,et al.Roles of the epoxygenase CYP2J2 in the endothelium[J].Prostaglandins Other Lipid Mediat,2013,107:56-63.
TheeffectofsolubleepoxidehydrolaseinhibitoronproliferationandPI3K/Aktsignalingpathwayinendothelialprogenitorcellsfrompatientswithcarotidstenosis
YanJing,ChenJun,AiZhibing,etal.
DepartmentofNeurology,TaiheHospitalAffiliatedtoHubeiUniversityofMedicine,Shiyan442000
ObjectiveTo investigate the molecular mechanism of the soluble epoxide hydrolase inhibitor (sEHi) 12-(3-adamantan-1-y1-ureido)-dodecagon acid (AUDA) in regulating the proliferation of endothelial progenitor cells (EPCs) in patients with carotid artery stenosis (CS).MethodsEPCs were isolated and cultured from the peripheral blood of CS patients,cells were collected after 7 days of culture in vitro,and all of them were divided into Untreated group,AUDA group,PI3K inhibitor LY294002 group and AUDA+ LY294002 group.The proliferation of EPCs was determined by MTT,while the expression of phosphorylated Akt in EPCs was measured by Western blot.EPCs from people without carotid artery stenosis were also cultured as the controls.ResultsThe proliferation of EPCs was stronger in the AUDA group than that in the untreated group,LY294002 group and AUDA+ LY294002 group,and the proliferation of EPCs was stronger in the untreated group and AUDA+ LY294002 group than that in the LY294002 group.Moreover,AUDA treatment increased phosphorylation of Akt,LY294002 which also blocked these effects.ConclusionThe results of the present study suggested that AUDA promoted EPCs proliferation was related to the PI3K/Akt pathway.
Soluble epoxide hydrolase inhibitor Carotid Stenosis Endothelial progenitor cell PI3K /Akt signaling pathway
R543.5
A
1007-0478(2017)05-0402-05
10.3969/j.issn.1007-0478.2017.05.005
(2016-12-30收稿)
