外源NO协同N-乙酰半胱氨酸对肥城桃果实线粒体抗氧化系统的调控作用
2017-11-04高吉刚朱树华
高 珊,王 泉,高吉刚,朱树华
(山东农业大学 化学与材料科学学院,山东 泰安 271018)
外源NO协同N-乙酰半胱氨酸对肥城桃果实线粒体抗氧化系统的调控作用
高 珊,王 泉,高吉刚,朱树华
(山东农业大学 化学与材料科学学院,山东 泰安 271018)
探讨外源NO和N-乙酰半胱氨酸对冷藏期间肥城桃果实线粒体抗氧化系统的影响。分别用15 μmol/L NO溶液,80 mmol/L N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC,活性氧清除剂)和15 μmol/L NO的混合溶液,5 μmol/L的c-PTIO(NO清除剂)溶液对肥城桃果实进行浸果处理,测定果实冷藏期间线粒体呼吸、线粒体膜电势、线粒体中丙二醛和活性氧含量及抗氧化酶活性的变化。15 μmol/L NO处理显著降低了桃果实线粒体ROS的含量;80 mmol/L NAC-15 μmol/L NO处理桃果实线粒体ROS含量在第2周后显著低于对照和其他处理;而5 μmol/L c-PTIO处理桃果实线粒体ROS含量显著高于其他处理。在抗氧化酶(POD、SOD、CAT)活性测定中,15 μmol/L NO处理提高了桃果实线粒体中抗氧化酶的活性,高于对照和5 μmol/L c-PTIO处理;80 mmol/L NAC-15 μmol/L NO处理能够提高SOD的活性,但对于POD和CAT的活性有抑制作用;而5 μmol/L c-PTIO处理抑制桃果实线粒体中抗氧化酶的活性。15 μmol/L NO处理降低了桃果实线粒体中MDA含量,除第2周均低于对照和其他处理外;80 mmol/L NAC-15 μmol/L NO处理桃果实线粒体MDA含量在第1周后显著高于对照和其他处理;而5 μmol/L c-PTIO处理桃果实在第2,3周时线粒体中MDA含量高于对照和15 μmol/L NO处理。15 μmol/L NO处理能够提高线粒体膜电势,在第3周时到达最大值,是对照的1.2倍;80 mmol/L NAC-15 μmol/L NO处理桃线粒体膜电势最高,高于对照和其他处理;而5 μmol/L c-PTIO处理降低了线粒体膜电势,显著低于对照和其他处理。15 μmol/L NO处理抑制了桃线粒体呼吸;80 mmol/L NAC-15 μmol/L NO处理使线粒体呼吸高峰提前1周;而5 μmol/L c-PTIO处理提高了线粒体呼吸高峰,耗氧量大于对照和其他处理。外源NO和NAC处理能够提高桃果实线粒体抗氧化系统的抗氧化能力,延缓桃果实线粒体功能的下降。
桃;NO;N-乙酰半胱氨酸;线粒体;抗氧化系统
线粒体是真核细胞制造能量和有氧呼吸的主要场所,在能量转化、氧化磷酸化、细胞代谢调控及细胞凋亡等方面发挥着重要作用[1-4]。线粒体内含有大量的活性氧类(Reactive oxygen species,ROS),对于氧化应激、细胞凋亡等有重要作用。低温等环境胁迫会引起线粒体ROS爆发,过量的ROS会使细胞面对氧化胁迫的危害,并导致酶失去活性、DNA损伤及脂质过氧化等一系列危害细胞正常生理活动的反应,进而导致细胞死亡[5-6]。桃果实是典型的温敏型果实,对于低温敏感,冷藏期间易发生冷害,从而限制了桃产业的发展。因此,研究采后桃果实线粒体的抗氧化系统,对延长果实储藏期,提高桃的商业价值具有重大作用。桃果实采后贮藏一直是人们研究的重点,前人已经研究1-甲基环丙烯[7]、γ-氨基丁酸[8]、聚乙烯毗络烷酮[9]等物质能够延长桃果实采后贮藏时间,桃果实采后贮藏受温度影响[10],低温下贮藏对桃果实有冷害影响,且5 ℃下桃果实受冷害最严重[11]。采后果实贮藏过程中会产生大量的ROS[12],ROS作为生物中重要的信号分子,参与蛋白巯基氧化特异性传导[13],还在肺组织细胞线粒体凋亡至肺纤维化中发挥重要作用[14],在生物代谢中受到严格控制[15],过量的ROS能够抑制果实和线粒体中氧化损伤,而引起果实衰老。ROS的产生与线粒体膜电势和细胞呼吸链有关[16]。线粒体是细胞呼吸作用产生ATP的场所,是细胞内ROS的主要来源。NO是一种极不稳定的生物自由基,在动物体内的生理功能、信号传递、细胞凋亡及酶调节等都具有重要作用[17],还能调控线粒体中氧的消耗和ROS的生成[18]并且能提高抗氧化酶活性来减少果实中ROS的含量[19],保护李果实线粒体膜的氧化损伤[20],抑制小麦种子在高盐下的线粒体氧化损伤[21],并且对采后果实贮藏品质具有重要的调节作用[22]。N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)作为抗氧化剂,具有抗氧化作用,并对已有的自由基有清理作用,是阻断细胞凋亡的过程[23]。动物组织中NAC在调控细胞代谢、调节免疫功能、抑制炎症反应、预防基因损伤等方面都发挥着重要作用[24-25]。最近研究发现,NO能够抑制李果实存储期间的呼吸速率和ROS的产生[20],并且能够延长桃果实采后的贮藏期[26]。而NAC能够抑制小鼠骨髓干细胞ROS的产生和改善大鼠细胞氧化应激来预防大鼠后囊和核区白内障的发生[27-28]。但是现在的研究对5 ℃下NO处理对桃果实线粒体抗氧化系统的影响,NO和NAC应用于植物抗氧化方面都少有报道。本研究以肥城大红袍桃为试材,采后经15 μmol/L NO溶液、80 mmol/L N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC,活性氧清除剂)和15 μmol/L NO的混合溶液、5 μmol/L的c-PTIO(NO清除剂)溶液浸果处理,测定果实冷藏期间线粒体呼吸、线粒体膜电势、线粒体中丙二醛和活性氧含量及抗氧化酶活性的变化,进而探讨NO和NAC处理对桃果实线粒体抗氧化系统的影响和作用机理,旨在为NO和NAC应用于肥城桃储藏保鲜提供试验依据。
1 材料和方法
1.1试验材料
试验所用肥城桃品种为大红袍,于2014年9月采摘于桃基地,采摘后即刻运回实验室。选择大小相似、长势良好、无病虫害且无机械损伤的八成熟桃果实进行处理。
将肥城桃在0 ℃环境中预冷存储24 h,分别用15 μmol/L NO溶液(处理Ⅰ)、80 mmol/L NAC(预试验最适浓度)和15 μmol/L NO的混合溶液(处理Ⅱ)、5 μmol/L c-PTIO(NO清除剂)溶液(处理Ⅲ),以双蒸水溶液为对照,浸泡30 min,晾干果实表面残留水分后于5 ℃贮藏,每7 d取样1次,所取样品于-80 ℃超低温冰箱存储备用。每种处理用桃30个,各设3个重复。
1.2试验方法
1.2.1 线粒体的提取 参考Braidot等[29]和Millar等[30]的方法,称取桃果实8 g,将其研磨成粉末状,加入16 mL的 25 mmol/L Mops-KOH(pH值7.8,含10 mmol/L麦黄酮,8 mmol/L L-半胱氨酸,0.1% PVP40,1 mmol/L EGTA,0.4 mol/L甘露醇,0.1% BSA),用纱布过滤,在4 ℃下离心(6 000 r/min,5 min),取上清液,在4 ℃下离心(12 000 r/min,30 min),弃上清液。用0.5 mL的10 mmol/L Mops-KOH(pH值7.2,含1 mmol/L EGTA,0.4 mol/L甘露醇,0.1% BSA),重悬浮沉淀,得到线粒体的粗提溶液。重复提取3次。
1.2.2 线粒体的纯化 用蔗糖密度梯度离心法纯化线粒体粗提液[31]。配置2种浓度的蔗糖溶液(0.6,1.4 mol/L蔗糖,0.1% BSA,1 mmol/L EGTA,10 mmol/L Mops-KOH(pH值7.2)),在离心管中加入6 mL 0.6 mol/L蔗糖溶液,将1.4 mol/L蔗糖溶液注射到下层,将线粒体的粗提液,缓缓地铺在0.6 mol/L 蔗糖溶液的上层,4 ℃下离心(12 000 r/min,60 min),抽取0.6 mol/L与1.4 mol/L 2层蔗糖溶液之间的溶液,4 ℃下离心(12 000 r/min,30 min),弃上清液,沉淀即为纯化后的线粒体,冰浴中保存备用。
1.2.3 线粒体蛋白浓度的测定 用1 mL Tris-HCl缓冲液(50 mmol/L,pH值8.5)重悬浮纯化的线粒体。考马斯亮蓝法[32]测蛋白含量,以牛血清蛋白为标准,计算蛋白含量。
1.2.4 线粒体中ROS含量的测定 参考Degli[33]和Jambunathan[34]的方法。用1 mL Tris-HCl缓冲液(100 mmol/L,pH值8.5)重悬浮纯化的线粒体,取100 μL线粒体溶液(空白参比为Tris-HCl缓冲液),加入900 μL Tris-HCl缓冲液(10 mmol/L,pH值7.2)和10 μL 2 mmol/L 2′,7′-二氯荧光素乙二酸盐(DCF-DA)溶液,室温黑暗中孵育0.5 h,用荧光分光光度计检测其荧光强度(最大激发波长 485 nm,最大发射波 530 nm,狭缝 5 nm)。线粒体中ROS含量结果以单位浓度蛋白的相对荧光强度(a.u)表示((a.u)/mg)。
1.2.5 线粒体中SOD、POD、CAT活性的测定 用1.0 mL Tris-HCl缓冲液(10 mmol/L,pH值7.2)重悬浮纯化的线粒体。具体步骤参考购自南京建成生物工程研究所的总超氧化物歧化酶(T-SOD)测试盒、过氧化物酶测试盒、过氧化氢酶测试盒说明书。SOD以每毫克线粒体蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U),SOD活力表示为U/mg;POD以每毫克线粒体蛋白每分钟催化1 μg底物的酶量定义为一个酶活力单位(U),POD活力表示为U/mg;CAT以每mg线粒体蛋白每秒分解1 μmol的H2O2的量为一个活力单位(U),CAT的活性表示为U/mg。
利用粉晶X射线衍射仪ShimadzuXRD-6100进行实验,实验前先将煤样研磨成粉末状,在CuKa辐射、电压20kV、电流30mA、扫描速度3°/mm、扫描范围5°~80°的条件下进行物相分析。
1.2.6 线粒体中MDA含量的测定 参照赵世杰等[35]的方法。用1.5 mL Tris-HCl缓冲液(10 mmol/L,pH值7.2)重悬浮纯化的线粒体,取1.0 mL线粒体溶液(空白参比为Tris-HCl缓冲液),加入1.0 mL 0.6%硫代巴比妥酸(TBA)溶液,沸水浴15 min,冷却至室温后离心(12 000 r/min,1 min),取上清液,分别测定波长450,532,600 nm处的吸光度。根据CMDA(μmol) =6.45(D532-D600)-0.56 D450,计算MDA浓度,并根据蛋白浓度计算线粒体中MDA含量,以μmol/g表示。
1.2.7 线粒体膜电势的测定 参照Baracca等[36]的方法。用1.0 mL HEPES-HCl缓冲液(10 mmol/L,pH值7.4)重悬浮纯化的线粒体,取0.2 mL线粒体溶液,加入1 mL的10 mmol/L HEPES-HCl(pH值7.4,含2 mmol/L MgCl2,100 μmol/L K-EGTA,4 mmol/L KH2PO4,250 mmol/L蔗糖),25 ℃孵育5 min,加入1 μL Rh123溶液(2 μg/mL),立即检测4 min内荧光强度变化(最大激发波长503 nm,最大发射波长576 nm)。线粒体膜电势以Rh123荧光淬灭速率与线粒体的蛋白浓度的比值表示为(ΔF/Fi)/(s·mg)。
1.2.8 线粒体呼吸的测定 参照潘俨等[37]和Hu等[38]的方法。用1.0 mL Tris-HCl缓冲液(10 mmol/L,pH值7.2)重悬浮纯化的线粒体,取0.2 mL线粒体溶液,加入1.8 mL Tris-HCl缓冲液(10 mmol/L,pH值7.2),室温下用Oxygraph Plus液相氧电极测定线粒体耗氧速率。线粒体呼吸以单位蛋白浓度在单位时间内的耗氧量表示(nmol/(min·mg))。
1.2.9 NAC对离体线粒体抗氧化系统的影响 将对照桃果实线粒体纯化,用80 mmol/L NAC溶液处理20 min,以不作处理为对照,检测各项生理指标。
1.3数据统计与分析
所有样品平行测定3次,数据用平均值±标准偏差表示,用Origin 8.5作图,用Excel 2013软件对数据进行方差分析(ANOVA),用 SPSS 进行差异显著性分析(P<0.05)。
2 结果与分析
2.1NO对线粒体活性氧含量的影响
如图1所示,5 ℃ 15 μmol/L NO处理降低了桃果实线粒体活性氧的含量,尤其在第1周时,ROS含量是对照的50%,是5 μmol/Lc-PTIO处理的43%。80 mmol/L NAC-15 μmol/L 验室NO处理降低了线粒体活性氧的含量,维持一个较低的水平,在2周后显著低于对照和其他处理(P<0.05),第3周时ROS含量最低是对照的35%,是15 μmol/L NO处理的38%。而5 μmol/L c-PTIO处理桃果实线粒体ROS含量显著高于对照和其他处理(P<0.05)。
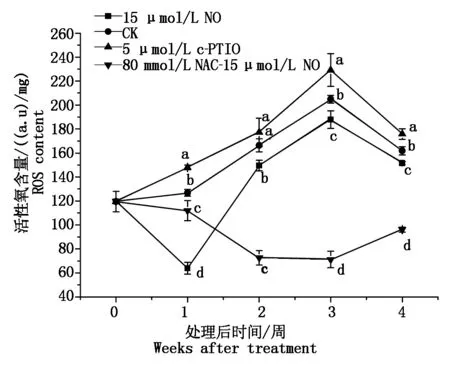
a、b、c、d.相同时间不同处理之间差异性分析(P<0.05)。图2-6同。Lower letters indicate significant differences among treatment at the same week (P<0.05). The same as Fig.2-6.
2.2NO对SOD、POD和CAT活性的影响
如图2所示,15 μmol/L NO处理提高了桃果实线粒体SOD活性,第2周时SOD的活性达到最大值,是5 μmol/L c-PTIO处理的1.2倍,此后15 μmol/L NO处理线粒体SOD活性高于对照和5 μmol/L c-PTIO处理。80 mmol/L NAC-15 μmol/L NO处理提高了线粒体SOD的活性,除第3周其他贮藏期间均显著高于对照和15 μmol/L NO处理(P<0.05),尤其在第2周时SOD的活性是对照的1.2倍。而5 μmol/L c-PTIO处理降低了线粒体SOD的活性,除第3周外,均低于对照和其他处理。
随桃果实贮藏时间的增加,POD活性呈降低趋势。而15 μmol/L NO处理提高了桃果实线粒体POD活性,尤其在第1周时POD的活性是对照的1.5倍,除第2周时15 μmol/L NO处理略低于对照,POD活性均高于对照和其他处理外。80 mmol/L NAC-15 μmol/L NO处理和对照的POD活性除第3周外无显著差异,均低于15 μmol/L NO处理。而5 μmol/L c-PTIO处理POD活性除第3周外,均低于对照和其他处理。
15 μmol/L NO处理提高了桃果实线粒体CAT活性,而在第1周时,CAT活性最低,是对照的1.3倍,是5 μmol/L c-PTIO处理的2.6倍。80 mmol/L NAC- 15 μmol/L NO处理显著降低了桃果实线粒体CAT活性(P<0.05),第2周CAT活性较小,仅为对照的45%,第2 周后CAT活性升高,但低于对照和15 μmol/L NO处理。而5 μmol/L c-PTIO处理降低了线粒体CAT的活性,低于对照和15 μmol/L NO处理。
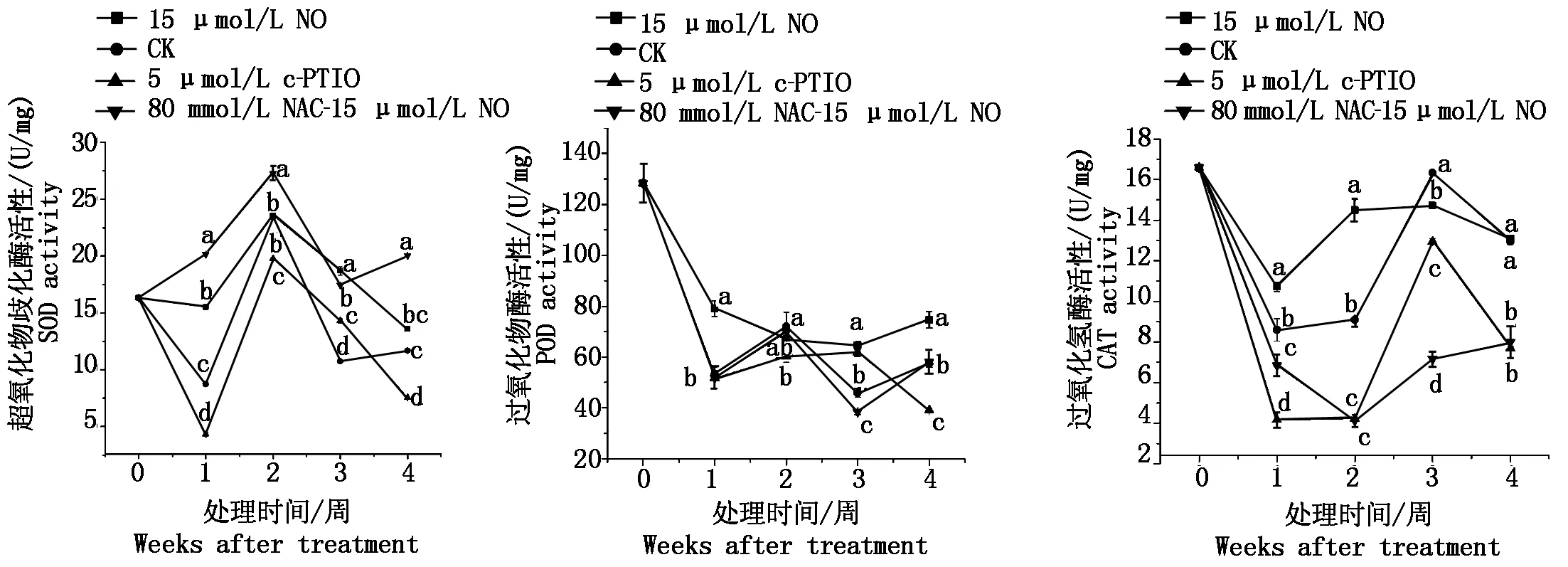
图2 不同处理冷藏桃果实线粒体中抗氧化酶活性变化Fig.2 Changes in the activities of mitochondrial antioxidant enzymes of peaches with different treatments during cold storage
2.3NO对线粒体内MDA含量的影响
如图3所示,整个贮藏期间,15 μmol/L NO处理桃果实线粒体中丙二醛的含量维持在较低水平,除第2周,15 μmol/L NO处理丙二醛含量均低于对照和其他处理。80 mmol/L NAC-15 μmol/L NO处理桃线粒体MDA含量在第1周后显著提高,高于对照和其他处理(P<0.05)。而5 μmol/L c-PTIO处理桃果实线粒体MDA含量在第2~3周高于对照和15 μmol/L NO处理。
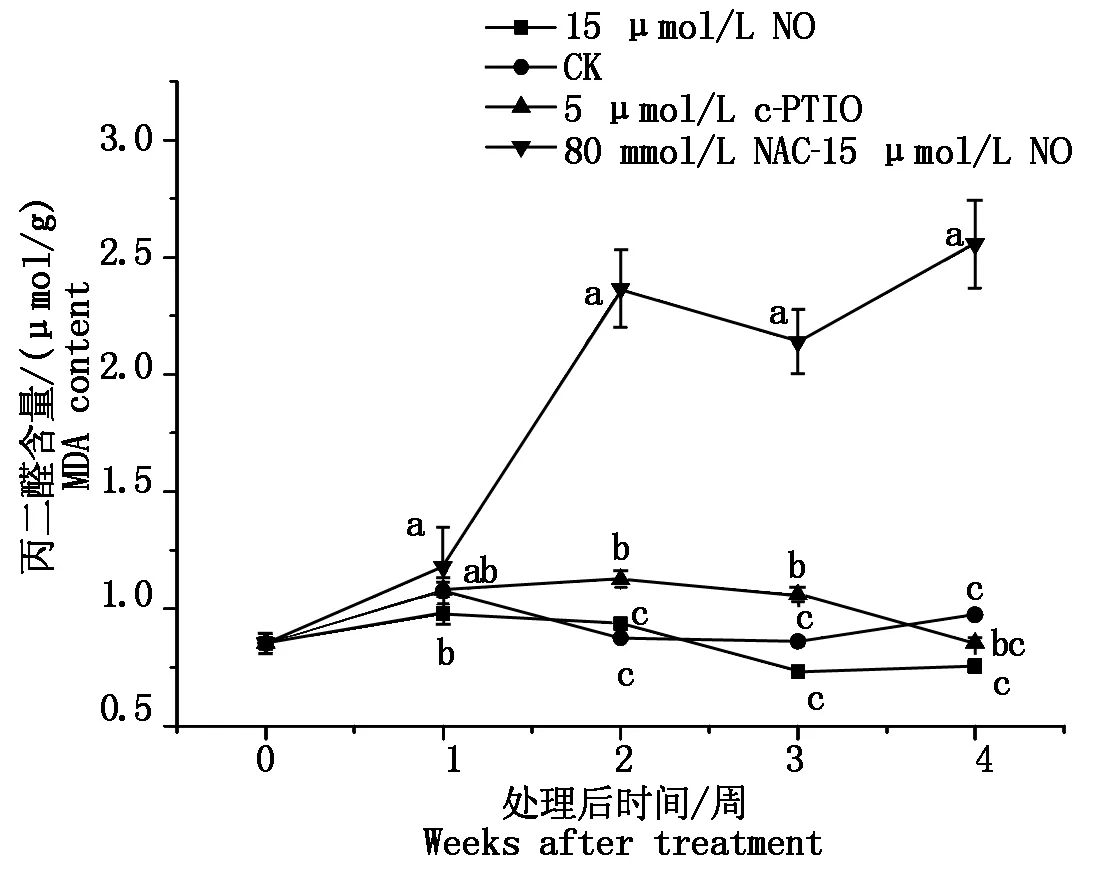
图3 不同处理冷藏桃果实线粒体中MDA含量变化Fig.3 Changes in mitochondrial MDA content of peaches with different treatments during cold storage
2.4NO对线粒体膜电势的影响
线粒体膜电势是生物膜两侧离子浓度不同所产生的跨膜电位差,是反映线粒体功能完整性和评价线粒体功能的敏感指标[39]。如图4所示,随着贮藏时间增加,线粒体膜电势呈逐渐降低的趋势。15 μmol/L NO处理提高了线粒体膜电势,尤其第3周时是对照的1.2倍,整个贮藏期间膜电势高于对照和5 μmol/L c-PTIO处理。80 mmol/L NAC-15 μmol/L NO处理提高了线粒体膜电势,显著高于对照和其他处理(P<0.05),能够维持采后果实贮藏中较高线粒体膜电势。而5 μmol/L c-PTIO处理降低了线粒体膜电势,显著低于对照和其他处理(P<0.05)。
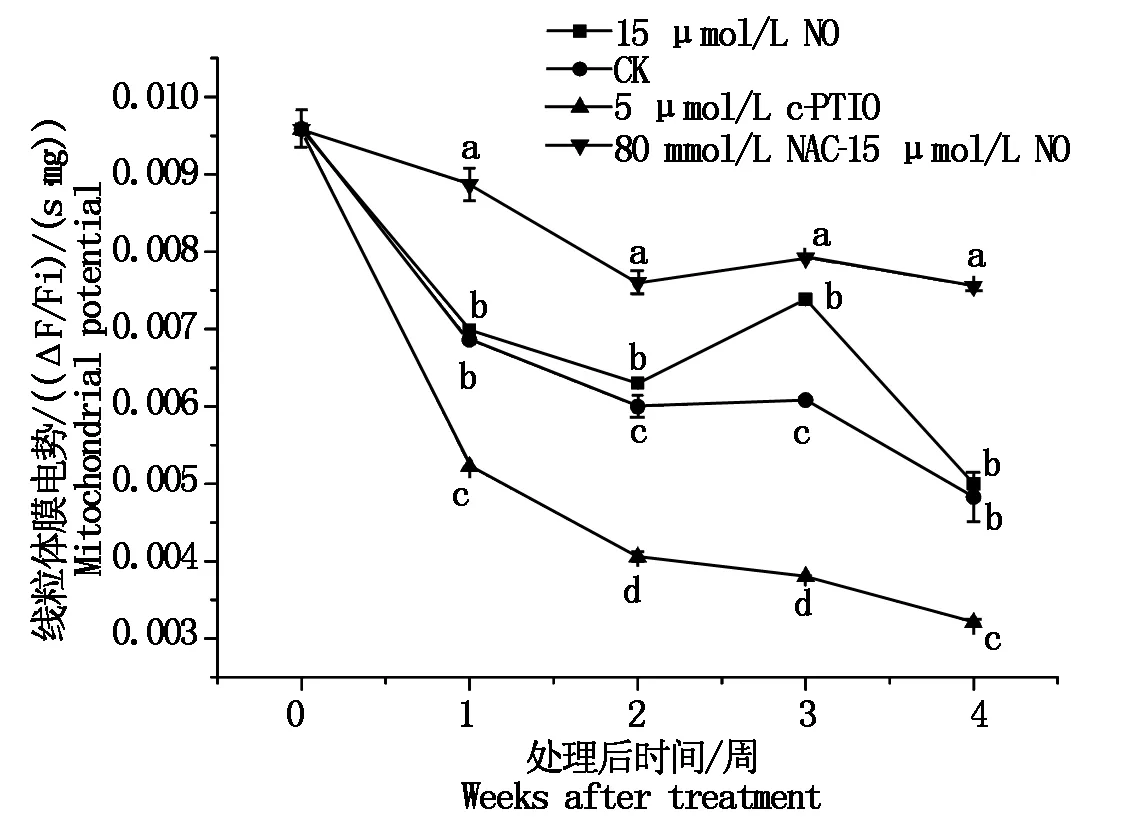
图4 不同处理冷藏桃果实线粒体膜电势的变化Fig.4 Changes in mitochondrial membrane potential of peaches with different treatments during cold storage
2.5NO对线粒体呼吸的影响
如图5所示,对照和15 μmol/L NO处理桃果实线粒体在第3周出现呼吸高峰,耗氧量分别为95.43,75.42 nmol/(min·mg),15 μmol/L NO处理桃果实线粒体的呼吸高峰明显低于对照的呼吸高峰。5 μmol/L c-PTIO处理和80 mmol/L NAC-15 μmol/L NO处理桃果实线粒体呼吸高峰在第2周出现,比对照提前1周。5 μmol/L c-PTIO处理呼吸高峰高于对照和其他处理。
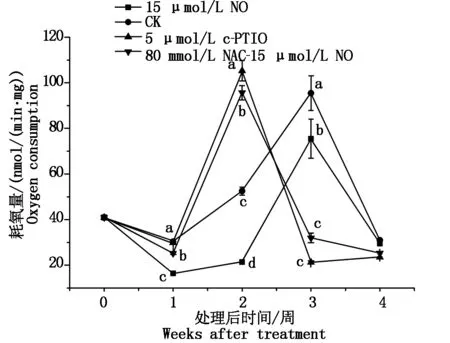
图5 不同处理冷藏桃果实线粒体耗氧量的变化Fig.5 Changes in mitochondrial oxygen consumption of peaches with different treatments during cold storage
2.6NAC对离体线粒体生理指标的影响
如图6所示,80 mmol/L NAC处理离体线粒体内ROS含量显著低于对照(P<0.05),仅为对照的59.7%;SOD活性是对照的1.3倍;POD活性和CAT活性显著低于对照(P<0.05),分别为对照的38.2%和54.7%;MDA含量是对照的31.6%;线粒体耗氧量略低于对照,是对照的94.9%;线粒体膜电势是对照的1.1倍。
3 讨论与结论
线粒体是植物ROS的重要来源和作用靶点。正常生理状态下,植物细胞中仅含有少量的ROS并发挥重要的生理作用,但是细胞衰老会产生大量的ROS[12],过量的ROS可能直接破坏线粒体膜的脂质和蛋白,增加线粒体膜的氧化损伤,使线粒体中MDA含量提高,降低线粒体膜电势[40],而线粒体膜电势的降低会使活性氧进一步增多,引发恶性循环,从而破坏果实线粒体的抗氧化系统,导致细胞死亡。因此,保持ROS产生和清除之间的平衡对于细胞正常代谢具有积极作用。植物线粒体呼吸是产生ROS的主要方式[41]。本试验中,5 ℃ 15 μmol/L NO处理能够降低线粒体中MDA的含量,减缓了线粒体膜电势的降低速率,降低了线粒体的耗氧量。外源NO能够抑制线粒体膜脂过氧化,从而维持线粒体膜电位的稳定,保持线粒体膜功能和结构的完整性,同时抑制线粒体的呼吸,减少ROS的产生,维持细胞内环境的稳定。前人在李果实线粒体膜研究中有相似结论[20]。前人已经研究NAC能延缓兔肝细胞细胞凋亡[42],并且能影响线粒体中的能量代谢[43]。本试验发现,80 mmol/L NAC-15 μmol/L NO处理能够减缓膜电势的降低速率,维持线粒体膜电势的稳定性,但是提高桃线粒体内的MDA含量和呼吸高峰,与NAC处理离体线粒体结果不同,可能是NO和NAC的协同处理一定程度上提高了线粒体呼吸,从而导致细胞内ROS的增加,破坏了线粒体外环境的稳定,从而使线粒体膜脂过氧化,线粒体中MDA含量增加。
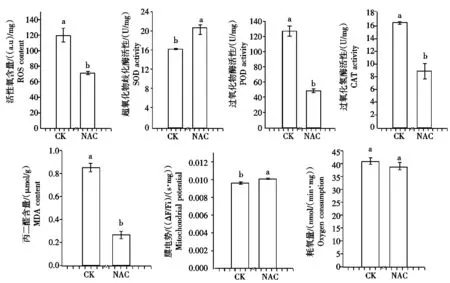
图6 NAC处理对离体线粒体的影响Fig.6 Effects of NAC on in intro mitochondria
在植物体内ROS的清除是由酶促和非酶促抗氧化系统共同完成的[44-45],其中,SOD、POD和CAT等抗氧化酶可以清除植物组织中过量的ROS,从而维持线粒体内环境的相对平衡。前人研究表明,适宜浓度的外源NO可以抑制采后番茄[46]、猕猴桃[47]等果实中活性氧的累积,并保持果实中较高的SOD、POD、CAT的活性。在本研究中,15 μmol/L NO处理显著降低了线粒体内ROS含量,有效提高了线粒体SOD、POD、CAT抗氧化酶的活性,与前人研究结果一致[20]。前人已经证实NAC能够抑制动物细胞的死亡和对小鼠肝脏细胞氧化胁迫起保护作用[48-49]。在本试验中发现,80 mmol/L NAC-15 μmol/L NO处理能够降低果实线粒体中ROS的含量,提高SOD的活性,在NAC处理离体线粒体中也得到相似结果。这与前人在大鼠肝线粒体损伤中得到结论相似[50]。NO和NAC处理显著降低了离体线粒体ROS含量并提高了线粒体SOD活性,从而促进了超氧阴离子自由基向H2O2的转化。但NO和NAC处理降低了离体线粒体POD和CAT的活性,可能是因为NAC能透过线粒体膜,在线粒体内脱去乙酰基,形成L-半胱氨酸并大量合成谷胱甘肽,这些谷胱甘肽作为还原剂通过非酶促途径与H2O2反应,从而减少了POD和CAT的底物,表现出较低的POD和CAT活性。此外,NO还可以与ROS直接反应并相互调节[51],从而降低过量ROS对线粒体的伤害,维持线粒体的抗氧性。
本试验初步探讨了外源NO和NAC处理对采后桃线粒体抗氧化系统的影响。由于NO和NAC在生物抗氧化性研究中发挥越来越重要的作用,而且细胞内很多生理生化反应依赖于线粒体,因此,对NO和NAC维持线粒体抗氧化系统的确切机理及线粒体正常的生理功能值得深入研究。
NO和NAC处理能够通过显著降低线粒体中ROS含量、提高抗氧化酶SOD的活性,降低线粒体中膜电势的降低速率,保持较高的膜电势,维持线粒体内环境的稳定来提高线粒体抗氧化系统的抗氧化能力。从而提高桃的贮藏时间。
5 ℃ 15 μmol/L NO处理能够提高桃线粒体中SOD、POD和CAT的活性,有效减少了线粒体中ROS的含量,抑制线粒体的呼吸速率,从而降低了ROS对线粒体的伤害;减缓线粒体中膜电势的降低速率,维持较高膜电势,保持线粒体膜功能和结构的完整性,维持线粒体内环境的稳定,提高线粒体抗氧化系统的抗氧化能力。
[1] Chaban Y,Boekema E J,Dudkina N V. Structures of mitochondrial oxidative phosphorylation supercomplexes and mechanisms for their stabilisation[J]. Biochimica et Biophysica acta,2014,1837(4):418-426.
[2] Kiss G,Konrad C,Pour-Ghaz I,et al. Mitochondrial diaphorases as NAD+donors to segments of the citric acid cycle that support substrate-level phosphorylation yielding ATP during respiratory inhibition[J]. FASEB Journal,2014,28(4):1682-1697.
[3] Bai X,Yan Y,Canfield S,et al. Ketamine enhances human neural stem cell proliferation and induces neuronal apoptosis via reactive oxygen species-mediated mitochondrial pathway[J]. Anesthesia and Analgesia,2013,116(4):869-880.
[4] Cheng Z,Ristow M. Mitochondria and metabolic homeostasis[J]. Antioxidants & Redox Signaling,2013,19(3):240-242.
[5] Dixon S J,Stockwell B R. The role of Iron and reactive oxygen species in cell death[J]. Nature Chemical Biology,2014,10(1):9-17.
[6] Alfadda A A,Sallam R M. Reactive oxygen species in health and disease[J]. Journal of Biomedicine and Biotechnology,2012,doi:10.1155/2012/936486.
[7] 刚成诚,王亦佳,陈奕兆,等.不同1-MCP处理对水蜜桃采后生理及贮藏品质的影响[J].天津农业科学,2012,18(3):26-32.
[8] Shang H,Cao S,Yang Z,et al. Effect of exogenous γ-aminobutyric acid treatment on proline accumulation and chilling injury in peach fruit after long-term cold storage[J]. Journal of Agricultural and Food Chemistry,2011,59(4):1264-1268.
[9] 杨青珍,王 锋. PVP对大久保桃贮藏品质和褐变的影响[J].食品科学,2016,34(14):264-269.
[10] 申 江,刘 丽,宋 烨,等.冰温气调贮藏对平谷大桃品质影响的实验研究[J].食品工业科技,2013,34(5):330-332,337.
[11] 陈京京,金 鹏,李会会,等.低温贮藏对桃果实冷害和能量水平的影响[J].农业工程学报,2012,28(4):275-281.
[12] Gualanduzzi S,Baraldi E,Braschi I,et al. Respiration,Hydrogen peroxide leves and antioxidant enzyme ativities during cold storage of zucchini squash fruit[J].Postharvest Biology and Technology,2009,52(1):16-23.
[13] Reczek C R,Chandel N S. ROS-dependent signal transduction[J]. Current Opinion in Cell Biology,2015,33:8-13.
[14] 姚三巧,张 林,何艳玲,等.活性氧介导的肺组织细胞线粒体凋亡在染矽尘大鼠肺纤维化中的作用[J].工业卫生与职业病,2015,41(1):1-6.
[15] 耿军伟,于 涵,林 枝,等.动物细胞中活性氧的生成及代谢[J].生命科学,2015,27(5):609-617.
[16] Batandier C,Leverve X,Fontaine E. Opening of the mitochondrial permeability transition pore induces reactive oxygen species production at the level of the respiratory chain complex I[J]. The Journal of Biological Chemistry,2004,279(17):17197-17204.
[17] 邵瑞鑫,李蕾蕾,郑会芳,等.外源一氧化氮对干旱胁迫下玉米幼苗光合作用的影响[J].中国农业科学,2016,49(2):251-259.
[18] Sarkela T M,Berthiaume J,Elfering S,et al. The modulation of oxygen radical production by nitric oxide in mitochondria[J]. The Journal of Biological Chemistry,2001,276(10):6945-6949.
[19] Zhu S,Sun L,Liu M,et al. Effect of nitric oxide on reactive oxygen species and antioxidant enzymes in kiwifruit during storage[J]. Journal of the Science of Food and Agriculture,2008,88(13):2324-2331.
[20] 姚婷婷,朱丽琴,杨 双,等.一氧化氮对采后李果实线粒体膜氧化损伤的影响[J].中国农业科学,2010,43(13):2767-2774.
[21] Zheng C,Jiang D,Liu F,et al. Exogenous nitric oxide improves seed germination in wheat against mitochondrial oxidative damage induced bu high salinity[J]. Environmental and Experimental Botany,2009,67(1):222-227.
[22] 朱树华,周 杰,束怀瑞.一氧化氮对草莓果实衰老的影响[J].园艺学报,2005,32(4):589-593.
[23] Wu M S,Lien G S,Shen S C,et al. N-acetyl-L-cysteine enhances fisetin-induced cytotoxicity via induction of ROS-Independent apoptosis in human colonic cancer cells[J]. Molecular Carcinogenesis,2014,53(S1):119-129.
[24] Drago L,De Vecchi E,Mattina R,et al. Activity of N-acetyl-L-cysteine against biofilm ofStaphylococcusaureusandPseudomonasaeruginosaon orthopedic prosthetic materials[J]. The International Journal of Artificial Organs,2013,36(1):39-46.
[25] 李毅敏,赵树仪. N-乙酰半胱氨酸的研究进展[J].天津药学,2003,15(2):50-53.
[26] 朱树华,刘孟臣,周 杰.一氧化氮熏蒸对采后肥城桃果实细胞壁代谢的影响[J].中国农业科学,2006,39(9):1878-1884.
[27] 谢荣辉,周师洁,殷 明,等. N-乙酰半胱氨酸对过氧化氢诱导的骨髓间充质干细胞凋亡的保护及作用机制研究[J].中国药理学通报,2014,30(1):54-59.
[28] 马奕萍,马 萍,姜海瑞. N-乙酰半胱氨酸预防亚硒酸钠诱导大鼠白内障的研究[J].现代药物与临床,2014,29(7):717-720.
[29] Braidot E,Petrussa E,Macrì F,et al. Plant mitochondrial electrical potential monitored by fluorescence quenching of rhodamine 123[J]. Biologia Plantarum,1998,41(2):193-201.
[30] Millar A H,Liddell A,Leaver C J. Isolation and subfractionation of mitochondria from plants[J]. Methods in Cell Biology,2001,65(61):53-74.
[31] Frezza C,Cipolat S,Scorrano L. Organelle isolation:functional mitochondria from mouse liver,muscle and cultured fibroblasts[J]. Nature Protocols,2007,2(2):287-295.
[32] 柳 荫,吴凤智,陈 龙,等.考马斯亮蓝法测定核桃水溶性蛋白含量的研究[J].中国酿造,2013,32(12):131-133.
[33] Degli Esposti M. Measuring mitochondrial reactive oxygen species[J]. Methods,2002,26(4):335-340.
[34] Jambunathan N. Determination and detection of reactive oxygen species (ROS),lipid peroxidation,and electrolyte leakage in plants[J]. Methods in Molecular Biology,2010,639(1):292.
[35] 赵世杰,许长成,邹 琦,等.植物组织中丙二醛测定方法的改进[J].植物生理学通讯,1994,30(3):207-210.
[36] Baracca A,Sgarbi G,Solaini G,et al. Rhodamine 123 as a probe of mitochondrial membrane potential:evaluation of proton flux through F0 during ATP synthesis[J]. Biochimica et Biophysica acta,2003,1606(1/3):137-146.
[37] 潘 俨,车凤斌,董成虎,等.模拟运输振动对新疆杏呼吸途径和品质的影响[J].农业工程学报,2015,31(3):325-331.
[38] Hu W H,Shi K,Song X S,et al. Different effects of chilling on respiration in leaves and roots of cucumber (Cucumissativus)[J]. Plant Physiology and Biochemistry,2006,44(11/12):837-843.
[39] 苏荣胜,潘家强,刘好朋,等.谷胱甘肽对铜孵育的肉鸡肝线粒体膜电势及膜通透性的保护作用[J].中国兽医杂志,2012,48(1):23-25.
[40] 冯 阳,刘建军,黄 钢.线粒体膜通透性转换孔结构与功能研究进展[J].上海交通大学学报:医学版,2012,32(3):356-360.
[41] Sharma L K,Fang H,Liu J,et al. Mitochondrial respiratory complex I dysfunction promotes tumorigenesis through ROS alteration and AKT activation[J]. Human Molecular Genetics,2011,20(23):4605-4616.
[42] 戴大军,蔡俊赢. N-乙酰半胱氨酸对兔肝缺血/再灌注损伤的保护作用[J].中国当代医药,2015,22(36):7-10.
[43] 魏衍刚,徐兆发,邓 宇,等. N-乙酰半胱氨酸对甲基汞致大鼠脑皮质氧化损伤和谷氨酸代谢障碍的影响[J].毒理学杂志,2012,26(2):79-83.
[44] 李良德,王定锋,吴光远.线粒体内活性氧产生靶标位点研究进展[J].生命科学研究,2015,19(6):530-535.
[45] 张梦如,杨玉梅,成蕴秀,等.植物活性氧的产生及其作用和危害[J].西北植物学报,2014,34(9):1916-1926.
[46] 徐福乐.外源一氧化氮熏蒸处理对番茄采后活性氧代谢的影响[J].食品科技,2010,35(1):66-71.
[47] 朱树华,孙丽娜,周 杰.一氧化氮对猕猴桃果实营养品质和活性氧代谢的影响[J].果树学报,2009,26(3):334-339.
[48] 原红艳,张淑香,李兴启,等. N-乙酰半胱氨酸对活性氧诱导耳蜗毛细胞凋亡的抑制作用的观察[J].听力学及言语疾病杂志,2012,20(3):266-268.
[49] 杨 峰,王旭荣,李新圃,等. N-乙酰-L-半胱氨酸对Ia型牛源无乳链球菌诱导的小鼠肝脏氧化损伤的保护作用[J].中国畜牧兽医,2013,40(8):78-83.
[50] 关 坤,徐兆发,张芳林,等. N-乙酞半胧氨酸对锅致大鼠肝线粒体损伤的影响[J].环境与健康杂志,2008,25(8):683-685.
[51] Mafolepsza U,Rózalska S. Nitric oxide and hydrogen peroxide in tomato resistance: Nitric oxide modulates hydrogen peroxide level in o-hydroxyethylorutin-induced resistance toBotrytiscinereain tomato[J]. Plant Physiology and Biochemistry,2005,43(6):623-635.
RegulationbyExogenousNitricOxideandN-acetyl-L-cysteineonMitochondrialAntioxidantSysteminFeichengPeaches
GAO Shan,WANG Quan,GAO Jigang,ZHU Shuhua
(College of Chemistry and Material Science,Shandong Agricultural University,Tai′an 271018,China)
To study the regulation by exogenous nitric oxide (NO) and N-acetyl-L-cysteine(NAC)on mitochondrial antioxidative system of Feicheng peaches during cold storage. Feicheng peaches were dipped in 15 μmol/L NO,80 mmol/L N-acetyl-L-cysteine (NAC,reactive oxygen species scavenger) plus 15 μmol/L NO,and 5 μmol/L c-PTIO (NO scavenger) solution,respectively. The changes in mitochondrial respiration,mitochondrial membrane potential,the contents of malonaldehyde (MDA) and reactive oxygen species (ROS) and the activities of antioxidant enzymes were detected. Treatment with 15 μmol/L NO significantly decreased mitochondrial ROS content. Especially at the 1st week,mitochondrial ROS content in peaches treated with 15 μmol/L NO was only 50% of the control. Mitochondrial ROS content in peaches treated with 80 mmol/L NAC-15 μmol/L NO was significantly lower than that of the control and other treatments after 2 weeks,while treatment with 5 μmol/L c-PTIO increased the content of mitochondrial ROS. The activities of antioxidative enzymes (POD,SOD and CAT) in mitochondria of peaches treated with 15 μmol/L NO was higher than that of the control and treatment with 5 μmol/L c-PTIO. Treatment with 80 mmol/L NAC-15 μmol/L NO increased the activity of mitochondrial SOD and decreased the activities of mitochondrial POD and CAT. Treatment with 5 μmol/L c-PTIO decreased the activities of antioxidative enzymes in mitochondria. Mitochondrial MDA content in peaches treated with 15 μmol/L NO was lower than that of the control and other treatments during the storage except for the second week. However,mitochondrial MDA content in peaches treated with 80 mmol/L NAC-15 μmol/L NO was significantly higher than that of the control and other treatments after 1 week. Mitochondrial MDA content in peaches treated with 5 μmol/L c-PTIO was higher than that of the control and treatment with 15 μmol/L NO in the second and third week. Mitochondrial membrane potential was improved by treatment with 15 μmol/L NO,reached the maximum,which was 1.2 times as high as that of the control,at 3 weeks. Mitochondrial membrane potential of peaches treated with 80 mmol/L NAC-15 μmol/L NO was higher than that of the control and other treatments. However,treatment with 5 μmol/L c-PTIO decreased mitochondrial membrane potential. The mitochondrial respiration of peaches was inhibited by treatment with 15 μmol/L NO. Mitochondrial respiration peak of peaches treated with 80 mmol/L NAC-15 μmol/L NO appeared 1 week earlier than the control. Treatment with 5 μmol/L c-PTIO maintained high respiration of mitochondria. Exogenous nitric oxide and N-acetyl-L-cysteine could improve the antioxidant capacity of mitochondrial antioxidant system of peaches during storage,and delay the decrease of mitochondrial function.
Peach (Prunuspersica); Nitric oxide; N-acetyl-L-cysteine;Mitochondria;Antioxidant system
2017-06-03
国家自然科学基金项目(31270723)
高 珊(1990-),女,山东潍坊人,在读硕士,主要从事化学生物分析研究。
朱树华(1978-),男,山东泰安人,教授,博士,主要从事化学生物学研究。
S662.1
A
1000-7091(2017)05-0163-08
10.7668/hbnxb.2017.05.025
