番茄颈腐根腐病病原鉴定及2种接种方法的评价
2017-11-04张尚卿韩晓清缪作清吴志会张立娇
张尚卿,韩晓清,缪作清,吴志会,张立娇
(1.唐山市农业科学研究院,河北 唐山 063001;2.中国农业科学院 植物保护研究所,北京 100193;3.石家庄市鹿泉区植物保护检疫站,河北 石家庄 050200)
番茄颈腐根腐病病原鉴定及2种接种方法的评价
张尚卿1,韩晓清1,缪作清2,吴志会1,张立娇3
(1.唐山市农业科学研究院,河北 唐山 063001;2.中国农业科学院 植物保护研究所,北京 100193;3.石家庄市鹿泉区植物保护检疫站,河北 石家庄 050200)
为了确定引起河北省丰南区发现的一种植株青枯、维管束褐变的番茄病害的病原菌,进行了病原菌分离培养纯化、致病性测定、田间接种后再分离、菌落和形态学观察结合分子鉴定,确定该病害为尖孢镰刀菌番茄颈腐根腐病专化型引起的番茄颈腐根腐病。确定病原菌为尖孢镰刀菌番茄颈腐根腐病专化型。对茎基接种和浸根接种进行了评价,结果表明,茎基接种发病率和死亡率均高于浸根接种。为接种完成该病害的抗病育种和防治药剂筛选的研究提供了理论依据。
番茄;颈腐根腐病;病原菌鉴定;浸根接种;茎基接种
番茄颈腐根腐病(Fusariumcrown and root rot,FCRR)是由尖孢镰刀菌番茄颈腐根腐病专化型(Fusariumoxysporumf.sp.radicis-lycopersici(Forl))引起的一种重要的土传病害[1]。该病害于1974年首次在日本发现,随后在美洲、欧洲和非洲等多个国家发生,造成严重损失[2-7]。该病菌在有机质含量较高的土壤中几乎不能生长,容易侵染高温或广谱杀菌剂灭菌的土壤,基质或无土栽培设施番茄发病后严重减产甚至绝收。我国于2007年首次在北京地区发现该病,之后在山东、黑龙江等地设施番茄主产区发现该病害发生,并呈现暴发趋势[8-10]。由于对该病害了解较少,多地误诊为青枯病或根腐病。菜农称之为“死棵”。番茄颈腐根腐病主要症状为植株茎基部交接处、环绕茎基部有明显的深褐色病斑,被侵染植株苗期易从病斑处折倒而萎蔫致死;五叶期以后至开花结果期发病,则表现为茎基部缢缩、呈深褐色,植株仍然直立而萎蔫致死[10]。症状和寄主范围区别于番茄枯萎病。
唐山市农业科学研究院植物保护研究室于2016年在河北省唐山市丰南区钱营镇后打弓庄村发现该地区多个日光温室在番茄膨果期,出现一种地上症状“青枯”,茎部地表以上部分,可见绿色至褐色的纵向条状凹陷斑(区别于番茄青枯病)的病害。该病害发现症状后几天内植株青枯死亡。发病日光温室发病率达30%~60%,严重棚室绝收。造成严重损失。采样后带回实验室进行分析、分离培养后,对病原菌进行了形态学和ITS序列分析鉴定。同时,对不同的接种方法进行了评价,对番茄颈腐根腐病研究方法、防治方法和抗病育种研究工作提供理论依据。
1 材料和方法
1.1发病症状与标本采集
于2016年4月在河北省唐山市丰南区春茬日光温室中,选取典型发病番茄植株,带回实验室进行病株解剖观察和病原菌分离。
1.2病原菌的分离纯化
采用常规组织分离方法分离病原菌。用无菌水冲洗病茎,将病茎浸入75%酒精中30 s,对病茎表面进行消毒。在超净工作台中切取病健交界处组织大小约0.3 mm×0.3 mm。在75%酒精中消毒30 s,再用无菌水冲洗5~6次。灭菌后将其均匀放在PDA培养基上,每皿8~10块。于26 ℃培养箱中黑暗培养,待菌落长出后进行单孢纯化,置于4 ℃下保存。
1.3病原菌的培养特性和形态学观察
将病原菌接种在PDA培养基上,置于26 ℃培养箱内黑暗培养,3,5,7,14 d观察菌落特征,测量菌落直径,在光学显微镜下观察菌丝和孢子的形态学特征。
1.4致病性测定及病原菌再分离
1.4.1 致病性测定 将番茄种子于68 ℃干热灭菌后,用45 ℃温水催芽,于25 ℃待幼苗根长至1~2 cm,将幼苗置于培养好的待测病菌未转接的原始分离菌落表面,定期观察48,96 h后,调查发病情况。
1.4.2 两种田间定植时接种方法 试验于2017年4月在唐山市农科院试验场3号日光温室中进行。
浸根接种:将菌体刮入无菌水中,滤去菌体,配制成8×106个/mL的孢子悬浮液。使用灭菌土育苗,在番茄苗长到4~5片真叶时,用清水将根清洗干净,用竹片(灭菌)压住3~5根须根,在上面轻微摩擦,造成伤口,放在孢子悬浮液中浸根处理20 min,对照采用相同方式创伤后,放在清水中浸根处理20 min,然后移栽到唐山市农科院试验场3号日光温室中。每小区8 m2,分2行在畦内栽种50~60棵处理过的番茄苗,每处理重复3次(参考Benaouali等[1]的接种方法)。
茎基部接种:使用灭菌土育苗,在番茄苗长到4~5片真叶时,将苗移栽到唐山市农科院试验场3号日光温室中。在土壤下面1~2 cm处用竹片(灭菌)擦伤0.5 cm×0.1 cm的表皮,将室内培养的带菌培养基切成1 cm×1 cm的小块,将菌落面正对伤口连同培养基覆盖贴靠在伤口上;对照采用相同方式创伤。定植时覆土位置高于创伤位置1~2 cm。每小区8 m2,分2行在畦内栽种50~60棵处理过的番茄苗,每处理重复3次。
调查方法:定植后10,15 d调查各处理感病情况,记录总株数、发病株数、死苗株数,计算发病率和死亡率(公式①、②);每小区随机取样3株,连根挖出,洗净后记录须根条数。

①

②
1.4.3 病原菌再分离 待1.4.2中2种接菌方法发病后,采用1.2中的常规分离方法进行再分离,并对分离得到的病原菌进行鉴定。
1.5病原菌分子鉴定
将病原菌在PDA培养基上培养7 d,收集菌丝体,利用Ezup柱式真菌基因组DNA抽提试剂盒对病原菌进行提取。利用真菌核糖体基因转录间隔区(ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGC
GG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)对TSHD2016-5的rDNA-ITS区域进行PCR扩增。扩增条件为:94 ℃预变性4 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR产物经琼脂糖凝胶电泳检测,使用SaPrep柱式DNA胶回收试剂盒进行回收,将扩增产物送生工生物工程(上海)股份有限公司测序。所得序列测序结果在NCBI上Blast比对。根据测序结果比对NCBI上其他真菌相关序列信息,利用MEGA 7软件构建系统发育树。
2 结果与分析
2.1发病症状和病害种类初步判断
发病植株膨果期中午高温时全株叶片突然萎蔫,呈青枯状(图1-A)。茎部地表以上部分,可见绿色至褐色的纵向条状凹陷斑,病斑可至地面上至少15~30 cm(图1-B)。横切或纵切茎基部,可见维管束褐色病变,部分褐色病变延续至韧皮部至外皮层;髓部正常,大部分韧皮部正常(图1-C、D)。在地面以下部分,可见褐色腐烂,纵切面可见维管束褐色、韧皮部褐色腐烂(图1-E)。
根据植株症状,判断可能是真菌性颈腐根腐病、枯萎病或者是细菌性青枯病,因此,首先通过病茎横切面挤压,未见菌浓流出,再通过将横切茎置于无菌水中,放置1~8 h观察,未见菌浓溢出,在维管束的褐色病变处,可见白色絮状菌丝产生(图1-F)。因此,初步鉴定该病为真菌性病害。

A.田间发病症状;B.茎部地表以上;C.纵切茎基部;D.横切茎基部;E.斜切茎基部;F.横切面静置出现白色菌丝。A.Symptoms of plant; B.Collar rot; C.Longitudinal sections of the pivot of tomato plant,browning; D.Cross section of tomato plant pivot;E.Oblique section of tomato plant; F.Static presence of white hyphae.
2.2分离纯化
在河北省唐山市丰南区采集的番茄病茎中共分离获得7个菌株,对菌株产生的菌落和真菌的形态学特征进行观察。结果表明,性状和分生孢子形态特征上无明显差异。将该病菌编号TSHD2016-5。
2.3病原菌的培养特性和形态学特征
TSHD2016-5在PDA培养基上培养5 d,菌落直径为5.46 cm(图2-A、B),7~8 d长满直径为90 mm的培养基。菌落圆形,菌丝白色绒毡状,随时间增加,菌落逐渐变为淡紫色。具有大、小分生孢子、厚垣孢子(图3)。大分生孢子多隔,两端尖镰刀型。小型分生孢子0~3隔,长圆形。根据形态学特征初步判断该病原菌为一种尖孢镰刀菌。
2.4致病性测定
结果表明,2 d后有部分根系发褐色,茎部完好(图4-A);4 d后大部分根系变褐色;7 d后大部分根系褐色腐烂,茎部一般大多完好(图4-B、C)。
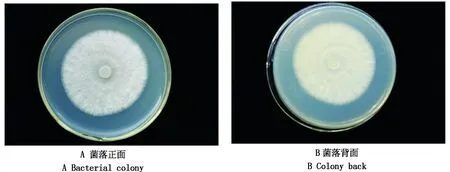
图2 TSHD2016-5菌落形态Fig.2 Colony morphology of TSHD2016-5
2.5田间定植时浸根接种和茎基部接种的比较
2.5.1接种发病症状 TSHD2016-5接种后出现田间采样病株根、茎类相似症状(图5)。2种接种方法接种后与未接菌的对照处理(图5-C)进行比较,茎部均出现纵向条形褐色病斑,略有凹陷,切开横截面,两接种处理均出现维管束褐色病变。茎部接种发病较快,接种后第8 天茎基部接种出现该症状(图5-B);根部坏死,须根脱落;病斑上部近地表处长出次生根。茎基部接种的茎基部易折,根部轻度坏死,须根少量脱落,次生根数量较多;浸根接种根部大量坏死,须根大量脱落,次生根数量较多(图5)。

A.根部接种;B.茎基接种;C.对照处理茎基;照片右下角为对应处理病部横切面。A.Inoculation on root; B.Inoculation on the base of stem; C.Not inoculated;The lower right corner of the photograph is the cross section of the sick section.
2.5.2 浸根接种和茎基接种的发病情况比较 由表1可以看出,接种后10 d 两接种处理须根数显著低于对照,浸根接种须根数最少,为17.33条;茎基接种发病率和死亡率高于浸根处理,分别达到81.25%,23.33%。接种后15 d浸根接种须根数最少,为23.67条;茎基接种发病率和死亡率高于浸根处理,分别达到93.33%和23.33%。
2.5.3 接种后再分离 接种后3 d,浸根接种和茎基接种的病茎组织在PDA培养基上长出了相同的菌落(图6),挑取菌落孢子在显微镜下观察,菌落形态与孢子性状大小与TSHD2016-5一致。
该病害田间发病症状与《Plant Pathology》第5版中记录的由尖孢镰刀菌番茄颈腐根腐专化型致病的番茄颈腐根腐病症状、发病速度和发病时期一致[11];产生孢子类型、大小和形状与Benaouali等[1]研究的尖孢镰刀菌番茄颈腐根腐专化型相同。因此,判断分离纯化得到的病原菌为尖孢镰刀菌番茄颈腐根腐专化型(Fusariumoxysporumf.sp.radicis-lycopersici)。
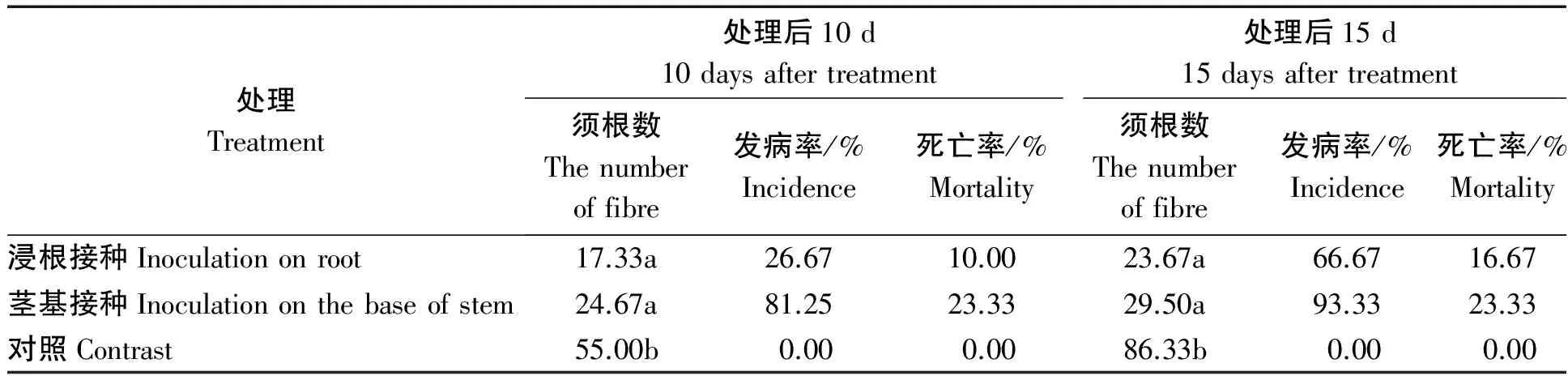
表1 浸根接种、茎基接种试验结果Tab.1 Result of inoculation test
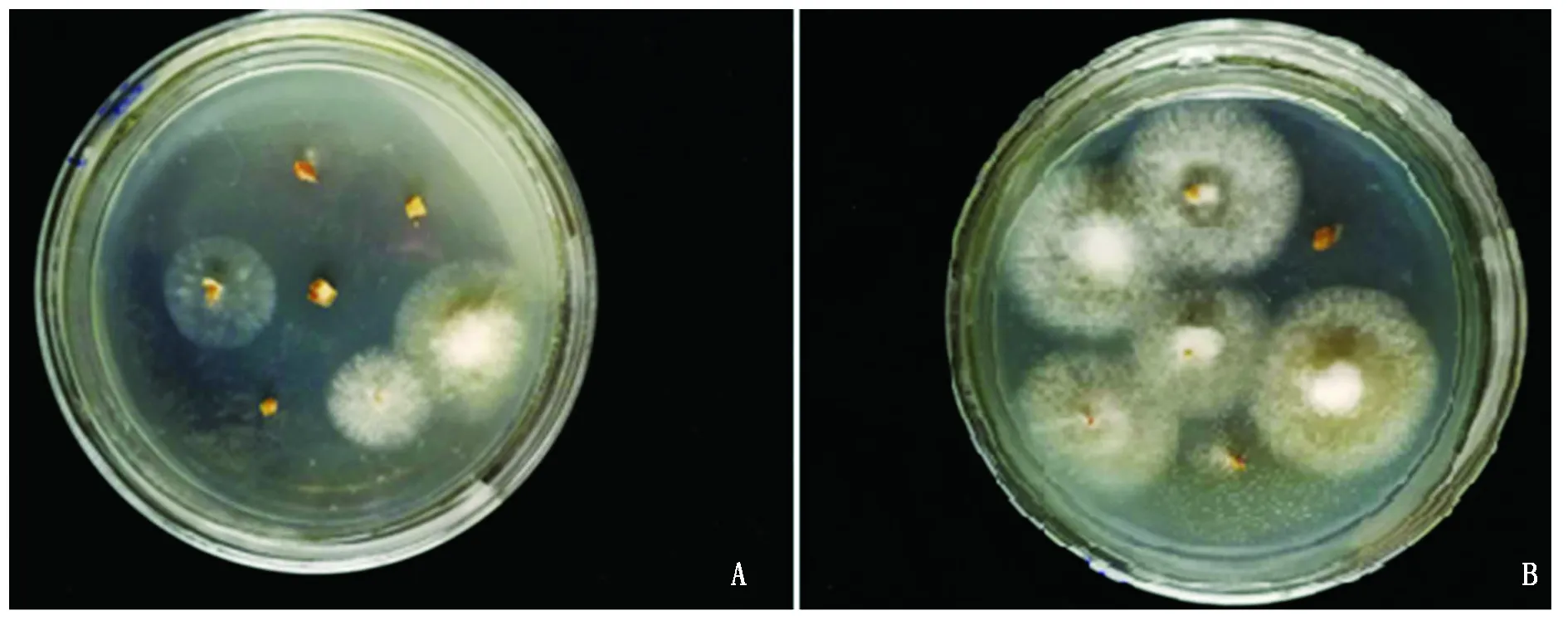
A.浸根接种;B.茎基接种。A.Inoculation on root;B.Inoculation on the base of stem.
2.6病原菌分子鉴定
通过rDNA-ITS PCR扩增,获得520 bp长度的片段(图7)。菌株TSHD2016-5的DNA测序,拼装后去除测序引物,获得505 bp长度的片段。在GenBank中同源性比对。结果表明,该菌与尖孢镰刀菌KY318502.1、KX421442.1同源性达到100%。构建系统发育树显示(图8),菌株TSHD2016-5与尖孢镰刀菌鹰嘴豆专化型(Fusariumoxysporumf.sp.ciceris isolate)位于同一分支上。
因此,结合培养性状、形态特征和田间发病症状,确定引起该病害的病原菌TSHD2016-5为尖孢镰刀菌番茄颈腐根腐病专化型。

图7 PCR扩增结果Fig.7 Result of PCR amplification
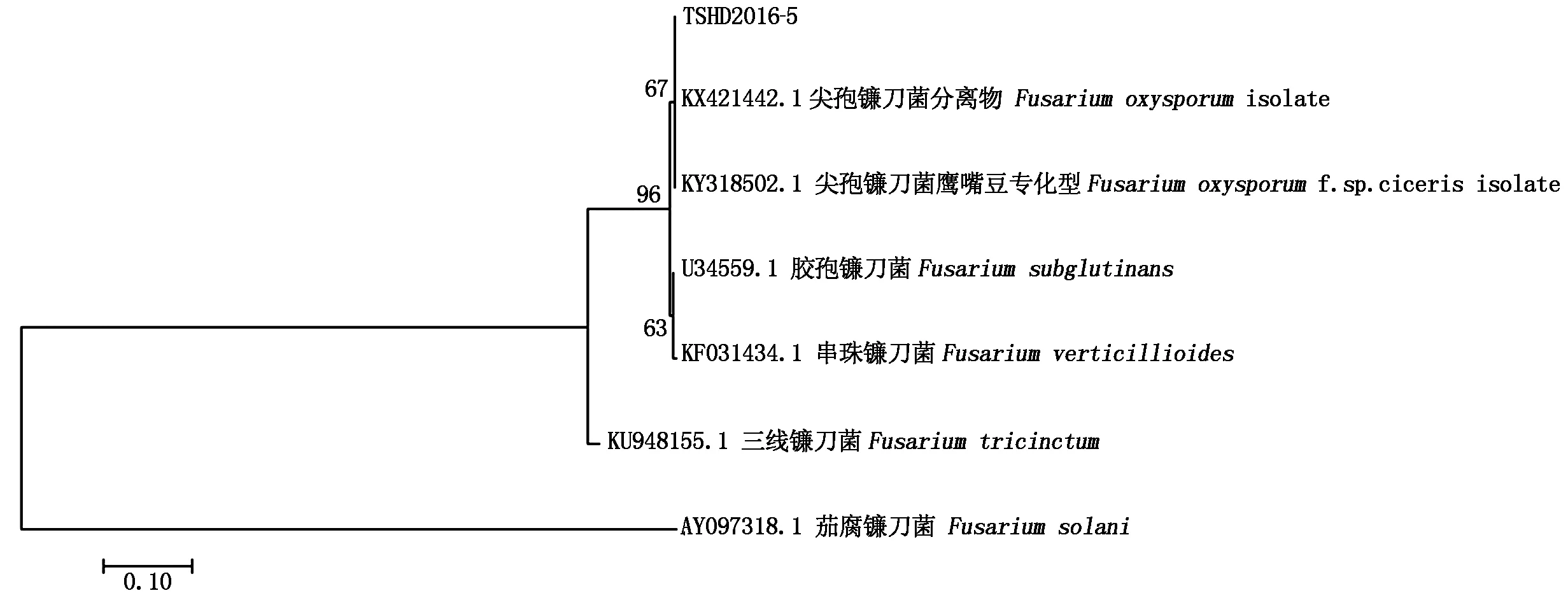
图8 TSHD2016-5和其他镰刀菌构建的系统发育树Fig.8 Phylogenetic tree constructed by TSHD2016-5 and other Fusarium
3 结论与讨论
本研究在河北省唐山市丰南区钱营镇发现一种类似青枯病症状的病害,经病原菌分离培养纯化、致病性测定、田间接种后再分离、菌落和形态学观察结合分子鉴定,确定该病害为尖孢镰刀菌番茄颈腐根腐病专化型引起的番茄颈腐根腐病。该病害田间症状类似青枯病,但横切面挤压、置于无菌水中静置,未见菌浓溢出。在维管束的褐色病变处,可见白色絮状菌丝。区别于青枯病[12-16]。另外,该病害显症到植株死亡时间较短,较少出现叶片黄化,茎部绿色至褐色的纵向条状凹陷斑可至地面上15~30 cm,区别于枯萎病[17-19]。
目前,对于该病害的研究,主要采用浸根接种[20-21]。本研究对2种接种方法进行了评价。2种方法均可接种发病,茎基接种发病较快,8 d出现番茄颈腐根腐病典型症状:茎基部出现纵向条形褐色病斑,略有凹陷;发病率和死亡率高于浸根接种。接种后10 d发病率达到81.25%,15 d发病率达到93.33%。为茎基接种方式进行该病害的发病条件、寄主范围、抗病育种和防治药剂筛选的研究提供了理论依据。
[1] Benaouali H N,Hamini-Kadar A,Bouras S L,et al.Isolation,pathogenicity test and physicochemical studies ofFusariumoxysporumf.sp radicis lycopersici [J].Advances in Environmental Biology,2014,8(810):36-49
[2] Szczechura W, Staniaszek M,Habdas H.Fusariumoxysporumf.sp.radicis-lycopersici-the cause ofFusariumcrown and root rot in tomato cultivation[J].Journal of Plant Protection Research,2013,53(2):172-175.
[3] Thomas F W,Bloemberg G V,Arjan J.Biocontrol by phenazine-1-carboxamide-Producing pseudomonas chlororaphis PCL1391 of tomato root rot caused byFusariumoxysporumf.sp.radicis-lycopersici.molecular Plant-Microbe interaction[J].1998,11(11):1069-1077.
[4] Haapalainen M,Latvala S,Kuivainen E,et al.Fusariumoxysporum,F.proliferatumandF.redolensassociated with basal rot of onion in Finland[J].Plant Pathology,2016,65(8):1310-1320.
[5] Kamilova F,Kravchenko L V,Shaposhnikov A I,et al.Effects of the tomato pathogenFusariumoxysporumf.sp.radicis-lycopersici and of the biocontrol bacteriumPseudomonasfluorescensWCS365 on the composition of organic acids and sugars in tomato root exudate[J].Molecular Plant-microbe Interactions,2006,19(10):1121-1126.
[6] Anastasia L L,Arthur F R,Lamers G M,et al.Novel aspects of tomato root colonization and infection byFusariumoxysporumf.sp.radicis-lycopersici revealed by confocal laser scanning microscopic analysis using the green fluorescent protein as a marker[J].The American Phytopathological Society,2002,15(2):172-179.
[7] 佘小漫,杨亚飞,何自福,等.番茄细菌性髓部坏死病原鉴定病原的鉴定[J].植物病理学报,2017,47(2):180-186.
[8] 刘 蕾,王 辉.番茄颈腐根腐病病原菌及抗病育种研究进展[J].长江蔬菜,2016(6):35-37.
[9] 程 琳,张 生,李艳青,等.番茄颈腐根腐病病原鉴定与抗病种植材料的筛选[J].2016,43(4):781-788.
[10] 耿丽华,李常保,迟胜起,等.番茄颈腐根腐病病原鉴定及不同条件对其生长的影响[J].植物病理学报,2012,42(5):449-455.
[11] 沈崇尧,彭友良,康振生,等. 植物病理学[M].北京:中国农业大学出版社,2009:513-515.
[12] 郑雪芳,刘 波,朱育菁.青枯病植物疫苗对番茄根系土壤微生物群落结构的影响[J].中国生物防治学报,2017,33(3):385-393.
[13] 杨尚东,吴 俊,赵久成,等.番茄青枯病罹病植株和健康植株根际土壤理化性状及生物学特性的比较[J].中国蔬菜,2013,1(22):64-69.
[14] 陈玉婷,林威鹏,范雪滢,等.硅介导番茄青枯病抗病性的土壤定量蛋白质组学研究[J].土壤学报,2015,52(1):162-173.
[15] 黄明媛,顾文杰,张发宝,等.番茄青枯病拮抗菌筛选鉴定及其发酵条件初探[J].微生物学通报,2011,38(2):214-220.
[16] 王丽丽,周旭东,李国安,等.番茄青枯病病原菌拮抗菌株的筛选及其田间防控作用研究[J].植物保护,2017,43(1):182-185,223.
[17] 刘邮洲,陈志谊,刘永锋,等.枯草芽孢杆菌sf628和咪鲜胺锰盐协同作用防治番茄枯萎病[J].江苏农业学报,2011,27(6):1249-1253.
[18] 张 亮,王改兰,段建南,等.广谱生防菌对番茄枯萎病的防病效果及其机理[J].中国生物防治学报,2015,31(6):897-906.
[19] Kouki S,Saidi N,Rajeb A B,et al.Control ofFusariumwilt of tomato caused byFusariumoxysporumf.sp.radicis-lycopersici using mixture of vegetable andPosidoniaoceanicacompost[J].Applied & Environmental Soil Science,2014,2012(4):225-226.
[20] Jacobs A,Van Heerden S W.First report ofFusariumoxysporumf.sp.radicis-lycopersici in South Africa[J].Australasian Plant Disease Notes,2012,7(1):29-32.
[21] 王小皙,高增贵,张 硕,等.尖孢镰孢菌番茄专化型的鉴定研究[J].北方园艺,2013(11):100-103.
PathogenIdentificationandTwoInoculationMethodofFusariumCrownandRootRot
ZHANG Shangqing1,HAN Xiaoqing1,MIAO Zuoqing2,WU Zhihui1,ZHANG Lijiao3
(1.Tangshan Academy of Agricultural Sciences,Tangshan 063001,China; 2.Institute of Plant Protection,Chinese Academy of Agricultural Sciences,Beijing 100193,China;3.Luquan District Plant Protection and Quarantine Station,Shijiazhuang 050200,China)
In order to identify the pathogenic fungi which causing tomato bacterial wilt in Fengnan District of Hebei Province.This study proved the disease asBipolarissorokinianaby pathogen isolation,pathogenicity test,morphological observation,and rDNA-ITS gene sequence analyses was caused byFusariumoxysporumf.sp.radicis-lycopersici(Forl).The result showed that the mortality and morbidity of stem based inoculation were higher than root soaking inoculation.So,the disease with stem based inoculation developed faster.The study provided theoretical basis for the breeding of disease resistance and the screening of the fungicides.
Tomato;Fusariumcrown and root rot;Identification of pathogenic bacteria;Root soaking inoculation; Inoculation on the base of stem
2017-07-28
唐山市科技计划项目(15120203a)
张尚卿(1985-),男,河北唐山人,助理研究员,硕士,主要从事农药施药技术及有害生物综合防治研究。
韩晓清(1966-),女,河北唐山人,副研究员,主要从事有害生物综合防治研究。
S436.412
A
1000-7091(2017)05-0124-06
10.7668/hbnxb.2017.05.019
