3种离子强度下pH值对罗非鱼肌球蛋白溶解度及分子构象的影响
2017-11-03付苇娅周春霞朱潘红郑惠娜洪鹏志杨萍
付苇娅,周春霞,2*,朱潘红,郑惠娜,2,洪鹏志,2,杨萍,2
1(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,广东 湛江,524088) 2(广东海洋大学 深圳研究院,广东 深圳,518120)
3种离子强度下pH值对罗非鱼肌球蛋白溶解度及分子构象的影响
付苇娅1,周春霞1,2*,朱潘红1,郑惠娜1,2,洪鹏志1,2,杨萍1,2
1(广东海洋大学 食品科技学院,广东省水产品加工与安全重点实验室,广东 湛江,524088) 2(广东海洋大学 深圳研究院,广东 深圳,518120)
研究了3种离子强度下,不同pH值(2.0~12.0)对罗非鱼(Oreochromisniloticus)肌球蛋白溶解性、表面疏水性、SDS-PAGE及α-螺旋含量的影响。结果表明,在实验范围内,离子强度增大使肌球蛋白等电点向酸性方向偏移,在低离子强度(1 mmol/L KCl)、生理离子强度(150 mmol/L KCl)及高离子强度(600 mmol/L KCl)条件下,其溶解度最小的pH值分别为5.5、5.0和4.5,极端酸性(pH 2.0)和碱性(pH 11.0~12.0)条件下,肌球蛋白溶解度较高(>80%);在中性和高离子强度条件下,分子表面疏水性低,α-螺旋含量高,稳定性较好;酸诱导去折叠过程中,在等电点附近表面疏水性较低,在偏离等电点的酸性条件下,表面疏水性增加,而极端酸性条件下展开的肌球蛋白分子可能会发生折叠,分子降解及静电相互作用导致溶解度增大;碱诱导去折叠过程中,表面疏水性随pH值的升高而增加,肌球蛋白重链通过二硫键形成聚合物;在中性、碱性和极端酸性条件下,α-螺旋含量随着盐浓度的增加而增大,高盐对肌球蛋白的二级结构有保护作用。总体分析,在高盐浓度和极端碱性条件下,肌球蛋白呈现“熔球态”构象。
罗非鱼肌球蛋白;pH值;离子强度;去折叠;溶解度;构象
罗非鱼是我国淡水养殖的主要鱼类之一。鱼肌肉蛋白的主要成分是肌球蛋白,占肌原纤维蛋白的55%~60%,决定了鱼肌肉盐溶性蛋白的溶解性及相关功能特性[1-2]。肌球蛋白分子含有2个球状头部和1个棒状尾部,由2条分子质量为220 kDa的肌球蛋白重链(MHC)和4条分子质量为17~22 kDa的肌球蛋白轻链(LHC)组成[1]。在体外受pH值、离子强度、热处理等的影响,鱼肌肉蛋白分子结构、溶解度及相关性质发生变化,尤其是MHC的降解或聚合[3-4]。在广泛pH范围(2~12)内,低盐(10 mmol/L NaCl)条件下酸诱导鳕鱼肌肉MHC降解,而碱性条件下MHC通过二硫键形成聚合物;而高盐(600 mmol/L NaCl)使肌肉蛋白等电点向酸性方向偏移约2个pH单位,且在酸性条件下发生聚集,碱性条件下分子发生重折叠[3]。极端酸/碱处理都会导致鳕鱼MHC的球状头部构象完全改变,LHC大部分损失,在极端酸性(pH 2.5)条件下,肌球蛋白分子棒状尾部完全解离,而极端碱性(pH 11.0)条件下分子不发生解离,再调节pH值回到中性(pH 7.5)时,肌球蛋白棒状尾部折叠成原有构象,而球状头部不能重新折叠回原有构象[5];酸/碱处理前加盐(600 mmol/L NaCl)对体系有保护作用,调节回中性(pH 7.3)后肌球蛋白分子变性程度较小[6]。极低离子强度条件(不含盐)下,pH值4~7时,鲑鱼肌球蛋白的溶解度极低,随着离子强度(0~0.5 mol/L KCl)增加,静电和疏水相互作用变化导致溶解度增大[7],通常认为一定范围内这种盐溶(salting-in)效应与Cl-在蛋白表面选择性结合使蛋白分子间静电斥力增强有关,且随盐浓度的进一步增大,高盐离子会屏蔽蛋白质分子表面电荷,压缩双电层,产生盐析(salting-out)效应[8-9],鲑鱼肌球蛋白体系盐浓度高于0.5 mol/L KCl时,溶解度即开始下降[7];在低于等电点的酸性(pH 3.5)条件下,带正电的蛋白分子与Cl-结合,猪肉肌原纤维蛋白的溶解度也随NaCl浓度(低于0.8 mol/L)的增加而下降[10]。但是,在等电点和中性条件下,猪肉肌原纤维蛋白的溶解度随NaCl浓度(0.2~0.8 mol/L)的增加而增大,且在此盐溶过程中静电相互作用增加不明显[10],其盐溶机理主要与阳离子(Na+)高水合程度有关[10-11]。也有研究报道,当体系KCl浓度从0.1增加0.5 mol/L时,秘鲁鱿鱼肌原纤维蛋白分子所带电荷增加,同时高盐离子的屏蔽效应增强,分子间相互吸引作用的下降导致溶解度增加[12]。因此,离子对蛋白质的影响非常复杂,Na+和K+对蛋白质分子稳定性的影响也不完全相同[13],肌肉蛋白的溶解可能与蛋白来源、体外离子强度、离子类型及pH值等因素的共同影响有关,不同条件下的盐溶机理可能不完全相同,其加工应用特性也不一样。为此,本研究以罗非鱼肌球蛋白为对象,试验3种典型的KCl浓度条件下,广泛pH范围内肌球蛋白分子去折叠过程中分子结构和性质的变化,以探讨肌球蛋白溶解性与构象的关系。
1 材料与方法
1.1材料与试剂
鲜活罗非鱼:2016年3月~8月购自湛江当地市场,体重为(900±100)g,迅速带回实验室,手工去内脏、去头、去皮,取背部白肉、分装、-75 ℃储存备用。
5-腺苷三磷酸二钠盐(ATP)、二硫苏糖醇(DTT),广州齐云生物科技有限公司;乙二醇-双-(2-氨基乙醚)四乙酸(EGTA),上海源叶生物科技有限公司;三羟基甲基氨基甲烷(Tris),广州化学试剂厂;快速Lowry法蛋白含量测定试剂盒(2000T),上海荔达生物科技有限公司;SDS-PAGE凝胶快速配制试剂盒、SDS-PAGE蛋白上样缓冲液(5X)、考马斯亮蓝染色液(常规法),碧云天生物技术研究所;蛋白质分子质量标准(宽),宝生物工程(大连)有限公司;8-苯胺基-1-萘磺酸(8-Anilino-1-naphthalenesulfonic acid,ANS)、6-丙酰基-2-(N,N二甲胺基)萘(N,N-dimethyl-6-propionyl-2-naphthylamine,PRODAN),购于美国SIGMA公司;以上试剂均为分析纯;马来酸(maleic acid),美国MP公司,为优级纯试剂。其余试剂均为分析纯。
1.2仪器与设备
Avanti J-26sxp高效离心机,美国Beckman公司;UV-2550型紫外分光光度计,RF-5301P荧光分光光度计,日本岛津公司;ECP3000电泳仪和DYCZ-24DN双垂直电泳槽,北京六一仪器厂;UVP凝胶成像系统,美国UVP公司;Chirascan圆二色谱仪,英国应用光物理公司。
1.3实验方法
1.3.1 肌球蛋白的提取
参照STAFFORD等[14]的方法,进行了改进。实验所有操作均在4 ℃条件下进行,所用溶液均预先冷却到4℃。取新鲜搅碎的鱼肉200 g,加5倍(g/mL)缓冲液A(20 mmol/L 2HO2·NaH2PO4-12HO2·Na2HPO4,pH 7.0,0.02% NaN3),高速匀浆(20 000 r/min,30 s),浸提15 min后离心(5 500×g,10 min),取沉淀重复上述过程2次。向所得沉淀中加入3倍(g/mL)提取液B(0.45 mol/L KCl,5 mmol/L ATP,7.5 mmol/L MgCl2,0.15 mmol/L DTT,pH 6.4),搅拌15 min后离心(10 000×g,10 min)。4层纱布过滤,取滤液用9倍(mL/mL)蒸馏水稀释,静置10 min后离心(6 000 g,10 min)得沉淀。向沉淀中加入1/5倍(g/mL)缓冲液C(0.12 mol/L maleic acid,3 mol/L KCl,0.6 mmol/L DTT,pH 7.5),混匀后放置2 h,混合体系中添加1/10倍(g/mL)ATP溶液D(0.11 mol/L ATP,55 mmol/L MgCl2,5.5 mmol/L EGTA,pH 7.5)溶液后,搅拌1 h。加入硫酸铵至饱和度40%~45%进行分级,沉淀于透析液E(20 mmol/L Tris-HCl,0.6 mol/L KCl,0.1 mmol/L DTT,pH 7.0)中透析至无SO42-检出,然后离心(50 000×g,60 min),所得上清液即为肌球蛋白溶液。采用Lowry法[15]检测上清液蛋白含量,以牛血清白蛋白(BSA)为标准物,测量波长为750 nm,并进行SDS-PAGE电泳(5%分离胶,12%浓缩胶),经凝胶成像系统计算蛋白质纯度高于94%。
1.3.2 三种离子强度下酸/碱去折叠肌球蛋白样液的制备
用透析液E稀释肌球蛋白溶液至2.0 mg/mL,分别取50 mL溶液用2 mol/L的HCl调节pH值至6.0、5.0、4.0、3.0和2.0,用2 mol/L的NaOH调节pH值至8.0、9.0、10.0、11.0和12.0,各条件下溶液于低温条件下搅拌30 min后离心(10 000 g,15 min,4℃),所得上清液即为600 mmol/L KCl中酸/碱去折叠肌球蛋白样液。
分别用低离子强度透析液(20 mmol/L Tris-HCl,1 mmol/L KCl,pH 7.0)和生理离子强度透析液(20 mmol/L Tris-HCl,150 mmol/L KCl,pH 7.0)透析肌球蛋白,采用LOWRY法[15]检测测定透析后溶液的蛋白含量,并用对应的透析液稀释肌球蛋白浓度至2.0 mg/mL,同上调节体系的pH值,离心所得上清液即为1 mmol/L KCl和150 mmol/L KCl溶液中酸/碱去折叠肌球蛋白样液。各操件均在低温条件下进行。
1.3.3 溶解度的测定
用各样品对应的缓冲液适当稀释上述各处理的样品上清液,采用lowry法[15]测蛋白含量,肌球蛋白的溶解度按离心所得上清液蛋白含量占未处理前溶液中总蛋白含量的百分比计算。每个样品测定3次以上。
1.3.4 电泳分析
SDS-PAGE电泳根据LAEMMLI[16]的方法,采用分离胶浓度为12%、浓缩胶浓度为5%的变性聚丙烯酰胺凝胶进行还原(含β-巯基乙醇)及非还原(不含β-巯基乙醇)电泳。
1.3.5 表面疏水性的测定
采用ANS和PRODAN荧光探针法[17]检测可溶性蛋白的表面疏水性。将经过酸/碱去折叠处理的肌球蛋白上清液逐步稀释(0.062 5、0.125、0.25和0.5 mg/mL),取不同浓度的溶液各4 mL,分别加入20 μL的ANS溶液(8.0 mmol/L ANS,0.01 mol/L 2HO2·NaH2PO4-12HO2·Na2HPO4,pH 7.0)和10 μL的PRODAN溶液(1.0 mmol/L PRODAN,甲醇),振荡,分别静置10 min和15 min(避光),测定样品的相对荧光强度(FI)。本实验中,ANS荧光探针检测的激发波长和发射波长分别为374 nm和485 nm,PRODAN荧光探针检测的激发波长和发射波长分别为365 nm和465 nm,狭缝宽均为5 nm。减去各样品溶液未加探针时的荧光强度即为每种蛋白的相对荧光强度值(RFI)。以RFI对蛋白质浓度作图,其初始段的斜率作为蛋白质的表面疏水性指标(ANS-S0或PRODAN-S0)。每个样品测定3次以上。
1.3.6 二级结构含量分析
二级结构含量采用圆二色谱仪检测。将经过酸/碱去折叠处理的肌球蛋白上清液稀释至蛋白浓度0.1 mg/mL,进行圆二色谱测定。波长扫描范围为190~260 nm,样品池光径为1 mm,上样量0.3 mL,测量温度为5 ℃,测定分辨率为0.5 mm,扫描速度为100 nm/min,灵敏度为20 mdeg,响应时间为0.25 s,以未添加肌球蛋白的缓冲液做空白,实验结果取3次扫描的平均值。α-螺旋含量的计算公式如下[18]:
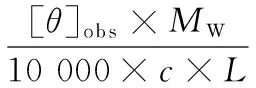
(1)
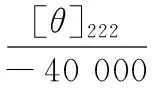
(2)
式中:[θ]obs为蛋白质溶液在222 nm处测得的椭圆率,mdeg;MW为肌球蛋白分子的平均氨基酸残基分子质量,取115 g/mol;c为测量的肌球蛋白溶液的浓度,0.1 mg/mL;L为样品测量时的比色皿光程长度,cm;[θ]222为222 nm处的摩尔椭圆率,deg·cm2/dmol。每个样品测定2次取平均值。
1.3.7 统计分析
利用JMP 7.0软件进行方差分析,差异显著性(p<0.05)分析使用多重比较。采用Origin 7.5软件对各指标的变化趋势作图。
2 结果与讨论
2.1 pH值对罗非鱼肌球蛋白溶解性的影响
选取0.001、0.15和0.6 mol/L KCl三种代表性的盐浓度,分别试验pH值对肌球蛋白溶解度的影响,结果如图1。
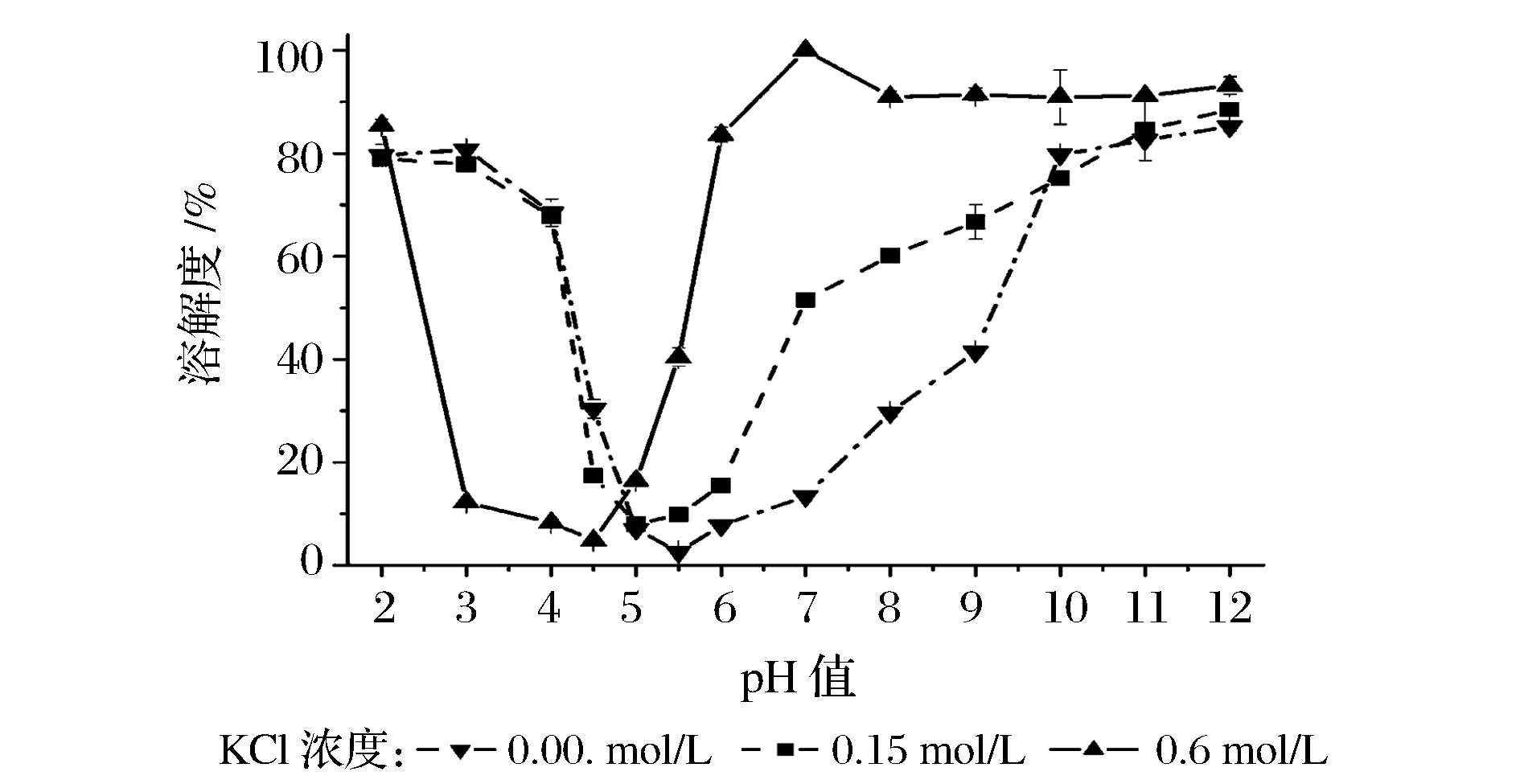
图1 三种离子强度下pH值对罗非鱼肌球蛋白溶解性的影响Fig.1 Effect of pH on solubility of tilapia myosin at three ionic strength levels
前者为低离子强度溶液,体外在此低离子强度条件下,肌球蛋白组装成纤丝,呈不溶状态;0.15 mol/L为肌肉组织的生理离子强度,此状态下肌球蛋白是不溶的,表现为分散的粗丝状态;后者是可提取肌球蛋白的高离子强度,此状态下肌球蛋白呈单体状态[9,19]。由图1可知,在实验范围内,3种KCl浓度条件下,肌球蛋白溶解度随pH值变化的曲线趋势基本相似,其溶解度最小的pH值分别为5.5、5.0和4.5(p<0.05);而随着pH值偏离等电点,由于肌球蛋白所带净电荷的增多导致蛋白分子间静电斥力增强,肌球蛋白溶解度增大,但不同pH值和盐浓度条件下的溶解度不同。(1)在0.001 mol/L KCl条件下,在pH值5.0~7.0范围内,肌球蛋白的溶解度较低(<15%);在偏离此范围的酸性条件下,溶解度迅速增加,pH值由5.0到4.0过程中溶解度由7.05%升高至68.5%,且在极端酸性(pH 2.0~3.0)条件下,溶解度在80%左右;当pH值由7.0至10.0的过程中肌球蛋白的溶解度迅速升高,且在极端碱性(pH 11.0~12.0)条件下,溶解度达到80%以上。(2)在0.15 mol/L KCl条件下,pH值从5.0向酸性方向偏移,溶解度的变化规律与低离子强度条件下的变化类似;pH值由等电点向碱性方向变化时,当pH值由6.0上升到7.0过程中,溶解度迅速增加达到51.6%,pH值由7.0到11.0变化过程中,溶解度的变化不太剧烈,而在极端碱性条件下,溶解度高于80%。(3)在0.6 mol/L KCl条件下,在pH值4.5~3.0范围内,肌球蛋白的溶解度较低(<13%),当pH值从3.0降低至2.0时,溶解度明显增大(p<0.05),达到85.4%;而pH值从4.5到7.0时,溶解度急剧增大(p<0.05)到100%;在极端碱性条件下,溶解度高于90%。(4)比较而言,随着离子强度的增大,肌球蛋白的等电点向酸性方向偏移,且离子强度越大偏移越大,其原因可能是Cl-与带正电氨基酸的结合能力比K+与带负电氨基酸的结合能力更强[3,9];由等电点范围向酸性偏移(pH 5.0→3.0)的过程中,肌球蛋白的溶解度均是随着离子强度的增大而减小,而由等电点范围向碱性偏移(pH 5.0→9.0)的过程中,肌球蛋白的溶解度均是随着离子强度的增大而增大。
2.2pH值对肌球蛋白电泳图谱的影响
3种离子强度下,肌球蛋白经酸/碱去折叠处理后的还原(添加β-巯基乙醇)和非还原(未添加β-巯基乙醇)电泳结果如图2所示。
因溶解度差异,本部分仅列出代表性的几个样品来说明。对于溶解度较低的pH范围(pH 4.0~6.0),肌球蛋白条带较弱。在低离子强度条件下,在pH 4.0~5.0时基本没有蛋白条带出现;在生理离子强度和高离子强度条件下,在pH 5.0~6.0时蛋白条带极其微弱,与溶解度的检测结果相一致(图谱未列出)。(1)在0.6 mol/L KCl溶液中,中性和碱处理的各蛋白样品在非还原电泳图上均出现分子质量高于200 kDa的条带,且极端碱性(pH 11.0)条件下凝胶顶部多聚体更明显,表明碱性条件下肌球蛋白更容易聚集;而经β-巯基乙醇处理后,肌球蛋白重链(约200 kDa)和3条轻链(约26、21和17 kDa)条带清晰,未出现分子质量高于200 kDa的条带,由此表明聚合物主要由肌球蛋白重链(MHC)彼此间通过二硫键形成;而极端酸性条件(pH 2.0和3.0)下蛋白条带相对较弱,但本实验中,pH 2.0时溶解度仍高于80%,推测可能是此条件下肌球蛋白重链降解。类似的结果在pH对鳕鱼肌肉蛋白可溶性组分的研究中也有报道,当盐浓度为600 mmol/L NaCl时,pH 2.0~5.0之间可溶性蛋白组分中肌球蛋白重链消失,推测可能是盐析导致的蛋白质沉淀[4],也可能是高盐条件下SDS反离子结合度增大,在SDS-PAGE样品处理过程中形成胶束被去除了[20]。(2)生理离子强度和低离子强度条件下,极端酸/碱去折叠处理的肌球蛋白均出现了分子质量高于200 kDa的条带,且碱性和(或)生理离子强度下肌球蛋白重链的聚集更明显,而经β-巯基乙醇处理后,均出现清晰的肌球蛋白重链和轻链条带,而低离子强度和中性pH条件下,蛋白条带很弱,与溶解度的检测结果一致。
2.3pH值对罗非鱼肌球蛋白表面疏水性的影响
采用ANS和PRODAN两种外源荧光探针检测可溶性肌球蛋白的表面疏水性,探讨蛋白质三级结构的变化[6,17]。由图3可知,在广泛pH范围内,肌球蛋白的表面疏水性不同,且3种离子强度条件下,表面疏水性随pH值的变化趋势类似。(1)在中性条件下,肌球蛋白的表面疏水性较低,2种荧光探针检测的疏水性值都较小;在碱性条件下,随着pH值的升高,PRODAN-S0和ANS-S0值增大,表明肌球蛋白分子部分展开,表面疏水基团暴露;且在中性和碱性条件下,随着离子强度的增加,肌球蛋白分子的聚集状态变化,表面疏水性增大。低离子强度条件下,肌球蛋白分子处于聚集状态,表面疏水性较低,而体外高离子强度条件下蛋白质分子间静电相互作用被破坏,分子解离成单体,尾部的疏水基团充分暴露,结合更多的探针指示物[3-4],因此在0.6 mol/L KCl溶液中,肌球蛋白的溶解性和表面疏水性明显增加。(2)在酸性范围内,表面疏水性的变化比较复杂,表明肌球蛋白分子在酸性条件下的稳定性较差。在pH 2.0~5.0范围内,随着pH值的降低,ANS-S0值增大(p<0.05),可能与酸性条件下肌球蛋白分子的展开及此条件下带净正电荷的蛋白分子与ANS间的静电相互作用有关。ANS是一种带负电荷的阴离子荧光探针,可与蛋白表面的阴/阳离子基团通过离子对的形成发生强结合,因此ANS-S0所反映的是蛋白质表面疏水性以及ANS与蛋白质分子间的静电作用[17];比较而言,PRODAN是一种不带电荷的溶剂敏感性探针,可以消除测量过程中可能存在的静电相互作用的干扰[21]。因此,在酸性条件下,PRODAN-S0值明显低于ANS-S0值,且极端酸性(pH 2.0~3.0)条件下,PRODAN-S0值低于中性和碱性条件下的PRODAN-S0值,由此推测肌球蛋白在酸性条件下的溶解可能受静电相互作用的影响;在0.15 mol/L KCl和0.001 mol/L KCl条件下,肌球蛋白分子表面疏水性最低出现在pH 5.0,在偏离等电点的酸性范围内,随着pH值的降低,PRODAN-S0值先增大后减小,在实验范围内,pH 2.0条件下的PRODAN-S0值均低于pH 3.0,表明在极端酸性条件下肌球蛋白分子展开到一定程度后,进一步降低pH值也可能会使蛋白分子重新折叠,导致表面疏水性下降[22];此外,等电点附近的蛋白构象呈现特殊变化,pH 6.0时表面疏水性值较大,因此时溶解度极低,其结构变化的机理,还需借助新技术进一步研究。(3)总体分析,碱诱导肌球蛋白去折叠过程中,分子部分展开,表面疏水性随pH值的升高而增加,静电相互作用和疏水相互作用导致溶解度增加,而酸诱导肌球蛋白去折叠过程中,在等电点附近表面疏水性较低,在偏离等电点的酸性条件下,表面疏水性增加,而在极端酸性条件下展开的肌球蛋白分子可能会发生折叠;结合溶解度的影响分析,分子在极端酸性条件下的溶解主要受分子降解及静电相互作用的影响。
2.4pH值对肌球蛋白α-螺旋含量的影响

图4 三种离子强度下pH值对罗非鱼肌球蛋白α-螺旋含量的影响Fig.4 Effect of pH onα-helix content of tilapia myosin at three ionic strength levels
肌球蛋白分子包含球状头部和棒状尾部,棒状尾部95%是由α-螺旋构成,而球状头部含有的α-螺旋结构所占比例较少[23],因此α-螺旋含量的变化可以反映出棒杆状尾部的变化。不同离子强度下广泛pH值对肌球蛋白二级结构的影响用圆二色谱进行表征。在实验范围内,在中性和碱性条件下,肌球蛋白的圆二色谱图在208 nm和222 nm处均出现2个负的特征肩峰谱带(光谱图未列出),这是典型的α-螺旋特征峰,由此计算α-螺旋含量。由图4可知,3种离子强度下,pH值对可溶性肌球蛋白分子α-螺旋含量的影响与溶解性的变化趋势类似,等电点pH值附近α-螺旋含量最低,随着pH值偏离等电点α-螺旋含量升高,碱性条件下α-螺旋先升高后稍微下降。根据DUMETZ等[24]的研究报道,pH值对肌球蛋白α-螺旋含量的影响主要是改变肌球蛋白带电氨基酸和肌球蛋白表面的α-羟基及α-氨基末端的质子化程度。在等电点附近蛋白分子表面净电荷接近零,分子的静电斥力下降导致肌球蛋白发生疏水聚集,肌球蛋白的溶解性和α-螺旋含量下降;而偏离等电点的酸性和碱性条件下,蛋白质所带净电荷增加,肌球蛋白逐渐恢复单体状态,α-螺旋含量上升;但在极端酸性和碱性条件下,蛋白变性增加,α-螺旋含量降低。在0.5 mol/L NaCl溶液中,当pH值由7.0下降到5.5时,静电作用和氢键稳定性的变化导致猪肌球蛋白α-螺旋含量由87.4%下降到15.8%[7]。此外,pH值对肌球蛋白α-螺旋含量的影响也与盐浓度有关,在中性、碱性和极端酸性(pH 2.0)条件下随着盐浓度的增加,肌球蛋白的α-螺旋含量增加,可能与高盐离子掩蔽蛋白质分子间的静电斥力,减弱电荷对氢键的影响有关。
3 结论
pH值对肌球蛋白溶解度及构象的影响与盐浓度有关。离子强度增大使肌球蛋白的等电点向酸性方向偏移,高盐对肌球蛋白的二级结构有保护作用;在中性和高离子强度条件下,罗非鱼肌球蛋白重链(约200 kDa)和3条轻链(约26,21和17 kDa)条带清晰,分子的稳定性较好;随着pH值偏离中性环境,肌球蛋白分子结构发生去折叠;碱诱导肌球蛋白去折叠过程中,分子部分展开,静电相互作用和疏水相互作用导致溶解度增加,肌球蛋白重链(MHC)彼此间通过二硫键形成聚合物;酸诱导肌球蛋白去折叠过程中,在偏离等电点的酸性条件下,分子部分展开和降解,而极端酸性条件下展开的肌球蛋白分子可能会发生折叠,分子降解及静电相互作用导致溶解度增加。
[1] HARRINGTON W F,RODGERS M E.Myosin[J].Annual Review of Biochemistry,1984,53(1):35-73.
[2] AZADIAN M,MOOSAVI-NASAB M,ABEDI E.Comparison of functional properties and SDS-PAGE patterns between fish protein isolate and surimi produced from silver carp[J].European Food Research and Technology,2012,235(1):83-90.
[3] THAWORNCHINSOMBUT S,PARK J W.Role of pH in solubility and conformational changes of Pacific whiting muscle proteins[J].Journal of Food Biochemistry,2004,28(2):135-154.
[4] THAWORNCHINSOMBUT S,PARK J W.Role of ionic strength in biochemical properties of soluble fish proteins isolated from cryoprotected Pacific whiting mince[J].Journal of Food Biochemistry,2005,29(2),132-151.
[5] KRISTINSSON H G,HULTIN H O.Effect of low and high pH treatment on the functional properties of cod muscle proteins[J].Journal of Agricultural and Food Chemistry,2003,51(17):5 103-5 110.
[6] RAGHAVAN S,KRISTINSSON H G.Conformational and rheological changes in catfish myosin during alkali-induced unfolding and refolding[J].Food Chemistry,2008,107(1):385-398.
[7] LIN T M,PARK J W.Solubility of salmon myosin as affected by conformational changes at various ionic strengths and pH[J].Journal of Food Science,1998,63 (2):215-218.
[8] HAMM R.Biochemistry of meat hydration[J].Advances in Food Research,1960,10(2):355-463.
[9] PUOLANNE E,HALONEN M.Theoretical aspects of water-holding in meat[J].Meat Science,2010,86 (1):151-165.
[10] WU Li-jun,WU Tao,WU Ju-qing,et al.Effects of cations on the “salt in” of myofibrillar proteins[J].Food Hydrocolloids,2016,58(6):179-183.
[11] VALLE-DELGADO J J,MOLINA-BOLIVAR J A,GALISTEO-GONZALEZ F,et al.Evidence of hydration forces between proteins[J].Current Opinion in Colloid & Interface Science,2011,16(6):572-578.
[12] ZHANG Rui,ZHOU Ru,PAN Wei-chun,et al.Salting-in effect on muscle protein extracted from giant squid (Dosidicus gigas)[J].Food Chemistry,2017,215:256-262.
[13] JUNGWIRTH P,CREMER P S.Beyond Hofmeister[J].Nature Chemistry,2014,6(4):261-263.
[14] HWANG G,WATABE S,HASHIMOTO K.Changes in carp myosin ATPase induced by temperature acclimation[J].Journal of Comparative Physiology B,1990,160 (3):233-239.
[15] LOWRY O H,ROSEBROUGH N J,FARR A L,et al.Protein measurement with the Folin phenol reagent[J].Journal of Biological Chemistry,1951,193(1):265-275.
[16] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227 (5 259):680-685.
[17] HASKARD C A,LI-CHAN E C Y.Hydrophobicity of bovine serum albumin and ovalbumin determined using uncharged (PRODAN) and anionic (ANS-) fluorescent probes[J].Journal of Agricultural and Food Chemistry,1998,46(7):2 671-2 677.
[18] OGAWA M,KANAMARU J,MIYASHITA H,et al.Alpha-helical structure of fish actomyosin:changes during setting[J].Journal of Food Science,1995,60(2):297-299.
[19] CHEN Xing,ZOU Yu-feng,HAN Min-yi,et al.Solubilisation of myosin in a solution of low ionic strength L-histidine:Significance of the imidazole ring[J].Food Chemistry,2016,196:42-49.
[20] BIESHEUVEL P M,VAN SOESTBRGEN M.Counterion volume effects in mixed electrical double layers[J].Journal of Colloid and Interface Science,2007,316(2):490-499.
[21] WEBER G,FARRIS F J.Synthesis and spectral properties of a hydrophobic fluorescent probe:6-propionyl-2-(dimethylamino) naphthalene[J].Biochemistry,1979,18(14):3 075-3 078.
[22] GOTO Y,FINK A L.Conformational states in β-lactamase:molten-globule states at acidic and alkaline pH with salt[J].Biochemistry,1989,28(3):945-952.
[23] CAO Yun-gang,XIONG You-ling.Chlorogenic acid-mediated gel formation of oxidatively stressed myofibrillar protein[J].Food Chemistry,2015,180,235-243.
[24] DUMETZ A C,CHOCKLA A M,KALER E W,et al.Effects of pH on protein-protein interactions and implications for protein phase behavior[J].Biochimica et Biophysica Acta,2008,1 784(4):600-610.
EffectofpHontilapiamyosinsolubilityandconformationunderthreeionicstrengthsolutions
FU Wei-ya1,ZHOU Chun-xia1,2*,ZHU Pan-hong1, ZHENG Hui-na1,2,HONG Peng-zhi1,2,YANG Ping1,2
1 (College of Food Science and Technology,Guangdong Ocean University, Guangdong Provincial Key Laboratory of Aquatic Product Processing and Safety,Zhanjiang 524088,China) 2 (Shenzhen Research Institute of Guangdong Ocean University,Shenzhen 518120,China)
Effect of various pH (2.0-12.0) on solubility of tilapia myosin and surface hydrophobicity, SDS-PAGE and α-helix contents of tilapia myosin were investigated at three ionic strength levels. Results showed that, in the experimental range, with increasing of ionic strength, the isoelectric point of myosin was shifted to acidic pH. In low ionic strength (1 mmol/L KCl), physiological ionic strength (150 mmol/L KCl) and high ionic strength (600 mmol/L KCl) solution, the pH of the minimum solubilities of myosin was 5.5, 5.0 and 4.5 respectively. At extreme acid (pH 2.0) and alkali (pH 11.0-12.0) condition, the solubility of myosin was higher than 80%. Under the neutral and high ionic strength, surface hydrophobicity was low and α-helix content was high and stability of myosin was good. During acid-induced refolding process, lower surface hydrophobicity was observed near the isoelectric point, and surface hydrophobicity increased under the acid condition of deviating from the isoelectric point. However, unfolded myosin might refold partly under extreme acidic conditions, and molecular degradation and electrostatic interactions could lead to the high solubility. During alkali-induced refolding process, the surface hydrophobicity increased with the rising of pH value, the macro-molecular polymer was formed through disulfide bonding between myosin heavy chains. In neutral pH condition, alkaline and extreme acidic conditions, α-helix content increased with the increase of salt concentration, and therefore high salt could protect the secondary structure of myosin. All above results indicated that myosin molecule could be unfolded to an intermediate sate similar to “molten globule” at extreme alkali and high salt condition.
tilapia myosin; pH; ionic strength; unfolding; solubility; conformation
硕士研究生(周春霞副教授为通讯作者,E-mail:chunxia.zhou@163.com)。
国家自然科学基金项目(31201389);广东省教育厅科技创新项目(2013KJCX0098);广东省省部产学研合作专项(2013A090100009)
2017-02-12,改回日期:2017-03-24
10.13995/j.cnki.11-1802/ts.014028
